术前外周血中性粒细胞/淋巴细胞比值对高龄结肠癌患者预后的评估价值
2017-03-23朱磊阚丽丽王俊平徐亮吴杰牟春露
朱磊,阚丽丽,王俊平,徐亮,吴杰,牟春露
(辽宁辽河油田总医院 1. 普通外科 2. 药学部 3. 放射线科,辽宁 盘锦 124010)
结肠癌发病率位于西方国家中常见恶性肿瘤的第3位[1],近年来在发展中国家,结肠癌是发病率较前明显增加[2]。虽然过去几十年来结肠癌的外科手术和药物治疗手段不断改善,但其预后仍然很不理想[3-4],特别是老年患者,预后更差,这主要归因于缺乏可靠且敏感特异的老年结肠癌的预测指标。既往大量的研究[5-6]表明,肿瘤相关性炎性反应可以促进肿瘤侵袭转移,中性粒细胞/淋巴细胞(NLR)是全身炎症反应的有效评价指标之一,能够在一定程度上反应炎性反应和抗肿瘤免疫之间的动态关联,是肿瘤复发的一项预测因子。NLR现已被证实是膀胱癌、胃癌、直肠癌、肺癌、卵巢癌等多种恶性肿瘤不良预后的预测指标[7-10]。本文回顾性分析高龄老年性结肠癌患者(≥75岁)术前NLR水平与临床病理特征及患者预后的关系,旨在探讨术前外周血NLR在评估在高龄老年结肠癌患者预后方面的临床意义,为高龄老年结肠癌患者的预测和个体化治疗提供进一步参考依据。
1 资料与方法
1.1 一般资料
本文回顾性分析2008年1月—2013年1月收治的67例75岁以上结肠癌患者的临床资料。患者术前均经肠镜活检,病理证实为结肠恶性肿瘤并行根治性切除手术;血液标本是在手术前1周内获得的。排除标准:⑴ 术前进行辅助放化疗者;⑵ 术前伴有其它感染疾病致使中性粒细胞或(和)淋巴细胞异常者;⑶ 术中探查有腹腔内多发转移,未能完成手术者;⑷ 术后因其它脏器疾病死亡者;⑸ 随访不足3个月者。
1.2 方法
术前1周内抽取患者静脉血,根据血常规中中性粒细胞计数及淋巴细胞计数,计算得到NLR;CEA≥9.7 ng/mL定为阳性。
1.3 统计学处理
用SPSS 17.0软件进行统计分析,计数资料应用χ2检验或Fisher精确概率法检验。检验水准α=0.05。
2 结 果
2.1 NLR截点值及病例分组
根据ROC曲线确定NLR最佳值,当NLR为2.98时,Youden指数最大为0.534,故取3为NLR最佳截点,对应的敏感性和特异性分别为0.723和0.922(图1);根据该截点值,将患者分为低NLR组(NLR<3)与高NLR组(NLR≥3),前者44例,后者23例。
2.2 两组患者临床病理特征比较
NLR与高龄老年结肠癌患者临床病理资料关系的分析结果显示,低NLR组患者中性别和手术类型等因素与高NLR组比较,差异无统计学意义(P>0.05);低NLR组患者中肿瘤分化程度(P=0.040)、淋巴结转移(P=0.018)、TNM分期(P=0.008)、CEA水平(P=0.026)因素与高NLR组比较,差异有统计学意义(表1)。

图1 确定NLR最佳截点的ROC曲线Figure 1 ROC for determination of the cut-off point of NLR
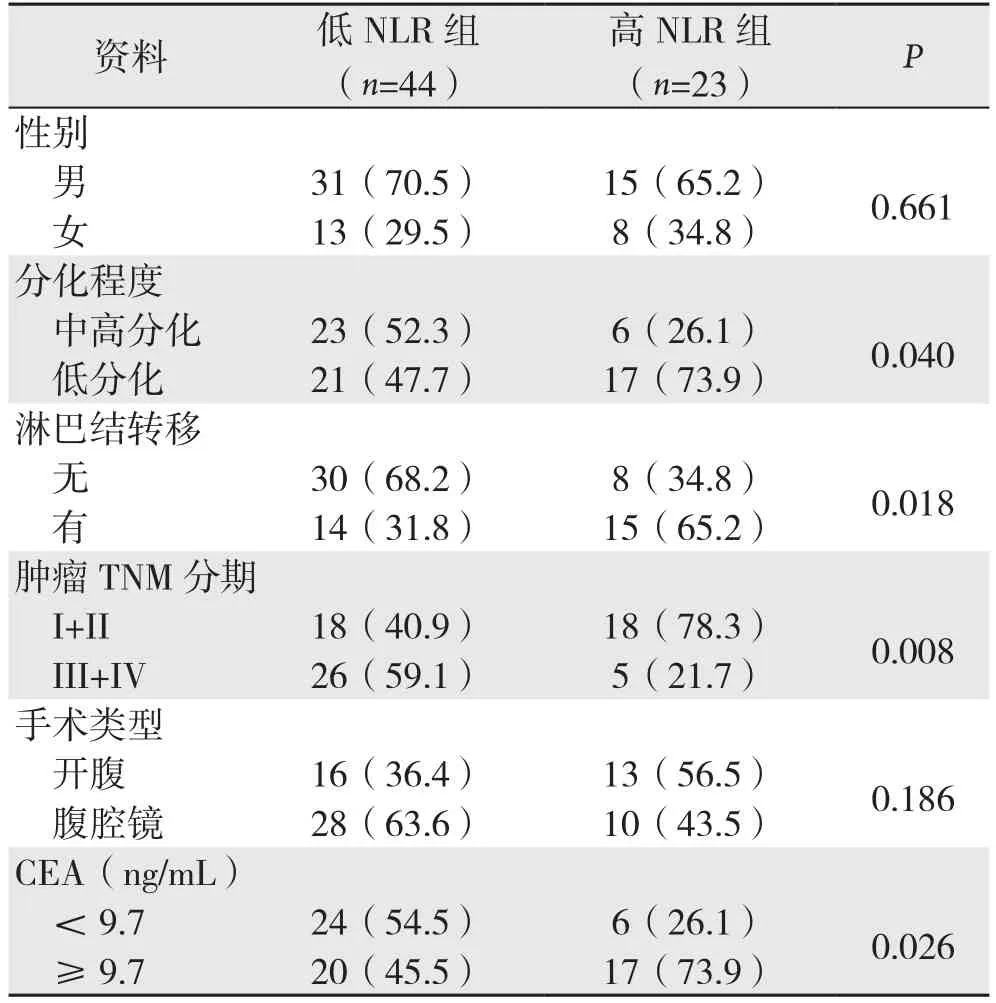
表1 术前NLR与患者临床病理因素的关系[n(%)]Table 1 Relations of preoperative NLR with clinicopathologic factors of the patients [n (%)]
2.3 低NLR组和高NLR组术后生存情况
全组病例术后平均随访时间62个月,中位随访时间47.6个月。3年总生存率62.7%,其中低NLR组72.7%,高NLR组43.5%,两组间差异有统计学意义(P=0.019)。
2.4 影响高龄老年结肠癌患者预后的因素
单因素预后分析结果显示,术前N L R(P=0.019)、分化程度(P=0.039)、淋巴结转移(P=0.027)及肿瘤分期(P=0.024)、术前CEA水平升高(P=0.013)是高龄老年结肠癌患者预后的危险因素(表2)。
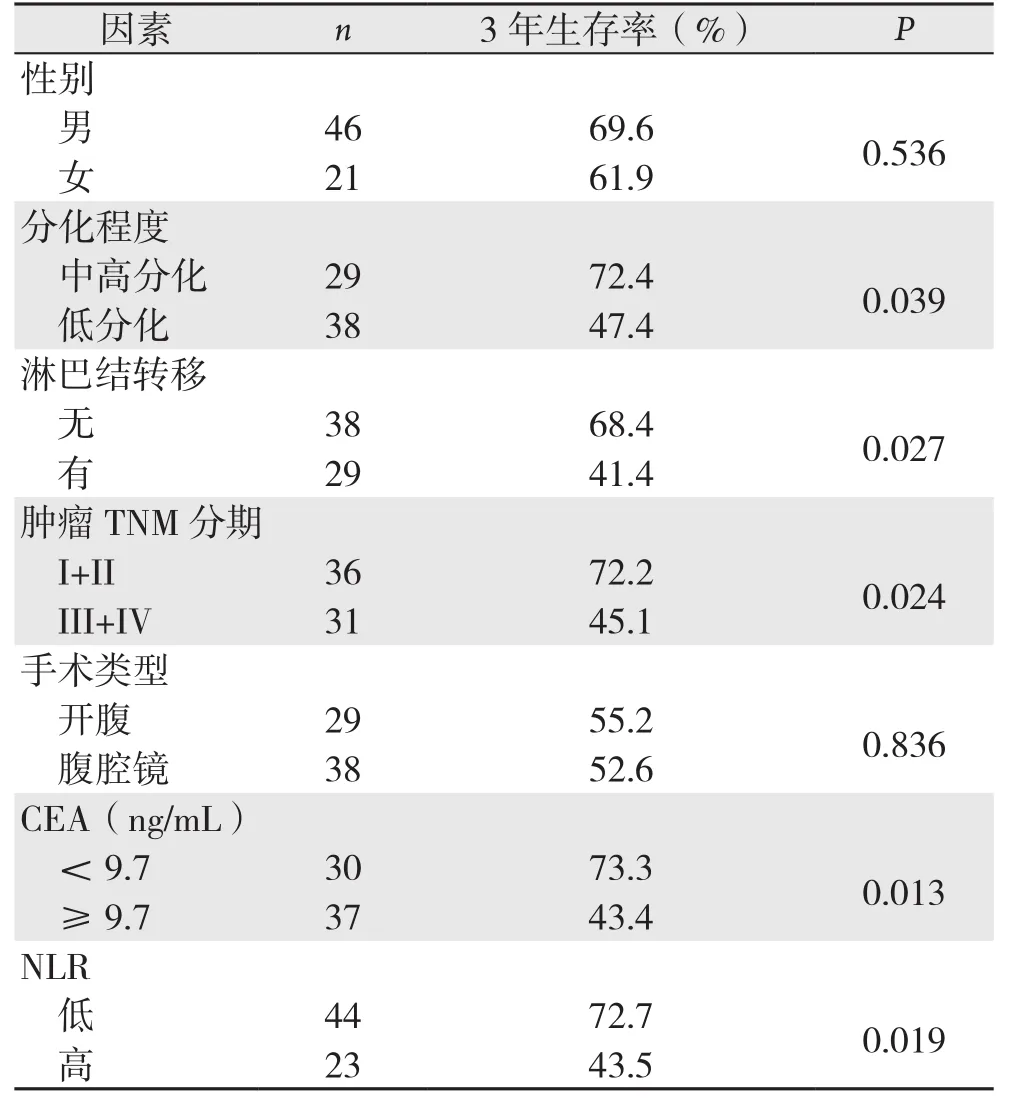
表2 影响本组结肠癌患者3年生存率因素的单变量分析Table 2 Univariate analysis of factors affecting the 3-year survival rates in this group of patients
3 讨 论
在结肠癌的预后判断中,主要因素包括肿瘤分化程度、肿瘤分期、淋巴结转移、远处转移等[11-12],然而,仍有很多难以解释的临床问题,即使处于疾病早期,仍会伴有远处转移出现。这说明除了传统的临床病理指标以外,仍有诸多未知因素影响着患者的预后,而高龄老年结肠癌患者明确诊断时,多以中晚期为主,且多数错过了最佳手术时机;因此,在临床上寻找老年结肠癌患者预后生存的评估指标,显得意义更为重要。
炎症是肿瘤进展的一个非常重要组成部分,很多恶性肿瘤起源于慢性炎症、感染的刺激[13-14]。肿瘤微环境中的炎性细胞是肿瘤发展过程中的重要参与者,相关研究[15-17]发现,机体对于肿瘤的免疫反应是淋巴细胞依赖性的,淋巴细胞介导的细胞毒性作用及释放的细胞因子能够抑制肿瘤的增殖及转移行为;而中性粒细胞因肿瘤所致炎性反应聚集而改变肿瘤细胞微环境,中性粒细胞分泌血管内皮生长因子,促进微小血管增生,进而为肿瘤细胞的增殖和迁移活动提供养分[18]。
人体外周血中性粒细胞的水平通常反映人体全身炎性反应的情况,目前NLR被认为是一项抗瘤性炎性反应与促瘤性炎性反应的平衡指标。NLR可以综合反映肿瘤患者体内炎症和免疫状态,NLR升高提示人体炎性反应强、肿瘤杀伤力低下,使得平衡状态被打破,炎症反应向着促进肿瘤生长方向发展,使转移复发的风险提高,导致预后不良。对于不同肿瘤的患者、是否可行手术治疗、是否接受化学治疗,其NLR临界点多不相同,现有研究大部分将其界定在3~5[7-9]。本研究根据ROC曲线,NLR=3时Youden指数最大,因此作者取NLR=3作为评价的临界点,与其他相关文献报道一致。
鉴于本研究中患者高龄且伴有较多基础疾病、强烈化疗耐受性差等因素[19-20],故53例II期以上患者仅予以单药卡培他滨(希罗达)化疗[21-22],并无严重不良反应发生;同时本研究单因素预后分析显示,术前NLR、分化程度、淋巴结转移、TNM分期和术前CEA水平与老年性结肠癌患者预后相关。术前NLR的升高可能预示着老年结肠癌肿瘤病灶分化程度差,TNM分期较晚,对于术者提前预估手术情况和病灶所需切除范围、判定其是否可达到根治水平具有很大帮助;再者,术前NLR的升高也可能预示老年结肠癌患者淋巴结转移较早,对探讨术中是否扩大淋巴结清扫范围具有指导意义。因此,术前NLR的高低,可以作为老年结肠癌患者术前制定手术方式和淋巴结清扫范围的参考指标之一。
本文检测了术前结肠癌患者NLR与肿瘤分化程度、淋巴结转移、肿瘤临床分期、CEA水平与生存时间的关系,发现高NLR与低NLR患者相比临床分期更晚,较为容易出现淋巴结转移,而笔者[23]早前的研究结果认为,血清CEA与结肠癌的T分期、TNM分期、淋巴结转移具有重要关联,术前血清CEA水平与结肠癌T分期、TNM分期、淋巴结转移和脉管浸润有关,同时再结合本研究提示NLR与CEA联合检测可以更好的预测老年性结肠癌的预后情况。术前CEA水平升高,术后生存率低,说明NLR与结肠癌患者不良预后相关,进而证实术前NLR具有评估结肠癌患者术后预后的临床价值。
本文之所以选择3年生存率,而未选择常用的5年生存率,是出于高龄老年患者预期寿命受到其它因素影响所致。老年结肠癌患者,尤其是≥75岁的高龄结肠癌患者,超出了临床上许多新近的治疗方案的入组条件,以至于老年结肠癌患者的生存预后一直难以提升。NLR在临床中较为容易获得,可为≥75岁的老年患者提供一项有助于预测术后生存期的指标,对于高龄结肠癌患者的术前评估具有一定价值。
[1] Siege R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1):9–29. doi: 10.3322/caac.21208.
[2] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11–30. doi: 10.3322/caac.21166.
[3] Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2014,15(10):1065–1075. doi: 10.1016/S1470–2045(14)70330–4.
[4] Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study[J]. J Clin Oncol, 2008, 26(12):2013–2019. doi: 10.1200/JCO.2007.14.9930.
[5] Turner N, Wong HL, Templeton A, et al. Analysis of local chronic in fl ammatory cell in filtrate combined with systemic in fl ammation improves prognostication in stage II colon cancer independent of standard clinicopathologic criteria[J]. Int J Cancer, 2016,138(3):671–678. doi: 10.1002/ijc.29805.
[6] Galizia G, Lieto E, Zamboli A, et al. Neutrophil to lymphocyte ratio is a strong predictor of tumor recurrence in early colon cancers: A propensity score-matched analysis[J]. Surgery, 2015, 158(1):112–120. doi: 10.1016/j.surg.2015.02.006.
[7] 罗显策. 中性粒细胞与淋巴细胞比值与膀胱尿路上皮癌预后的相关性[J]. 临床误诊误治, 2015, 28(9):82–84. doi: 10.3969/j.issn.1002–3429.2015.09.033.Luo XC. Correlation of neutrophils and lymphocytes ratio with the prognosis of bladder urothelial carcinoma[J]. Clinical Misdiagnosis and Mistherapy, 2015, 28(9): 82–84. doi: 10.3969/j.issn.1002–3429.2015.09.033.
[8] Balta S, Unlu M, Arslan Z, et al. Neutrophil-to-Lymphocyte Ratio in Prognosis of Gastric Cancer[J]. J Gastric Cancer, 2013,13(3):196–197. doi: 10.5230/jgc.2013.13.3.196.
[9] Cedrés S, Torrejon D, Martínez A, et al. Neutrophil to lymphocyte ratio (NLR) as an indicator of poor prognosis in stage IV non-small cell lung cancer[J]. Clin Transl Oncol, 2012, 14(11):864–869. doi:10.1007/s12094–012–0872–5.
[10] Williams KA, Labidi-Galy SI, Terry KL, et al. Prognostic significance and predictors of the neutrophil-to-lymphocyte ratio in ovarian cancer[J]. Gynecol Oncol, 2014, 132(3):542–550. doi:10.1016/j.ygyno.2014.01.026.
[11] 陈钰锋, 曾杨, 何晓生, 等. 影响II期结直肠癌患者预后的临床病理因素分析[J]. 中华消化外科杂志, 2011, 10(6):430–435.Chen YF, Zeng Y, He XF, et al. Clinicopathological factors on the prognosis of patients with stage II colorectal cancer[J]. Chinese Journal of Digestive Surgery, 2011, 10(6):430–435.
[12] 陈创奇, 方乐堃, 马晋平, 等. 结直肠癌2042例临床病理特点及预后回归分析[J]. 中华医学杂志, 2010, 90(26):1804–1807. doi:10.3760/cma.j.issn.0376–2491.2010.26.003.Chen CQ, Fang LK, Ma JP, et al. Regression analysis of the characteristics and outcome of colorectal cancer 1995–2007[J].National Medical Journal of China, 2010, 90(26):1804–1807. doi:10.3760/cma.j.issn.0376–2491.2010.26.003.
[13] Absenger G, Szkandera J, Stotz M, et al. Preoperative neutrophilto-lymphocyte ratio predicts clinical outcome in patients with stage II and III colon cancer[J]. Anticancer Res, 2013, 33(10):4591–4594.doi: 10.1038/bjc.2013.346.
[14] Absenger G, Szkandera J, Pichler M, et al. A derived neutrophil to lymphocyte ratio predicts clinical outcome in stage II and III colon cancer patients[J]. Br J Cancer, 2013, 109(2):395–400. doi: 10.1038/bjc.2013.346.
[15] Maeda K, Shibutani M, Otani H, et al. Inflammation-based factors and prognosis in patients with colorectal cancer[J]. World J Gastrointest Oncol, 2015, 7(8):111–117. doi: 10.4251/wjgo.v7.i8.111.
[16] Paramanathan A, Saxena A, Morris DL. A systematic review and meta-analysis on the impact of pre-operative neutrophil lymphocyte ratio on long term outcomes after curative intent resection of solid tumours[J]. Surg Oncol, 2014, 23(1):31–39. doi: 10.1016/j.suronc.2013.12.001.
[17] Roberts SJ, Ng BY, Filler RB, et al. Characterizing tumor-promoting T cells in chemically induced cutaneous carcinogenesis[J]. Proc Natl Acad Sci U S A, 2007, 104(16):6770–6775.
[18] Jin H, Zhang G, Liu X, et al. Blood neutrophil-lymphocyte ratio predicts survival for stages III-IV gastric cancer treated with neoadjuvant chemotherapy[J]. World J Surg Oncol, 2013, 11:112.doi: 10.1186/1477–7819–11–112.
[19] Sanoff HK, Carpenter WR, Freburger J, et al. Comparison of adverse events during 5-fluorouracil versus 5-fluorouracil/oxaliplatin adjuvant chemotherapy for stage III colon cancer: a population-based analysis[J]. Cancer, 2012, 118(17):4309–4320.doi: 10.1002/cncr.27422.
[20] Park BK, Park JW, Han EC, et al. Systemic in fl ammatory markers as prognostic factors in stage IIA colorectal cancer[J]. J Surg Oncol,2016, 114(2):216–221. doi: 10.1002/jso.24299.
[21] Kumar A, Kennecke HF, Renouf DJ, et al. Adjuvant chemotherapy use and outcomes of patients with high-risk versus low-risk stage II colon cancer[J]. Cancer, 2015, 121(4):527–534. doi: 10.1002/cncr.29072.
[22] Labianca R, Nordlinger B, Beretta GD, et al. Early colon cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24(Suppl 6):vi64–72. doi: 10.1093/annonc/mdt354.
[23] 朱磊, 赵阳, 韩仕峰, 等. 术前血清CEA和CA19–9水平检测对结肠癌术后早期复发转移的预测价值[J]. 中国普通外科杂志,2015, 24(8):1170–1174. doi:10.3978/j.issn.1005–6947.2015.08.023.Zhu L, Zhao Y, Han SF, et al. Predictive significance of preoperative serum CEA and CA19–9 determination in early recurrence/metastasis of colon cancer after operation[J]. Chinese Journal of General Surgery, 2015, 24(8):1170–1174. doi:10.3978/j.issn.1005–6947.2015.08.023.
