牛源致病性大肠杆菌O78型的分离与鉴定
2017-03-22李天芝于新友沈志强
李天芝,于新友,沈志强
(1.山东绿都生物科技有限公司,滨州 256600;2.山东省滨州畜牧兽医研究院,滨州 256600)
牛源致病性大肠杆菌O78型的分离与鉴定
李天芝1,于新友1,沈志强2
(1.山东绿都生物科技有限公司,滨州 256600;2.山东省滨州畜牧兽医研究院,滨州 256600)
本研究对山东省东营市某牛场病死牛的病料进行了病原菌的分离,并对分离菌株进行形态学观察、生化试验、PCR鉴定、药敏试验和动物致病性试验。结果显示,本研究成功分离到一株O78型大肠杆菌,药敏试验结果证实该菌株具有多重耐药性;致病性试验结果显示该菌株对昆明系小白鼠具有一定的致病性。
牛源;致病性大肠杆菌;分离;鉴定
2016年3月份,山东省东营市某牛场新生犊牛出现不同程度的食欲不振、精神沉郁、不愿站立、呼吸急促、全身衰弱、排灰白色水样稀粪和肛门周围、腹部及后肢有粪便黏附症状,有的病牛眼眶下陷,最后陷入脱水状态,衰竭死亡。剖检发现肠内有灰白色稀粪,混有血丝和气泡,肠黏膜出血,部分肠黏膜脱落,肠系膜淋巴结肿大,真胃有凝乳块,胃黏膜水肿、充血,肝脏有出血点,心内膜出血。笔者通过试验排除了球虫、隐孢子虫、牛轮状病毒和牛病毒性腹泻病毒感染的可能,从病死牛的肝脏和肠系膜淋巴结病料中分离鉴定出一株O78型牛大肠杆菌,并对其进行了药敏试验和致病性试验,为该菌株的后续工作奠定了基础。
1 材料与方法
1.1 病料
无菌采取病死牛部分肝脏、肠系膜淋巴结作为病料。
1.2 试验动物
20只18~22g清洁级昆明系小白鼠购自山东省实验动物中心。
1.3 试剂及耗材草酸铵结晶紫、革兰氏碘液、石炭酸复红染液、血琼脂平板、普通营养琼脂平板、麦康凯营养琼脂培养基和肉汤液体培养基均由本公司质检部提供;DL2000 Marker、TaqDNA聚合酶均购自宝生物工程(大连)有限公司;DNA回收试剂盒和质粒小量提取试剂盒购自生工生物工程(上海)股份有限公司;药敏纸片、糖发酵管及生化试验用各种试剂购自杭州天和微生物试剂有限公司;大肠杆菌O型单价阳性标准血清购自中国兽医药品监察所。
1.4 试验设计
1.4.1 引物设计与合成
根据GenBank中大肠杆菌LEE毒力岛的eaeA基因序列(AJ223063),设计1对引物,上游引物:5′-ATAAACCGTGGTCTCAGCAAATCG -3′,下游引物:5′- ATCACCATCAATACTCAACGGG -3′,扩增片段1 043bp。引物由生工生物工程(上海)股份有限公司合成。
1.4.2 寄生虫和轮状病毒检查
取新鲜牛粪便2~3g放于量杯,加入30mL饱和食盐水,搅拌,混和均匀,用双层纱布过滤,收集滤液,静置半小时,用金属圈水平沾取液面,显微镜下检测有无球虫卵囊。
按照李安平等[1]、于新友等[2、3]的方法检测粪便中是否有隐孢子虫、牛轮状病毒和牛病毒性腹泻病毒。
1.4.3 细菌检测与分离培养
将病料涂片或触片、干燥、固定,革兰氏染色、镜检,筛选出具有细菌形态特征的病料。将这些病料划线接种于血液琼脂平板,37℃培养24h,对可疑菌落进行涂片、革兰氏染色及镜检。挑取单个可疑菌落接种于普通肉汤培养基、麦康凯营养琼脂培养基和营养琼脂培养基,37℃培养24h,观察生长情况,对可疑菌落进行涂片,革兰氏染色及镜检[4]。
1.4.4 生化鉴定
分离菌株经营养琼脂平板24h纯培养后,分别进行糖发酵试验及其他生化试验。
1.4.5 PCR鉴定
挑取麦康凯营养琼脂上单个菌落作为PCR的模板,进行PCR扩增。反应体系(50μL):10×Buffer(含MgCl2)5μL,上下游引物各2μL(20pmol/L),dNTP4μL,TaqDNA聚合酶0.5μL,模板1μL,加水补足至50μL。扩增反应程序:94℃ 5min;94℃ 50s,55℃ 50S,72℃ 50S,30个循环,72℃7min。取5μL扩增产物进行1.0%琼脂糖凝胶电泳检测。回收PCR产物,连pMD18-T载体,转化感受态细胞DH5α,挑单菌落,振摇培养过夜,提取质粒,再次鉴定,将阳性质粒送生工生物工程(上海)股份有限公司测序。
1.4.6 药敏试验
采用药敏纸片琼脂扩散法( K-B法)检测该分离菌株的药物敏感性,方法如下:将分离菌株的24h肉汤纯培养物做10倍稀释,用无菌棉签均匀涂布于麦康凯营养琼脂平板上;用无菌镊子取药敏纸片,均匀放于培养基表面,使纸片之间距离适当,置37℃培养24h。观察结果,测量抑菌圈直径。
1.4.7 O抗原血清型鉴定
从麦康凯琼脂平板上挑取单菌落,接种于肉汤培养基,37℃振荡培养24h,离心取沉淀,加入0.5%灭菌石炭酸生理盐水制成菌悬液,置于121℃下高压2h,作为待检抗原,取制备的待检抗原和大肠杆菌O抗血清各10μL,在玻璃板上混匀,同时设生理盐水阴性对照,观察并记录反应结果,30s内出现明显凝集者判为阳性,否则为阴性。
1.4.8 致病性试验
将20只小白鼠随机分成两组,分别为试验组和对照组,每组10只。取37℃24h肉汤纯培养物(含菌量8×108CFU/mL)腹腔注射接种于小白鼠,0.1mL/只;对照组小白鼠腹腔注射肉汤,0.3mL/只。注射后隔离饲养,观察发病及死亡情况,并对死亡小白鼠进行细菌分离。
2 结果与分析
2.1 寄生虫和轮状病毒检查
显微镜下检测未发现球虫卵囊,说明没有球虫感染。隐孢子虫、牛轮状病毒、牛病毒性腹泻病毒核酸检测结果均为阴性。
2.2 细菌检测与分离培养
肠系膜淋巴结、肝脏触片革兰氏染色镜检,可见两端钝圆的革兰氏阴性杆菌。37℃培养24h后,在血琼脂平皿上有大小均一、边缘整齐、光滑、湿润、乳白色、半透明、有光泽的圆形菌落生长。在麦康凯琼脂培养基上为边缘整齐、表面光滑湿润、圆形、桃红色菌落。营养琼脂培养基上也有圆形、半透明菌落,肉汤培养基呈均匀浑浊状。分别挑取单个菌落和浑浊菌液涂片进行革兰氏染色,镜检为中等大小、两端钝圆的革兰氏阴性杆菌。
2.3 生化试验
由表1可知,该分离菌株能发酵葡萄糖、麦芽糖、果糖、木糖、半乳糖、乳糖、鼠李糖、山梨醇,不能发酵肌醇、卫矛醇、赤鲜醇、菊糖,V-P试验阴性,M-R试验阳性,靛基质试验阳性,氧化酶、尿素酶阴性,硫化氢试验阴性,与大肠杆菌的生化特征一致。
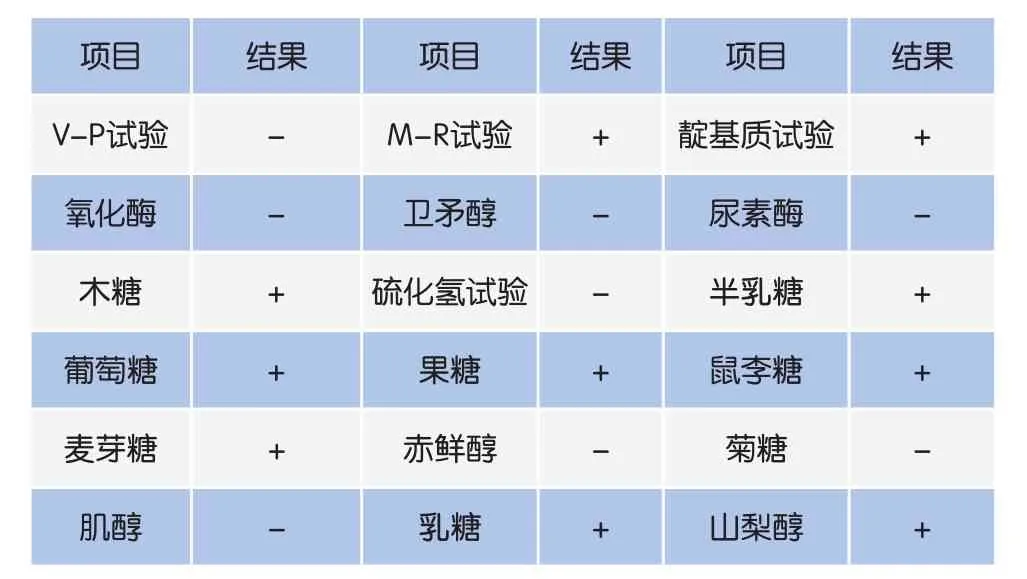
表1 分离菌株的生化试验结果
2.4 PCR鉴定
PCR扩增产物经琼脂糖凝胶电泳检测,其片段大小与预期结果一致(图1)。将该片段测序结果与GenBank登录的大肠杆菌eaeA基因(AJ223063)进行比对,相似性为100%。

图1 大肠杆菌分离株PCR检测结果
2.5 药物敏感性试验
由表2可知,分离菌株对头孢曲松、庆大霉素、氟苯尼考、硫酸新霉素高度敏感,对四环素、卡那霉素、环丙沙星、左氧氟沙星中敏,对青霉素G、强力霉素、泰乐菌素、链霉素、氨苄西林、磺胺甲氧嘧啶耐药。

表2 分离菌株的药物敏感性试验结果 单位:mm
2.6 血清型鉴定结果
玻片凝集试验结果显示,该分离菌株的O抗原血清型为O78。
2.7 致病性试验
试验组小白鼠注射分离菌株肉汤培养物2h后,出现精神萎靡、食欲不振等症状,48h内全部死亡,剖检发现小鼠小肠黏膜变薄且有出血点,肠系膜淋巴结水肿,肝脏出血、脾脏梗死,取死亡小鼠的心、肝和脾等组织在麦康凯平板上划线培养,涂片染色,镜检发现为革兰氏阴性短小杆菌。对照组小白鼠均健活,剖检未见异常。
3 讨论
随着养牛业的规模化发展,犊牛腹泻已成为一类重要疾病。引起犊牛腹泻的原因有很多,可分为传染性腹泻和营养性腹泻。传染性腹泻主要归因于各种细菌、病毒和寄生虫的感染。寄生虫主要包括球虫和隐孢子虫;病毒主要包括牛轮状病毒和牛病毒性腹泻病毒;细菌主要是大肠杆菌。由大肠杆菌引起的犊牛腹泻有着较高的发病率和死亡率[5],主要发生于1月龄以内的犊牛,一年四季均可发生,特别是气候突变、饲养管理不当和抵抗力下降时,有时呈地方性流行[6],可导致犊牛大量死亡,给养牛业造成严重的经济损失。
eaeA基因是肠致病性大肠杆菌LEE毒力岛上的标志基因,编码一种称为紧密素的细菌外膜蛋白,介导细菌黏附于肠道上皮细胞[7]。本试验选取eaeA基因作为PCR鉴定的靶基因,可快速对分离菌株进行分子水平的鉴定,从而为致病性牛大肠杆菌病的快速鉴定提供研究基础。
由于养牛场长期不规范、不科学用药,而大肠杆菌又极易产生可遗传的耐药质粒[8],所以牛大肠杆菌的抗药性日益严重,给牛大肠杆菌病的治疗造成很大的困难。药敏试验结果表明,该分离菌株对头孢曲松、庆大霉素、氟苯尼考、硫酸新霉素高度敏感,因此,可选取这些药物进行治疗,提高疗效,并且要多种药物交替、轮换使用,以避免再次产生耐药性。若牛场暴发细菌病,都应进行细菌分离和药敏试验,以便针对性地用药,降低牛场损失。
大肠杆菌血清型众多,对牛致病的大肠杆菌血清型主要有O15、O44、O55、O78、O86、O101、O141 和O125等[9,10],各血清型之间的交叉保护性效果不好。临床中大肠杆菌优势血清型具有一定的区域性,可以筛选优势血清型且具有良好免疫原性的菌株制备多价苗进行免疫预防。本研究分离出的血清型O78大肠杆菌,为进行该分离菌的下一步研究奠定了基础。
[1] 李安平,黄克和,王权,等.微小隐孢子虫和安氏隐孢子虫SYBR Green real time PCR检测方法的建立[J].中国兽医科学, 2009,39(06):510-515.
[2] 于新友,李天芝,沈志强.牛轮状病毒套式RT-PCR检测方法的建立和应用[A].第七届中国奶业大会论文集[C].2016年.
[3] 于新友,李天芝,沈志强.牛病毒性腹泻病毒一步法.RT-PCR检测方法的建立及应用[J].中国奶牛,2015,09:27-29.
[4] 胡桂学.兽医微生物实验教程[M].北京:中国农业大学出版社,2006,35-38.
[5] 陆承平.兽医微生物学[M].北京:中国农业出版社,2006:215-223.
[6] 贺晓龙,史福胜.育肥牛场致病性人肠埃希菌及沙门菌的分离鉴定[J].动物医学进展,2011,32(11):123-126.
[7] 方光远,范红结,张玉红,等.犊牛腹泻大肠杆菌LEE和HPI毒力岛相关基因的检测[J].金陵科技学院学报,2008,24(02):92-97.
[8] 高睿,张彦明,张耀相,等.犊牛产肠毒素型大肠杆菌病的诊治[J].畜牧与兽医,2009,41(7):110-112.
[9] 马长宾,陈文武,王忠山,等.致犊牛腹泻大肠杆菌的分离鉴定及药敏试验[J].中国动物检疫,2015,32(03):78-82.
[10] 喻华英,杨晓华.新疆部分地区犊牛腹泻病大肠杆菌的分离、鉴定与血清型分析[J].新疆农业科学,2011,48(09):1752-1756.
Isolation and Identification of Escherichia coli Serotype O78 from Cattle
LI Tian-zhi1, YU Xin-you1, SHEN Zhi-qiang2
(1.Shandong Lvdu Bio-Science and Technology Co.Ltd.,Binzhou 256600; 2.Animal Science and Veterinary Medicine Academy, Binzhou 256600)
The pathogen was isolated on a dead cattle from a farm in Shandong Dongying. The serotype O78 Escherichia coli was confirmed by morphological observation,biochemical test,PCR assay,drug sensitive test and animal infection experimen. Results showed that the isolates with multidrug-resistant had certain pathogenic to Kunming mice.
Bovine; Escherichia coli; Isolation; Identification
S858.23
A
1004-4264(2017)02-0026-04
10.19305/j.cnki.11-3009/s.2017.02.007
2016-07-02
山东省现代产业技术体系牛创新团队项目(SDAIT-12-011-12);山东省自然科学基金项目(ZR2014CQ012)。
李天芝(1985-),女,山东菏泽人,助理研究员,硕士,主要从事动物传染病诊断技术研究工作。
