蛇毒金属蛋白酶抑制剂重组蛋白抗肿瘤血管生成作用及其机制
2017-03-17纪明开陈丽红林建银
纪明开,陈丽红,程 波,师 仪,林 旭,林建银
(1.福建医科大学附属第一医院皮肤科,福建 福州 350004;2.福建省肿瘤医院病理科,福建 福州 350014;3.福建医科大学分子医学研究中心,消化道恶性肿瘤教育部重点实验室,福建 福州 350004)
蛇毒金属蛋白酶抑制剂重组蛋白抗肿瘤血管生成作用及其机制
纪明开1,3,陈丽红1,程 波1,师 仪2,林 旭3,林建银3
(1.福建医科大学附属第一医院皮肤科,福建 福州 350004;2.福建省肿瘤医院病理科,福建 福州 350014;3.福建医科大学分子医学研究中心,消化道恶性肿瘤教育部重点实验室,福建 福州 350004)
目的 研究蛇毒金属蛋白酶抑制剂重组蛋白(recombinant snake venom metalloproteinase inhibitor,rSVMPI)对血管生成的影响及其分子机制。方法 应用鸡胚绒毛尿囊膜(chicken chorioallantoic membrane,CAM)血管生成模型观察SVMPI重组蛋白对血管生成的影响;采用Alamar Blue分析方法检测人脐静脉内皮细胞(human umbilical veins endothelial cells,HUVECs)增殖能力、Annexin V-FITC双标记流式细胞术检测细胞凋亡、划痕标记法检测细胞体外迁移能力、Boyden小室分析方法检测细胞体外趋化能力及管腔形成法检测体外血管新生能力;通过real-time PCR及Western blot检测重组蛋白处理后的HUVECs KDR、FGFR-1表达。结果 rSVMPI减少鸡胚尿囊膜新生血管密度指数,减弱由VEGF诱导的HUVECs趋化能力,抑制HUVECs体外新生小管的形成,降低HUVECs细胞KDR和FGFR-1的表达水平。结论 rSVMPI可能通过阻断VEGF-KDR或bFGF-FGFR信号转导途径,发挥抑制血管生成的作用。
蛇毒;基质金属蛋白酶抑制剂;重组蛋白;表达纯化;血管生成; 信号转导
肿瘤血管生成是肿瘤生长、侵袭和转移的关键步骤,也是肿瘤靶向治疗的主要研究领域之一,抑制肿瘤血管生成已被公认为一种较为有效的抗癌策略[1]。近年来许多研究表明,作为基质金属蛋白酶(matrix metalloproteinase,MMP)抑制物的基质金属蛋白酶抑制剂(TIMP),除了抑制MMP的活性外,还具有抑制血管生成的作用[2]。
蛇毒金属蛋白酶抑制剂SVMPI是来自美洲矛头蝮(Bothrops jararaca)血清的一类金属蛋白酶抑制剂,属cystatin超家族的胎球蛋白(fetuin)家族成员,具有抗肿瘤侵袭转移作用的潜能。实验室前期已成功构建毕赤酵母表达质粒pPICZαA-SVMPI,获得GS115-SVMPI转化子,建立稳定的蛇毒金属蛋白酶抑制剂重组蛋白(recombinant snake venom metalloproteinase inhibitor,rSVMPI)制备工艺,获得高纯度、高活性的rSVMPI。我们前期研究结果表明,rSVMPI可抑制肿瘤细胞MMP-2/MMP-9的活性,我们推断rSVMPI可能具有抑制血管生成的作用。另外,本实验室的前期工作亦表明rSVMPI具有抑制小鼠黑色素瘤细胞B16F10 和人肝癌细胞MHCC97H肿瘤血管生成作用的潜能[3]。为此,本研究应用鸡胚尿囊膜血管生成模型及分子生物学技术,进一步观察和评价rSVMPI对血管生成的影响及其分子机制,为将rSVMPI开发为抗肿瘤侵袭转移的新药提供理论依据和实验基础。
1 材料
1.1 菌株、细胞与种蛋 GS115-SVMPI菌株由本实验室构建保存;原代人脐静脉内皮细胞(HUVEC)取自健康剖腹产孕妇的脐静脉。种蛋购自福州农工商种禽公司。
1.2 试剂与仪器 酵母培养基YNB(yeast nitrogen base )和EnzChek Gelatinase/Collagenase Assay Kit购自Invitrogen公司;蛋白胨(peptone)购自Sigma公司;酵母提取物购自Difco公司;Prestained protein ladder(P7709)购自New England BioLab公司; BCA蛋白浓度测定试剂盒为碧云天公司产品;Ni Sepharose 6 Fast Flow(Cat#:17-0921-07)为GE Healthcare产品;M199培养基、胰蛋白酶/EDTA、胎牛血清购自美国Gibco公司; vWF(Cat#: sc-21784)、FGFR-1(Cat#: sc-121)、KDR (Cat#: sc-48161) 一抗均为Santa Cruz公司产品;SP超敏试剂盒、DAB显色系统购自福州迈新公司,其余试剂均为进口或国产分析纯。
凝胶成像系统(Syngene公司);大容量摇床(Thermo Electron公司);大容量冷冻离心机(Beckman公司);垂直蛋白电泳仪(Pharmacia Biotech公司);电穿孔仪(Gene Pulser II BioRad 公司);超净工作台(苏州安泰空气技术公司);荧光分光光度计[Spectrofluorophotometer, RF-5301(PC)S, Shimadzu corporation, Japan]; AKTATMprime protein purification system(GE通用公司);Rotor-Gene 3000 real-time PCR system(Corbett Research,UK);Model 550 酶标仪(Bio-Rad 公司);流式细胞仪(美国贝克曼公司)。
2 方法
2.1 SVMPI在巴斯德毕赤酵母(pichia pastoris)系统中的分泌表达、纯化、鉴定及保存 根据文献[4],将GS115-SVMPI菌接种于含25 mL BMGY培养液的摇瓶中,添加纯甲醇诱导,离心,收集上清,加入ProBondTM树脂纯化柱纯化,收集纯化蛋白进行11%Tris-Tricine电泳后,将蛋白电转移至PVDF转印膜(Amersham),进行免疫印迹分析。一抗为鼠抗c-myc单克隆抗体(购自Invitrogen公司,以封闭液1 ∶1 000稀释后使用),二抗、封闭液、洗液及化学发光检测系统均WesternBreeze Chromogenic Western Blot Immunodetection Kit(Cat#: WB7105, Invitrogen)组分,具体操作参见试剂盒说明书。将上述纯化后的重组蛋白进行Tris-Tricine聚丙烯酰胺凝胶电泳检测分析(4%浓缩胶、11%分离胶),R-250染色过夜。质谱测定:分离目的蛋白,送复旦大学生物医学研究院测定。
2.2 rSVMPI对鸡胚尿囊膜(chicken chorioallantoic membrane,CAM)血管生成的影响[5]7 d鸡胚蛋酒精擦拭消毒后,放37℃培养箱孵育,钝端(大头端)气室向上,呈45°倾斜放置。将胚蛋置检卵灯下寻找气室位置,在距胚头前1 cm,两条前卵黄静脉之间的卵壳投影部位或正对鸡胚的位置,标记1.0 cm×1.5 cm的开窗位置,75%酒精消毒后,用牙科钻钻约1.0~2.0 mm小孔,并穿透气室壳膜,眼科镊去除长方形区域内卵壳及卵壳膜。用1 mL注射器往卵壳膜与尿囊膜交接处血管较少的卵壳膜处轻轻插入并注射100 μL的无菌PBS(注射时针头往上挑,避免刺破下方的尿囊膜),轻轻晃动胚蛋,置于培养箱中几分钟后,用眼科镊轻轻撕掉这层卵壳膜。
选择定性滤纸,用打孔器制成直径5 mm的圆片,双蒸水润湿,湿热高压灭菌,烘干备用。将制备好的直径5 mm定性滤纸圆片置于CAM和卵黄囊膜外2/3血管相对较少的部位(肉眼观),然后用微量进样器向滤纸分别加入终浓度为100、200、400 mg·L-1的rSVMPI(20 μL),对照组加入等量PBS,每个浓度12个胚蛋。无菌透明胶带封住卵窗,标记后,置37℃培养箱继续孵育72 h。揭去封窗的透明膜,数码相机拍照记录结果,用图像分析软件Image-Pro Plus 6.0处理图像,计数测量区(以加药部位为中心,直径为1 cm的圆)血管数目,计算单位面积的血管密度指数(vascular density index),并且根据下列公式计算血管抑制率(inhibition rate,IR)。
2.3 rSVMPI对人脐静脉内皮细胞(human umbilical veins endothelial cells, HUVECs)生物学特性的影响
2.3.1 HUVECs原代培养及鉴定[6]HUVECs来自健康剖腹产孕妇的脐静脉。具体方法如下:脐带剪下后,立即浸泡在4 ℃含双抗灭菌的PBS溶液中,用含双抗灭菌PBS溶液冲洗脐静脉腔至液体变清亮。将37 ℃预温的1% Ⅱ型胶原酶约12 mL注入脐静脉腔,37 ℃孵育15 min。用约4 mL胎牛血清中止胶原酶消化作用后,再用约45 mL含双抗灭菌的PBS溶液反复冲洗脐静脉腔,洗液经1 200 r·min-1离心10 min,收集沉淀的HUVECs,悬浮于含20%胎牛血清、20 000 U·L-1青霉素、20 000 U·L-1链霉素和0.3 g·L-1谷氨酰胺的M199培养基,接种于0.2%明胶包被的培养瓶中,37℃、5% CO2培养至细胞融合后,取部分细胞爬片,用vWF抗体直接免疫标记法鉴定HUVECs细胞。细胞至80%~90%融合时,0.25%胰蛋白酶消化,用含10%胎牛血清的M199常规传代培养,取第3~4代对数生长期的HUVECs用于后续实验。
2.3.2 rSVMPI对HUVECs体外生长增殖能力的影响 采用改良的AlamarBlue分析方法[7]进行检测,将处于对数生长期的HUVECs用0.25%胰酶消化后,分别悬浮于10% FBS-RPMI 1640和10% FBS-DMEM培养液,并用血球计数板计数,将其配制为1×106·L-1浓度的单细胞悬液,接种于96孔细胞培养板中,每孔100 μL,置于37℃ CO2培养箱培养,待细胞贴壁后,分别加入终浓度为(25、50、100、200、400 mg·L-1)的rSVMPI培养液,同时设立对照组,每组设5个复孔。分别在 24、48、72、96、120 h终止培养,酶标仪测定细胞在550 nm、595 nm两波长OD值,计算细胞还原率,比较3组细胞增殖情况。每组设5个复孔。
2.3.3 rSVMPI对HUVECs体外凋亡的影响 采用Annexin V-FITC双标记流式细胞术检测rSVMPI诱导HUVECs早期凋亡。将处于对数生长期的HUVECs细胞制成单细胞悬液,按每孔3×105浓度接种于12孔细胞培养板常规培养,待贴壁后,分别加入终浓度为25、50、100、200、400 mg·L-1的rSVMPI,设立PBS对照组,作用24 h后,离心收集细胞,PBS洗涤离心2次,顺序加入195 μL Annexin V-FITC结合液(1×) 和5 μL Annexin V-FITC,轻轻重悬细胞,轻轻混匀。室温(20~25℃)避光孵育10 min。1 000 r·min-1离心5 min,弃上清,加入190 μL Annexin V-FITC结合液(1×)轻轻重悬细胞,加入10 μL碘化丙啶染色液,轻轻混匀,进行流式细胞仪检测。每组实验重复3次。
2.3.4 rSVMPI对HUVECs体外趋化能力的影响 根据文献采用Boyden小室分析方法[8]进行检测。Transwell小室置于24孔细胞培养板中,取-80°C冻存的Matrigel(8.6 g·L-1)与无血清的细胞培养液于冷EP管中以1 ∶3稀释,混匀后,取20 μL滴加在小室聚碳酸酯膜内侧。取-80℃冻存的Fibronectin(1 g·L-1)与无血清细胞培养液于冷EP管中以1 ∶1稀释,混匀后,取20 μL滴加在小室聚碳酸酯膜外侧。收集对数生长期的HUVECs细胞,PBS洗涤,重悬于分别含有终浓度为25、50、100、200、400 mg·L-1rSVMPI的1%FBS培养液中,于37 ℃、5% CO2温育2 h后,以每孔1×105个细胞加入小室上室,下室加700 μL含10%FBS 及VEGF(终浓度为20 mg· L-1)的细胞培养液,置37 ℃、5% CO2培养24 h,取出小室,弃除上室液体,PBS洗涤,用棉签擦尽上室膜面未穿膜的细胞及Matrigel,室温下结晶紫染色10 min,PBS小心冲洗,200倍光镜下计数5个视野的侵袭细胞数,取其平均值,以侵袭细胞的相对数目表示肿瘤细胞的侵袭能力,每个浓度设5个复孔。
侵袭抑制率/%=

2.3.5 划痕标记法检测HUVECs体外运动能力 每孔用250 μL的FN(10 mg·L-1)包被24孔培养板,每孔加入250 μL含0.1% BSA 的无血清培养液,37℃孵育1 h。将常规传代的细胞消化洗涤后,以每孔 2×105个/500 μL的密度接种入包被好的24 孔板,细胞融合后,换成无血清培养基培养12 h,使细胞同步化。用移液器滴头沿培养板底部呈“一”字型1 mm划痕,镜下记录划痕区相对距离,PBS轻轻洗涤2次以去除细胞碎片,无血清培养液洗涤后,更换含2%血清的培养基(实验组分别为含25、50、100、200、400 mg·L-1的rSVMPI),继续培养24 h,观察划痕区细胞的生长情况。
2.3.6 rSVMPI对HUVECs体外血管新生能力的影响 采用管腔形成法[9](tube formation)进行检测。在96孔培养板中每孔分别加入20 μL Matrigel(5 g·L-1)进行包被,置37℃、5%CO2孵育1 h,PBS轻轻冲洗2次,HUVECs细胞收集后以PBS洗2次,以每孔1.5×104个细胞加到已包被好的96孔培养板,融合30 min后,待细胞融合后分别加入终浓度为25、50、100、200、400 mg·L-1的rSVMPI,设立PBS对照组。常规培养细胞12、24、36 h后,分别取出96孔板,显微镜下观察,200倍光镜下每孔随机选取5个视野并照相,计算HUVECs形成的小管样结构(tubule-like structure, TLS)数量,采用Image Tools 3.00分析软件进行分析。
2.3.7 rSVMPI对HUVECs细胞KDR、FGFR-1表达的影响
2.3.7.1 荧光实时定量PCR(real-time PCR)分析目的基因表达 rSVMPI(100 mg·L-1)作用于HUVECs细胞,同时设立对照组。TRIzol一步法提取不同浓度处理的各组HUVECs细胞总RNA,按照常规方法逆转录,采用SYBR Green法实时定量分析各组目的基因mRNA表达,以GAPDH为管家基因,采用2-ΔΔCt法计算基因表达的相对变化。各目的基因引物序列见Tab 1。

Tab 1 The primer senquence of real time PCR
2.3.7.2 免疫印迹(Western blot)验证目的基因表达 不同组别的细胞经RIPA裂解后离心,并保留上清液,测定上清液蛋白浓度。取等量蛋白进行SDS-PAGE凝胶电泳分离样品;将蛋白电转移至PVDF膜,进行Western blot分析,一抗及工作浓度分别是:KDR(1 ∶500),bFGFR(1 ∶800),以β-tubulin(1 ∶1 000)作为内参照,计算蛋白表达的相对变化。
2.4 统计学分析 应用SPSS 13.0软件进行分析。
3 结果
3.1 SVMPI在pichia pastoris系统中的表达、纯化及鉴定 纯化的rSVMPI经Tris-Tricine电泳及ImageQuant TLv2003.03软件分析,纯度高达98.06%,产量为10.15 mg·L-1,分子质量约为57.9 ku,考虑所表达的目的蛋白因为糖基化所致,用EndoH糖苷酶酶切后分子质量为38 ku。而通过Vector NT I软件计算分子质量约为36.867 2 ku,由于酵母表达载体含His和c-myc标签(约2.5 ku),故rSVMPI的分子质量应为二者相加,测得实际分子质量为38.754 ku,理论和实际相符合。采用免疫印迹技术鉴定GS115-SVMPI表达上清及纯化的重组蛋白,结果显示,表达上清及纯化后产物均在57.9 ku处有一明显的免疫印迹条带,而GS115-pPICZαA培养上清泳道未出现此条带,表明表达产物为rSVMPI。纯化后的重组蛋白经聚丙烯酰胺凝胶电泳后,挖胶送质谱分析,测序结果与理论序列一致,表明经过表达、分离纯化所获得的产物为rSVMPI,EnzChek Gelatinase/Collagenase Assay Kit检测rSVMPI,选择有活性的重组蛋白保存在-20℃冰箱,作为后续实验的材料。
3.2 rSVMPI对CAM血管生成的影响 为进一步评价rSVMPI对肿瘤血管生成的影响,我们选用CAM模型进行体外实验。结果如Fig 1所示,对照组CAM血管生长良好,呈叶脉样、放射状分布,结构清晰,主血管粗状,长势旺盛。rSVMPI处理组新生毛细血管生成受到明显抑制,血管密度降低,管径变细,结构被破坏,呈透明或模糊样结构,颜色变浅,血管分支多处断开,分布零乱,而且产生视觉可见的无血管区域,未见周围血管呈放射状朝向滤纸生长的“血管辐辏现象”,也未发现主干血管向载体弯曲或靠近的“血管吸引现象”;rSVMPI各处理组的血管密度指数分别为(68.51±5.3)、(56.34±5.8)和(52.56±2.6),抑制率分别为14.2%、29.4%和34.2%, 呈剂量依赖性, 与对照组(79.83±6.2)相比,差异具有统计学意义(P<0.05)。
3.3 rSVMPI对HUVECs生物学功能的影响
3.3.1 HUVECs原代培养及鉴定 分离HUVECs后进行原代培养,应用形态学结合免疫细胞化学检测来鉴定,镜下观察到培养的原代细胞呈菱形或多角形,贴壁生长,汇合成片后呈铺路石样排列。体积大,胞质丰富,细胞排列均匀,偶见双核。采用消化的第2代细胞,应用内皮细胞特异性vWF标记血管内皮细胞,胞质染色呈棕黄色,阳性率≥97%,证实这些细胞为HUVECs,选择阳性的细胞用于后续实验。

Fig 1 Effect of rSVMPI on CAM vasculargenesis(n=12)
A: CAM vasculargenesis. a: control; b: 100 mg·L-1rSVMPI; c: 200 mg·L-1rSVMPI; d: 400 mg·L-1rSVMPI. B: The vascular density index of CAM by rSVMPI treatment.*P<0.05vscontrol
3.3.2 rSVMPI对HUVECs体外生长增殖能力的影响 HUVECs分别用25、50、100、200、400 mg·L-1的rSVMPI处理不同时间后,AlamarBlue法测定吸光度。结果显示,与对照组比较,5种不同浓度的rSVMPI处理后的HUVECs体外生长速度未见明显改变(P>0.05),表明rSVMPI对HUVECs细胞的体外生长无明显影响。
3.3.3 rSVMPI对HUVECs体外凋亡的影响 HUVECs用25、50、100、200、400 mg·L-1的rSVMPI处理24 h后,采用Annexin V-FITC双标记流式细胞术检测HUVECs细胞早期凋亡。结果显示,各组经rSVMPI作用后见少量凋亡细胞,但与对照组比较,差异没有统计学意义(P>0.05),表明rSVMPI不能诱导HUVECs凋亡。
3.3.4 rSVMPI对HUVECs体外迁移运动能力的影响 细胞划痕实验结果显示,划痕后24 h处理组细胞迁移能力有所减弱,但与对照组相比,差异没有统计学意义(P>0.05,n=5)。
3.3.5 rSVMPI对HUVECs体外趋化能力的影响 应用改良的Boyden小室检测25、50、100、200、400 mg·L-1的rSVMPI处理24 h后,HUVECs穿越重建基底膜的细胞数,结果如Fig 2所示,5种不同浓度的rSVMPI处理后穿越重建基底膜的HUVECs细胞数目分别是(40.4±2.7)、(36.8±1.5)、(27.8±1.3)、(23.6±2.3)和(19.7±1.9),与对照组(60.8±2.9)相比,差异有统计学意义(P<0.01),趋化抑制率分别是33.55%、39.47%、54.28%、61.18%和 67.6%。

Fig 2 Effect of rSVMPI on HUVECs chemotaxis (×200)
A:HUVECs migrated to the bottom face of the membrane. a:control; b:25 mg·L-1rSVMPI;c:50 mg·L-1rSVMPI; d:100 mg·L-1rSVMPI; e:200 mg·L-1rSVMPI; f:400 mg·L-1rSVMPI. B:The number of cell chemotaxis by rSVMPI treatment.**P<0.01vscontrol
3.3.6 rSVMPI对HUVECs新生小管生成能力的影响 HUVECs用25、50、100、200、400 mg·L-1的rSVMPI处理不同时间后,观察小管样结构(TLS) 的形成情况。结果如Fig 3A所示,在包被Matrigel的培养板中,HUVECs细胞会自发生首尾相连,胞体细长,或几个胞体环抱,末端回折形成管样结构,或几个细胞胞体相互连接形成管样结构,这种类似条索样管腔形成现象,称为小管样结构。 HUVECs用5种不同浓度的rSVMPI处理后,分别在12、24、36 h观察小管样结构的形成,可见其数量均明显减少,与对照组相比,差异均具有统计学意义(Fig 3B)。
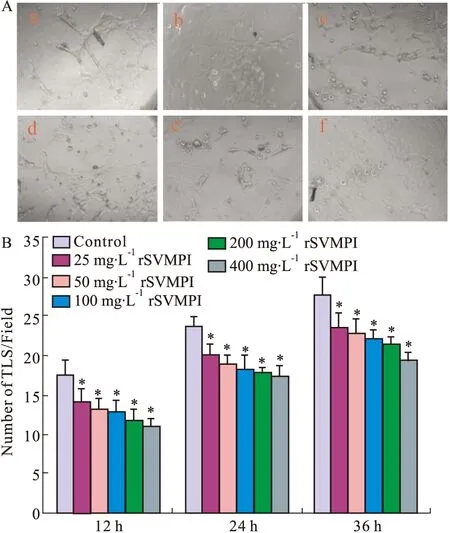
Fig 3 Effect of rSVMPI on TLS of HUVECs
A: TLS of HUVEC after 24 h(×200). a:control; b:25 mg·L-1rSVMPI; c:50 mg·L-1rSVMPI; d:100 mg·L-1rSVMPI; e:200 mg·L-1rSVMPI; f: 400 mg·L-1rSVMPI; B: The number of TLS after 12 h, 24 h, 36 h.*P<0.05vscontrol
3.3.7 rSVMPI对HUVECs细胞 KDR、FGFR-1表达水平的影响 鉴于KDR与FGFR-1所介导的信号转导通路在肿瘤血管生成过程中的重要作用,本实验采用实时定量PCR和免疫印迹技术分析rSVMPI对HUVECs细胞KDR、FGFR-1 mRNA和蛋白表达水平的影响。结果如Fig 4、5所示,rSVMPI处理组中的KDR和FGFR-1mRNA的相对表达量分别是0.605和0.804,差异具有统计学意义(P<0.05);与对照组相比较,rSVMPI处理组中的KDR和FGFR-1的蛋白表达水平明显下降(P<0.05),并呈剂量依赖性。这些资料表明rSVMPI可抑制HUVECs细胞KDR和FGFR-1的表达。
4 讨论
肿瘤血管生成是多因素参与,多步骤的复杂过程,主要包括血管内皮细胞的增殖、迁移,细胞外基质的降解,管状结构形成等多个环节。其中最重要的一环就是血管内皮细胞的增殖、侵袭和迁移。原代培养的HUVECs是体外研究血管生成最理想的工具,HUVECs新生小管生成能力已成为判断血管生成的重要指标[9]。本研究结果表明,5种浓度的rSVMPI均能明显抑制HUVECs的趋化能力和HUVECs的小管形成能力,而对HUVECs增殖和凋亡没有影响。CAM是高度血管化的、附着于蛋壳内面、薄而透明的膜结构,在剔除其他干扰因素情况下,通过探讨药物对CAM血管生成的抑制作用,可直接证明药物的抗血管生成功效。该方法最初由Lewis等于1931年建立,用来研究胚胎组织移植物发育的潜能。1975年,Folkman等将CAM法首先应用于肿瘤血管生成的研究,具有简单、方便、价格便宜、观察指标明了等优势,是研究抗血管生成药物经典且理想的体内实验方法。本实验通过CAM法探讨了 rSVMPI 的抗血管生成活性,结果显示,随着rSVMPI剂量的不断增加,尿囊膜新生毛细血管也相应减少,体内抗血管生成方面具有很大的潜力。本实验室先前的研究表明,SVMPI基因转染具有抑制B16F10血管生成拟态的能力[10]。综上所述,这些资料证明rSVMPI具有较强的抑制肿瘤血管生成作用。

Fig 4 Effect of rSVMPI on expression levels of KDR and FGFR-1 in HUVECs by real-time PCR
A. The amplification plots and dissociation curve of real time PCR. a,b:GAPDH; c,d:KDR; e,f:FGFR-1. B:Relative expression levels of KDR and FGFR-1 in HUVECs by rSVMPI treatment.*P<0.05vscontrol

Fig 5 Immunoblot analysis of KDR and FGFR-1 in HUVECs by rSVMPI treatment
A: Immunoblot analysis of KDR and FGFR-1; B: The ratio of KDR and FGFR-1vsβ-tubulin respectively.*P<0.05vscontrol
rSVMPI抑制肿瘤血管生成的机制尚不清楚。肿瘤血管生成是肿瘤细胞与血管内皮细胞及其周围微环境共同作用的结果。肿瘤细胞所分泌的VEGF和bFGF是2种重要的血管生成促进因子,它们同内皮细胞上的受体KDR和FGFR结合,激活内皮细胞信号传导途径,释放MMPs,促进内皮细胞增殖、迁移、降解细胞外基质、侵袭基底膜,最终形成新的血管[11-13]。鉴于KDR与FGFR-1所介导的信号转导通路在肿瘤血管生成过程中的重要作用,本实验采用实时定量PCR和免疫印迹技术分析rSVMPI对HUVECs细胞KDR、FGFR-1 mRNA和蛋白表达水平的影响,结果显示rSVMPI可明显降低HUVECs细胞KDR和FGFR-1的表达水平。这些资料证明rSVMPI可能通过阻断VEGF-KDR或bFGF-FGFR/MMPs信号转导途径,抑制肿瘤血管生成。
综上所述,本研究初步证明rSVMPI可能通过阻断VEGF-KDR或bFGF-FGFR信号转导途径,发挥抑制血管生成的作用,为将rSVMPI开发为抗肿瘤药物提供了理论依据和实验数据。
[1] 陈锡强,程丽芳,徐新刚,等.熊果酸对斑马鱼血管生成及斑马鱼移植癌的抑制作用[J]. 中国药理学通报, 2015,31(7):1004- 8.
[1] Chen X Q,Cheng L F,Xu X G, et al.Inhibition of ursolic acid on angiogenesis and xenografts in zebrsfish (danio rerio)[J].ChinPharmacolBull, 2015,31(7): 1004- 8.
[2] Abdalla D R,Simoens C,Bogers J P, et al.Angiogenesis markers in gynecological tumors and patents for anti-angiogenic approach: review[J].RecentPatAnticancerDrugDiscov,2015,10(3):298-307.
[3] Ji M K, Shui Y, Xu J W, et al. Recombinant snake venom metalloproteinase inhibitor BJ46A inhibits invasion and metastasis of B16F10 and MHCC97H cells through reductions of matrix metalloproteinases 2 and 9 activities[J].AnticancerDrugs, 2013, 24(5):461-72.
[4] Shi Y, Ji M K, Xu J W et al.High-level expression, purification, characterization and structural prediction of a snake venom metalloproteinase inhibitor in pichia pastoris[J].ProteinJ,2012,31(3):212-21.
[5] Montecorboli U, Annese T, Marinaccio C, et al. Angiogenesis and hyperbaric oxygen in the chick embryo chorioallantoic membrane[J].IntJDevBiol,2015,59(10):461-4.
[6] Rossig L, Hermann C, Haendeler J, et al. Angiotensin II-induced upregulation of MAP kinase phosphatase-3 mRNA levels mediates endothelial cell apoptosis[J].BasicResCardiol, 2002, 97(1): 1-8.
[7] Pettit R K, Weber C A, Kean M J, et al. Microplate Alamar blue assay for Staphylococcus epidermidis biofilm susceptibility testing [J].AntimicrobAgentsChemother, 2005,49(7): 2612-7.
[8] Yeh C H, Peng H C, Yang R S, et al. Rhodostomin, a snake venom disintegrin, inhibits angiogenesis elicited by basic fibroblast growth factor and suppresses tumor growth by a selective alpha(v) beta(3) blockade of endothelial cells[J].MolPharmacol, 2001,59(5): 1333-42.
[9] 席 聪,安 睿,李海勋,等. rAAV-PR39-ADM 防治大鼠脑缺血 /再灌注损伤的研究[J]. 中国药理学通报,2015, 31(5):641-7.
[9] Xi C,An R,Li H X, et al. Research on prevention and treatment effect of rAAV-PR39-ADM in cerebral ischemia reperfusion injury in rats[J].ChinPharmacolBull, 2015, 31(5): 641-7.
[10]徐剑文,林建银,林 旭,等.蛇毒金属蛋白酶抑制剂对小鼠黑色素转移瘤血管生成拟态形成的影响[J]. 解剖学杂志,2009,32(4): 466-8.
[10]Xu J W, Lin J Y, Lin X, et al. Influence of snake venom metalloproteinase inhibitor BJ46a on mouse melanoma vasculogenic mimicry[J].ChinJAnat, 2009, 32(4):466-8.
[11]Li L,Pan Y,Dai L, et al. Association of genetic polymorphisms on vascular endothelial growth factor and its receptor genes with wusceptibility to coronary heart disease[J].MedSciMonit, 2016, 22(4):31-40.
[12]Omar H A,Arafa el-S A,Salama SA, et al. OSU-A9 inhibits angiogenesis in human umbilical vein endothelial cells via disrupting Akt-NF-κB and MAPK signaling pathways[J].ToxicolApplPharmacol,2013,272(3):616-24.
[13]Yi E Y,Kim Y J. Xylitol inhibitsinvitroandinvivoangiogenesis by suppressing the NF-κB and Akt signaling pathways[J].IntJOncol,2013,43(1):315-20.
The inhibition effects and mechanism of recombinant snake venom metalloproteinase inhibitor on tumor angiogenesis
JI Ming-kai1,3,CHEN Li-hong1, CHENG Bo1,SHI Yi2,LIN Xu3, LIN Jian-yin3
(1.DeptofDermatology,theFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350004,China;2.DeptofMolecularPathology,FujianProvincialTumorHospital,Fuzhou350014,China; 3.ResearchCenterofMolecularMedicine,KeyLaboratoryofEducationforGastrointestinalCancer,FujianMedicalUniversity,Fuzhou350004,China)
Aim To investigate the effect of recombinant snake venom metalloproteinase inhibitor (rSVMPI) on neovascularization and its molecular mechanism. Methods Chicken chorioallantoic membrane (CAM) assay was used to examine the antiangiogenic effect of rSVMPI. Alamar blue analysis was used to detect cell proliferation. Annexin V-FITC double labeling flow cytometry was used to assay cell apoptosis. Scratch marker was used to assay cell migration. Boyden chamber analysis method was used to detect cells chemotaxisinvitro. Tube like structure(TLS) of HUVECs was used to detect the ability of neovascularizationinvitro. Real-time PCR and Western blot were used to assay the expressions of KDR and FGFR-1 in HUVECs. Results The vascular density index (VDI) of CAM was drastically decreased after rSVMPI treatment, chemotaxis of HUVECs in response of VEGF was inhibited in the presence of rSVMPI, TLS of HUVECs was less than control group. The expressions of KDR and FGFR-1 were down-regulated by real-time PCR and Western blot assay. Conclusion rSVMPI may inhibit neovascularization by blocking the VEGF-KDR or bFGF-FGFR signal transduction pathway.
snake venom; matrix metalloproteinase; recombinant protein; expression and purification; neovascularization; signal transduction
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.040.html
2016-10-14,
2016-12-17
福建省卫生系统中青年骨干人才培养项目(No 2014-ZQN-JC-17)
纪明开(1974-),男,博士,副教授,副主任医师,研究方向:肿瘤分子生物学、生物工程,E-mail:mingkai_ji@163.com; 林建银(1945-),男,硕士,教授,博士生导师,研究方向:肿瘤分子生物学,通讯作者,Tel:0591-83569132,E-mail:jylin@mail.fjmu.edu.cn
10.3969/j.issn.1001-1978.2017.03.020
A
1001-1978(2017)03-0394-07
R-332;R322.123;R329.24;R364.3;R977.6;R996.3
