浙江省12个区(县)分枝杆菌菌种鉴定及耐药相关基因特征分析
2017-03-16徐凯进嵇仲康胡海洋毕晟胡飞枢郑琳金秀媛徐文杰王淑婷杨美芳邵俊丹李鹏程黄艳芳盛吉芳李兰娟
徐凯进 嵇仲康 胡海洋 毕晟 胡飞枢 郑琳 金秀媛 徐文杰 王淑婷 杨美芳 邵俊丹 李鹏程 黄艳芳 盛吉芳 李兰娟
·论著·
浙江省12个区(县)分枝杆菌菌种鉴定及耐药相关基因特征分析
徐凯进 嵇仲康 胡海洋 毕晟 胡飞枢 郑琳 金秀媛 徐文杰 王淑婷 杨美芳 邵俊丹 李鹏程 黄艳芳 盛吉芳 李兰娟
目的 了解浙江省12个区(县)分枝杆菌菌种流行情况及结核分枝杆菌的INH、RFP耐药相关基因特征。方法 收集2012年1月至2016年6月浙江省12个区(县)初诊为菌阳肺结核患者的2803株临床分离菌株标本,运用基因芯片技术进行菌种鉴定和INH、RFP耐药检测。结果 2803份菌株中,NTM占7.3% (205株),前6位菌种为:胞内分枝杆菌101株,堪萨斯分枝杆菌50株,龟-脓肿分枝杆菌24株,鸟分枝杆菌16株,偶然分枝杆菌4株,浅黄色分枝杆菌1株;2598株MTB中耐INH者占12.5% (326株),耐RFP 者占9.8% (254株),MDR 占6.7% (173株)。425株MTB耐药突变位点结果中,katG315位点占INH耐药突变的81.1% (279/344),rpoB531位点占RFP耐药突变的56.6% (155/274)。结论 通过涂片诊断肺结核患者中有13.5% (378/2803)为NTM和MDR感染,INH耐药的主要突变位点是katG315,RFP耐药的主要突变位点是rpoB531,在基层医疗机构积极推行分枝杆菌菌种鉴定技术和耐药检测技术将有利于加快我国结核病疫情控制。
分枝杆菌, 结核; 分枝杆菌, 非典型性; 抗药性, 多种, 细菌; 基因, MDR; 点突变; 数据说明, 统计
非结核分枝杆菌(nontuberculous mycobacteria, NTM)是泛指结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex, MTBC)和麻风分枝杆菌(Mycobacteriumleprae)以外的分枝杆菌[1-2],抗酸染色呈阳性是两者的共同特征。MTB和 NTM均可引起肺部感染,出现的症状和肺部影像学表现非常相似, 临床上很难鉴别。与许多发展中国家一样,在中国痰涂片找抗酸杆菌仍然是许多基层卫生机构诊断肺结核的唯一细菌学依据,缺乏MTB培养、菌种鉴定、耐药检测能力。在此状况下,NTM、耐多药(multiple drug resistance, MDR) MTB感染均被诊断为肺结核,并接受国家推行的标准抗结核药物化疗方案治疗(2H-R-Z-E/4H-R或2H2-R2-Z2-E2/4H2-R2),误诊误治的结果导致病情迁移不愈,患者传染性持续存在,对患者与社会均造成了伤害。
掌握被基层医疗卫生机构初诊为“肺结核”的患者中,MDR与NTM感染所占比例,了解NTM的流行情况和INH与RFP相关耐药突变基因特征,对中国结核病防控策略的完善与修订具有现实意义,对其他国家的结核病防控也有一定的借鉴价值。笔者对浙江省12个县(市)初诊为菌阳肺结核患者的2803份临床分离菌株标本,运用基因芯片技术进行菌种鉴定和INH、RFP耐药检测,现将结果报告如下。
资料和方法
一、研究对象
2012年1月至2016年6月,浙江省12个区(县)共完成18 722例结核病疑似患者痰液培养,每份痰标本分别接种于2支罗氏固体培养基(Löwenstein-Jensen medium,L-J medium ),其中有2803份痰标本培养阳性并经过萋-尼染色法(Ziehl-Neelsen stain)证实为抗酸杆菌(acid-fast bacilli)。
二、 实验方法
1. 菌株来源地情况:浙江省位于中国东南沿海长江三角洲南翼,地势由西南向东北倾斜,可分为平原、丘陵、盆地、山地、沿海平原及岛屿等地形。选择浙江省12个区(县),分别为浙江省绍兴市柯桥区(原绍兴县)、桐乡市、舟山市普陀区、舟山市临城新区、桐庐县、湖州市吴兴区、湖州市南浔区、德清县、安吉县、三门县、玉环县和仙居县。上述区(县)涵盖了各种流行病学特征,不同流行学水平,高中低经济发展程度,山区、平原、海岛不同地形。12个区(县)覆盖人口582.16万名(2010年数据),分别为绍兴柯桥区72.70万名,桐乡市67.4万名,舟山市普陀32.13万名,舟山定海区临城新区37.59万名,桐庐县40.25万名,湖州市吴兴区59.85万名,湖州市南浔区49.06万名,德清县43万名,安吉县45.77万名,三门县42.92万名,玉环县41.96万名,仙居县49.53万名[3]。2012年,在以上区(县)实行结核病疑似患者[咳嗽、咯痰≥2周,和(或)胸部X线检查有可疑结核病灶]分枝杆菌培养,并收集所有培养阳性的菌株,利用基因芯片技术进行INH、RFP耐药突变检测和分枝杆菌菌种鉴定,分析MDR与NTM感染的现况。
2. 分枝杆菌菌种鉴定:采用北京博奥生物(CapitalBio)生产的分枝杆菌菌种鉴定试剂盒(mycobacteria identification array kit)进行鉴定,该方法包含了17种分枝杆菌特异性的16s RNA探针(结核分枝杆菌、鸟分枝杆菌、胞内分枝杆菌、不产色分枝杆菌、蟾蜍分枝杆菌、耻垢分枝杆菌、金色分枝杆菌、土分枝杆菌、戈登分枝杆菌、草分枝杆菌、龟-脓肿分枝杆菌、浅黄色分枝杆菌、瘰疬分枝杆菌、偶然分枝杆菌、苏尔加分枝杆菌、海-溃疡分枝杆菌、堪萨斯分枝杆菌),能明确待检菌株是否为MTB和NTM,如果是NTM可进一步鉴定是否为前述的16种NTM之一[4-6]。实验步骤简述如下:用接种环从罗氏培养基收集菌株,加入核酸提取液,使用Extractor 36核酸快速提取仪振荡5 min,95 ℃水浴5 min,2348×g离心1 min,取上清液作为模板进行PCR,获得荧光标记的PCR扩增产物,将PCR产物95 ℃裂解10 min,获得的单链DNA置于冰水混合物中,与杂交缓冲液按比例混合,用微量移液器吹吸2次混匀,经盖片的加样孔加入杂交反应混合物,迅速盖上杂交盒并密封后放入杂交仪中,计时120 min。杂交反应结束后,将杂交盒水平取出拆开,将芯片取出,用晶芯®SlideWasherTM8芯片洗干仪自动洗涤除去非特异性杂交的背景染色。然后于离心机中60×g离心5 min,甩干后扫描。使用LuxScan 10K-B微阵列芯片扫描仪和相应软件进行信号的读取及结果判读。
3. MTB的耐药鉴定:采用北京博奥生物生产的结核分枝杆菌耐药基因检测试剂盒,该方法包含的RFP相关耐药突变检测位点有rpoB基因的 C531G、C531T、CG531AC、A526C、A526G、A526T、C526A、C526G、C526T、T533C、A516G、A516T、G516T、T511C、T511G、C513A、A513T、C522T;包含的INH相关耐药检测突变位点有katG基因的 G315A、G315C、G315T、C315及inhA基因的启动子区(-15)C-T突变型[7]。实验步骤同菌种鉴定。
三、统计学分析
利用SPSS 21.0 统计学软件进行描述性统计分析。
结 果
1.分枝杆菌菌种鉴定结果:2803份菌株中,MTB有2598株,占92.7%。NTM有205株,占7.3%;前6位菌种:胞内分枝杆菌101株,堪萨斯分枝杆菌50株,龟-脓肿分枝杆菌24株,鸟分枝杆菌16株,偶然分枝杆菌4株,浅黄色分枝杆菌1株。基因芯片检测结果提示9株为NTM,但未能分型确定具体的菌种,结果见表1。
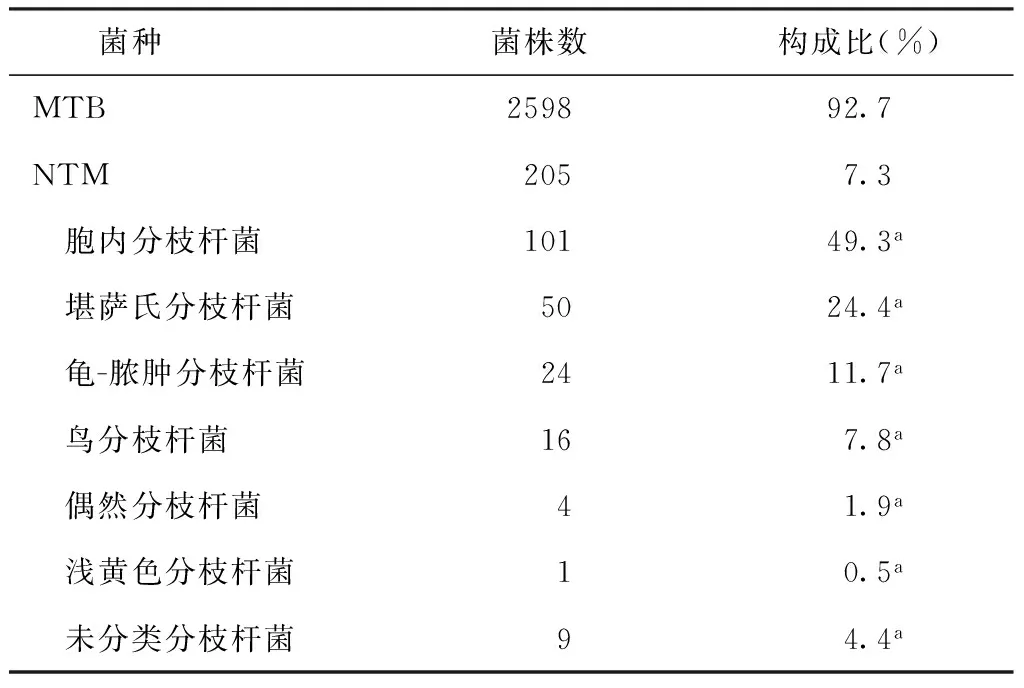
表1 2803株分枝杆菌的菌种鉴定情况
注a:为该菌种在所有NTM中所占比例
2. 耐药菌株鉴定:2598株MTB中,对INH、RFP均敏感者有2173株,占83.6%;MDR菌株有173株,占6.7%;单耐INH者有171株,单耐RFP者有81株(表2)。
对MTB耐药突变位点检测的结果提示,katG315是INH耐药的主要突变位点,与其相关的INH耐药突变占81.1%(279/344);rpoB531是RFP耐药的主要突变位点,与其相关的RFP耐药突变占61.0%(155/254)。254株耐RFP菌株的rpoB基

表2 2598株MTB对INH和RFP是否耐药的检测结果
因突变位点中,均为点突变,未见插入突变或缺失型突变;单位点突变 234例(92.1%),双位点突变 20 例(7.9% );常见突变位点为rpoB531者占61.0%(155/254)、rpoB526者占14.2%(36/254)、rpoB516者占13.4%(34/254)、rpoB511者占12.6%(32/254)、rpoB533者占5.1%(13/254)、rpoB513者占1.6%(4/254);MTB耐药突变位点的分布情况见表3、4。

表3 254株耐RFP菌株的rpoB基因突变位点检测结果

表4 344例耐INH菌株基因突变位点检测结果
讨 论
浙江省12个区(县)收集到的2803份菌株中分离到NTM、MDR共378株,占总菌株的13.5%;这些菌株的感染者如按照经验性使用国家推荐的标准方案(2H-R-Z-E/4H-R或2H2-R2-Z2-E2/4H2-R2)治疗,效果是无效或是效果不佳的[8]。如果能在基层医疗机构及疾病预防控制中心采取分枝杆菌菌种鉴定,在诊断初期及时甄别NTM与MTB感染,可提高结核病诊断的正确性,及时获得MDR感染信息并给予合理的治疗;如此就有希望提高结核病患者的治愈率,对控制结核病疫情将有很好的促进作用。
浙江省的状况在一定程度上反映了中国现阶段结核病防控方面存在的问题。县级医疗机构是中国结核病诊治工作的主要承担者,但目前有大部分的县级医疗机构不具备对MTB进行分离培养的能力,更无法进行MTB耐药检测与分枝杆菌菌种鉴定;由这些机构诊断的肺结核患者中可能有一部分患者是NTM或MDR感染,在治的化疗方案是不合理的[9]。中国是结核病高负担国家,为加快结核病疫情的控制,中国有必要在所有承担结核病诊治任务的基层医疗机构规划推行分枝杆菌菌种鉴定技术和耐药检测技术。
本研究显示,拟诊为肺结核的菌阳患者中,大约有7.3%的患者实际是NTM感染,我们应该高度重视NTM在结核病控制中的混杂干扰作用,避免误诊误治,减少医疗浪费,减轻患者的经济负担。在浙江省,胞内分枝杆菌、堪萨斯分枝杆菌、龟-脓肿分枝杆菌是最常见的NTM流行菌种,与前期报道基本一致[10]。类似韩国、日本、台湾[11-13],关于这些NTM感染患者的治疗与预防知识对于大部分临床医生还是很陌生的,加强知识的普及也是疾病防控工作中的重要环节[14]。
在MTB耐药突变位点资料中,所有菌株中存在耐INH位点突变的菌株占12.5%,其中单耐INH的菌株为6.6%;所有菌株中存在耐RFP位点突变的菌种占9.8%,其中单耐RFP的菌株为3.1%;可见RFP耐药位点突变后进一步转化为MDR菌株的概率要高一些[15],这些信息对结核病临床工作中进行耐药检测靶点、耐药预测的把握上有一定的参考价值。
[1] El Helou G,Viola GM,Hachem R,et al. Rapidly growing mycobacterial bloodstream infections. Lancet Infect Dis,2013,13(2):166-174.
[2] Menzies D,Nahid P. Update in tuberculosis and nontuberculous mycobacterial disease 2012. Am J Respir Crit Care Med,2013,188(8):923-927.
[3] 浙江省统计局,国家统计局浙江调查总队.浙江省统计年鉴(2011).北京:中国统计出版社,2011.
[4] Zhu L,Jiang G,Wang S,et al. Biochip system for rapid and accurate identification of mycobacterial species from isolates and sputum. J Clin Microbiol,2010,48(10):3654-3660.
[5] Pang Y,Zhou Y,Wang S,et al. Rapid molecular identification of mycobacterial species in positive culture isolates using the biochip test. Int J Tuberc Lung Dis,2011,15(12):1680-1685.
[6] Liu J,Yue J,Yan Z,et al. Performance assessment of the CapitalBio mycobacterium identification array system for identification of mycobacteria. J Clin Microbiol,2012,50(1):76-80.
[7] Guo Y,Zhou Y,Wang C,et al. Rapid and accurate determination of MDR inM.tuberculosisisolates and clinical sputum using a biochip system. Int J Tuberc Lung Dis,2009,13(7):914-920.
[8] Zhao Y, Xu S,Wang L,et al.National survey of drug-resistant tuberculosis in China.N Engl J Med,2012,366(23):2161-2170.
[9] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室. 2010年全国第五次结核病流行病学抽样调查报告. 中国防痨杂志,2012,34(8):485-508.
[10] Xu K,Bi S,Ji Z,et al. Distinguishing nontuberculous mycobacteria from multidrugr resistantMycobacteriumtuberculosis,China. Emerg Infect Dis,2014,20(6):1060-1062.
[11] Ryoo SW,Shin S,Shim MS,et al. Spread of nontuberculous mycobacteria from 1993 to 2006 in Koreans. J Clin Lab Anal,2008,22(6):415-420.
[12] Tsukamura M,Kita N,Shimoide H,et al. Studies on the nontuberculous lung mycobacteriosis in Japan. Kekkaku,1988,63(7):493-499.
[13] Chiang CY,Luh KT,Enarson DA,et al. Accuracy of classification of notified tuberculosis cases in Taiwan. Int J Tuberc Lung Dis,2007,11(8):876-881.
[14] McGrath EE,McCabe J,Anderson PB. Guidelines on the diagnosis and treatment of pulmonary non-tuberculous mycobacteria infection. Int J Clin Pract,2008,62(12):1947-1955.
[15] Zumla AI,Gillespie SH,Hoelscher M,et al. New antituberculosis drugs,regimens,and adjunct therapies: needs,advances,and future prospects. Lancet Infect Dis,2014,14(4):327-340.
(本文编辑:范永德)
Strain identification and analysis of drug resistance gene characteristics inM.tuberculosisstrains from 12 districts in Zhejiang Province
XUKai-jin,JIZhong-kang,HUHai-yang,BISheng,HUFei-shu,ZHENGLin,JINXiu-yuan,XUWen-jie,WANGShu-ting,YANGMei-fang,SHAOJun-dan,LIPeng-cheng,HUANGYan-fang,SHENGJi-fang,LILan-juan.
StateKeyLaboratoryforDiagnosisandTreatmentofInfectiousDiseases,theFirstAffiliatedHospital,SchoolofMedicine,ZhejiangUniversity,CollaborativeInnovationCenterforDiagnosisandTreatmentofInfectiousDiseases,Hangzhou310003,China
LILan-juan,Email:ljli@zju.edu.cn
Objective To analyze the epidemiological characteristics of Mycobacterium strains and drug-resistance gene characteristics inMycobacteriumtuberculosisstrains from 12 counties in Zhejiang Province, China. Methods From January, 2012, to June, 2016, a total of 2803 sputum positive samples (positive staining that confirmed growth of acid-fast bacilli) were collected from patients newly diagnosed with TB in Zhejiang Province. Mycobacteria Identification Array Kits andM.tuberculosisDrug Resistance Detection Array Kits were used to further identify and characterize the strains in each sample. Results We identified 2598 of the 2803 strains (92.7%), asMycobacteriumtuberculosisand 205 strains (7.3%) as NTM. NTM strains were further identified as follows:Mycobacteriumintracellulare, 101 isolates;Mycobacteriumkansasii, 50 isolates; Turtle/Mycobacteriumabscessus, 24 isolates;Mycobacteriumavium, 16 isolates;Mycobacteriumfortuitum, 4 isolates;light yellowMycobacterium,1 isolate. Among the 2598M.tuberculosisstrains there were 326 (12.5%) INH-resistant strains, 254 (9.8%) RFP-resistant strains,and 173 (6.7%) MDR TB strains. Among the drug-resistant strains ofM.tuberculosis, 81.1% (279/344) of the INH-resistant mutations were related tokatG315, and 84 (60.0%) of 140 RFP-resistant mutations were associated withrpoB531. Conclusion Among the 2803 strains collected from patients in 12 counties of Zhejiang Province, 378 (13.5%) were designated as either MDR TB or NTM. In addition,katG315 was the main point mutation associated with INH resistance inM.tuberculosisstrains, andrpoB531 was the main point mutation for RFP resistance. Mycobacterium strain identification and drug-resistance testing are important in enhancing regulation and prevention of TB in basic medical institutions.
Mycobacteriumtuberculosis; Mycobacteria, atypical; Drug resistance, multiple, bacterial; Genes, MDR; Point mutation; Data interpretation, statistics
10.3969/j.issn.1000-6621.2017.02.010
“十二五”国家科技重大专项(2013ZX10004-904;2014ZX10003002);浙江省卫生和计划生育委员会医药卫生科技计划项目(2015KYA102)
310003 杭州,浙江大学医学院附属第一医院 传染病诊治国家重点实验室 感染性疾病诊治协同创新中心
李兰娟,Email:ljli@zju.edu.cn
2016-08-22)
