免疫辅助治疗初治肺结核的研究
2017-03-16何娅潘洪秋范琳
何娅 潘洪秋 范琳
·论著·
免疫辅助治疗初治肺结核的研究
何娅 潘洪秋 范琳
目的 评估免疫辅助治疗初治肺结核的疗效并探讨使用适应证。方法 回顾性研究2014年1月至2015年12月上海市肺科医院收治的246例初治肺结核患者。以CD4+/CD8+比值及是否进行免疫辅助治疗(强化期连续注射外源性母牛分枝杆菌菌苗免疫制剂),将患者分为“CD4+/CD8+≥1+辅以免疫治疗”组(简称“A1”组,64例)、“CD4+/CD8+≥1+非免疫治疗”组(简称“A2”组,61例)、“CD4+/CD8+<1+辅以免疫治疗”组(简称“B1”组,65例)、“CD4+/CD8+<1+非免疫治疗”组(简称“B2”组,56例),并且随访、比较4个组患者的疗效。结果 CD4+/CD8+<1的患者,治疗2个月末病灶吸收的有效率B1组[80.0%(52/65)]高于B2组[55.4%(31/56)],差异有统计学意义(χ2=8.48,P=0.006); B1组较B2组患者在并发肺外结核[84.2%(32/38),50.0%(16/32)]、涂阳肺结核[83.3%(25/30),47.8%(11/23)]、无并发症[82.9%(34/41),52.8%(19/36)]及广泛病灶[76.9%(40/52),52.5%(21/40)]方面差异均有统计学意义(χ2=9.43,P=0.002;χ2=7.53,P=0.006;χ2=8.12,P=0.004;χ2=6.04,P=0.016)。A1组CD4+/CD8+比值治疗后(1.87±0.78)较治疗前(2.19±0.94)降低,差异有统计学意义(t=3.39,P=0.001); B1组及B2组CD4+/CD8+比值治疗后(1.12±0.53;1.27±0.76)较治疗前(0.79±0.34;0.87±0.49)升高,差异均有统计学意义(t=4.88,P=0.001;t=3.98,P=0.001)。结论 对于初治肺结核可以将CD4+/CD8+=1作为给予免疫治疗的适应证指标,当CD4+/CD8+<1时,对于涂阳肺结核、无并发症肺结核、肺部病灶广泛、并发肺外结核的患者给予免疫辅助治疗,可加快病灶的吸收。
结核; 肺; 免疫疗法; 主动; 治疗结果; 数据说明; 统计分析; 疗效比较研究
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis,MTB)引起的以侵犯肺脏为主的传染病,严重威胁人类健康。结核病患者的转归与宿主细胞免疫功能密切相关,当MTB侵入机体后,可引起以细胞免疫为主的免疫应答,而机体细胞免疫功能状态可以用T细胞及其亚群含量来衡量,CD4+/CD8+比值可很好地反映宿主免疫调节平衡[1],已被作为最常用的评价机体免疫状态的指标。Bold和Ernst[2]研究显示,结核病患者体内CD8+T细胞的功能依赖于CD4+T细胞的功能,且两群细胞的比值较健康者明显降低,下降程度也与病情的严重程度呈正相关。故可认为,抗结核化疗的同时给予正确的免疫治疗能提高抗结核药物治疗的效果,但目前缺乏使用免疫制剂的适应证。本研究对上海市肺科医院初治肺结核患者进行回顾性分析,观察在不同CD4+/CD8+比值下,接受抗结核化疗联合使用免疫辅助治疗的临床疗效。
资料和方法
一、研究资料
1. 研究对象:对上海市肺科医院2014年1月至2015年12月住院的246例初治肺结核患者进行回顾性研究,其中男149例(60.6%),女97例(39.4%),年龄17~85岁,平均(43.35±17.96)岁,并发肺外结核142例、其他并发疾病(糖尿病23例、肝功能异常20例、低蛋白血症10例、慢性阻塞性肺病13例、白细胞减少4例、尘肺3例、药物过敏3例、产褥期4例、胃炎3例、肾结石3例)患者86例、肺部广泛病灶者178例。以CD4+/CD8+比值及是否进行免疫辅助治疗将患者分为CD4+/CD8+≥1+辅以免疫治疗组(简称“A1组”,64例)、CD4+/CD8+≥1+非免疫治疗组(简称“A2组”,61例)、CD4+/CD8+<1+辅以免疫治疗组(简称“B1组”,65例)、CD4+/CD8+<1+非免疫治疗组(简称“B2组”,56例)。以上4个组患者性别、年龄、并发症的差异均无统计学意义(χ2=5.84,P=0.119;F=0.05,P=0.984;χ2=28.40,P=0.551),见表1。
2.患者入选及排除标准:(1)入选标准:入选患者符合《肺结核诊断和治疗指南》[3]的初治肺结核诊断标准。(2)排除标准:①非初治肺结核患者;②初治肺结核化疗超过2周的患者;③经药物敏感性试验(简称“药敏试验”)证实为耐药的初治肺结核患者;④ 初治肺结核并发妊娠和严重心、肝、肾脏疾病,并发HIV感染和其他免疫性疾病;⑤近3个月使用过任何调节免疫功能药物的患者。

表1 各组患者的性别、年龄、主要并发症分布情况
注 其他并发症包括:药物过敏、产褥期、胃炎、肾结石
二、研究方法
1.外周血采样及主要仪器和试剂:采集所有患者抗结核化疗前及治疗后6个月末清晨空腹静脉血,经乙二胺四乙酸二钠(EDTA-2Na)抗凝后送检(标本量2 ml)。采用Epics XL型流式细胞仪(美国Beckman Coulter公司)检测血中自然杀伤(natural killer,NK)细胞和自然杀伤T(natural killer T,NKT)细胞和T细胞亚群,计数CD3+、CD4+、CD8+淋巴细胞。
2. CD4+/CD8+比值:正常比值参考范围为“1.54±0.59”,95%的正常人CD4+/CD8+比值都在“1”以上,本研究以CD4+/CD8+的参考值下限近似值 “1”作为分组参考标准。
3.治疗方案:所有患者均给予标准初治抗结核药物治疗方案2H-R-E-Z/4H-R,并发肺外结核者延长巩固期治疗至总疗程12个月。A1组和B1组强化期均给予连续2个月的外源性注射类免疫调节治疗。免疫制剂为母牛分枝杆菌菌苗(M.vaccae,微卡;安徽龙科马生物制药有限公司生产;生产批号:20131120;国药准字:S2001003)22.5 μg/次,1次/周,肌内注射。
4. 观察项目及疗效判定:所有涂阳患者在治疗5、6个月末行痰涂片荧光染色,以连续2个月痰涂片阴性且不再复阳为阴转。于治疗2个月末及6个月末行胸部X线摄影检查,以胸片所有病灶相加后占所有的肺野数来计算病变范围,并且作为疗效判定标准。(1)病灶变化标准:明显吸收(病灶吸收≥1/2),吸收(病灶吸收<1/2),不变(病灶无明显变化),恶化(病灶扩大或播散);病灶有效(显吸+吸收),病灶无效(不变+恶化);(2)空洞变化标准:闭合,缩小(空洞缩小≥原空洞直径1/2),不变(空洞缩小或增大<原空洞直径1/2),增大(空洞增大>原空洞直径1/2);空洞有效(闭合+缩小),空洞无效(不变+增大);(3)病变范围:广泛病灶(病灶累及肺野≥3个)。
三、统计学分析
应用SPSS 17.0软件对所有数据进行统计学处理,计数资料“率”的比较采用χ2检验和Fisher确切概率法, 计量资料采用方差分析和t检验,以P<0.05为差异有统计学意义。
结 果
一、抗结核治疗后的影像学改变
1.患者在治疗2个月末的病灶有效吸收情况:A1组与A2组间差异无统计学意义(χ2=0.35,P=0.851),B1组疗效明显优于B2组(χ2=8.48,P=0.006),见表2。CD4+/CD8+<1组并发肺外结核、涂阳肺结核、无并发症及广泛病灶的患者B1组优于B2组(χ2=9.43,χ2=7.53,χ2=8.12,χ2=6.04,P值均<0.05),见表3。
2.患者在治疗6个月末病灶吸收有效率:A1组与A2组(χ2=0.02,P=0.880)、B1组与B2组(χ2=1.21,P=0.272)差异均无统计学意义,见表4。
3.患者在2、6个月末并发空洞者病灶吸收情况:2、6个月末A1组较A2组(χ2=0.01,χ2=2.14,P值均>0.05),B1组较B2组(χ2=2.13,χ2=0.13,P值均>0.05)差异均无统计学意义,见表5。
二、患者在治疗后5、6个月末痰涂片阴转率的比较
A1组与A2组比较(χ2=0.03,P=0.867);B1组与B2组比较(χ2=0.01,P=0.912),差异均无统计学意义,见表6。
三、各组患者治疗前后CD4+/CD8+比值的变化情况
A1组CD4+/CD8+比值治疗后较治疗前下降,差异有统计学意义(t=3.39,P=0.001);A2组治疗后较治疗前差异无统计学意义(t=0.09,P=0.926);B1组及B2组CD4+/CD8+比值治疗后较治疗前均增高,差异均有统计学意义(t=4.88,t=3.98,P值均=0.001)。治疗后B1组及B2组间CD4+/CD8+比值差异无统计学意义(t=1.25,P=0.213),见表7。
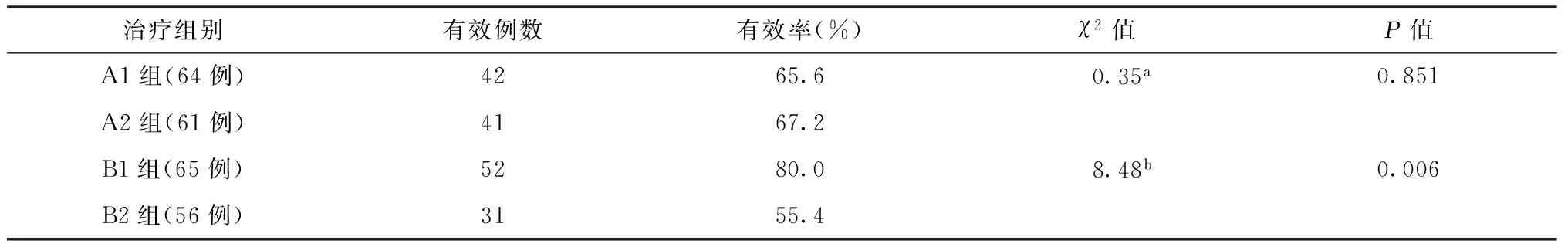
表2 各组患者在治疗后2个月末病灶有效吸收率的比较
注 有效:明显吸收+吸收;a:A1组与A2组比较;b:B1组与B2组比较

表3 CD4+/CD8+<1的患者类型在治疗2个月末病灶吸收有效率的比较
注 有效:明显吸收+吸收
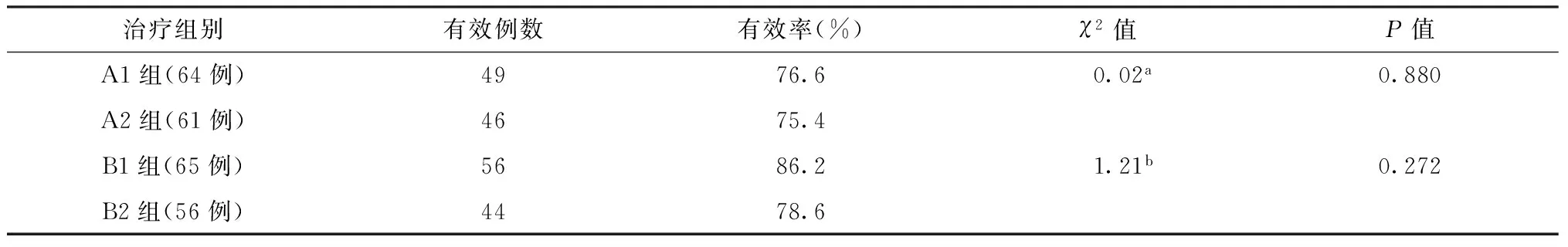
表4 各组患者在治疗后6个月末病灶吸收有效率的比较
注a:A1与A2组比较;b:B1与B2组比较

表5 各组患者在治疗后2、6个月末空洞吸收有效率的比较
注a:2个月末A1组与A2比较;b:6个月末A1组与A2比较;c:2个月末B1组与B2比较;d:6个月末B1组与B2比较

表6 各组患者在治疗后5、6个月末痰菌阴转率的比较
注a:A1与A2组比较;b:B1与B2组比较

表7 各组患者治疗前后CD4+/CD8+比值变化情况
讨 论
一、结核病的免疫反应特征
进入21世纪后,由于HIV感染、免疫抑制剂的广泛使用、耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)的出现,结核病的发病率逐年升高,临床治疗面临极大的困难[4]。MTB引起的保护性免疫反应主要是T细胞辅助细胞(Th1细胞)介导的细胞免疫反应。CD4+细胞在细胞免疫中起重要作用。其可分泌多种细胞因子(cytokines,CK),激活巨噬细胞,参与结核病免疫反应。CD4+细胞根据其分泌CK的不同分为Thl和Th2细胞。Thl细胞促进细胞免疫,消除感染源。Th2细胞抑制Thl介导的保护性免疫应答。Thl/Th2应答失衡是结核病发生、发展的重要机制[5-6]。结核病的发生发展是免疫应答失衡的疾病过程,CD4+、CD8+细胞的数量和功能与其疾病演变密切相关。对于结核病患者T淋巴细胞亚群的变化,目前认为存在CD4+T细胞下降、CD8+T细胞增多,CD4+/CD8+比值下降甚至倒置是结核病患者免疫受损的最主要表现[7]。辅助免疫治疗主要通过促进Th1型免疫应答反应及其细胞因子的产生,刺激机体保护性免疫应答,以改善临床症状、缩短化疗疗程,减少机体组织的病理损伤[8]。因此,辅以免疫制剂治疗可能会改变T细胞数量及功能失调的状态,达到促进疗效的目的,并成为结核病综合治疗的方法之一。在抗结核新药的研发相对滞后于疫情控制需求的局面下,对如何正确、有效地使用现有免疫制剂提出了要求,即如何通过现有的检测手段有选择地筛选出真正需要免疫治疗的结核病患者。
二、结核病的免疫治疗适应证
目前,报道的大多数研究是以免疫指标的变化来衡量免疫治疗的效果,而对于哪些结核病患者需要辅助免疫治疗没有给出更好的参考标准。本研究则采用国内较为普及的流式细胞仪检测CD4+/CD8+比值,以其参考值下限近似值“1”为节点,来判断以CD4+/CD8+比值的变化能否成为给予肺结核患者免疫治疗的适应证之一。本研究结果显示,在2个月末病灶吸收情况比较中,CD4+/CD8+<1(即B1组及B2组)的患者中给予免疫治疗与不予免疫治疗的比较差异有统计学意义(χ2=8.48,P<0.01);且并发肺外结核、涂阳肺结核、无并发症肺结核、广泛病灶的患者,B1组均优于B2组(χ2=9.43,χ2=7.53,χ2=8.12,χ2=6.04,P值均<0.05)。以上结果与2011年Yang等[9]进行的一项荟萃分析所报道的微卡辅助化疗可改善影像学表现的结论相符。但对于6个月末病灶疗效差异无统计学意义,说明当CD4+/CD8+<1时,对于涂阳肺结核患者、并发肺外结核、无并发症肺结核、广泛病灶肺结核患者给予早期合理的免疫辅助治疗,可加快强化期病灶的吸收,并取得较好疗效。
本研究结果还显示,B1组及B2组CD4+/CD8+比值通过治疗后均增高,差异有统计学意义(t=4.88,t=3.98,P值均<0.01),治疗后B1组及B2组之间的比较CD4+/CD8+比值差异无统计学意义(t=1.25,P>0.05),与吴碧彤等[10]报道的结果一致。说明对于CD4+/CD8+<1者合适的治疗更易使得细胞免疫水平得到提高;但辅以免疫治疗会提高患者早期疗效,且相较于2个月末病灶疗效,同时进行2个月末的CD4+/CD8+检测可能会更有意义。而A1组及A2组的CD4+/CD8+比值却没有得到提升,说明对于CD4+/CD8+>1患者治疗效果与是否辅以免疫治疗无相关性,故CD4+/CD8+>1的初治肺结核患者可不必给予微卡等免疫治疗。也进一步说明CD4+/CD8+=1可以作为是否给予免疫治疗的验证界值,笔者认为具有一定的指导意义,为今后有针对性地选择患者进行有效的免疫治疗提供了免疫指标量化的参考标准。
本研究结果显示,各组在治疗后5、6个月末痰涂片阴转率差异无统计学意义,除了上述原因,还可能与随访中患者取痰送检质量和样本量较少有关;对于并发空洞的患者,在治疗后2、6个月末空洞病灶吸收率各组差异无统计学意义,可能与空洞的吸收和闭合是一个较长的修复过程,本研究观察时间比较短有关。对于结核病痰菌涂阳阴转率、疗程中远期病灶吸收疗效、根治效果和防止结核病远期复发的确切效果,未来需要在多中心、大样本、远期随访的研究中进一步阐明。此外,本研究对于MDR-TB、有并发症的肺结核患者的免疫治疗效果评价也未能分辨,将有待针对特定患者进行临床考评。
三、结核病免疫制剂的选择
结核病的免疫治疗制剂有母牛分枝杆菌菌苗、多种细胞因子[γ-干扰素(IFN-γ)、白细胞介素(IL)-12、肿瘤坏死因子-α,等等]、结核DNA疫苗、卡介苗等[5]。目前,较为常用的是母牛分枝杆菌菌苗(M.vaccae,微卡),其为注射类药物,是1964年Benicke等首次从牛乳腺中分离到的一种快生长非结核分枝杆菌(NTM),对人畜无致病性;WHO在制定20世纪90年代结核病研究与发展战略规划中,提出结核病化学疗法与免疫疗法相结合,母牛分枝杆菌菌苗是惟一被推荐的免疫治疗制剂,并有报道推荐微卡作为结核病的常规辅助治疗制剂[11-12],这也是本研究采用的免疫治疗药物。微卡的作用机制包括,提高巨噬细胞产生自由基NO、H2O2的能力,明显增强机体内T淋巴细胞和自然杀伤细胞功能,激活T细胞释放各种淋巴因子,提高IL-2、IL-12受体的表达和IFN-γ的诱生水平;并且微卡具有双向免疫调节功能,对免疫功能低下和亢进者均有调节和治疗作用,可使CD3+和CD4+值增高、CD8+值降低;还具有改善细胞免疫功能、抑制变态反应、减轻病理损伤的特性,已广泛用于结核病的免疫治疗。本研究以CD4+/CD8+=1为界限决定对初治肺结核是否采用微卡进行免疫治疗,结果表明患者CD4+/CD8+比值<1是进行免疫治疗的适应证,>1者不必进行免疫治疗。 B1组较B2组在促进CD4+/CD8+增高的同时也获得了较好的2个月末疗效,并进一步分析当CD4+/CD8+<1时并发肺外结核、涂阳肺结核、无并发症、广泛结核病灶时强化期辅以免疫治疗可取得较好的早期疗效,显示对于相对重症的结核病患者早期的免疫干预对于病灶吸收有积极的促进作用。这也符合近期发表的一篇综述中指出的微卡对初治及复治肺结核具有肯定的治疗作用[13]。有研究证实加微卡进行免疫辅助治疗可加快治疗后2个月末患者痰菌阴转、病灶吸收及空洞缩小、闭合的速度,缩短短程化疗疗程,提高联合化疗的疗效。但是针对微卡的研究报道局限于一些小样本的研究,对其使用的确切适应证还缺乏严格的论证基础[14]。而对于其他免疫制剂,是否以CD4+/CD8+=1为参考标准进行免疫治疗需要在今后的研究中得到进一步验证。
综上所述,初治肺结核CD4+/CD8+比值“1”可作为给予免疫治疗的标准,>1可不必给予免疫治疗,<1且并发肺部病灶广泛、涂阳肺结核、肺外结核者应早期辅以免疫治疗,可加快治疗初期病灶吸收。结核病化疗和免疫治疗相辅相成,不可偏倚,也不能盲目;为避免过度治疗,选择以上指标作为免疫治疗的适应证,可以取得最大的收益。
[1] 曹志红,王心静,程小星.结核病患者T淋巴细胞亚群变化的影响因素分析.中国卫生检验杂志,2011, 21(7): 1688-1690.
[2] Bold TD,Ernst JD. CD4+T cell-dependent INF-γ production by CD8+effect T cell inMycobacteriumtuberculosisinfection. J Immunol, 2012, 189(5):2530-2536.
[3] 中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志, 2001, 24 (2): 70-74.
[4] Pelizon AC, Martins DR, Zorzella-Pezavento SF,et al. Neonatal BCG immunization followed by DNAhsp65 boosters:highly immunogenic but not protective against tuberculosis-a paradoxial effect of the vector? Scand J Immunol, 2010, 71(2): 63-69.
[5] 黄秀芳,钟利.结核病免疫治疗进展.国外医药抗生素分册,2012,33(6):241-243,S1.
[6] Abebe F, Bjune G. The protective role of antibody responses duringMycobacteriumtuberculosisinfection. Clin Exp Immunol, 2009, 157(2):235-243.
[7] 忻小和,钱五四.肺结核患者CD4+、CD8+淋巴细胞变化分析.中国防痨杂志, 2005, 27(2):111-112.
[8] 刘其会,孙峰,张文宏.结核病的辅助免疫治疗研究进展.中华实验和临床感染病杂志(电子版), 2015, 9(3):305-308.
[9] Yang XY,Chen QF,Li YP,et al.Mycobacteriumvaccaeas adjuvant therapy to anti-tuberculosis chemotherapy in never-treated tuberculosis patients: a meta-analysis. PLoS One, 2011, 6 (9): e23826.
[10] 吴碧彤,谭守勇,蔡智群,等.母牛分枝杆菌菌苗免疫辅助治疗老年初治空洞型肺结核的疗效分析.临床肺科杂志,2013,18(7):1267-1270.
[11] 王倩,张洁,黄淑萍,等.母牛分枝杆菌菌苗辅助治疗复治性及耐多药结核的Meta分析.中国药房, 2008, 19(11): 838-841.
[12] Dlugovitzky D,Stanford C,Stanford J.Immunological basis for the introduction of immunotherapy withMycobacteriumvaccaeinto the routine treatment of TB. Immunotherapy, 2011, 3 (4): 557-568.
[10] 吴碧彤,谭守勇,蔡智群,等.母牛分枝杆菌菌苗免疫辅助治疗老年初治空洞型肺结核的疗效分析.临床肺科杂志,2013,18(7):1267-1270.
[13] Gröschel MI, Prabowo SA, Cardona PJ, et al. Therapeutic vaccines for tuberculosis-a systematic review. Vaccine, 2014, 32 (26): 3162-3168.
[14] 范琳.耐多药肺结核的免疫治疗研究进展.中国防痨杂志,2015,37(11): 1144-1149.
(本文编辑:孟莉 范永德)
Analysis of immune adjuvant therapy for the initial treatment pulmonary tuberculosis
HEYa,PANHong-qiu,FANLin*.
*TuberculosisClinicalResearchCenterofShanghaiPulmonaryHospitalaffiliatedtoTongjiUniversity,ShanghaiKeyLaboratoryofTuberculosis(Lung),Shanghai200433,China
FANLin,Email:fanlinsj@163.com
Objective To evaluate the efficacy of adjuvant therapy for pulmonary tuberculosis, and explore its clinical indications. Methods Data from 246 patients with pulmonary tuberculosis collected from January 2014 to December 2015 was analyzed retrospectively. Patients were divided into groups according to the CD4+/CD8+ratios and use of immunoadjuvant therapy (continuous injection of exogenous Mycobacterium vaccine immune agents during the intensive treatment period): CD4+/CD8+≥1 with immunoadjuvant therapy (A1 group, 64 cases), CD4+/CD8+≥1 without immunoadjuvant therapy (A2 group, 61 cases), CD4+/CD8+<1 with immunoadjuvant therapy (B1 group, 65 cases), and CD4+/CD8+<1 without immunoadjuvant therapy (B2 group, 56 cases), and the efficacy of anti-TB treatment in the four groups was followed up. Results After treatment for two months, the efficacy for patients with CD4+/CD8+<1 in the B1 group (80.0% (52/65)) was better than that in the B2 group (55.4% (31/56)), and the difference was statistically significant (χ2=8.48,P=0.006). The difference in concurrent extrapulmonary tuberculosis (84.2% (32/38), 50.0% (16/32)), Smear-positive pulmonary tuberculosis (83.3% (25/30), 47.8% (11/23)), no complications (82.9% (34/41), 52.8% (19/36)), and extensive lesions (76.9% (40/52), 52.5% (21/40)) was statistically significant (χ2=9.43,P=0.002;χ2=7.53,P=0.006;χ2=8.12,P=0.004,χ2=6.04,P=0.016). The CD4+/CD8+value of post treatment in group A1 (1.87±0.78) reduced significantly compared with that of prior treatment (2.19±0.94), the difference was statistically significant (t=3.39,P=0.001); the CD4+/CD8+values of post treatment in groups B1 and B2 (1.12±0.53, 1.27±0.76 respectively) increased significantly compared with that of prior treatment (0.79±0.34, 0.87±0.49), the differences were statistically significant (t=4.88,P=0.001,t=3.98,P=0.001); Conclusion This study shows that CD4+/CD8+=1 can be used as an indication of immune therapy. When CD4+/CD8+<1, patients with pulmonary tuberculosis, extensive lesions of pulmonary tuberculosis and combined pulmonary tuberculosis, the immune therapy can accelerate the absorption of lesions.
Tuberculosis; Pulmonary; Immunotherapy; Active; Treatment outcome; Data interpretation, Statistical analysis; Comparative effectiveness research
10.3969/j.issn.1000-6621.2017.02.006
上海市科委资助课题(14411966500);江苏省条件建设与民生科技专项资金(BL2014067)
200433 同济大学附属上海市肺科医院 结核病临床研究中心 上海市结核(肺)重点实验室(何娅、范琳);江苏大学附属镇江市第三人民医院(潘洪秋)
范琳,Email:fanlinsj@163.com
2016-10-23)
