炎性小体中凋亡相关斑点样蛋白抗结核分枝杆菌感染作用的研究
2017-03-16陈曦姜广路贾红彦张宗德
陈曦 姜广路 贾红彦 张宗德
·论著·
炎性小体中凋亡相关斑点样蛋白抗结核分枝杆菌感染作用的研究
陈曦 姜广路 贾红彦 张宗德
目的 分析核苷酸结合寡聚化结构域样受体家族含pyrin结构域蛋白3(NLRP3)炎性小体在结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染小鼠中的免疫保护作用。方法 选取无免疫缺陷的野生型(wide type,WT)C57BL/6小鼠、半胱天冬酶-1-/-小鼠、ASC-/-小鼠及NLRP3-/-小鼠用于体内MTB感染实验,各种系小鼠骨髓和腹腔巨噬细胞用于体外MTB感染实验。体内感染实验小鼠分为2组:第1组中4种小鼠各感染30只,用于细菌载量分析、细胞因子检测及生存期评价;第2组中4种小鼠各感染15只,用于组织病理学分析及肺组织细胞流式分析;实验第1、2、3、4周时各种系小鼠各取1只未感染小鼠作为对照。检测感染小鼠的生存率及肺组织匀浆中细菌载量;采用酶联免疫吸附试验(ELISA)法,测定未感染野生型小鼠、感染小鼠肺组织匀浆中的肿瘤坏死因子-α(TNF-α)、白细胞介素-12p40(IL-12p40)、IL-1β和γ-干扰素(IFN-γ)水平;应用流式细胞术分析小鼠感染后肺组织中的浸润细胞组分及细胞坏死情况,并以ELISA法分析支气管灌洗液和血清中坏死相关因子高迁移率族蛋白1(HMGB-1)和IL-1α的分泌情况;对感染肺组织进行组织病理学分析;采用蛋白质免疫印迹检测半胱天冬酶-1的成熟情况;采用ELISA法测定巨噬细胞培养上清中的IL-1β水平。结果 感染MTB 24 h后,野生型小鼠骨髓巨噬细胞培养上清中IL-1β水平明显高于半胱天冬酶-1-/-小鼠、ASC-/-小鼠及NLRP3-/-小鼠[分别为:(316.29±4.64) pg/ml、(21.30±2.37) pg/ml、(22.99±0.46) pg/ml、(32.61±0.22) pg/ml;F=30.53,P<0.01];野生型小鼠腹腔巨噬细胞培养上清中IL-1β水平也明显高于半胱天冬酶-1-/-小鼠、ASC-/-小鼠及NLRP3-/-小鼠[分别为:(2970.36±11.53) pg/ml、(130.48±2.52) pg/ml、(120.24±3.43) pg/ml、(121.66±2.48) pg/ml;F=549.92,P<0.01]。与野生型小鼠相比,半胱天冬酶-/-和NLRP3-/-小鼠未表现出对MTB抵抗力的降低,感染29周后生存率分别为72.2%(13/18)、66.7%(12/18)、61.1%(11/18),但ASC-/-小鼠对MTB高度易感,感染4~12周后全部死亡。感染4周时,ASC-/-小鼠肺脏细菌载量较野生型小鼠、半胱天冬酶-1-/-及NLRP3-/-小鼠升高约100倍(菌落计数分别为0.93×107±426、5.07×105±221、5.32×105±209、5.26×105±606;F=87.74,P<0.01),显微镜检表现为急性坏死性肺炎,坏死细胞数量明显增高,伴有大量中性粒细胞浸润,且全肺细胞计数明显高于野生型小鼠、半胱天冬酶-1-/-小鼠及NLRP3-/-小鼠[分别为(10 342.64±103.56)×105、(3014.26±22.87)×105、(2919.28±36.75)×105、(2974.77±17.35)×105;F=349.11,P<0.01);ASC-/-小鼠中与细胞坏死相关的血清HMGB-1、支气管灌洗液HMGB-1和支气管灌洗液中IL-1α水平较野生型小鼠明显升高[血清HMGB-1水平分别为(155 893.36±168.30) pg/ml、(5112.56±43.62) pg/ml;t=-206.98,P<0.01;支气管灌洗液HMGB-1水平分别为(137.80±1.67) ng/ml、(75.16±1.47) ng/ml;t=-21.71,P<0.01;支气管灌洗液IL-1水平分别为(848.17±4.40) ng/ml、(197.04±2.93) ng/ml;t=-54.78,P<0.01]。结论 在MTB感染中,ASC分子具有独立于炎性小体NLRP3和半胱天冬酶-1的关键保护性作用。ASC-/-小鼠中肺组织病理异常与增强的细胞坏死相关,细胞过度坏死引起组织损伤,可能造成的细菌载量升高及过度的免疫反应都可能导致宿主死亡。
分枝杆菌,结核; 巨噬细胞炎性蛋白质类; 自身免疫; 抗生作用; 动物,实验
全球约有1/3人口感染结核分枝杆菌(Mycobacteriumtuberculosis,MTB),但约 90% 的感染者没有出现临床症状,只有免疫功能受损的感染者易发生结核病[1]。因此,阐明宿主保护性免疫机制尤为重要。MTB感染宿主巨噬细胞后,可促进NOD样受体蛋白(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing card,ASC) 和半胱天冬酶-1蛋白组装为炎性小体复合体,随后半胱天冬酶-1成熟、白细胞介素-1β(IL-1β)和IL-18分泌[2-4]。体外研究发现,MTB毒力株H37Rv能以NLRP3和ASC依赖的方式,激活半胱天冬酶-1、引起IL-1β分泌[5]。但其他研究显示,MTB诱导的半胱天冬酶-1激活及IL-1β分泌是非NLRP3和ASC依赖性的[6]。尽管之前的研究显示小鼠敲除半胱天冬酶-1基因并没有增强其对MTB的易感性[7], 但也有研究证实半胱天冬酶-1和 ASC基因敲除使小鼠在MTB感染后期易感性部分提高[8]。因此,MTB感染时炎性小体各组成蛋白发挥免疫保护作用的详细机制尚不明确。本研究旨在阐述炎性小体及其组分在宿主抵抗MTB感染中的免疫保护作用。
材料和方法
1.实验动物:选取无免疫缺陷的野生型(wide type,WT)C57BL/6小鼠、半胱天冬酶-1-/-小鼠、ASC-/-小鼠及NLRP3-/-小鼠用于体内MTB感染实验和体外MTB感染实验。体内感染实验中,小鼠分为2组:第1组中4种小鼠各感染30只,用于细菌载量分析、细胞因子检测及生存期评价;第2组中4种小鼠各感染15只,用于组织病理学分析及肺组织细胞流式分析;并以4种未感染小鼠作为对照,对照小鼠每次试验各取1只。体外感染实验中每次实验4种小鼠各取1只,收集腹腔巨噬细胞用于MTB感染,体外感染实验重复3次。未感染对照小鼠及MTB感染小鼠均在无特异性病原体的环境中饲养,每周常规监测感染小鼠身体状态和体质量。实验小鼠购自中国医学科学院医学实验动物研究所,依据动物伦理委员会的程序执行动物实验各项操作。
2.仪器与试剂:流式细胞仪(美国BD Biosciences公司);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)偶联F4/80抗体、抗小鼠Gr1-PE抗体、FITC偶联CD4抗体、抗小鼠CD8-PE抗体、核酸染料(7-amino-actinomycin D,7AAD)、重组小鼠巨噬细胞集落刺激因子(GM-CSF)、兔抗半胱天冬酶-1 p10 IgG购自美国eBioscience公司;肿瘤坏死因子-α(TNF-α)、IL-12p40、IL-1β、IL-1α、IL-18酶联免疫吸附试验(ELISA)试剂盒购自美国eBioscience公司;γ-干扰素(IFN-γ)、高迁移率族蛋白1(high-mobility group box 1,HMGB-1)检测试剂盒购自加拿大BD Bioscience Pharmingen公司;细胞凋亡检测试剂盒Annexin V-FITC购自加拿大Caltag Laboratories 公司;抗兔IgG 偶联过氧化物酶、超敏电化学发光(electrochemiluminescence,ECL)检测试剂盒(ECL plus)购自瑞典GE Healthcare 公司;DNA酶Ⅰ(德国Sigma公司),胶原蛋白酶D(德国Roche公司),抗鼠β-肌动蛋白(β-actin)单克隆抗体(日本Sigma-Aldrich公司),70 μm尼龙细胞滤网(美国BD Biosciences公司),RPMI(Roswell Park Memorial Institute)1640(美国Gibco公司),10%胎牛血清(美国Hyclone公司);巯基乙酸盐、苯巴比妥、乙基苯基聚乙二醇 (Nonidet P-40)、亮肽素、抑肽素A、抗蛋白酶肽、二硫苏糖醇购自德国Sigma公司。
3.菌株及培养条件:MTB标准株H37Rv在7H9液体培养基中培养至对数生长期,收集细菌,应用玻璃珠震荡以分散成团细菌,静置30 min;收集上层悬浮菌液,于-80 ℃小份保存。菌液冻融后,150×g离心2 min,去除残存的细菌团,上层悬液用于感染实验。菌液10倍稀释后,接种于7H10琼脂培养板,于3周后计数克隆形成单位(CFU)。
4.腹腔和骨髓巨噬细胞收集及体外MTB感染:体外感染实验中,首先收集小鼠腹腔和骨髓巨噬细胞。小鼠腹腔注射3 ml巯基乙酸盐培养基溶液,3 d后收集腹腔巨噬细胞,应用细胞培养基RPMI 1640洗涤后,在含有10%胎牛血清的RPMI 1640培养基中于37 ℃孵育3 h,再次洗涤,贴壁细胞用于MTB感染。从小鼠股骨和胫骨中收集骨髓细胞,在含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素和100 ng/ml GM-CSF的RPMI 1640 培养基中孵育5 d,RPMI 1640洗涤,贴壁细胞用于MTB感染。
在48孔细胞培养板中,腹腔和骨髓巨噬细胞以5×105个/孔铺板,H37Rv标准株感染复数(multiplicity of infection,MOI)为5,感染3 h。磷酸盐缓冲溶液(PBS)洗涤后在含有10%胎牛血清的RPMI 1640中培养24 h,收集培养上清,用于细胞因子检测和免疫蛋白印迹分析。
5.MTB体内感染及细菌载量测定:在预实验中3只野生型小鼠在苯巴比妥麻醉下,鼻腔接种30 μl H37Rv标准株[菌液浓度5×103~5×104菌落形成单位(CFU)/ml],24 h后处死小鼠,检测小鼠肺组织中细菌载量,验证MTB接种剂量。体内感染实验中MTB感染方法同预实验,第1组小鼠感染1、2、3、4周后分别从4种小鼠中各取3只,处死后收集肺、肝、脾,PBS匀浆。依次以10倍法稀释组织匀浆,接种于7H10培养基上,37 ℃培养,3周后计数菌落。感染4周后,收集小鼠脏器的同时,每只小鼠以700 μl PBS冲洗气道、收集支气管灌洗液,并收集小鼠血清。收集的脏器组织匀浆、血清及支气管灌洗液用于细胞因子检测。剩余感染小鼠继续饲养,用于生存期观察。
6.组织病理学分析:体内感染实验中第2组小鼠感染4周后,每种小鼠各取3只,收集小鼠肺脏,经10%福尔马林固定后,取部分组织分别进行HE染色、Zeil-Neilson 染色。
7.肺组织细胞流式分析:体内感染实验中第2组小鼠感染1、2、3、4周后,每种小鼠各取3只,深度麻醉,以PBS灌洗双肺,直至肺组织完全变白。取出双肺,剪碎为1~2 mm3的小块,置于含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素、1 mg/ml 和20 ng/ml DNA酶Ⅰ的RPMI 1640 培养基中,37 ℃轻摇孵育1 h,组织消化液经70 μm尼龙细胞滤网过滤,收集单细胞悬液。NH4Cl/Tris溶液裂解红细胞后,台盼蓝溶液染色死亡细胞,全部肺脏细胞计数。细胞经PBS洗涤2次,浓度调整为1×106个/ml,依据染色抗体的说明书进行染色。染色后洗涤2次,以1%福尔马林固定,流式细胞仪分析。实验中所用染色抗体为F4/80-FITC、Gr1-PE、CD4-FITC、CD8-PE和7AAD。应用CellQuest 软件(美国BD公司)分析数据。
8.细胞因子及半胱天冬酶-1测定:按照ELISA试剂盒的操作程序,分别测定腹腔和骨髓巨噬细胞培养上清、肺组织匀浆、支气管灌洗液和血清中的TNF-α、IL-12p40、IL-1β、IL-1α、IFN-γ和HMGB-1。为检测半胱天冬酶-1,感染巨噬细胞洗涤后,进行细胞裂解,裂解液成分为:PBS、1%乙基苯基聚乙二醇(Nonidet P-40)、1 μg/ml 亮肽素、1 μg/ml 抑肽素A、1.5 μg/ml抗蛋白酶肽和2 mmol/L二硫苏糖醇。裂解产物中检测半胱天冬酶-1前体、培养上清液中检测其活性形式(p10)。样品分别进行免疫蛋白印迹分析,以兔抗半胱天冬酶-1 p10 IgG、抗兔IgG偶联过氧化物酶、ECL Plus显色。抗鼠β-actin单克隆抗体用于对照内参β-actin检测。
9.统计学分析:采用SPSS 17.0软件对数据进行方差分析。本研究中所有数据采用均数±标准差表示,P<0.05为有统计学意义。
结 果
1. MTB感染巨噬细胞中炎性小体活化机制:首先测定了野生型小鼠、半胱天冬酶-1-/-小鼠、ASC-/-小鼠和 NLRP3-/-小鼠骨髓和腹腔巨噬细胞感染MTB 24 h后IL-1β的分泌。结果显示,野生型小鼠骨髓巨噬细胞和腹腔巨噬细胞分泌高水平的IL-1β,明显高于半胱天冬酶-1-/-小鼠、ASC-/-小鼠、NLRP3-/-小鼠和未感染小鼠巨噬细胞分泌水平,差异有统计学意义(表1)。免疫印迹分析显示,只在感染的野生型小鼠腹腔巨噬细胞中检测到半胱天冬酶-1的成熟形式半胱天冬酶-1(p10),见图1。
2.各种系小鼠感染H37Rv后细菌载量和生存情况:低剂量的鼻内感染(约200 CFU/只)可引起ASC-/-小鼠快速死亡。感染3周后,ASC-/-小鼠体质量逐渐下降,感染4~12周后全部死亡(表2);感染4周后肺组织细菌载量,较其他小鼠高约100倍,差异有统计学意义(表3)。但半胱天冬酶-1-/-和 NLRP3-/-小鼠与野生型小鼠感染后依然能够控制体内急性感染,感染29周后的生存率分别达到66.7%(12/18)、61.1%(11/18)和72.2%(13/18),见表2、图2。

表1 各种系小鼠巨噬细胞感染MTB前后白细胞介素-1β分泌情况的比较
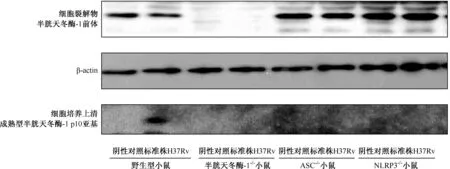
图1 各种系小鼠腹腔巨噬细胞感染结核分枝杆菌后半胱天冬酶-1表达
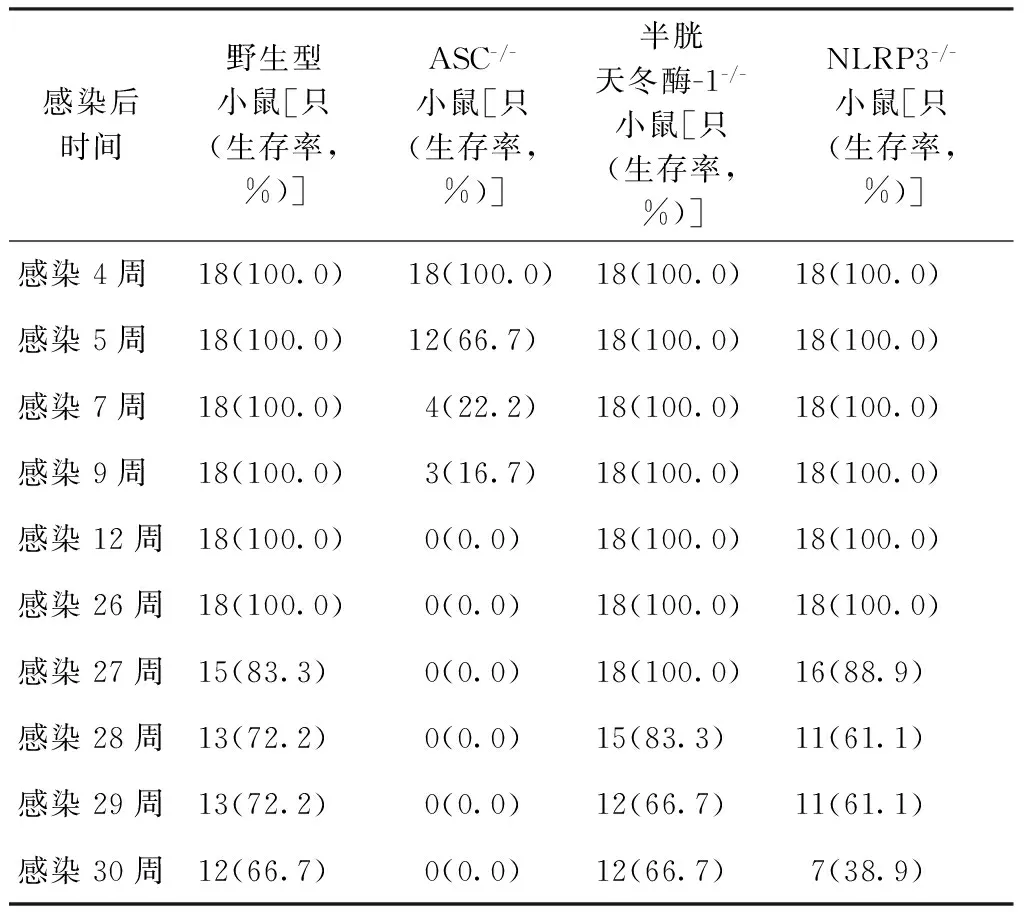
感染后时间野生型小鼠[只(生存率,%)]ASC-/-小鼠[只(生存率,%)]半胱天冬酶-1-/-小鼠[只(生存率,%)]NLRP3-/-小鼠[只(生存率,%)]感染4周18(100.0)18(100.0)18(100.0)18(100.0)感染5周18(100.0)12(66.7)18(100.0)18(100.0)感染7周18(100.0)4(22.2)18(100.0)18(100.0)感染9周18(100.0)3(16.7)18(100.0)18(100.0)感染12周18(100.0)0(0.0)18(100.0)18(100.0)感染26周18(100.0)0(0.0)18(100.0)18(100.0)感染27周15(83.3)0(0.0)18(100.0)16(88.9)感染28周13(72.2)0(0.0)15(83.3)11(61.1)感染29周13(72.2)0(0.0)12(66.7)11(61.1)感染30周12(66.7)0(0.0)12(66.7)7(38.9)
显微镜下观察发现,ASC-/-小鼠感染4周后肺组织表现为胸膜粘连,伴有巨大、融合结节,而半胱天冬酶-1-/-和NLRP3-/-小鼠与野生型小鼠表现一致。组织学检查发现ASC-/-小鼠存在严重的急性坏死性肺炎,伴有大量炎症细胞浸润。但野生型小鼠、NLRP3-/-和半胱天冬酶-1-/-小鼠肺组织中,虽然伴有浸润性细胞,但组织结构破坏不明显,表现为典型的肉芽肿。受损肺组织Zeil-Neilson染色结果与细菌载量结果一致,ASC-/-小鼠炎症细胞内、外均存在大量MTB(图 3)。

图2 各种系小鼠低剂量鼻内感染H37Rv 后不同时间的生存率
3.细胞因子分泌情况:与体外实验相比,半胱天冬酶-1-/-、ASC-/-和NLRP3-/-小鼠感染MTB后正常分泌IL-1β。尽管ASC-/-小鼠对MTB易感性升高(肺组织匀浆菌落计数升高),但肺组织中炎性小体介导的促炎因子如TNF-α、IFN-γ、IL-12p40的产生没有受到明显损伤。与其他小鼠相比,ASC-/-小鼠感染4周后,IL-1β、TNF-α水平明显升高,差异有统计学意义(表3)。

图3 各种系小鼠感染4周后病理组织学染色结果

免疫指标野生型小鼠ASC-/-小鼠半胱天冬酶-1-/-小鼠NLRP3-/-小鼠统计检验值P值肺脏组织匀浆菌落计数(x±s) 感染1周209±12205±6204±14201±7F=2.940.058 感染2周3992±443846±194002±113931±25F=2.990.081 感染3周0.82×106±3421.10×106±2010.78×106±5170.80×106±201F=5.750.047 感染4周5.07×105±2210.93×107±4265.32×105±2095.26×105±606F=87.74<0.01肺组织匀浆IL-1β(x±s,pg/ml) 阴性对照58.93±7.9665.33±0.2632.10±1.4754.85±1.12F=0.640.612 感染1周687.91±2.88674.29±3.33632.78±3.94811.67±6.73F=1.130.395 感染2周1509.03±17.541232.11±9.25 1225.97±12.19908.77±14.25F=2.050.186 感染3周2567.26±13.732220.40±19.082316.04±14.812387.16±23.18F=0.970.452 感染4周2214.13±28.204209.36±12.792427.65±21.211943.86±13.83F=146.04<0.01肺组织匀浆TNF-α(x±s,pg/ml) 阴性对照12.60±1.7410.62±0.9122.97±1.2817.95±0.20F=1.820.221 感染1周254.37±4.60178.66±2.81180.74±2.29182.48±2.22F=1.760.232 感染2周807.81±6.30678.57±13.29717.94±4.01897.56±5.85F=0.830.515 感染3周1565.65±15.241219.86±27.771231.89±16.521368.79±13.62F=2.310.153 感染4周1021.45±10.932642.16±15.151224.68±22.731413.20±11.33F=72.09<0.01肺组织匀浆IL-12p40(x±s,pg/ml) 阴性对照21.64±1.2011.47±0.759.70±1.1828.58±0.74F=0.220.878 感染1周358.73±1.33274.17±2.83294.86±4.80312.56±1.89F=0.420.745 感染2周930.80±6.91598.38±6.39698.78±6.61745.80±5.11F=3.910.054 感染3周1543.44±6.37 1715.45±9.62 1512.29±16.43 1522.67±14.25 F=3.680.062 感染4周2165.88±17.641876.86±24.29 2589.70±18.33 2712.77±34.94 F=3.660.063肺组织匀浆IFN-γ(x±s,pg/ml) 阴性对照87.65±2.3743.86±1.2032.19±0.4736.85±0.88F=1.150.385 感染1周278.66±3.13253.42±3.67312.79±1.78290.44±2.17F=0.550.663 感染2周980.86±5.821400.74±18.41 1104.93±9.80 1523.17±8.46 F=1.210.366 感染3周1524.86±10.201873.51±20.35 1237.65±12.69 1496.60±9.31 F=3.210.083 感染4周3652.76±32.943354.63±44.27 3321.34±62.75 3312.75±42.12 F=3.010.094全肺细胞计数(x±s,×105个) 感染1周193.33±3.10214.56±2.97187.38±3.21207.60±0.31F=2.520.132 感染2周1908.45±8.29 1893.22±17.80 1833.48±9.96 2004.34±4.22 F=1.070.415 感染3周2132.77±10.353812.06±44.93 2033.18±7.34 2058.40±6.66 F=70.52<0.01 感染4周3014.26±22.8710342.64±103.56 2919.28±36.75 2974.77±17.35 F=349.11<0.01
注 “-”:实验中未使用此种小鼠
4.细胞流式分析及细胞坏死相关因子分泌情况:ASC-/-小鼠感染MTB 4周后,细胞总数较其他种系小鼠明显增高;流式细胞术分析发现ASC-/-小鼠肺组织中F4/80+-Gr1+全肺巨噬细胞和F4/80--Gr1+全肺中性粒细胞明显升高,与组织学结果一致;但ASC-/-小鼠全肺CD4+T细胞和CD8+T细胞总数与其他小鼠没有明显差异,见表3。感染4周后,与野生型小鼠相比,ASC-/-小鼠血清和支气管灌洗液中HMGB-1和IL-1α的水平也明显升高(表3),与此结果一致的是显微镜下观察发现ASC-/-小鼠肺组织中存在大量坏死细胞及大量细胞碎片(台盼蓝染色,图3),但野生型小鼠感染MTB 4周后没有发生坏死性肺炎。
讨 论
本研究证实,半胱天冬酶-1以依赖 NLRP3和ASC的方式成熟,巨噬细胞分泌IL-1β需要NLRP3、ASC和半胱天冬酶-1炎性小体活化。这与之前的研究结果一致[2],还发现在宿主抵抗MTB感染的保护性免疫中,接头蛋白分子ASC以不依赖NLRP3和半胱天冬酶-1的方式发挥关键作用。McElvania Tekippe等[9]也发现在MTB感染中,ASC分子对于宿主保护性免疫和肉芽肿形成是至关重要的。另外,Dorhoi等[10]发现Toll样受体(Toll-like receptor,TLR)、NOD样受体(nucleotide binding oligomerization domain-like receptors,NLR)和β-葡聚糖受体(Dectin-1)信号下游存在另外一种接头蛋白——胱天蛋白酶募集域蛋白(caspase recruitment domain-containing protein 9,CARD9),CARD9缺失的小鼠对MTB高度易感,感染肺组织的病理表现类似于ASC-/-小鼠。与缺失髓样分化因子(myeloid differentiation factor 88, MyD88)或CARD9的小鼠相比,缺失一个或多个TLRs 和(或)NOD2受体的小鼠结核易感性并未明显升高。因此,本研究支持Dorhoi提出的“对于控制MTB感染,‘接头分子’可能比‘受体’重要”这一科学假设[10]。
本研究未发现半胱天冬酶-1-/-小鼠对MTB易感性增高,这与较早的研究结果一致[7],但在Mayer-Barber等[8]的研究中,与野生型小鼠相比,ASC-/-和 半胱天冬酶-1-/-小鼠对MTB更易感。可能的原因是小鼠基因背景、实验模型或菌株毒力等因素不尽相同,导致半胱天冬酶-1-/-小鼠感染后出现不同结果。该推测已经在对结核病患者的研究中得到证实,即NLRP3炎性小体编码基因的多态性与结核病的活动性相关[11-12];另外,MTB感染可引起NLRP3 炎性小体编码基因的甲基化修饰,抑制了炎性小体蛋白表达[13],提示MTB对宿主免疫网络的调控也会影响易感性。ASC-/-小鼠对MTB易感性升高,提示ASC分子具有不可或缺的、独立发挥保护性免疫作用的特点。
反应性氮类、IFN-γ、TNF-α、IL-12p40和IL-1β在小鼠控制MTB感染中起到关键作用[14]。本研究中,NLRP3、ASC、半胱天冬酶-1分子对IL-1β分泌单独发挥作用,该结果与之前报道一致[8-9]。值得关注的是,与MyD88-/-小鼠相比,ASC-/-小鼠肺组织中促炎细胞因子TNF-α、IL-1β分泌增强,且升高程度相似[7],提示体外实验证实的对于细胞因子分泌发挥重要作用的接头分子的缺失,在体内感染过程中可由复杂的替代途径来弥补。本结果进一步表明鼻内感染模型中,至少在感染早期,ASC-/-小鼠不能控制MTB感染不能归因于下游炎性小体依赖性或独立性的促炎细胞因子产生的缺失。
之前观察到MyD88和CARD9缺失小鼠虽然获得性免疫不受影响,能够正常募集、激活淋巴细胞,但感染MTB后却发生了致命性感染[10,15]。尽管本研究没有排除ASC-/-小鼠获得性免疫存在缺失(主要的肺组织病理学表现为肺组织结构严重破坏),但肺组织中IFN-γ水平没有明显降低。该结果提示过度的局部炎症性反应对感染宿主不仅是有害的,而且也是主要的致死原因。
越来越多的证据显示,MTB感染过程中凋亡具有保护性作用[16];而组织细胞坏死则可引起致命性细菌播散[17]。鉴于ASC是参与凋亡途径的接头分子[18],因此,可以假设ASC分子缺失可能造成感染细胞发生坏死,或进一步释放坏死相关的炎症因子;细胞坏死或坏死相关因子的释放反过来又可能延长感染部位炎症反应时间,从而使局部组织出现过度的炎症反应,甚至组织结构破坏。为了证实这种可能性,本研究对肺组织中细胞的坏死情况进行了分析,结果证实了该假设。
HMGB-1和IL-1α是细胞坏死的分子标志物,尤其 HMGB-1是感染晚期分泌的一种促炎因子,在细菌脂多糖(lipopolysaccharides,LPS)诱导的脓毒性休克中发挥主要作用,已证实HMGB-1能够提高骨髓细胞募集、启动和延长炎症反应,从而造成过度的炎症反应。因此,细胞坏死增多,并伴随坏死分子标志物释放,可能解释感染部位炎症反应升高,进一步发生局部组织结构破坏及宿主最终的死亡。另外,细胞坏死导致的MTB播散,也是肺组织中细菌载量升高的原因之一。
野生型小鼠感染MTB后肺脏未发生坏死性肺炎,虽然也观察到细胞坏死较不感染小鼠增高,但并没有明显差异。原因之一可能是二者肺组织中能够引起细胞坏死的细胞因子如IL-1α与HMGB-1的水平无差异,没有引起过度的炎症反应及细胞坏死;不仅如此,研究中也证实了ASC分子对小鼠肺脏感染MTB后的免疫保护也起到关键的作用。另外,本研究只观察了感染4周后的细胞坏死水平,并未对感染小鼠进行长期观察检测。因此,不排除野生型小鼠MTB长期感染后,肺脏细胞坏死水平发生变化。
[1] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016.
[2] Mishra BB,Moura-Alves P,Sonawane A, et al.Mycobacteirumtuberculosisprotein ESAT-6 is a potent activator of the NLRP3/ASC inflammasome. Cell Microbiol,2010, 12(8): 1046-1063.
[3] Mortaz E,Adcock IM,Tabarsi P, et al. Interaction of pattern recognition receptors withMycobacteriumtuberculosis. J Clin Immunol,2015, 35(1):1-10.
[4] Briken V, Ahlbrand SE, Shah S.Mycobacteriumtuberculosisand the host cell inflammasome: a complex relationship. Front Cell Infect Microbiol, 2013, 3:62.
[5] Carlsson F,Kim J,Dumitru C, et al. Host-detrimental role of Esx-1-mediated inflammasome activation in mycobacterial infection. PLoS Pathog,2010, 6(5): e1000895.
[6] Dorhoi A,Nouailles G,Jörg S, et al. Activation of the NLRP3 inflammasome byMycobacteriumtuberculosisis uncoupled from susceptibility to active tuberculosis. Eur J Immunol, 2012, 42(2): 374-384.
[7] Fremond CM,Yeremeev V,Nicolle DM, et al. FatalMycobacteriumtuberculosisinfection despite adaptive immune response in the absence of MyD88. J Clin Invest,2004, 114(12): 1790-1799.
[8] Mayer-Barber KD,Barber DL,Shenderov K, et al. Caspase-1 independent IL-1beta production is critical for host resistance toMycobacteriumtuberculosisand does not require TLR signaling in vivo. J Immunol,2010, 184(7): 3326-3330.
[9] McElvania Tekippe E,Allen IC,Hulseberg PD,et al. Granuloma formation and host defense in chronicMycobacteriumtuberculosisinfection requires PYCARD/ASC but not NLRP3 or caspase-1. PLoS One, 2010, 5(8): e12320.
[10] Dorhoi A,Desel C,Yeremeev V, et al. The adaptor molecule CARD9 is essential for tuberculosis control. J Exp Med,2010, 207(4): 777-792.
[11] Eklund D, Welin A, Andersson H, et al. Human gene variants linked to enhanced NLRP3 activity limit intramacrophage growth ofMycobacteriumtuberculosis. J Infect Dis, 2014, 209(5): 749-753.
[12] Souza de Lima D,Ogusku MM,Sadahiro A, et al. Inflammasome genetics contributes to the development and control of active pulmonary tuberculosis. Infect Genet Evol,2016, 41: 240-244.
[13] Wei M, Wang L, Wu T, et al. NLRP3 activation was regulated by DNA methylation modification duringMycobacteriumtuberculosisinfection. Biomed Res Int, 2016, 2016:4323281.
[14] Mishra BB, Rathinam VA, Martens GW, et al. Nitric oxide controls the immunopathology of tuberculosis by inhibiting NLRP3 inflammasome-dependent processing of IL-1β. Nat Immunol, 2013, 14(1): 52-60.
[15] Richardson ET, Shukla S, Sweet DR, et al. Toll-like receptor 2-dependent extracellular signal-regulated kinase signaling inMycobacteriumtuberculosis-infected macrophages drives anti-inflammatory responses and inhibits Th1 polarization of responding T cells. Infect Immun, 2015, 83(6): 2242-2254.
[16] Yu X, Li C, Hong W, et al. Autophagy duringMycobacteriumtuberculosisinfection and implications for future tuberculosis medications. Cell Signal, 2013, 25(5): 1272-1278.
[17] Divangahi M,Chen M,Gan H,et al.Mycobacteriumtuberculosisevades macrophage defenses by inhibiting plasma membrane repair. Nat Immunol,2009, 10(8): 899-906.
[18] Masumoto J,Taniguchi S,Ayukawa K, et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. J Biol Chem,1999, 274(48):33835-33838.
(本文编辑:李敬文)
Protection role of ASC in host resistance againstMycobacteriumtuberculosisinfection
CHENXi,JIANGGuang-lu,JIAHong-yan,ZHANGZong-de.
DepartmentofMolecularBiology,BeijingChestHospital,CapitalMedicalUniversity,BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
ZHANGZong-de,Email:zzd417@163.com
Objective To investigate the role of NLRP3 (NOD-like receptor family, pyrin domain-containing protein 3) inflammasome in host protective immunity againstMycobacteriumtuberculosis(MTB) infection. Methods Wild type (WT) C57BL/6 mice, mice deficient in either caspase-1,ASC or NLRP3 and the peritoneal macrophages (PECs) and bone-marrow derived macrophages (BMDMs) from corresponding mice were used to performinvitroinfection experiments with MTB. Mice were divided into 2 groups. In the first group, each type 30 mice were infected with MTB to analyze the bacterial loads, the concentration of cytokine and survival of mice. In the second group, 15 mice from each type were also infected with MTB for pathological examination and flow cytometry. At the first, second, third and fourth week after infection, one uninfected mouse from each type was used as control. The survival of mice and bacterial loads was determined from the lung homogenates after challenge of infection by MTB. The level of tumor necrosis factor α (TNF-α), interleukin-12p40 (IL-12p40), IL-1β and interferon γ (IFN-γ) from lung homogenates was determined by enzyme-linked immunosorbent assay (ELISA). Lung inflammatory cells were analyzed by flow cytometric analysis and the lung cells necrosis was tested respectively. ELISA determined the level of high-mobility group box 1 (HMGB-1) and IL-1α from bronchial veolar lavage fluid (BALF) and serum. Histopathological analysis was performed. Western blotting was performed to determine the mature of caspase-1 after infected with MTB. The productions of IL-1β in BMDMs and PECs obtained from WT, caspase-1-/-, ASC-/-and NLRP3-/-mice infected by MTB were determined. Results The levels of IL-1β produced by BMDMs and PECst which were obtained from WT mice was significantly higher than those obtained from caspase-1-/-, ASC-/-and NLRP3-/-mices infected with MTB post infection by 24 hour (BMDMs: (316.29±4.64) pg/ml, (21.30±2.37) pg/ml, (22.99±0.46) pg/ml, (32.61±0.22) pg/ml;F=30.53,P<0.01; PECs: (2970.36±11.53) pg/ml, (130.48±2.52) pg/ml, (120.24±3.43) pg/ml, (121.66±2.48) pg/ml;F=549.92,P<0.01). When compared with WT mice, mice deficient in caspase-1-/-and NLRP3-/-exhibited no decrease in the resistance to MTB infection, and the survival rates after infection of 29 weeks were 72.2% (13/18), 66.7% (12/18) and 61.1% (11/18), respectively. In contrast, the mice deficient in ASC-/-showed high susceptibility to MTB infection, which resulted into 100% of mortality rate during 4-12 weeks after infection. By the forth week after infection, the bacterial burden in the lungs of mice deficient in ASC-/-(0.93×107±426) was 100 times higher than those of WT mice (5.07×105±221), mice deficient in caspase-1-/-(5.32×105±209) and NLRP3-/-(5.26×105±606), respectively (F=87.74,P<0.01). Morphological analysis revealed that the number of the lung cells in the lungs of ASC-/-mice ((10 342.64±103.56)×105) were increased significantly than that from WT mice ((3014.26±22.87)×105), caspase-1-/-((2919.28±36.75)×105) and NLRP3-/-group ((2974.77±17.35)×105) after the infection by 4 weeks, respectively (F=349.11,P<0.01). The concentrations of HMGB-1 and IL-1α associated with necrosis were further detected by ELISA, and our data revealed that the concentrations of HMGB-1 in serum (155 893.36±168.30) pg/ml) and BALF (137.80±1.67 ng/ml) and IL-1a in BALF (848.17±4.40 ng/ml) of mice deficient in ASC-/-were significantly higher than those of WT mice (5112.56±43.62 pg/ml,t=-206.98,P<0.01 for HMGB-1 in serum; 75.16±1.47 ng/ml,t=-21.71,P<0.01 for HMGB-1 in BALF; and 197.04±2.93 ng/ml;t=-54.78,P<0.01 for IL-1α in BALF), respectively. Conclusion Our findings demonstrate that ASC molecule plays a protective role against MTB infection, which is independent from NLRP3 and caspase-1. The unusual presentations in the lungs of mice deficient in ASC-/-are associated with the increased necrosis. The excessive tissue damage may result in the increased bacterial burden and immune response, thereby leading to the mortality of hosts deficient in ASC-/-.
Mycobacteriumtuberculosis; Macrophage inflammatory proteins; Autoimmunity; Antibiosis; Animals, laboratory
10.3969/j.issn.1000-6621.2017.02.003
“十二五”国家科技重大专项(2015ZX10004801-003);重大传染病防治协同创新中心科技项目(PXM2015_014226_000058)
101149 首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所分子生物学研究室
张宗德,Email:zzd417@163.com
2016-07-06)
