异烟肼联合重组结核疫苗AEC/BC02对结核分枝杆菌感染豚鼠的治疗效果评价
2017-03-16卢锦标沈小兵苏城杨蕾都伟欣王国治陈保文
卢锦标 沈小兵 苏城 杨蕾 都伟欣 王国治 陈保文
·论著·
异烟肼联合重组结核疫苗AEC/BC02对结核分枝杆菌感染豚鼠的治疗效果评价
卢锦标 沈小兵 苏城 杨蕾 都伟欣 王国治 陈保文
目的 评价异烟肼联合重组结核疫苗AEC/BC02(BCG-CpG复合佐剂,即BCG-CpG-DNA+Al)对结核分枝杆菌感染豚鼠的治疗效果。方法 选取30只无特定病原体(specific pathogen free,SPF)级豚鼠,在皮下注射结核分枝杆菌菌液[1000菌落形成单位(CFU)/只]1周后,按不同治疗方式分成4个组:即AEC/BC02组(6只),采用AEC/BC02疫苗进行肌肉免疫;INH组(6只),采用异烟肼10 mg进行灌胃治疗;INH+AEC/BC02组,先采用异烟肼进行灌胃治疗2周后,再采用AEC/BC02疫苗进行肌肉免疫;生理盐水(NS)组(12只),作为阴性对照,仅注射NS。所有豚鼠在进行攻毒(注射结核分枝杆菌菌液)后第10周被解剖,以豚鼠肝、脾、肺脏病变指数评分评价脏器病变,并计算各脏器活菌载量(lg CFU)。结果 AEC/BC02组、INH组和INH+AEC/BC02组的整体脏器综合病变评分分别为(36.7±28.2)、(20.0±12.7)和(3.3±5.2)分,均低于NS组的(69.2±24.5)分,差异均有统计学意义(分别为q=4.37,P=0.023;q=6.61,P<0.001;q=8.85,P<0.001);INH+AEC/BC02组整体脏器综合病变评分低于AEC/BC02组,差异也有统计学意义(q=3.88,P=0.049)。INH+AEC/BC02组的脾脏活菌载量为(1.06±1.64) lg CFU,低于INH组的(3.55±1.90) lg CFU、AEC/BC02组的(4.21±0.78) lg CFU及NS组的(4.73±0.79) lg CFU,差异均有统计学意义(分别为q=4.84,P=0.011;q=6.12,P=0.001;q=8.23,P<0.001)。INH+AEC/BC02组的肺脏活菌载量为(0.69±1.07) lg CFU,低于INH组的(2.66±1.70) lg CFU、AEC/BC02组的(3.01±0.90) lg CFU及NS组的(4.36±0.79) lg CFU,差异均有统计学意义(分别为q=4.43,P=0.021;q=5.21,P=0.006;q=9.50,P<0.001);INH组的肺脏活菌载量低于NS组,差异也有统计学意义(q=4.39,P=0.022)。结论 异烟肼和AEC/BC02疫苗联合使用优于单一治疗方式,能够明显减轻动物脏器病变,降低脾脏和肺脏的活菌载量。
分枝杆菌,结核; 异烟肼; 疫苗,合成; 药物疗法, 联合; 疾病模型, 动物; 对比研究
据WHO估计[1-2],2015年全球共有1040万例新发结核病患者,其中中国新发患者92万例,在全球30个结核病高负担国家中位列第三。尽管卡介苗作为现在唯一可用的结核病疫苗在中国被广泛使用,但其对成人的保护效果不确定,且对潜伏性结核感染(LTBI)无效[3]。中国的LTBI者早期估计达到全人群的1/3,最近的研究认为这一人数被高估,但其数量仍然巨大[4];对这一人群进行提前干预,降低发病率,是中国结核病防制体系实施工作的关键。
目前,结核病患者和LTBI者的临床治疗手段主要是化疗,但因化疗存在不良反应多、患者治疗依从性不高等问题,易导致耐药结核病的发生。疫苗的作用机制决定其可以减轻或避免这些问题,目前临床上常用母牛分枝杆菌制剂(微卡)应用于初治、复治及耐药结核病的辅助治疗,效果显著[5-6],新的治疗型结核疫苗已有多个处于临床试验阶段[7]。值得注意的是,免疫治疗时,由于免疫制剂含有结核分枝杆菌(MTB)抗原,已感染个体再次接触此类抗原有发生超敏反应的风险[8-10]。因此,常采用化疗和免疫治疗相结合的方式,一方面先通过化疗抑制MTB,降低机体的免疫应答,使之规避后续疫苗免疫时的潜在风险;另一方面,化疗联合免疫方案较单一的化疗或免疫治疗可获得更好的效果[11-13]。
用于LTBI人群的重组结核新疫苗AEC/BC02是由重组MTB抗原Ag85b、早期分泌性抗原靶6(ESAT6)-培养滤液蛋白10(CFP10)与复合佐剂系统BC02(即BCG-CpG-DNA+Al)构成的,已获得临床批件。前期动物研究表明,AEC/BC02疫苗在豚鼠潜伏感染模型上具有保护效果[14],诱发MTB感染豚鼠产生超敏反应的风险较低[15]。本研究中,笔者对MTB感染豚鼠先进行INH治疗后,再采用AEC/BC02疫苗进行免疫,评价化疗和免疫治疗相结合后豚鼠的肝、脾、肺脏器病变程度和脾、肺脏活菌载量,并与单一化疗或单一免疫治疗结果进行比较,以期为AEC/BC02的临床应用提供依据。
材料和方法
一、材料
1. 动物:无特定病原体(specific pathogen free, SPF)级Hartley豚鼠30只,雌雄各15只,每只体质量250~350 g,由中国食品药品检定研究院实验动物资源中心提供。实验动物使用许可证号:SCXK(京)2011-0008。实验过程中饲养于达到生物安全Ⅲ级的负压动物房。
2. AEC/BC02疫苗和INH:AEC/BC02疫苗由重组MTB蛋白Ag85b和ESAT6-CFP10融合蛋白与BC02佐剂系统构成,1人份为(10 μg Ag85b+10 μg ESAT6-CFP10)/0.5 ml BC02,即每0.5 ml的BC02佐剂中含有10 μg Ag85b和10 μg ESAT6-CFP10;由安徽智飞龙科马生物制药有限公司提供。INH购自Sigma-Aldrich公司。
3. 攻毒试验菌液:MTB(CMCC95052,中国医学细菌保藏管理中心提供)接种于改良罗氏培养基上,37 ℃培养约4周后收集,比浊后稀释成1 mg/ml菌悬液,分装后保存于-70 ℃冰箱[16]。
二、方法
1. 豚鼠感染:从-70 ℃冰箱取出MTB菌液,室温融化后,用生理盐水将浓度稀释为2×103菌落形成单位(CFU)/ml,置冰浴中备用。在进行攻毒试验时,在豚鼠腹股沟皮下注射0.5 ml,即每只豚鼠感染量为1.0×103CFU。
2. 动物分组和免疫:30只豚鼠进行攻毒试验1周后,以雌雄各50%的比例通过随机数字表法分成4个组:(1)AEC/BC02组,6只,每只采用AEC/BC02疫苗1人份/针进行肌肉免疫,共6针,每针间隔9~10 d;(2)INH组,6只,每只采用INH灌胃,10 mg/次进行治疗,每周3次,共2周;(3)INH+AEC/BC02组,6只,先采用INH灌胃治疗2周后(用量同INH组),再采用AEC/BC02疫苗进行肌肉免疫(剂量和针次同AEC/BC02组);(4)NS组,12只,按AEC/BC02组的免疫间隔和针次仅注射NS作为阴性对照。所有豚鼠在进行攻毒试验后第10周解剖。
3. 脏器病变和细菌载量分析:感染后第10周,所有豚鼠处死解剖,先对肝脏、脾脏和肺脏分别进行病变评分(表1),总和为肝、脾、肺脏器的综合病变评分;再剪取1/2的脾脏或肺脏置于研磨器中,加入3 ml生理盐水研磨均匀。按0.5 ml脾、肺菌悬液︰4.5 ml生理盐水的比例进行10倍系列稀释,根据脏器病变程度接种不同的稀释度,每个稀释度接种于改良罗氏培养基上,共计2支(0.1 ml/支),37 ℃培养,4周后进行菌落计数。
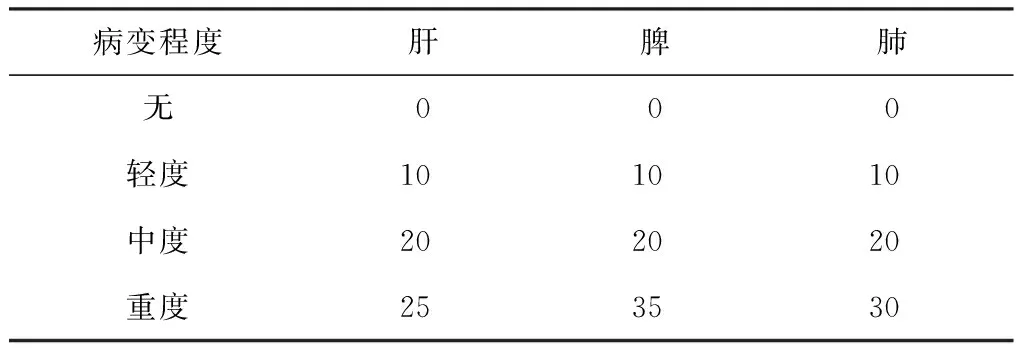
表1 豚鼠肝、脾、肺脏病变评分标准(分)[17]
结 果
一、肝、脾、肺脏器病变分析
如图1~4所示,各组豚鼠经AEC/BC02、INH或INH+AEC/BC02不同方案免疫和(或)化疗处理后,肝、脾、肺脏病变程度均有一定程度的减轻(图1~3),整体的脏器综合病变评分分别为(36.7±28.2)、(20.0±12.7)和(3.3±5.2)分,与未治疗的NS组[(69.2±24.5)分]进行比较,差异均有统计学意义(图4,分别为q=4.37,P=0.023;q=6.61,P<0.001;q=8.85,P<0.001)。其中INH+AEC/BC02联合治疗的效果最好,综合病变评分低于AEC/BC02,差异有统计学意义(q=3.88,P=0.049);也低于INH组,但差异无统计学意义(q=1.94,P=0.527)。同时,病理组织切片分析显示,各组豚鼠的肝脏、脾脏和肺脏均出现不同程度的以肉芽肿病灶为主的病理改变,病变程度由轻到重依次为INH+AEC/BC02组、INH组、AEC/BC02组和NS组。各组的肺部病理照片见图5~8。
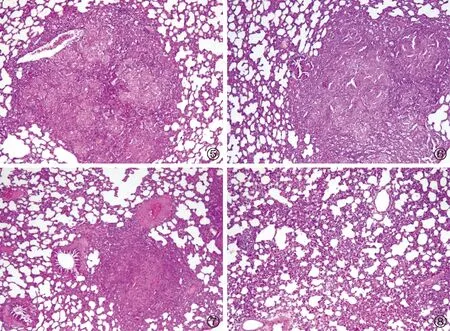
图5~8 豚鼠肺脏病理组织切片分析(HE ×100)。图5为NS组;图6为AEC/BC02组;图7为INH组;图8为INH+AEC/BC02组。各组肺脏均出现不同程度的以肉芽肿病灶为主的病理变化,病变程度由轻到重依次为INH+AEC/BC02组、INH组、AEC/BC02组和NS组
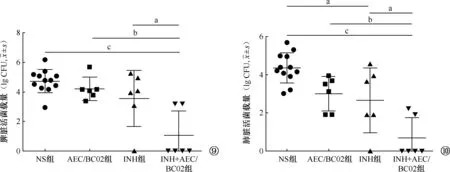
注 一元方差分析后的Tukey多重比较检验,a:P<0.05,b:P<0.01,c:P<0.001图9, 10 脾脏、肺脏活菌载量计数
二、脾、肺脏活菌载量(图9, 10)
豚鼠经过治疗后,INH+AEC/BC02组的脾脏活菌载量最低,为(1.06±1.64) lg CFU,与INH组的(3.55±1.90) lg CFU、AEC/BC02组的(4.21±0.78) lg CFU及NS组的(4.73±0.79) lg CFU比较,差异均有统计学意义(分别为q=4.84,P=0.011;q=6.12,P=0.001;q=8.23,P<0.001),但INH组、AEC/BC02组和NS组之间,差异无统计学意义(F=2.12,P=0.146)。
在肺脏活菌载量方面,INH+AEC/BC02组为(0.69±1.07) lg CFU,与INH组的(2.66±1.70) lg CFU、AEC/BC02组的(3.01±0.90) lg CFU及NS组的(4.36±0.79) lg CFU比较,差异均有统计学意义(分别为q=4.43,P=0.021;q=5.21,P=0.006;q=9.50,P<0.001);同时,INH组与NS组的差异也有统计学意义(q=4.39,P=0.022)。
讨 论
本研究在豚鼠模型上,将INH治疗和结核疫苗AEC/BC02免疫相结合,与单一的INH治疗或疫苗免疫比较,评价不同治疗方式的治疗效果。对于已感染MTB的豚鼠,抗生素治疗常可起到立竿见影的效果。参照LTBI治疗的临床推荐剂量(10 mg·kg-1·d-1)[18],本模型对感染豚鼠(按每只0.4 kg计算)灌胃INH剂量为每只每次10 mg,3次/周,但给药疗程并未采用临床推荐的长达24~36周的标准疗程[18]。主要考虑感染动物在长时间的化疗后,MTB可能彻底被清除或者长期潜伏不能复发,将无法评估化疗之后疫苗的免疫效果,因此,建立动物模型时,采用缩短的疗程更具有操作性[19-20]。
本研究中,豚鼠进行攻毒试验后单独使用INH治疗2周即可减轻各脏器的病变,体现在单个脏器的病变评分及综合评分上,与NS组比较,差异均有统计学意义(图1~4)。但是,由于INH给药时间过短,并不能完全清除MTB,在停药后经过长达7周的恢复期,MTB又得以复发。因此,INH组豚鼠的脾脏和肺脏活菌载量的下降幅度并不大(图9~10),脾脏活菌数下降1.18 lg CFU(4.73 lg CFU-3.55 lg CFU),肺脏活菌数下降1.70 lgCFU(4.36 lg CFU-2.66 lg CFU),其中仅肺脏活菌数与NS组比较,差异有统计学意义。与抗生素的作用机制不同,疫苗通过调动肌体的免疫系统发挥作用。但对已感染MTB的动物,单纯依靠疫苗免疫,即便可诱导出强烈的细胞免疫和体液免疫,保护作用往往十分有限[21-22]。本研究中,单独免疫AEC/BC02疫苗6针后,尽管豚鼠脏器综合病变评分与NS组比较差异也有统计学意义,但单个脏器中,肝脏和脾脏的病变程度没有明显减轻,与NS组比较,差异没有统计学意义。同时脏器的活菌计数结果显示,AEC/BC02组脾脏活菌载量下降0.52 lg CFU(4.73 lg CFU-4.21 lg CFU),肺脏活菌载量下降1.35 lg CFU(4.36 lg CFU-3.01 lg CFU),与INH组和NS组比较,差异均无统计学意义。总之,从脏器的外观来看,INH和AEC/BC02疫苗均能明显减轻脏器的病变程度,但脾脏活菌载量上,与NS组比较,差异均无统计学意义。但是在肺脏活菌计数结果上,INH组肺脏活菌计数与NS组比较,差异有统计学意义,提示INH治疗效果略好于AEC/BC02免疫效果。总体上,本模型中单一药物的治疗方式产生的保护效果不够充分。
为获得更好的治疗效果,将INH化疗和AEC/BC02免疫相结合,结果显示,豚鼠各脏器的病变进一步减轻,INH+AEC/BC02组6只豚鼠中仅2只观察到脾脏有轻微病变(图2),且脾、肺脏能分离出活菌,而其他4只豚鼠的肝、脾、肺脏无病变,且脾、肺脏均未分离出活菌。这意味着INH+AEC/BC02组发病率下降到(2/6),而其他组豚鼠均全部发病(6/6或12/12)。与INH组和AEC/BC02组比较,INH+AEC/BC02组脾脏、肺脏活菌计数值急剧下降(图9~10),其中,脾脏活菌数下降幅度分别达到2.49 lg CFU(3.55 lg CFU-1.06 lg CFU)和3.15 lg CFU(4.21 lg CFU-1.06 lg CFU),肺脏活菌数下降幅度分别达到1.97 lg CFU(2.66 lg CFU-0.69 lg CFU)和2.32 lg CFU(3.01 lg CFU-0.69 lg CFU),差异均有统计学意义。组织病理检查也显示,INH+AEC/BC02组脏器的病变程度最轻。这些结果表明,INH和AEC/BC02疫苗联合使用明显提高了对豚鼠的保护作用,能减轻豚鼠脏器病变,降低脾脏和肺脏的活菌载量。
目前抗结核药物仍是临床上治疗结核病和LTBI 的首选药物,但随着耐药和广泛耐药结核病患者的增多,化疗和疫苗免疫相结合不啻为解决目前单一化疗模式困境的新方法[7, 23-24]。先用抗结核药物杀灭绝大多数活跃的MTB,减轻病变部位的炎症反应;再进行疫苗免疫治疗,诱发超敏反应的风险较低[13],同时可激发免疫系统,清除残余的MTB;两者结合,期望达到彻底清除MTB的目的。本研究用豚鼠模型证实INH和AEC/BC02联合使用优于单一治疗方式,为重组结核病疫苗AEC/BC02预防LTBI的临床研究提供了新思路。
[1] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016.
[2] 唐神结,李亮,高谦,等. 2015年结核病流行及防治进展概述.结核病与肺部健康杂志, 2016, 5(2): 156-164.
[3] Roy A,Eisenhut M,Harris RJ,et al. Effect of BCG vaccination againstMycobacteriumtuberculosisinfection in children: systematic review and meta-analysis. BMJ, 2014, 349: g4643.
[4] Gao L,Lu W,Bai L,et al.Latent tuberculosis infection in rural China: baseline results of a population-based, multicentre, prospective cohort study. Lancet Infect Dis, 2015, 15(3): 310-319.
[5] 王倩,张洁,黄淑萍,等.母牛分枝杆菌菌苗辅助治疗复治性及耐多药结核的Meta分析.中国药房, 2008, 19(11): 838-841.
[6] Yang XY,Chen QF,Li YP,et al. Mycobacterium vaccae as adjuvant therapy to anti-tuberculosis chemotherapy in never-treated tuberculosis patients: a meta-analysis. PLoS One, 2011, 6(9): e23826.
[7] Gröschel MI,Prabowo SA,Cardona PJ,et al.Therapeutic vaccines for tuberculosis--a systematic review. Vaccine, 2014, 32(26): 3162-3168.
[8] Rook GA,al Attiyah R. Cytokines and the Koch phenomenon. Tubercle, 1991, 72(1): 13-20.
[9] Taylor JL,Ordway DJ,Troudt J,et al.Factors associated with severe granulomatous pneumonia inMycobacteriumtuberculosis-infected mice vaccinated therapeutically with hsp65 DNA. Infect Immun, 2005, 73(8): 5189-5193.
[10] Rook GA,Stanford JL. The Koch phenomenon and the immunopathology of tuberculosis. Curr Top Microbiol Immunol, 1996, 215: 239-262.
[11] 雷建平,熊国亮,胡群芳,等.化疗加用卡介苗免疫治疗预防耐多药结核病的研究.中华预防医学杂志, 2008, 42(2): 86-89.
[12] Nell AS,D’Lom E,Bouic P,et al.Safety, tolerability, and immunogenicity of the novel antituberculous vaccine RUTI: randomized, placebo-controlled phase Ⅱ clinical trial in patients with latent tuberculosis infection. PLoS One,2014, 9(2): e89612.
[13] Cardona PJ. RUTI: a new chance to shorten the treatment of latent tuberculosis infection. Tuberculosis(Edinb), 2006, 86(3-4): 273-289.
[14] Lu JB,Chen BW,Wang GZ,et al.Recombinant tuberculosis vaccine AEC/BC02 induces antigen-specific cellular responses in mice and protects guinea pigs in a model of latent infection. J Microbiol Immunol Infect, 2015, 48(6): 597-603.
[15] 卢锦标,陈保文,邓海清,等.结核分枝杆菌感染豚鼠接种重组结核疫苗 AEC/BC02后的超敏反应分析.中华结核和呼吸杂志, 2016, 39(7): 524-528.
[16] 刘刚,沈小兵,苏城,等.结核疫苗保护力评价用感染菌液的制备和保藏研究.微生物学免疫学进展, 2009, 37(3): 8-10.
[17] 陈保文,沈小兵,都伟欣,等.我国卡介苗保护力评价参考体系建立的探讨.中国防痨杂志, 2012, 34(3): 150-153.
[18] 刘二勇,周林,成诗明. 结核分枝杆菌潜伏性感染及预防性治疗研究进展的系统评价.中国防痨杂志, 2013, 35(4): 231-239.
[19] Alyahya SA,Nolan ST,Smith CM,et al.Immunogenicity wi-thout efficacy of an adenoviral tuberculosis vaccine in a stringent mouse model for immunotherapy during treatment. PLoS One, 2015, 10(5): e0127907.
[20] Aagaard C,Hoang T,Dietrich J,et al.A multistage tuberculosis vaccine that confers efficient protection before and after exposure. Nat Med, 2011, 17(2): 189-194.
[21] Chen L,Xu M,Wang ZY,et al.The development and preliminary evaluation of a newMycobacteriumtuberculosisvaccine comprising Ag85b, HspX and CFP-10:ESAT-6 fusion protein with CpG DNA and aluminum hydroxide adjuvants. FEMS Immunol Med Microbiol, 2010, 59(1): 42-52.
[22] Shanley CA,Ireton GC,Baldwin SL,et al.Therapeutic vaccination against relevant high virulence clinical isolates ofMycobacteriumtuberculosis. Tuberculosis(Edinb), 2014, 94(2): 140-147.
[23] McMurray DN. Therapeutic vaccination: hope for untreatable tuberculosis? J Infect Dis, 2013, 207(8): 1193-1194.
[24] Coler RN,Bertholet S,Pine SO,et al.Therapeutic immunization againstMycobacteriumtuberculosisis an effective adjunct to antibiotic treatment. J Infect Dis, 2013, 207(8): 1242-1252.
(本文编辑:郭萌)
Therapeutic evaluation of isoniazid in combination with recombinant tuberculosis vaccine AEC/BC02 in guinea pigs infected withMycobacteriumtuberculosis
LUJin-biao,SHENXiao-bing,SUCheng,YANGLei,DUWei-xin,WANGGuo-zhi,CHENBao-wen.
DivisionofTuberculosisVaccines,NationalInstitutesforFoodandDrugControl,KeyLaboratoryoftheMinistryofHealthforResearchonQualityandStandardizationofBiotechProducts,Beijing100050,China
CHENBao-wen,Email:bwnchen@126.com
Objective To evaluate the therapeutic effect of isoniazid combined with recombinant tuberculosis vaccine AEC/BC02 inMycobacteriumtuberculosis(MTB) infected guinea pigs. Methods Thirty guinea pigs challenged subcutaneously with 1000 CFU of MTB were divided into four groups one week later according to different treatment methods: normal saline (NS), AEC/BC02 vaccine, isoniazid (INH), and INH+AEC/BC02. In AEC/BC02 group, the animals were intramuscularly immunized with the single dose of AEC/BC02 vaccine six times at 10-day intervals. In INH group, each animal was treated with 10 mg isoniazid by oral gavage three times a week for 2 weeks. In INH+AEC/BC02 group, the guinea pigs firstly received INH treatment and then vaccinated with AEC/BC02 vaccine as the same dose and frequency as the INH group and AEC/BC02 group. NS group only received six doses of normal saline as a negative control. At ten weeks after infection, all guinea pigs were killed for necropsy. The liver, spleen and lung lesion indexes of guinea pig were scored to evaluate the organ lesions, and then tissue suspensions were cultured and calculated the bacterial loads (lg CFU). Results The gross pathological scores in AEC/BC02 group, INH group and INH+AEC/BC02 group were (36.7±28.2), (20.0±12.7) and (3.3±5.2) respectively, and significantly lower than that in NS group (69.2±24.5) (q=4.37,P=0.023;q=6.61,P<0.001;q=8.85,P<0.001, respectively). There was also a significant difference between AEC/BC02 group and INH+AEC/BC02 group (q=3.88,P=0.049). The spleen bacterial load in INH+AEC/BC02 group was (1.06±1.64) lg CFU and significantly lower than INH group ((3.55±1.90) lg CFU), AEC/BC02 group ((4.21±0.78) lg CFU) and NS group ((4.73±0.79) lg CFU)(q=4.84,P=0.011;q=6.12,P=0.001;q=8.23,P<0.001, respectively). There was significant difference among INH group, AEC/BC02 group and NS group. The lung bacterial load in INH+AEC/BC02 group was (0.69±1.07) lg CFU and significantly lower than INH group ((2.66±1.70) lg CFU), AEC/BC02 group ((3.01±0.90) lg CFU) and NS group ((4.36±0.79) lg CFU)(q=4.43,P=0.021;q=5.21,P=0.006;q=9.50,P<0.001, respectively). Also the significant difference was observed between INH group and NS group (q=4.39,P=0.022). Conclusion INH in combination with AEC/BC02 vaccine was superior to single isoniazid or AEC/BC02 treatment, could reduced the organ lesions and lowered the bacterial loads in spleens and lungs.
Mycobacteriumtuberculosis; Isoniazid; Vaccines, synthetic; Drug therapy, combination; Disease models, animal; Comparative study
10.3969/j.issn.1000-6621.2017.02.004
“十二五”国家科技重大专项(2012ZX10004701)
100050北京,中国食品药品检定研究院结核病疫苗室 卫生部生物技术产品检定方法及其标准化重点实验室
陈保文,Email:bwnchen@126.com
2016-11-24)
