盐酸环丙沙星与牛血清白蛋白的相互作用研究*
2017-03-15高奕红高丰琴
王 珊,高奕红,高丰琴
(咸阳师范学院 化学与化工学院,陕西 咸阳 712000)
面对有机体的多样与复杂及不断恶化的环境,人类仍然要直接或间接地遭受各种各样的危害,因此医学和生物学的进步和突破,对新型、高效的药物开发和应用显得尤为重要和迫切。牛血清白蛋白在结构与性能上与人血清白蛋白极为相似且便宜易得,通过把它放在模拟人体环境中来研究生物学和生命科学是十分有意义的[1-2]。由于牛血清白蛋白能与许多内源物质和外源物质结合,根据其原理在生理条件下,使目标药物与牛血清白蛋白相结合,通过对其仔细研究和多次重复实验来了解药物-牛血清白蛋白结合体的结合常数、结合位点数、结合力、结合距离等问题,对于生物学与生命科学的进一步了解和对高效、低毒的新药开发及正确用药有很强的指导和启发意义[3-7]。
1 实验部分
1.1 试剂与仪器
三羟甲基氨基甲烷:Mr=121.14,天津化学制药厂;牛血清白蛋白(BSA):Mr=66 430,天津化学制药厂;盐酸环丙沙星(CIP):Mr=385.82,山西津华晖星制药厂。以上试剂均为分析纯。
紫外-可见分光光度计:UV-Vis specord50,德国耶拿公司;荧光分光光度计:RT-5310PC,日本岛津公司;分析天平:AG135,瑞士梅特勒公司。
1.2 实验步骤
1.2.1 Tris-HCl(pH=7.40)缓冲溶液的配制
用分析天平准确称取3.028 5 g三羟甲基氨基甲烷,将三羟甲基氨基甲烷溶解后定容于250 mL的容量瓶中配成浓度为0.1 mol/L的A溶液。
再准确量取2.1 mL浓盐酸(12 mol/L),并将该浓盐酸转移至250 mL的容量瓶中并用蒸馏水定容,配成0.1 mol/L的盐酸溶液记为B液。将B液缓慢加入A液中,在小磁子的搅拌下,在pH=7.40时加入约230 mL B溶液。然后用分析天平准确称量2.925 g NaCl固体,加入至上述混合溶液中,配成c(NaCl)=0.1 mol/L。
最后准确称量0.066 4 g BSA固体,加入至上述混合液中,并用蒸馏水定容至500 mL,配成含c(BSA)=2×10-6mol/L的Tris-HCl-NaCl-BSA溶液。
1.2.2 CIP溶液的配制
准确称取0.009 6 g CIP,并用上述缓冲溶液-BSA溶解并定容于250 mL的容量瓶中配成的溶液c(CIP)=1×10-4mol/L。
1.2.3 不同c(CIP)的配制
取容量为25 mL的6个容量瓶,并依次标上0、1、2、3、4、5号,并按序号依次加入0、1、2、3、4、5 L已配好的c(CIP)=1×10-4mol/L溶液,然后用缓冲溶液-BSA定容,分别配成c(CIP)=0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6mol/L溶液用于荧光和紫外-可见光谱测量。
1.2.4 同步荧光光谱法测量不同c(CIP)
将0、1、2、3、4、5号不同c(CIP)依次加入到石英比色皿中,调节荧光光谱仪,使荧光发射与激发狭缝宽度分别是10和5,固定波长在280 nm处,波长范围为300~540 nm,进行同步荧光光谱法测量,将每组荧光强度和对应波长保存下来。
1.2.5 紫外-可见光谱法测量c(CIP)
将0、1、2、3、4、5号不同c(CIP)依次加入到石英比色皿中,调节紫外-可见分光光度仪,在波长范围为190~540 nm之间以蒸馏水作为参比,扫描紫外-可见光谱,并保存数据。
2 结果与讨论
2.1 药物与BSA的相互作用的光谱图
2.1.1 不同c(CIP)与BSA间作用的荧光光谱图
在c(BSA)=2×10-6mol/L条件下,不同c(CIP)与BSA间作用的荧光光谱图见图1。

λ/nm1~6为c(CIP)=0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6 mol/L图1 不同c(CIP)与BSA间作用的荧光光谱图
牛血清白蛋白的荧光发射波长在347 nm处[8]。由图1可见,随着c(CIP)的增大,牛血清白蛋白的荧光强度逐渐减小,说明盐酸环丙沙星对牛血清白蛋白具有猝灭的作用[9]。
2.1.2 不同c(CIP)与BSA间作用的同步荧光光谱图
在c(BSA)=2×10-6mol/L条件下,不同c(CIP)与BSA间作用的同步荧光光谱图见图2。
恒定波长的荧光光谱法被称为同步荧光光谱法,在可能的条件下,选择等于斯托克斯位移的Δλ,在理论上也应该这样,但实际上很多情况下要根据实验来进行择优选择,例如:荧光黄的同步荧光分析中Δλ=3 nm,此时所得同步荧光峰形好、互不干扰,而随着Δλ的增大,当Δλ=10.20 nm时,同步荧光峰将变宽,估计会有重叠。恒定波长同步荧光光谱法具有选择性好,灵敏度高,受干扰小等特征。

λ/nm1~6为c(CIP)=0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6 mol/L图2 不同c(CIP)与BSA间作用的同步荧光光谱图
通过对图2的分析可以清楚地知道,随着c(CIP)浓度的增大,牛血清白蛋白的荧光强度逐渐减小,这结果充分证明CIP对牛血清白蛋白有荧光猝灭的效果。另一方面,从对以上图谱的分析可充分证明CIP对牛血清白蛋白有荧光猝灭作用,而且伴随着c(CIP)的增大,猝灭强度也随之增强[10-12]。
2.1.3 紫外-可见分光光谱图
紫外-可见吸收光谱法是验证小分子药物与牛血清白蛋白是否生成复合物的非常有效的方法,为确证CIP与BSA的作用,分别测定了BSA及CIP-BSA体系的紫外-可见吸收光谱,在c(BSA)=2×10-6mol/L条件下,不同c(CIP)与BSA间作用的紫外-可见分光光谱图见图3。
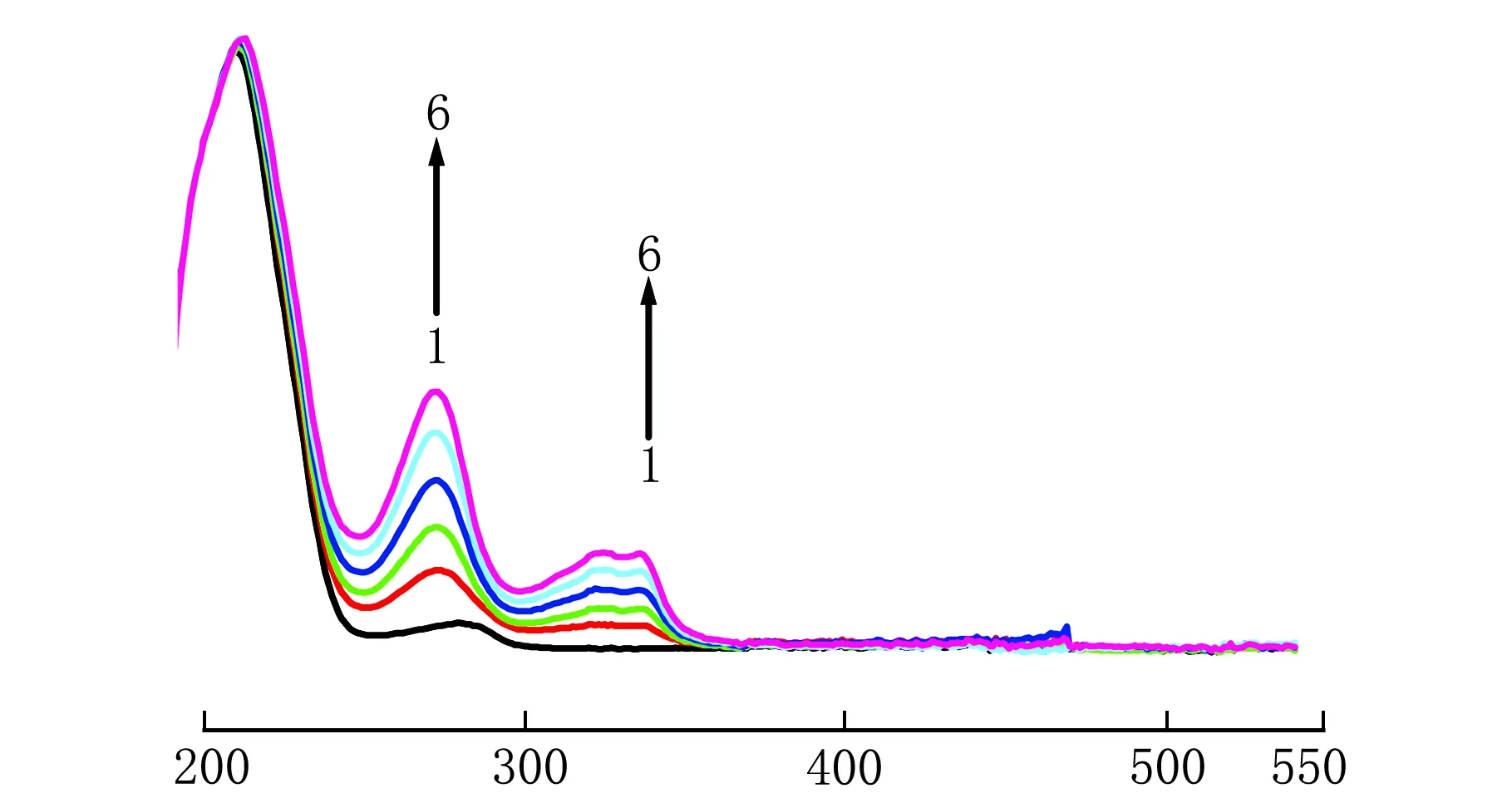
λ/nm1~6为c(CIP)=0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6 mol/L图3 不同c(CIP)与BSA间作用的紫外-可见分光光谱图
由图3可见,CIP-BSA体系的吸收光谱与其理论吸收光谱有明显差别,说明CIP与牛血清白蛋白之间发生了相互作用,并生成了新复合物[5]。
2.2 荧光光谱分析
2.2.1 CIP与BSA相互作用分析
通过对图1~图3的分析,牛血清白蛋白的荧光强度随c(CIP)的增大而表现为逐渐降低,且在最大发射波长的吸收峰处,牛血清白蛋白略有红移现象,说明CIP对牛血清白蛋白的荧光猝灭过程是静态猝灭,Stern-Volmer方程如下。
F0/F=1+Kqτ0c=1+Ksvc
(1)
式中,τ0为荧光寿命的大小,s;Ksv为Stern-Volmer猝灭常数,L/mol;Kq为猝灭速率常数,L/(mol·s);F0、F分别为有、无猝灭剂时的荧光强度;c为猝灭剂的浓度, mol/L。
CIP与BSA相互作用的Stern-Volmer分析见图4。
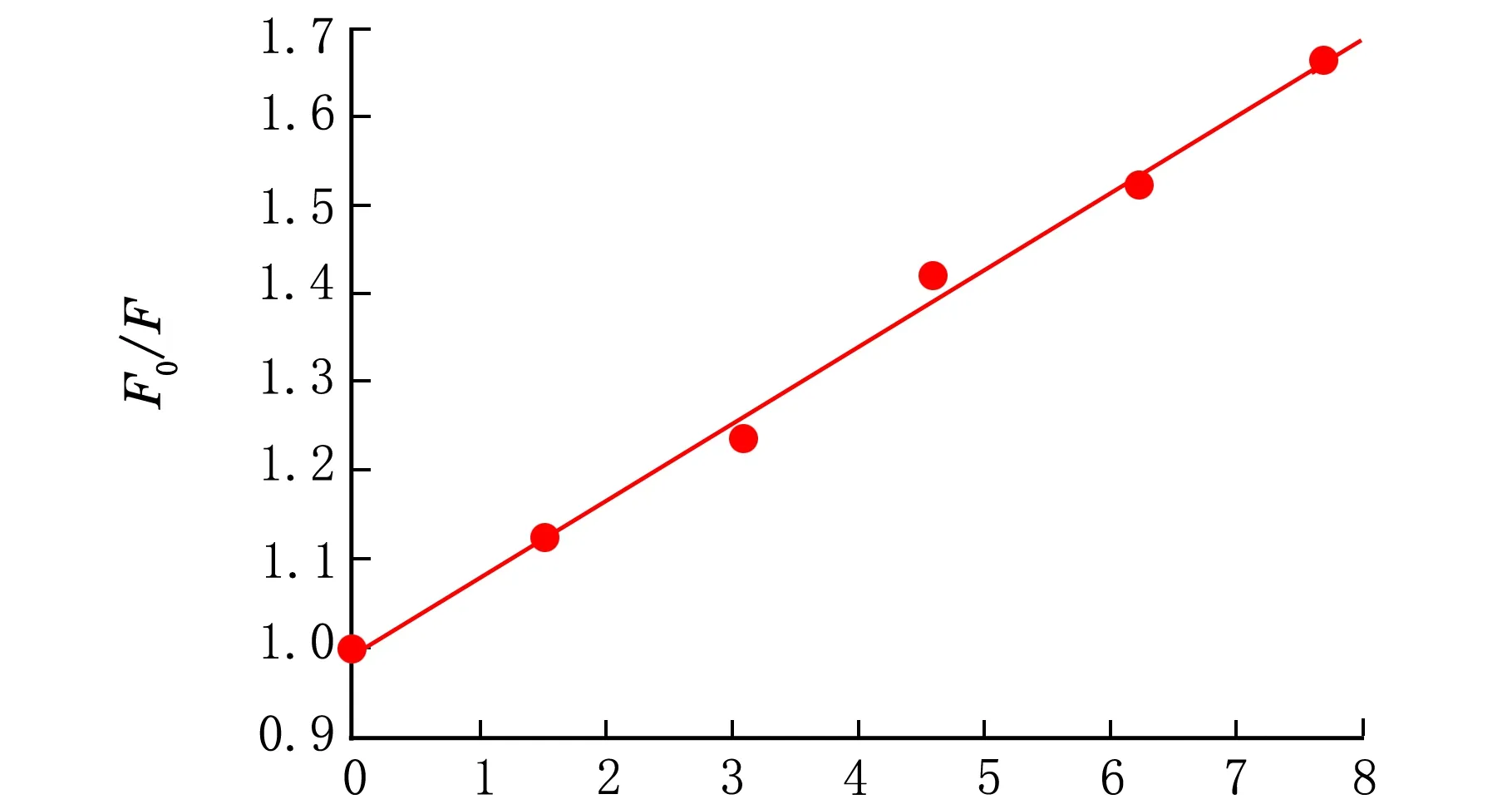
c(CIP)×106/(mol·L-1)图4 CIP与BSA相互作用的Stern-Volmer分析
由图4计算得出:Ksv=34 053 L/mol;Kq=3.405 3×1012L/(mol·s)。
Kq反映了体系中分子的彼此扩散和相互碰撞对生物大分子荧光寿命衰减速率的影响,各类荧光猝灭剂对生物大分子的最大动态荧光猝灭速率常数约为2.0×1010L/(mol·s)。通过计算结果发现CIP对牛血清白蛋白的荧光猝灭速率常数Kq值都远大于2.0×1010L /(mol·s)(最大扩散碰撞猝灭常数)[14],可以推断动态猝灭应该是静态猝灭。
当猝灭体分子和荧光物质分子之间形成新的复合物而发生静态猝灭时,服从Lineweaver-Burk双倒数方程:
(2)
通过图5计算得到静态猝灭常数KLB=3.593×10-5L/mol,更加充分证明了该荧光猝灭不是因为碰撞而引起的动态猝灭,而是通过反应生成的化合物而导致的静态猝灭[15]。
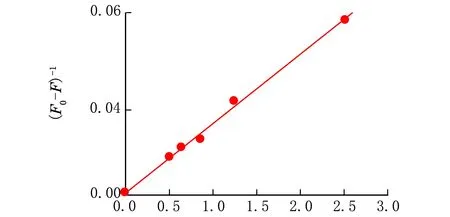
c(CIP)-1×10-5/(L·mol-1)图5 CIP与BSA相互作用的双倒数分析
2.2.2 药物与BSA相互作用的猝灭反应参数
药物与BSA相互作用的猝灭反应参数见表1。

表1 药物与BSA相互作用的猝灭参数
通过表1数据可知,CIP与牛血清白蛋白相互作用的猝灭规律为静态猝灭[11-13],同时由猝灭数据按Stern-Volmer方程,得到的猝灭速率常数Kq值都远大于2.0×1010L/(mol·s)(最大扩散碰撞猝灭常数),充分证实了猝灭不是由于碰撞引起的动态猝灭,而是由药物与牛血清白蛋白相互作用反应生成化合物而引起的静态猝灭[14-15]。另一方面,通过计算数据可知,由上述Stern-Volmer方程,双倒数曲线的相关系数R可看出各曲线线性很好,结合点数n都近似为1。
3 结 论
CIP与牛血清白蛋白相互作用的规律为静态猝灭,牛血清白蛋白与CIP之间的结合常数K=35 010.636、静态猝灭常数KLB=3.593×10-5、结合位点数n=1.081 3、猝灭速率常数Kq=3.405 3×1012。这些数据分析结果可以为之后的医药研发提供很大的帮助。
[1] 辛建伟.药物与纳米材料与牛血清白蛋白相互作用的光谱研究[D].延安:延安大学,2013.
[2] 王珊,高丰琴,杨小玲.以唑草·苯磺隆为模型研究酮类小分子与牛血清白蛋白的相互作用 [J].化工科技,2016,24(1):20-23.
[3] 王珊,高奕红,高丰琴.同步荧光光谱法研究叶酸与牛血清白蛋白的相互作用[J].化工科技,2015,23(1):14-17.
[4] 王珊,高奕红.以草甘膦,马拉·毒死蜱为模型研究有机磷农药与牛血清白蛋白的相互作用[J].化工科技,2015,23(2):27-31.
[5] 李惠卿,赵雅琴,杨斌盛,等.TNS与牛血清白蛋白相互作用的荧光光谱研究[J].光谱实验室,2007,24(1):1-5.
[6] 薛泽春,程新胜,杨丽文.尼古丁猝灭牛血清白蛋白荧光机制的研究[J].上海交通大学学报:农业科学版,2006,24(1):44-47.
[7] 陈克海,郑学仿,郭明,等.长春新碱与人血清白蛋白白蛋白的相互作用研究[J].化学学报,2007,65(17):1887-1891.
[8] 易丽.光谱法研究对硝基苯酚、苏丹Ⅲ与牛血清白蛋白的相互作用[D].沈阳:辽宁大学,2013.
[9] 王芳,裴明砚,唐乾,等.药物与血清白蛋白相互作用中荧光光谱学的研究进展[J].大连大学学报,2008,39(6):40-41.
[10] TIAN J N,LIU J Q,CHENG X G,et al.Study of the interaction of kaempferol with bovine serum albumin [J].J Mol Struct,2004,691(7):197-202.
[11] YAN Z Y,SHAO X F,YAN L,et al.Interaction between gatifloxacin and bovine serum albumin [J].J Chin Pharm Sci,2005,40(5):33-37.
[12] SHAO S,MA B,WANG X J,et al.Study on the interaction between cefodium sodium and serum albumin [J].Acta Phys Chim Sin,2005,21(7):792-795.
[13] RUSP O B,PUCHKAEV A V,Ivanov A I,et al.Interaction of albumins and heminwith aromatic antioxidants:a spectrophotometric and fluorometric study[J].Appl Biochem Micro,2006,36(1):36-45.
[14] SMYK B.Fluorescence study of sinapic acid interaction with bovine serum albumin and egg albumin [J].Fluoresc,2003,13(4):349-356.
[15] BAI H X,YANG C,YANG X R.Interaction between bovine serum albumin and Indo-1 using fluorescence spectro scopic method [J].Chem J Chinese Univ,2007,28(2):227-332.
