果胶酶辅助提取仙人掌总皂苷的工艺研究*
2017-03-15郑林禄阮俊峰王双花
郑林禄,陈 敏,魏 芬,阮俊峰,韩 莹,王双花
[1.宁德师范学院 化学系,福建 宁德 352100;2.福建省特色生物化工材料重点实验室,福建 宁德 352100;3.福建省生态产业绿色技术重点实验室(武夷学院),福建 南平 354300;4.宁德师范学院 生物系,福建 宁德 352100]
仙人掌皂苷是仙人掌中含治疗功效成分中的一种重要生物活性成分,主要以齐墩果酸型三萜类皂苷为主,具有降血糖、抗肿瘤、抗氧化和消炎止痛等独特生理功能[1-4]。将其配制成药内服,可达到祛痰、止咳、平喘的功效。此外,通过对三萜皂苷的结构和药理分析显示其还具有提高机体免疫能力、强心活血、提高应激能力和机体兴奋性的功效[5-7]。
对于仙人掌总皂苷的提取,研究者们一直在不断探索研究中。韩本勇等人[8-9]采用有机溶剂法从仙人掌中提取皂苷化合物。有机溶剂提取法主要存在的问题是采用的多数有机溶剂有毒、易挥发,而微波处理和超声波提取无形中又增加成本,大孔吸附树脂法浓缩时可能导致部分皂苷析出损失。近年来研究者发现酶解法可降低能耗,缩短提取时间,提高目标物质的提取率,且避免了挥发性有机物的使用,安全环保[10-15]。基于果胶酶可以发生酶解反应快速除去果胶物质,有效地破坏植物的细胞壁,能够更方便快捷的使皂苷溶解出来,故采用果胶酶辅助提取仙人掌总皂苷。
1 实验部分
1.1 试剂与仪器
果胶酶:食品级,南宁庞博生物工程有限公司;仙人掌粉:聚杰中药有限公司;甲醇:化学纯,乙醇、正丁醇、香草醛等试剂均为分析纯,天津市致远化学试剂有限公司。
紫外-可见分光光度计:UV-2100,北京瑞利分析仪器公司;循环水式多用真空泵:SHZ-D(III),河南省予华仪器有限公司;超级恒温水浴及机械搅拌器:HH-501,金坛市杰瑞尔电器有限公司。
1.2 实验方法
准确称取一定量的仙人掌粉末,添加适量果胶酶、调节酶解温度和溶液pH值提取总皂苷,提取液通过石油醚除杂,水饱和正丁醇萃取,再利用香草醛-冰醋酸显色,以齐墩果酸标准品溶液为对照品,通过紫外-可见分光光度法测定仙人掌中总皂苷的含量。在单因素实验(pH值、酶添加量、酶解温度和酶解时间)的基础上,采用L9(34)正交实验,得出仙人掌总皂苷的最佳提取条件;按照最佳提取工艺条件,进行重复性验证实验,计算仙人掌总皂苷提取率[16]。
1.3 仙人掌总皂苷提取率的测定
仙人掌总皂苷提取率按如下公式计算。

2 结果与讨论
2.1 标准曲线的建立
采用紫外-可见分光光度计,以齐墩果酸标准品为对照品,确定仙人掌总皂苷的最大吸收波长为547 nm,
以吸光度A为纵坐标,以标准品溶液的质量浓度ρ为横坐标,绘制标准曲线(见图1)。得到回归方程为y=19.367x+0.035 5,R2=0.994 6。说明标准品溶液的质量浓度在0~0.10 mg/mL与吸光度A具有良好的线性关系。
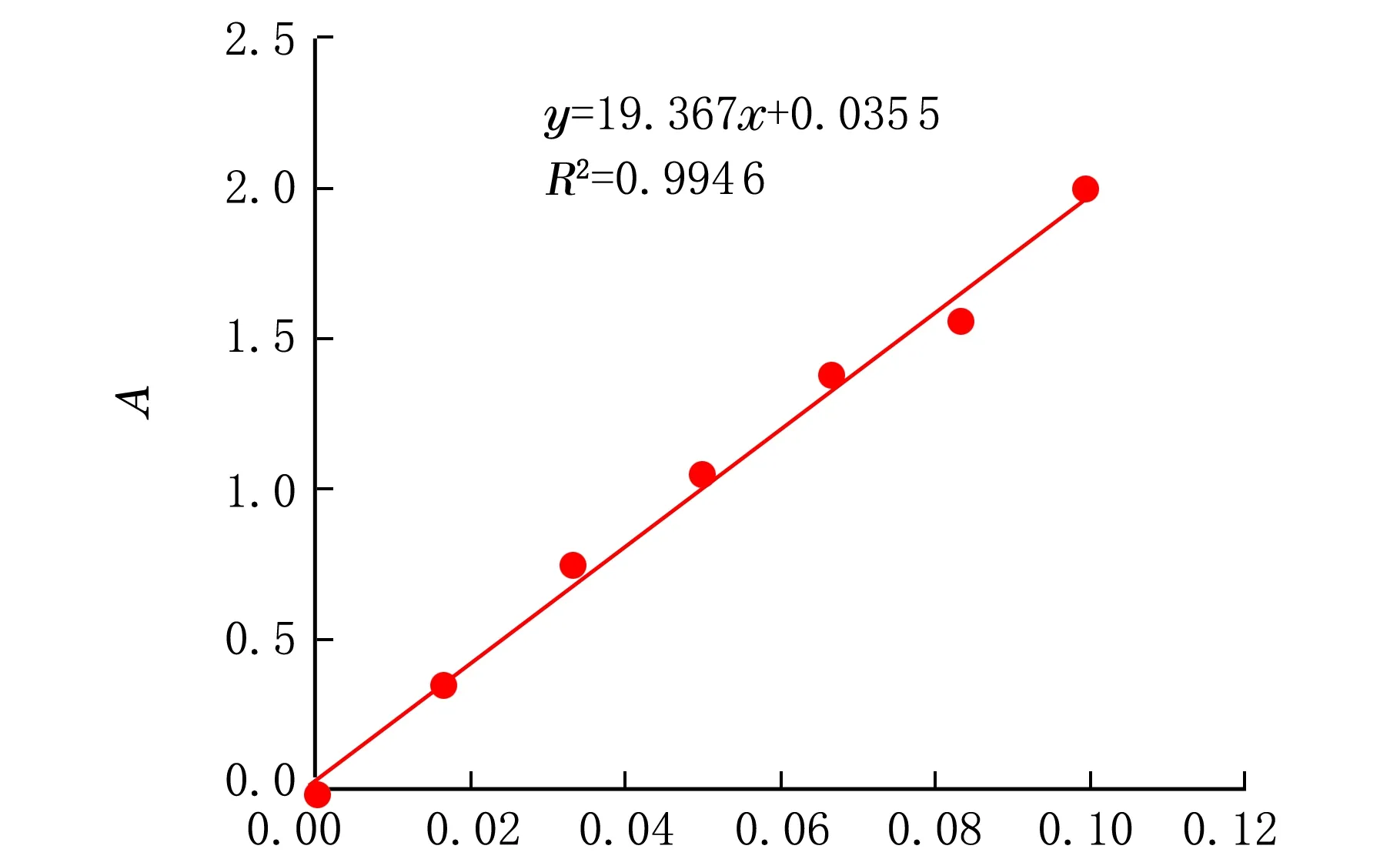
ρ/(mg·mL-1)图1 齐墩果酸对照品标准溶液的标准曲线图
2.2 单因素实验结果分析
2.2.1 最佳pH值的选择
准确称取5.00 g干燥的仙人掌粉末5份,加入0.030 g果胶酶和体积分数70%乙醇,[m(仙人掌粉末)∶V(乙醇)(g/mL,以下简称料液比)为1∶10,下同],调节pH值分别为3.5、4.0、4.5、5.0、5.5,温度为45 ℃,水浴酶解1.0 h后转入95 ℃水浴加热5 min,将提取后的溶液过滤,加入显色剂和氧化剂并定容,研究pH值对仙人掌总皂苷提取率的影响,结果见图2。

pH图2 不同pH值对仙人掌总皂苷提取率的影响
由图2可见,pH值对仙人掌总皂苷的提取率有一定的影响,pH=3.5~4.5时,随着pH值升高总皂苷的提取率也升高。当pH>4.5时,随着pH值升高总皂苷的提取率反而减少,pH=4.5时总皂苷的提取率最大,故最佳的提取pH=4.5。
实验结果分析:pH值影响着仙人掌提取液中被吸附物的吸附位点和理化性质,因此pH值对仙人掌中总皂苷的提取有一定程度的影响,因为仙人掌皂苷是天然弱酸性皂苷元,在弱酸性的条件下,其吸附性能好而且溶解度高。
2.2.2 最佳酶添加量的选择
准确称取5.00 g干燥的仙人掌粉末5份,分别加入0.020、0.030、0.040、0.050、0.060 g果胶酶和料液比1∶10的体积分数70%乙醇,调节pH=4.5,温度为45 ℃,水浴酶解1.0 h后转入95 ℃水浴加热5 min,加入显色剂和氧化剂并定容,研究酶添加量对仙人掌总皂苷提取率的影响,结果见图3。

m(酶)/g图3 酶添加量对仙人掌总皂苷提取率的影响
由图3可见,m(酶)=0.020~0.040 g时,随着酶添加量的增加,总皂苷的提取率也随之升高,当m(酶)=0.040 g时,总皂苷的提取率最大,当m(酶)>0.040 g时,总皂苷的提取率反而减少,故最佳酶添加量为0.040 g。
实验结果分析:一定量果胶酶的加入,改变仙人掌细胞壁的通透性,使得皂苷流露出来,增加提取率,但当继续添加果胶酶,反而抑制酶的作用,使得提取率下降,另外果胶酶含有竞争性抑制因子,也会抑制底物与酶的结合。
2.2.3 最佳酶解温度的选择
准确称取5.00 g干燥的仙人掌粉末5份,加入0.030 g果胶酶和料液比1∶10的体积分数70%乙醇,调节pH=4.5,温度分别为40、45、50、55、60 ℃,水浴酶解1.0 h后转入95 ℃水浴加热5 min,加入显色剂和氧化剂并定容,研究酶解温度对仙人掌总皂苷提取率的影响,结果见图4。

酶解温度/℃图4 酶解温度对仙人掌总皂苷提取率的影响
由图4可见,当酶解温度在40~55 ℃时,随着温度的升高总皂苷的提取率也升高,当酶解温度升高到55 ℃时,总皂苷的提取率达到最大值,当温度大于55 ℃时,总皂苷的提取率反而减少,故最佳的酶解温度为55 ℃。
实验结果分析:酶解温度升高可能会导致分子剧烈运动,从而使分子扩散速度加快,促使皂苷快速溶解出来,使得皂苷的提取率提高。但是如果温度过高,就会导致酶的活性成分被破坏,从而导致仙人掌总皂苷提取率减小。
2.2.4 最佳酶解时间的选择
准确称取5.00 g干燥的粉末5份,加入0.030 g果胶酶和料液比1∶10的体积分数70%乙醇,调节pH=4.5,温度为45 ℃,水浴酶解时间分别为1.0、1.5、2.0、2.5、3.0 h后转入95 ℃水浴加热5 min,加入显色剂和氧化剂并定容,研究酶解时间对仙人掌总皂苷提取率的影响,结果见图5。

酶解时间/h图5 酶解时间对仙人掌总皂苷提取率的影响
由图5可见,酶解时间对仙人掌总皂苷的提取有一定的影响,随着酶解时间的延长总皂苷的提取率升高,当酶解时间达到2.5 h时,总皂苷的提取率达到最大值,而当酶解时间继续延长时总皂苷的提取率并没有提高而趋于平稳,故最佳的酶解时间为2.5 h。
实验结果分析:随着酶解时间的延长,仙人掌总皂苷提取率先快速增加,后趋于平稳,原因可能是随着时间的加长,仙人掌逐渐酶解反应完全,所以再延长时间提取率并没有提高。
2.3 正交实验优化结果分析
为进一步优化果胶酶解法提取仙人掌总皂苷的工艺参数,在单因素实验的基础上,以皂苷提取率为考察指标,采用L9(34)安排正交实验,选取pH值(A)、酶的添加量(B)、酶解温度(C)、酶解时间(D)四个因素,正交实验因素水平表见表1。

表1 仙人掌总皂苷提取正交实验因素水平表
采用紫外-可见分光光度法测定总皂苷含量,通过L9(34) 正交实验优选出总皂苷的提取工艺,实验分析结果见表2。

表2 正交实验结果表
由表2可知,影响仙人掌中总皂苷的提取率的因素主次顺序为:B>A>C>D。最佳的提取条件为B2A2C2D1,即酶添加量为0.040 g,pH=4.5,酶解温度为55 ℃,酶解时间为2.0 h。
2.4 工艺验证实验
称取仙人掌粉末50.02 g,根据正交实验得到的最佳提取工艺条件进行验证实验。测得提取物中m(总皂苷)=0.091 3 g,总皂苷的提取率为0.182 5%。文献报道韩本勇等人[8]直接采用乙醇提取仙人掌总皂苷,与本实验采用果胶酶酶解法提取仙人掌总皂苷进行对比实验,结果见表3。表3结果表明,采用果胶酶辅助提取仙人掌中总皂苷工艺不仅可缩短提取时间,而且可有效提高总皂苷的提取率。

表3 两种提取方法的比较
3 结 论
基于酶具有高效性和特异性,酶解法不仅可降低提取成本,提高提取率,而且安全环保。本实验采用果胶酶辅助乙醇提取法,在单因素实验的基础上,采用L9(34)正交实验,实验结果得出果胶酶辅助提取仙人掌总皂苷的最佳提取工艺条件为m(酶)∶m(仙人掌粉末)=1∶125,pH=4.5,酶解温度55 ℃,酶解时间为2.0 h,在该条件下仙人掌中总皂苷的提取率为0.182 5%。与单纯乙醇提取法相比,果胶酶辅助提取法可有效缩短提取时间,提高总皂苷的提取率。
[1] 李亚军,赖亚辉.仙人掌的生物学功能及药理作用研究[J].北华大学学报:自然科学版,2007,8(3):228-231.
[2] 刘放.仙人掌的药理作用及其开发应用[J].浙江医学科学院学报,2001,48(3):29-32.
[3] 刘健剑,何计国.超声提取米邦塔仙人掌总皂苷的工艺优化[J].食品科学,2010,31(16):38-41.
[4] 许世华,王桂红,张慧勤.仙人掌提取物对小鼠血糖的影响[J].郑州大学学报:医学版,2003,38(4):543-544.
[5] 陈新梅.皂苷类脂质体研究新进展[J].中国民族民间医药,2010,19(2):20-36.
[6] 王楠,宋小骏.皂苷生物活性的研究进展[J].医学研究生学报,2007,20(2):211-214.
[7] 唐青涛,马忠华,黄苑玲,等.无患子皂苷生物活性及应用研究进展[J].天然产物研究与开发,2007,19(B11):562-565.
[8] 韩本勇.仙人掌总皂苷提取纯化工艺的研究[D].昆明:昆明理工大学,2008.
[9] 林爱琴,方幼兰,林曦.仙人掌皂甙化合物的提取与含量测定[J].福建师范大学学报,2003,19(4):116-120.
[10] 王颖莉,张丹丹.复合酶法提取远志总皂苷的工艺研究[J].世界科学技术:中医药现代化,2009,11(6):885-888.
[11] 张黎明,张露亿,杜连祥.酶解法提取胡芦巴种子中薯蓣皂苷元的工艺研究[J].农业工程学报,2005,21(2):161-164.
[12] 吕立华,周效思,彭艳梅.纤维素酶法提取知母甾体总皂苷元工艺研究[J].中医药导报,2007,13(10):73-75.
[13] 余洪波,张晓昱.酶法在中药提取中的研究进展[J].中成药,2005,27(5):591-593.
[14] 宋宏新,刘 静,张彦娟.半仿生酶法提取三七皂苷工艺研究[J].中草药,2009,40(6):905-907.
[15] 赖红芳,温晓娟.果胶酶法提取翠云草中总黄酮的工艺优选[J].中国实验方剂学杂志,2012,18(23):34-36.
[16] 林硕,岳琳娜,高学玲.果胶酶提取绞股蓝皂苷的工艺研究[J].中国食物与营养,2009(4):21-24.
