响应面法优化锦灯笼总黄酮的提取工艺*
2017-03-15钟晓瑞
闫 平,郑 蕾,赵 宁,钟晓瑞
(西安医学院 药学院,陕西 西安 710021)
锦灯笼是茄科植物酸浆干燥宿萼或带果实的宿萼,具有清热解毒、利咽化痰、利尿等作用,是常用的清热解毒药,外治天疱疮、湿疹[1],历代本草多有记载。有报道表明,锦灯笼含有黄酮类化合物[2]。在天然植物中,黄酮类化合物安全、无毒[3],具有良好的的生物活性[4-5],如抗肿瘤、抗氧化、抗衰老、抗炎等[6-7],锦灯笼提取物具有良好的抗肿瘤、抑菌活性等[8]。
关于黄酮类化合物提取、分离及纯化方法的研究报道很多,一般采用溶剂浸提法、微波法、超声波法、超临界流体萃取法、酶提法、超滤法等[9-13]。作者在前人的研究基础上,采用响应面法优化锦灯笼总黄酮的提取工艺[14],为进一步开发锦灯笼药用资源提供参考。
1 实验部分
1.1 试剂与仪器
锦灯笼:购于陕西兴盛德药业有限责任公司,由西安医学院药学院生药教研室冯永辉教授鉴定,经鉴定为PhysalisalkekengiL.Var.franchetii(Mast.) Makino 的干燥宿萼;芦丁对照品:批号为MUST-12040302,质量分数≥98%,北京恒元启天化工技术研究院;亚硝酸钠、硝酸铝、氢氧化钠、纯化水、无水乙醇、甲醇:均为分析纯,市售。
紫外-可见分光光度计:UV-160A,上海精密仪器厂;电子天平:SQP,北京赛多利斯科学仪器有限公司;架盘药物天平:IYT-10,上海光正医疗仪器有限公司;电热恒温水浴锅:DZKW-D-2,北京市永光明医疗仪器厂;循环水式真空泵:SHZ-D(Ⅲ),巩义市予华仪器有限责任公司;旋转蒸发仪:WZ-100,上海申生科技有限公司。
1.2 实验方法
1.2.1 标准溶液的配制
取芦丁标准品50.00 mg,精密称定,置于25 mL容量瓶中,加适量甲醇,置水浴上微热使其溶解,放冷,加甲醇至刻度,摇匀,精密量取10.0 mL,置100 mL容量瓶中,甲醇定容,摇匀,即得。
1.2.2 标准曲线的绘制
精密量取标准溶液1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL容量瓶中,加甲醇至6.0 mL,加质量分数5%亚硝酸钠溶液1.0 mL,摇匀,放置6 min,再加质量分数10%硝酸铝溶液1.0 mL,摇匀,放置6 min,加NaOH试液10.0 mL,再加甲醇至刻度,摇匀,放置15 min,用紫外分光光度法在500 nm波长处测定吸光度,以吸光度A为纵坐标,以标准品溶液的质量浓度ρ为横坐标,绘制标准曲线(见图1)。回归方程式:Y=11.368X+0.057 5,相关系数R=0.999 5,说明标准品溶液的质量浓度在0.008~0.048 mg/mL与吸光度A具有良好的线性关系。
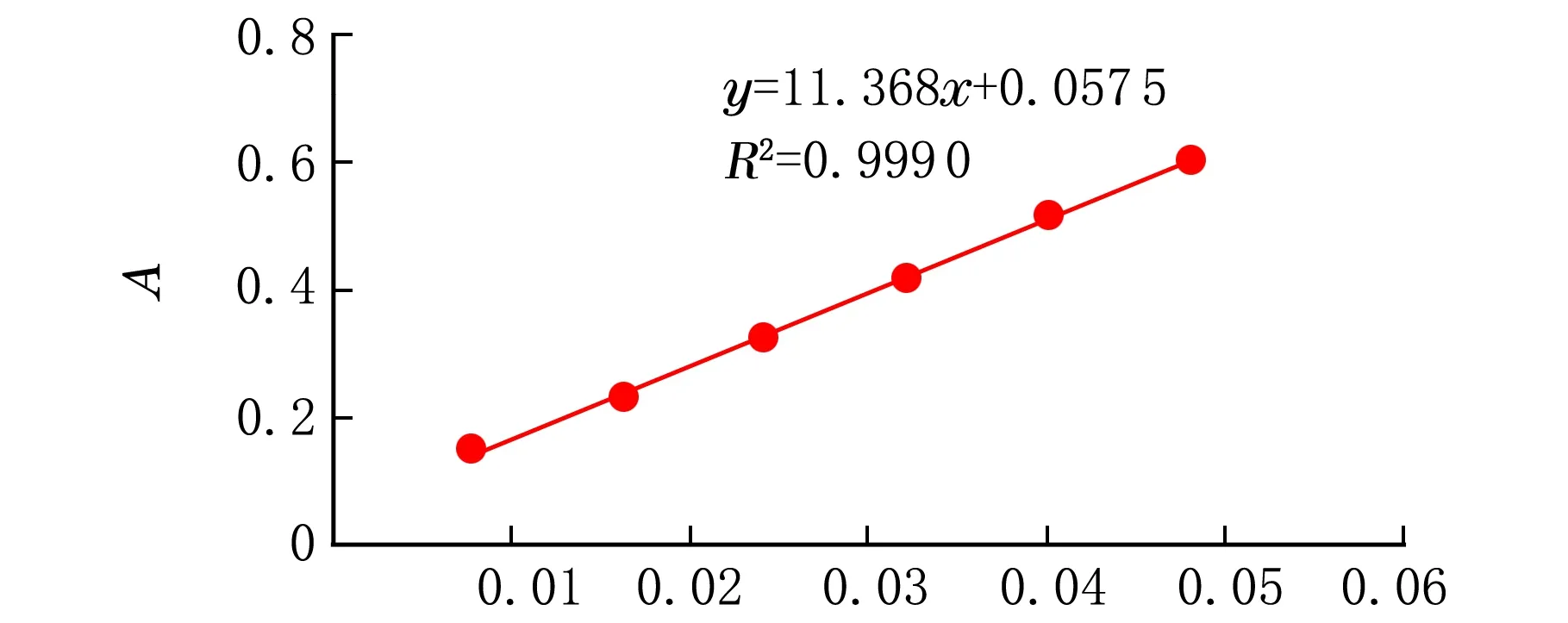
ρ/(mg·mL-1)图1 芦丁标准品曲线
1.2.3 测定样品中w(总黄酮)
取锦灯笼宿萼干燥粉末10.0 g,精密称定,用体积分数为80%的乙醇回流提取,将提取液浓缩为浸膏,低温50 ℃干燥,取浓缩后的提取物总质量的50%,精密称定,甲醇溶解并定容到100 mL容量瓶中。取锦灯笼提取液1.0 mL,按“1.2.2”项下方法测定吸光度,代入回归方程中,即可得到锦灯笼中w(总黄酮)。
2 结果与讨论
2.1 单因素考察
2.1.1 料液比的选择
取10.0 g锦灯笼宿萼5份,精密称量,按照m(锦灯笼宿萼)∶V(乙醇)(g/mL,以下简称料液比)为1∶10、1∶15、1∶20、1∶25、1∶30,用体积分数80%乙醇溶液回流提取1 h,提取2次,按照“1.2”项下方法测定w(总黄酮)并计算锦灯笼总黄酮的提取率,结果见图2。

料液比/(g·mL-1)图2 料液比对锦灯笼总黄酮提取率的影响
由图2可见,在φ(乙醇)、提取时间、提取次数一定的条件下,料液比1∶10~1∶30时提取率呈先增后减的趋势,在1∶20时达到最大值,故料液比以1∶20为宜。料液比增大而黄酮含量减小的原因可能是由于其它成分的浸出而影响了总黄酮的提取。
2.1.2 φ(乙醇)的选择
取10.0 g锦灯笼宿萼5份,精密称定,按照料液比1∶20,分别用φ(乙醇)=50%、60%、70%、80%、90%的乙醇溶液回流提取1 h,提取2次,按照“1.2”项下方法测定w(总黄酮)并计算锦灯笼总黄酮的提取率,结果见图3。

φ((乙醇)/%图3 φ(乙醇)对锦灯笼总黄酮提取率的影响
由图3可见,在料液比、提取时间、提取次数一定的条件下,随着φ(乙醇)的增加,总黄酮的提取率先增后减,当φ(乙醇)=80%时,黄酮提取率最大,故最佳φ(乙醇)=80%。
2.1.3 提取时间的选择
精密称取锦灯笼宿萼5份,每份10.0 g,固定料液比1∶20,φ(乙醇)=80%,提取次数为2次,提取时间分别为30、45、60、75、90 min进行乙醇回流提取,按照“1.2”项下方法测定w(总黄酮)并计算提取率,结果见图4。

t/min图4 提取时间对锦灯笼总黄酮提取率的影响
由图4可见,在固定料液比、φ(乙醇)及提取次数的条件下,随着提取时间的增加,总黄酮的提取率先增后减,当提取时间为60 min时,黄酮提取率最大,故最佳提取时间为60 min。
2.1.4 提取次数的选择
精密称取锦灯笼宿萼5份,每份10.0 g,固定料液比1∶20,φ(乙醇)=80%,提取时间60 min,乙醇回流分别提取1次、2次、3次,按照“1.2”项下方法测定w(总黄酮)并计算提取率,结果见图5。
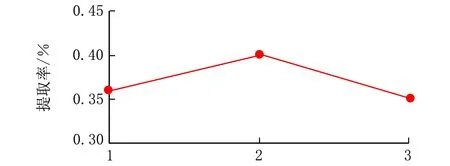
提取次数图5 提取次数对锦灯笼总黄酮提取率的影响
由图5可见,在固定料液比、φ(乙醇)及提取时间的条件下,随着提取次数的增加,总黄酮的提取率成上升趋势,当提取2次时,黄酮提取率达到最高值,故最佳提取次数为2次。
2.2 响应面法优化实验
2.2.1 模型建立及显著性实验
根据Box-Benhnken的中心组合实验设计原理,在单因素的基础上筛选出最优水平,以φ(乙醇)(A)、料液比(B)、提取时间(C)和提取次数(D)四个因素为自变量,以w(总黄酮)为响应值Y,采用四因素三水平进行响应面法实验。响应面因素和水平取值见表1。

表1 响应面实验因素与水平
按照Box-Benhnken的中心组合设计方案进行了四因素三水平共29个实验点的响应面分析实验,24个实验点和5个零点对总黄酮的乙醇回流提取工艺进行优化。实验设计及结果见表2。

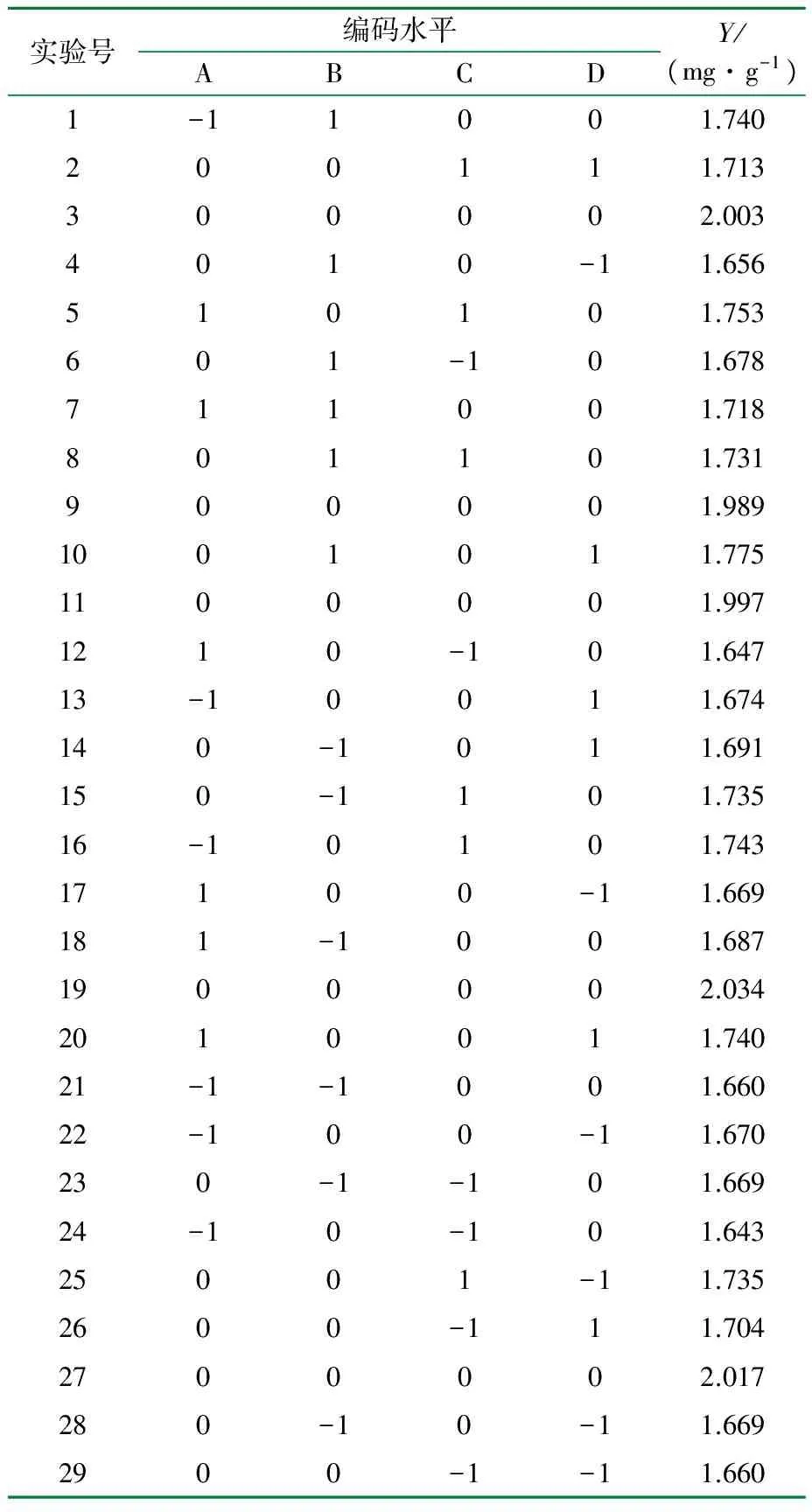
表2 响应面实验设计结果
同时对表2中的数据进行多元回归分析,其结果见表3。


表3 方差分析结果
1) ***表示差异极显著(P<0.001),**表示差异高度显著(P<0.01),*表示差异显著(P<0.05)。
2.2.2 响应曲面分析
在其它因素均为零的水平上,分析对总黄酮提取率的影响,选择φ(乙醇)、料液比、提取时间、提取次数四个变量中的任两个交互因素进行分析,回归优化响应面分别见图6~图11。
由图6~图11可知,此实验模型都能达到极值点。其中响应面图坡度越陡对黄酮提取率影响越大,坡度越缓对黄酮提取率影响越小,由以上6个图综合可得,四个因素对黄酮提取率影响的顺序由大到小为:料液比、φ(乙醇)、提取次数、提取时间。为确定最佳响应值的因素水平组合,利用Design-Expert 8.0.6.1统计软件进行分析,得出优化条件为:φ(乙醇)=80.24%,料液比1∶20,提取时间1.05 h,提取次数2.06次。考虑实际操作性,将工艺参数更改为φ(乙醇)=80%,料液比1∶20,提取时间1 h,提取次数为2次。
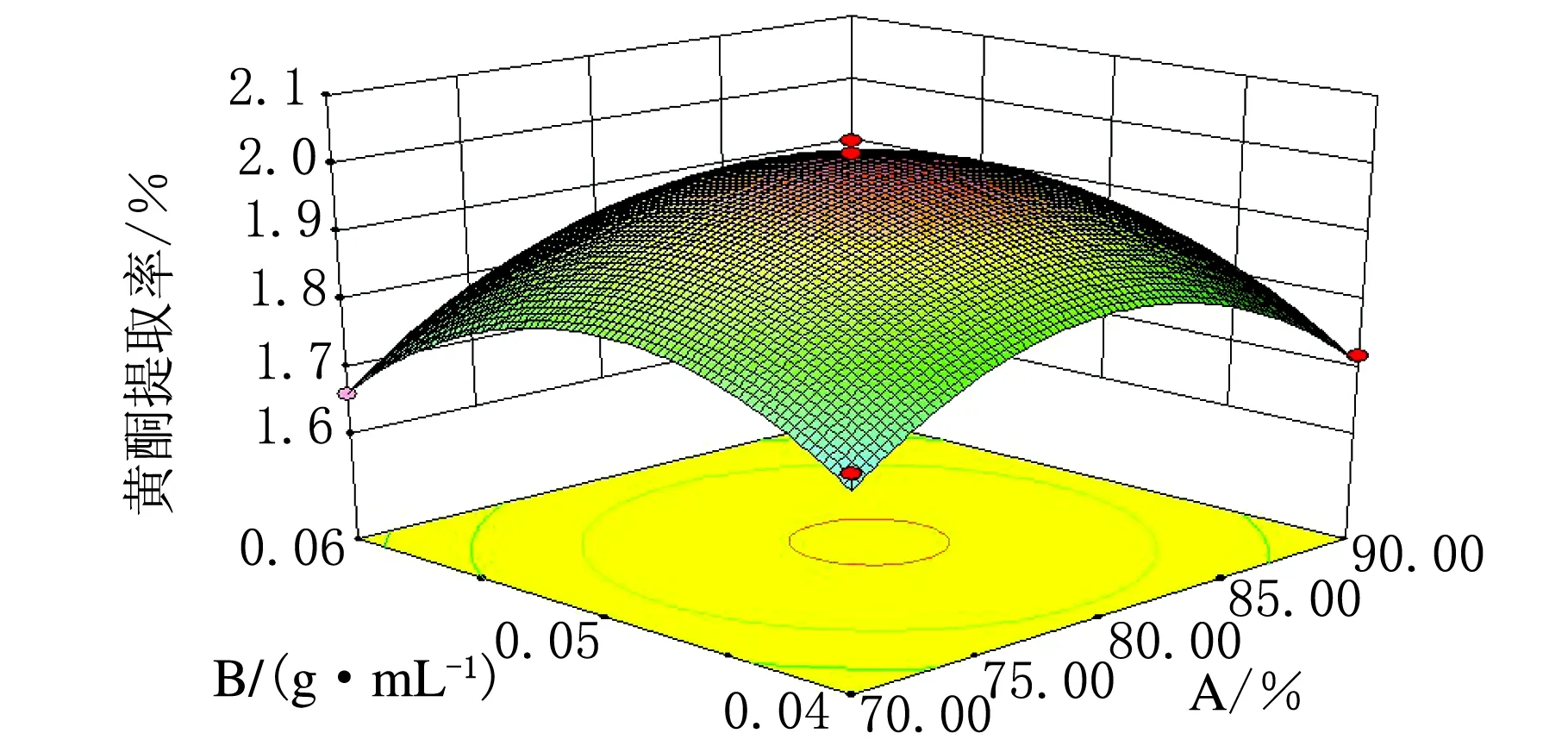
图6 φ(乙醇)与料液比交互作用影响锦灯笼总黄酮提取率的响应面图

图7 φ(乙醇)与提取时间交互作用影响锦灯笼总黄酮提取率的响应面图
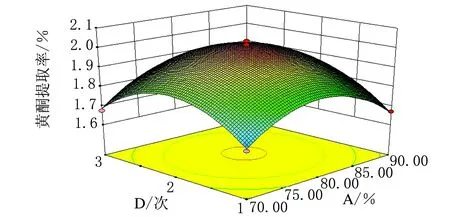
图8 φ(乙醇)与提取次数交互作用影响锦灯笼总黄酮提取率的响应面图
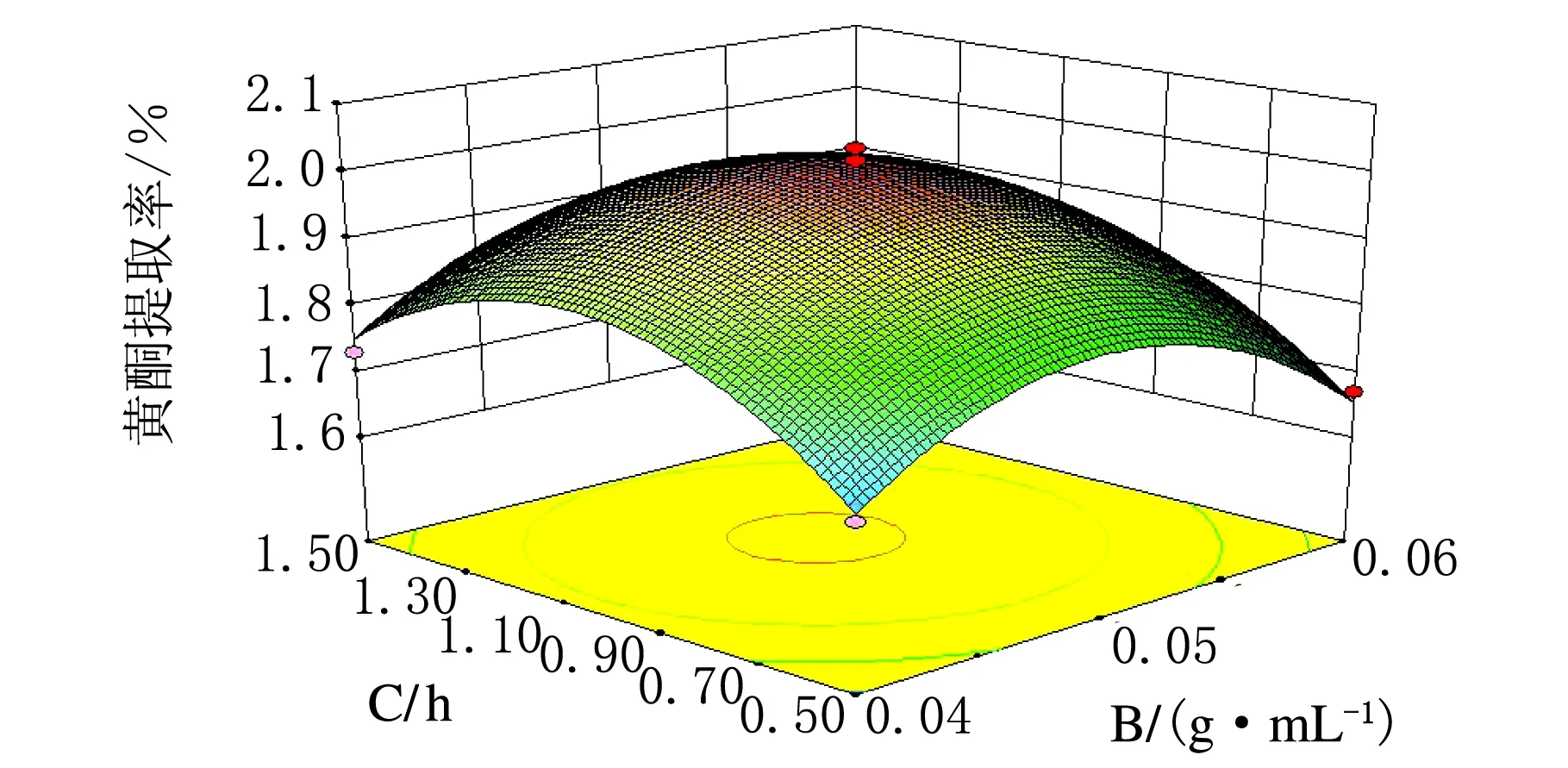
图9 料液比与提取时间交互作用影响锦灯笼总黄酮提取率的响应面图

图10 料液比与提取次数交互作用影响锦灯笼总黄酮提取率的响应面图

图11 提取时间与提取次数交互作用影响锦灯笼总黄酮提取率的响应面图
2.2.3 模型验证
采用修正后优化工艺参数条件按“1.2.3”项下方法,重复三次实验,平均w(总黄酮)=2.016 mg/g,此条件下w(总黄酮)的理论预测值为2.109 8 mg/g,两者相比,相对误差为2.39%,说明响应面优化法结果可靠,稳定可行。
3 结 论
本研究在单因素的基础上,通过响应面法考察了料液比、φ(乙醇)、提取时间、提取次数对锦灯笼总黄酮的影响,建立了锦灯笼总黄酮的多元回归模型,模型拟合度良好。确定了黄酮的最佳提取工艺:料液比1∶20,φ(乙醇)=80%,提取时间1 h,提取次数为2次,w(黄酮)可达到2.016 mg/g。单因素影响顺序为:料液比>φ(乙醇)>提取次数>提取时间。黄酮提取的实际值与预测值相近,各因素与w(总黄酮)呈显著的二次抛物关系,表明各交互因素在响应值Y处存在最大值。响应面法优化锦灯笼总黄酮的提取工艺,方法可行,预测性好,得到的工艺条件稳定,为进一步研究锦灯笼提供了可靠的理论依据。
[1] 郭颖,刘静,等.锦灯笼的研究进展[J].中药材,2012,35(12):2039-2043.
[2] 杨异卉,张明宇,等.锦灯笼宿萼中总黄酮的提取、富集及含量测定[J].哈尔滨医科大学学报,2012,46(6):553-555.
[3] 董宇.黄酮类化合物的提取方法研究及展望[J].人参研究,2009(4):33-35.
[4] 国家药典委员会.中国药典:Ⅰ部[M].北京:中国医药科技出版社,2010:333.
[5] TAVARINI S,DEGL'INNOCENTI E,REMORINI D,et al.Antioxidant capacity,ascoribic acid,total phenols and carotenoids changes during harvest and after storage ofHaywardkiwifruit[J].Food Chemistry,2008,107(1):282-288.
[6] 王赵改,杨慧.香椿产业的现状及发展趋势[J].农产品加工,2013(7):8-10.
[7] 王慧.黄酮类化合物生物活性的研究进展[J].食品与药品,2012,12(9):347-350.
[8] 王战勇,苏婷婷,等.锦灯笼宿萼提取物的提取及其抑菌作用研究[J].食品科技,2009,44(8):142-145.
[9] 姜红波.黄酮类物质的提取和含量测定方法研究进展[J].化工时刊,2010,24(11):45-49.
[10] 吴聪华,程华,等.药用植物黄酮类化合物的提取方法[J].武汉工程大学学报,2011,33(9):33-38.
[11] 黄丽芸,邓鼎森,等.黄酮类化合物常用提取方法研究[J].药物研究,2014,10(9):57-58.
[12] 赵子龙,薛培凤,等.天然药物中总黄酮的提取工艺研究进展[J].内蒙古医学院学报,2012,34(6):512-516.
[13] 邸娜,郑喜清,等.植物天然成分黄酮类化合物的提取方法[J].安徽农业科学,2014,42(33):11888-11889.
[14] 刘艳杰,项荣武.响应面法在药学试验设计中的应用[J].中国现代应用药学杂志,2007,24(6):455-457.
[15] 杨文鸽,谢果凰,等.响应面分析法优化海鳗的湿腌工艺[J].中国食品科学报,2010,101(1):133-139.
