芦丁β-环糊精聚合物的制备及性能研究*
2017-03-15杨黎燕唐成芳张雪娇罗诗琪秦欢欢谭健聪
杨黎燕,唐成芳,张雪娇,尤 静,罗诗琪,秦欢欢,谭健聪
(西安医学院 药物研究所,陕西 西安710021)
芦丁(Rutin)又名芸香苷、路丁、络通或槲皮素-3-O-芸香糖苷,是黄酮醇槲皮素与二糖芸香二糖α-L-鼠李吡喃糖基-(1→6)-β-D-葡萄吡喃糖之间形成的糖苷,是一种天然绿色药物。具有抗菌、消炎、抗辐射、抗氧化、调节毛细血管壁的渗透性和降低血管的脆性等功用[1-2]。临床上可用于防治脑溢血、高血脂、高血压、脑血栓、糖尿病、视网膜出血、紫癜和急性出血性肾炎、心机梗塞等[3-4]。由于是天然绿色药物,芦丁适合在功能性食品中添加,但其水溶性过低,如何增加其水溶性,以拓展其在食品药品中的应用范围是科学工作者需要考虑的问题之一。环糊精分子略成锥体状的环形空腔,在开口较小的上方边缘排列着伯羟基,所有的仲羟基都排在环状分子开口较大的下边缘[5],内部疏水、外部亲水使得它们既有水溶性,又可将疏水的组分包在其空腔内,形成主-客体分子或超分子配合物[6],将环糊精与聚合物结合可形成环糊精聚合物,这种新材料除了保持环糊精本身的特性外,还具有聚合物的各种优良性能,如环境pH值、温度、光响应性等,聚合物链上同时含有多个单元还具有独特的高分子效应,如协同效应、邻基效应和较高的力学强度等,这些性能使得它在医药、环保、食品、生命科学等领域获得很好的应用[7-11]。环糊精聚合物分子内疏水外亲水性可增强脂溶性药物的溶解作用,并且空腔大小与许多药物分子匹配,这就拓宽和加速了芦丁在医药领域的应用[12]。
作者选用反相乳液聚合法制备β-环糊精聚合物微球,共沉淀法制备芦丁β-环糊精聚合物(β-CDP)微球,并对其在不同pH条件下缓释性能进行了考察。
1 实验部分
1.1 试剂与仪器
芦丁:标准品,质量分数≥98%,国药集团化学试剂有限公司;β-环糊精(β-CD)、环氧氯丙烷:天津博迪化工有限公司;Tween20:天津市科密欧化学试剂有限公司;Span80:天津化学试剂有限公司;乙醇:体积分数95%,天津市河东区红岩试剂厂;以上试剂均为分析纯;煤油:市售;实验用水为蒸馏水。
集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司;精密増力电动搅拌器:JJ-1,上海浦东物理光学仪器厂;恒温水浴锅:HH-WO-501,江苏省金坛市医疗仪器厂;离心机:TDL-40B,上海安亭科学仪器厂;真空干燥箱:DZF-6050,上海琅玕实验设备有限公司;电动搅拌器:JJ-1,江苏金坛市正基仪器有限公司;超声仪:KQ5200E,昆山市超声仪器有限公司;光学显微镜:XSP-XSZ,北京泰克仪器有限公司;傅里叶红外光谱仪:VECTOR-22,德国BRUKER公司;紫外可见分光光度计:UV-2102 PCS,尤尼克(上海)仪器有限公司;Malvem激光粒度仪:ZEN3600,上海帮亿精密仪器公司。
1.2 实验方法
1.2.1 空白β-CDP微球的制备[13]
以β-CD为原料,环氧氯丙烷为交联剂,煤油为油相,用反相乳液法合成β-CDP微球。
1.2.2 芦丁β-CDP微球包合物的制备方法
选择芦丁和β-CDP微球不同投料比,称取一定量芦丁溶解于水中,加入1 g空白β-CDP微球,70 ℃下磁力搅拌4 h,反应结束后冷却至室温,在冰箱中冷藏24 h,过滤,充分洗涤,60 ℃真空干燥至质量恒定。
1.2.3 芦丁标准曲线的绘制
精密量取标准溶液1.0、2.0、3.0、4.0、5.0 mL于50 mL容量瓶中,用体积分数30%的乙醇定容,摇匀,紫外可见分光光度计于257 nm波长处测吸光度,得到标准曲线回归方程:y=0.032 3x+0.042 9,R2=0.993 5。
1.2.4 评价指标
分别取不同投料比的载药微球0.5 g,溶于100 mL蒸馏水中。在60 ℃下充分降解,然后取滤液稀释到一定浓度范围,于紫外可见分光光度计检测,计算芦丁载药量(Y1)和包封率(Y2)。
(1)
(2)
分别设定微球载药量、包封率最高得10 分,最低得1 分,按照比例关系计算出其它得分,然后相加芦丁的包封率和微球的载药率得分,得出每号实验结果的经验得分Y0,然后把经验得分Y0作为因变量,将Y1,Y2分别作为自变量,求出它们的线性回归方程式。再把各号实验的评分实测值代入线性回归方程中计算,即得该号实验的线性回归综合评分Y。
1.2.5 芦丁β-CDP载药微球的释药性能
用动态透析法考察芦丁β-CDP载药微球不同投料比m(芦丁)∶m(微球)为0.02∶1、0.03∶1、0.05∶1时的释药性能。取芦丁β-CDP载药微球,转入已处理好的长度约为10 cm的透析袋中,两端系紧,分别置于100 mL,(37±5) ℃磷酸缓冲液pbs(pH=7.4)和pbs(pH=1.2)中,50 r/min磁力搅拌进行溶出。分别于第0.25、0.5、1、2、3、4、6、8、10、12、24、36、48、60 h时取样4 mL,同时补充等体积同温度的pbs缓冲液,定容,最大吸收波长处紫外分光光度计测定吸光度,计算累积释药量,绘制累计释药曲线图。
1.2.6 微球粒径及Zeta电位
分别取不同投料比[m(芦丁)∶m(微球)]为0.03∶1、0.05∶1、0.1∶1的载药微球和空白微球适量,均匀分散在适量的无水乙醇中,超声30 min,并用微孔滤膜(0.45 μm)过滤,分别取1 mL制备好的上述溶液,通过Malvem激光粒度仪测定粒径和Zeta电位。
1.2.7 傅里叶红外光谱测试
取微量芦丁、制备好的β-CDP微球、芦丁β-CDP载药微球包合物固体粉末,将样品与溴化钾充分研磨后压片,测其红外光谱。
2 结果与讨论
2.1 m(芦丁)∶m(微球)对载药量和包封率的影响
按照1.2.2项下实验方法,考察m(芦丁)∶m(微球)为0.01∶1、0.02∶1、0.03∶1、0.05∶1、0.1∶1、0.2∶1时,载药微球的载药量和包封率,结果见图1。

m(芦丁)∶m(微球)图1 m(芦丁)∶m(微球)的影响
结合综合评分图(见图2),Y=0.537 3Y1+0.254 0Y2-14.504 2,m(芦丁)∶m(微球)从0.01∶1至0.02∶1时,综合评分的增加较之后的变化较为显著,之后随着投药量的增加,综合评分变化较小。当投料比达到0.02∶1时,包封率为 88.41%,载药率为2.07%。

m(芦丁)∶m(微球)图2 m(芦丁)∶m(微球)的综合评价
2.2 载药微球的释药性能
按照1.2.5项下实验,m(芦丁)∶m(微球)=0.02∶1时,载药微球在37 ℃下pbs(pH=7.4)和pbs(pH=1.2)中的体外释药累积曲线见图3。
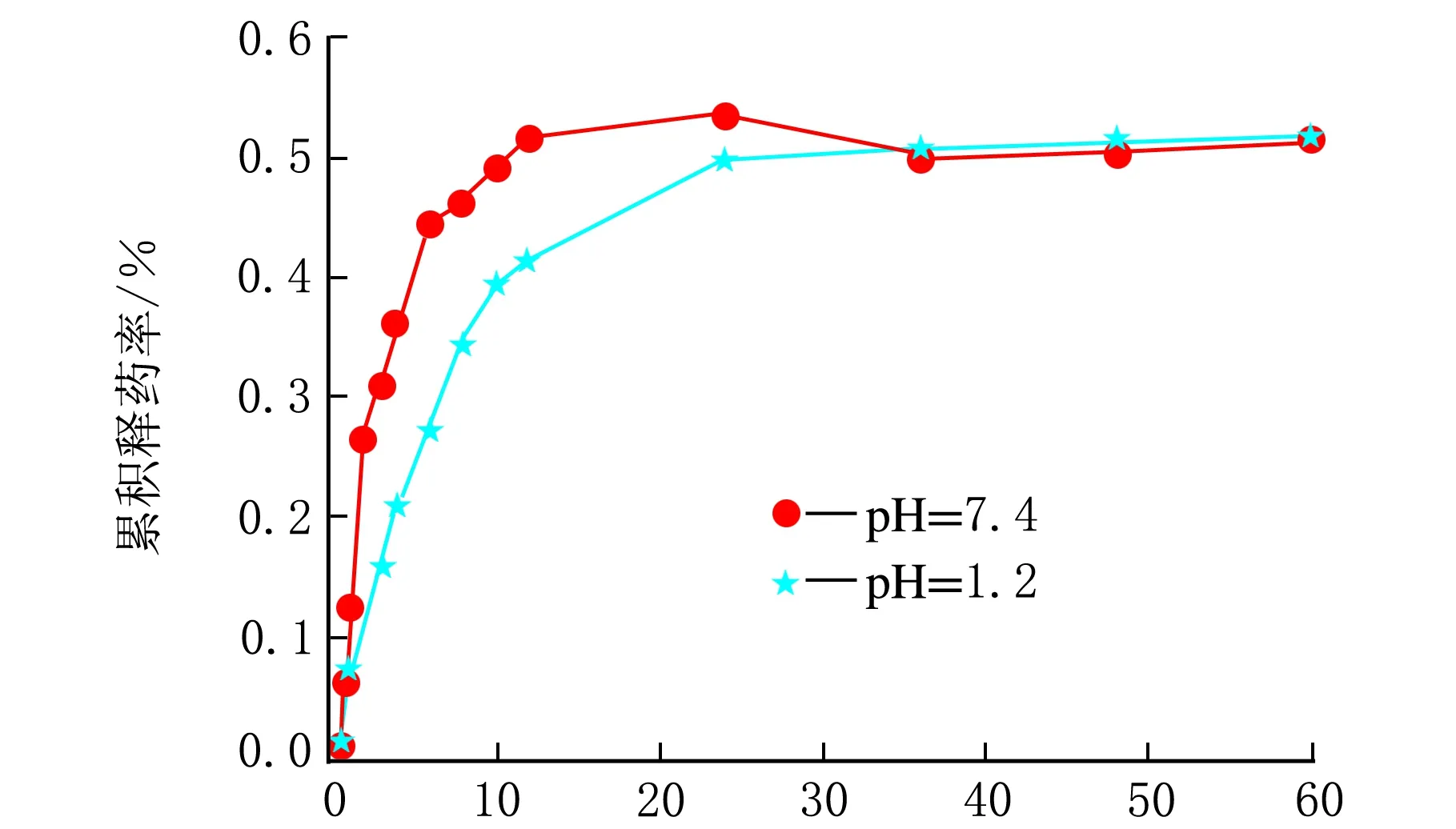
t/h图3 m(芦丁)∶m(微球)=0.02∶1的累积释药率
由图3可见,m(芦丁)∶m(微球)=0.02∶1的芦丁β-CDP载药微球在pbs(pH=7.4)和pbs(pH=1.2)中均释放较慢。芦丁β-CDP载药微球在pH=7.4中,芦丁开始释放速率较快,到达12 h时释放速率减缓,这可能是刚开始芦丁的浓度高,释放能力较大,而且吸附在微球表面的药物也快速溶解在缓冲液中,随着释放时间的延长,药物释放逐渐从微球表面过度到微球内部,此时微球里面的药物缓慢而均匀向外扩散。在pH=7.4时,芦丁释药比pH=1.2时的释药程度略好。40 h以后基本达到平衡,药物达到吸附-吸收动态平衡,24 h后累积释药量达53.49%。芦丁β-CDP载药微球在pbs(pH=1.2)中,24 h后累积释药量为49.82%。
m(芦丁)∶m(微球)=0.03∶1时,37 ℃下载药微球分别于pbs(pH=7.4)和pbs(pH=1.2)中的体外缓释累积曲线见图4。

t/h图4 m(芦丁)∶m(微球)=0.03∶1的累积释药率
从图4可知,芦丁β-CDP载药微球在pH=1.2的pbs中,药物刚开始释放迅速,继而变化平缓,整个过程呈持续缓慢释放的趋势,此时微球里面的药物缓慢而均匀向外扩散,12 h以后基本达到平衡,48 h后累积释药量达34.58%,说明缓释作用较好。而芦丁β-CDP载药微球在pbs(pH=7.4)中,24 h后累积释药量为24.67%,其释放在50 h后增加较快。
m(芦丁)∶m(微球)=0.05∶1时,37 ℃下载药微球分别于pbs(pH=7.4)和pbs(pH=1.2)中的体外缓释累积曲线见图5。
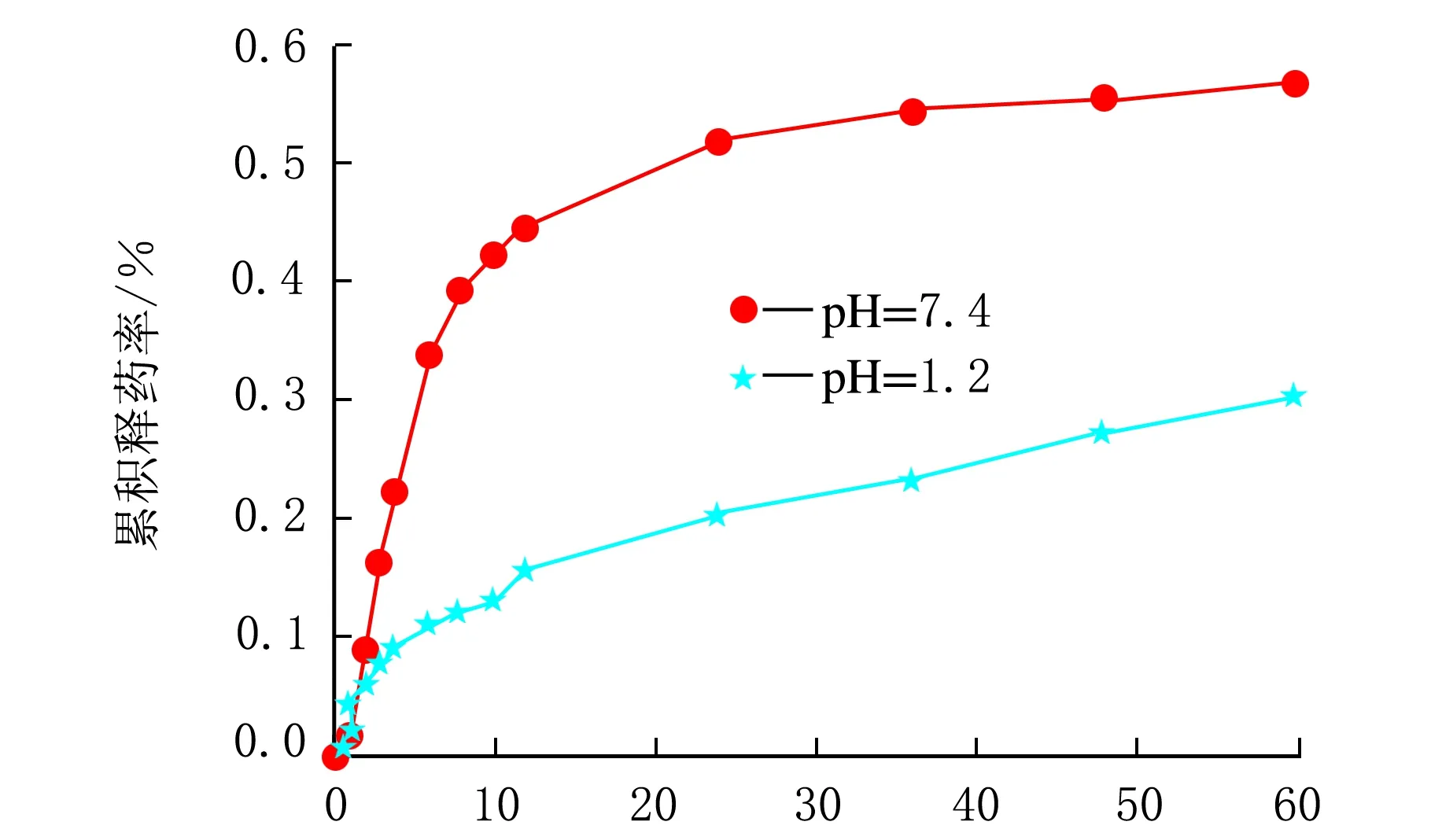
t/h图5 m(芦丁)∶m(微球)=0.05∶1的累积释药率
由图5可知,pH=7.4环境下,芦丁释放较快,24 h后累积释药量达51.76%,而pH=1.2中的芦丁β-CDP载药微球中,24 h后累积释药量仅为20.47%,释放较慢。
剧场的大门开了,人们头也不回地朝外走去,我相信在以后的日子里,即使碰见,他们也会装作不认识,即使别人问起,他们也不会对外多说半个字,这次演出将和他们的秘密一起被埋在心底的最深处,永远不再碰触,而他们的表演,也已被记录下来,将放映在那些专爱花大钱欣赏最真实的人性表演的富人面前。
2.3 释药动力性能
选择m(芦丁)∶m(微球)=0.02∶1、pH=1.2缓冲液,分别用零级(mt/m∞=kt),一级(mt/m∞=l-e-kt),Higuchi(mt/m∞=kt0.5),Korsmeyer-Peppas(mt/m∞=ktn)模型方程拟合。
零级动力学方程式中mt/m∞为药物在某一时刻溶剂中的累积释药百分率,k为零级释放常数,t为释药时间;
一级动力学方程式中mt/m∞为药物在某一时刻溶剂中的累积释放百分率,k为一级释放常数,t为释药时间;
Higuchi方程式中mt/m∞为药物在某一时刻溶剂中的累积释放百分率,Higuchi扩散常数为k,t为释药时间;
Korsmeyer-Peppas方程式中mt/m∞为药物在某一时刻的累积释放百分率,k为动力学常数,t为释药时间,n为释放参数。
所得回归方程见图6,a线为零级模型方程拟合,b线为一级模型方程拟合,c线为Higuchi模型方程拟合,d线为Korsmeyer-Peppas模型方程拟合。结果见表1[以m(芦丁)∶m(微球)=0.02∶1芦丁β-环糊精微球、pH=1.2缓冲液为例],其中一级模型方程拟合的R2=0.998 05;由此可以说明,芦丁β-CDP微球的一级动力学释放较好,其释放符合一级动力学释放。
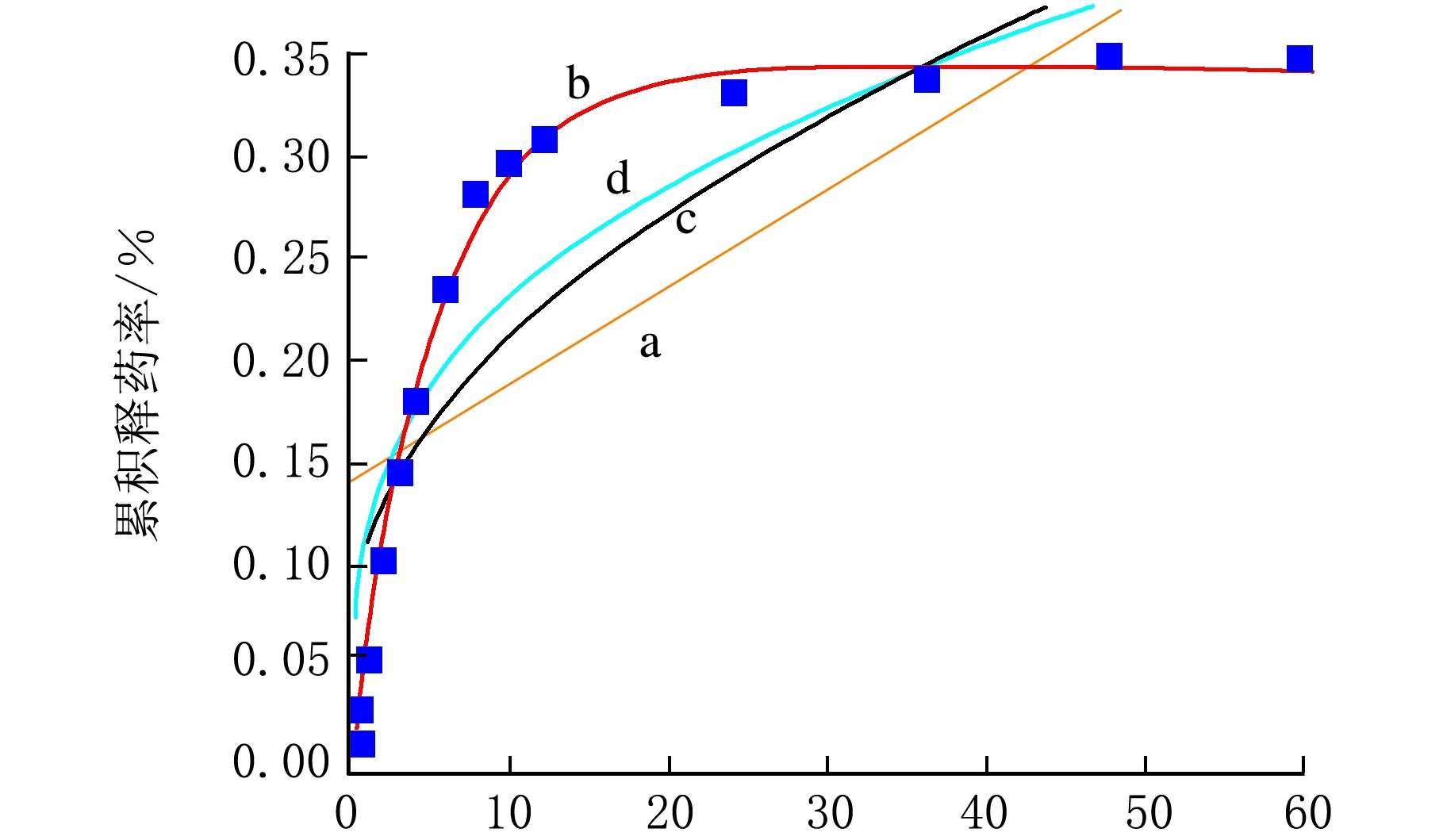
t/h图6 m(芦丁)∶m(微球)=0.02∶1时芦丁β-CDP微球速率方程拟合

模型回归方程R2零级y=0.14155+0.00474x0.50733一级y=0.34206×[1-e(-0.19051x)]0.99805Higuchiy=0.04631x0.5+0.065970.74329Korsmeyer⁃Peppasy=0.11322x0.30950.83377
2.4 傅立叶红外光谱
芦丁、β-CDP微球和芦丁β-CDP微球的红外光谱见图7。

σ/cm-1图7 芦丁、β-CDP微球和芦丁β-CDP微球的红外光谱
图7中 a、b、c分别为芦丁、β-CDP微球、芦丁β-CDP载药微球包载物的红外谱图。与b、c两线相比,c线在约3 400 cm-1的—OH吸收峰稍有增强,这是因为β-CDP微球载上芦丁后羟基增多所致;在约1 650 cm-1的吸收峰增强,是芦丁中不饱和酮在此出峰叠加所致;其它特征峰的位置没有发生太大的变化,也没有在1 600、1 200 cm-1处出现如a线所示的芦丁的特征峰,是因为两种单体发生了结合,但并没有产生新的基团。
2.5 微球粒径及电位分析
微球的粒径及电位见表2。

表2 微球的粒径及电位
由表2可知,空白微球的粒径较小,而载药后微球的粒径都相应的增加,这表明药物被包载进去,且载药量大的聚合物粒径更大,根据PdI的大小变化可知载药微球的分布不太均匀。
从Zeta电位的结果可见,载药微球Zeta电位值均大于空白微球,可见载药微球比空白微球稳定。
3 结 论
(1) 不同投料比的芦丁β-环糊精微球的载药率和包封率比较,m(芦丁)∶m(微球)=0.02∶1的芦丁β-CDP微球较为适宜,此时包封率为 88.41%,载药率为2.07%,缓释效果也较为理想;
(2) 芦丁β-环糊精载药微球缓释实验结果表明,m(芦丁)∶m(微球)=0.02∶1的载药微球在pH=1.2环境中体外释药更符合一级释药方程;
(3) 红外图谱表征说明芦丁已被β-CDP聚合物包合,芦丁与β-CDP聚合物并不是简单的物理混合。Zeta电位测试结果表明芦丁被包载进入聚合物后,分布不太均匀,但载药微球比空白微球稳定。
[1] 胡杰,邓宇.芦丁提取工艺的综述[J].中国食品添加剂,2006(5):94-99.
[2] KREFT I,FABJAN N,YASUMOTO K.Rutin content in buckwheat (FagopyrumesculentumMoench) food materials and products[J].Food Chemistry,2005,98:508-512.
[3] 韩英华,秦元璋.芦丁研究现状[J].山东中医杂志,2003,22(10):635-637.
[4] 李仲谨,杨威,刘艳,等.芦丁β-环糊精聚合物微球的制备与表征[J].粮油加工,2010(11):86-89.
[5] 常聪,陈露,梁英,等.β-环糊精的修饰方法及其在药物控制释放领域的应用[J].湖北中医药大学学报,2016,18(4):112-116.
[6] CRINI G.Review:a history of cyclodextrins[J].Chem Rev,2014,114(21):10940-10975.
[7] 杨黎燕,谢婷婷,邢壮壮,等.β-环糊精聚合物在药学领域的应用研究[J].化工科技,2016,24(1):78-82.
[8] GOU P F,ZHU W P,SHEN Z Q.Synthesis,self-assembly,and drug-loading capacity of well-defined cyclodextrin-centered drug-conjugated amphiphilic A14B7 miktoarm star copolymers based on poly(ε-caprolactone) and poly(ethylene glycol) [J].Biomacromolecules,2010,11:934-943.
[9] GOUREVICH D,DOGADKIN O,VOLOVICK A,et al.Ultrasound-mediated targeted drug delivery with a novel cyclodextrin-based drug carrier by mechanical and thermal mechanisms [J].Journal of Controlled Release,2013,170(3):316-324.
[10] CRINI G,MORCELLET M.Synthesis and applications of adsorbents containing cyclodextrins [J].Journal of Separation Science,2002,25(13):789-813.
[11] HU J,TAO Z,LI S,et al.The effect of cyclodextrins on polymer preparation[J].J Mater Sci,2005,40(23):6057-6061.
[12] 杨黎燕,杨欣雨,赵灵芝,等.响应曲面法优化茴香油β-环糊精的制备工艺研究[J].食品工业科技,2013,34(7):269-271.
[13] 杨黎燕,杨威,李仲谨,等.茶碱β-环糊精聚合物微球的制备与缓释性能的研究[J].中国实验方剂学杂志,2011,17(16):8-12.
