PFNA与股骨近端解剖锁定板治疗股骨转子间骨折围手术期失血量对比研究
2017-03-13石利涛周维娜刘彦博王金铸
石利涛 周维娜 刘彦博 王金铸
PFNA与股骨近端解剖锁定板治疗股骨转子间骨折围手术期失血量对比研究
石利涛 周维娜 刘彦博 王金铸
股骨转子间骨折是股骨颈基底部至股骨小转子水平以上部位的骨折,主要发生在老年人群,多数原因是骨质疏松和外伤。随着社会老龄化的加速,股骨转子间骨折病人逐年增多,保守治疗的死亡率可达20%[1],因此,股骨转子间骨折病人临床首选的治疗方案是手术治疗[2]。目前临床手术应用较多的内固定材料是股骨近端防旋髓内钉(proximal femoral nail anti-rotation, PFNA)和股骨近端解剖锁定板。PFNA具有微创、术中出血少等优点,但是临床应用过程中发现,术后病人常常出现严重的贫血,这与术中、术后所见失血量很不相符。隐性失血的概念由Sehat等[3]在2000年提出,但在手术治疗股骨转子间骨折中未引起足够重视。本文对接受股骨近端解剖锁定板和PFNA内固定治疗的老年股骨转子间骨折病人的临床资料进行了回顾性分析,旨在分析不同内固定方式治疗老年股骨转子间骨折病人围手术期失血特点,重视围手术期的隐性失血。
1 资料与方法
1.1 一般资料 收集承德医学院附属医院骨科2010年7月1日至2015年12月10日诊疗的179例股骨转子间骨折病人的临床资料,记录病人的性别、年龄、身高、体质量、骨折类型、受伤原因、术前及术后的血常规,包括红细胞计数、血红蛋白(hemoglobin, Hb)和红细胞压积(hematocrit, Hct)、麻醉方式、术中失血量、术后引流量、围手术期输血量、是否出现并发症(消化道出血等)。纳入标准:(1)年龄>50岁;(2)低能量损伤;(3)无血液系统疾病;(4)非多发性创伤;(5)无严重基础疾病;(6)术前及术后1、3、5 d内均有血常规检查。排除标准:(1)病理性骨折病人;(2)多发性骨折病人;(3)血液系统疾病病人;(4)凝血功能障碍病人;(5)消化道出血的病人以及严重的肝肾功能障碍的病人。179例病人中男77例,女102例;年龄50~95岁,平均(79.1±5.5)岁;致伤原因:摔伤145例,交通伤34例;受伤至手术时间5 h至10 d;骨折按AO分型,A1型42例,A2型76例,A3型61例。其中有140例病人符合纳入标准。根据内固定方式不同分为2组,钛板组70例,男28例,女42例;平均年龄(78.9±6.5)岁,身高(1.56±0.07)m,体质量(56.7±7.6)kg,骨折按AO分型:A1型15例,A2型31例,A3型24例,术前Hb为(107.9±13.2)g/L。PFNA组70例,男29例,女41例;平均年龄(79.7±5.4)岁,身高(1.57±0.06)m,体质量(57.2±5.2)kg,骨折按AO分型:A1型14例,A2型32例,A3型24例, 术前Hb为(108.2±12.5)g/L。2组病人的性别、年龄、身高、体质量、骨折类型、术前Hb比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 术中及术后处理 PFNA组术中均选择闭合复位,按照PFNA的标准操作流程,记录从切皮开始到切口缝合完毕的手术时间及术中失血量,术后一般不放置引流管,少数放置负压引流管,记录术后引流量,并在引流量<30 ml/d时予以拔除。钛板组按照标准的操作流程,记录从切皮开始到切口缝合完毕的手术时间及术中失血量,术后常规放置引流管,记录每日引流量,并在引流量<30 ml/d时予以拔除。2组病人术后24 h给予应用低分子肝素抗凝预防下肢深静脉血栓形成,术后第1天常规复查血常规,对Hb<80 g/L的病人给予输血,术后第3天,第5天复查血常规。术后第5天复查的血常规作为最终测量的Hb和Hct。
1.3 隐性失血量的计算方法 应用Gross方程[4]计算红细胞的容量,并进一步计算围手术期失血量及隐性失血量,术前病人血容量(patient blood volume, PBV)可以通过Nadler等[5]的方法计算,PBV=k1h3+k2w+k3,其中h为身高,单位为m; w为体质量,单位为kg; k为常数,男性k1=0.3669、k2=0.0322、k3=0.6041,女性k1=0.3561、k2=0.0331、k3=0.1833,总红细胞丢失量=术前PBV(Hct术前-Hct术后),理论失血总量=总红细胞丢失量/Hct术前。围手术期实际失血量=隐性失血量+显性失血量;显性失血量=术中出血量+术后引流量;术中失血量=术中引流量+纱布浸血量;术中引流量=引流瓶总量-术中冲洗液量;纱布浸血量=纱布净增重量;阶段性隐性失血量为不同时间段内的隐性失血量:术后第1天隐性失血量=术后第1天失血总量-显性失血量,术后第2~3天隐性失血量=术后第2~3天失血总量-显性失血量,术后第4~5天隐性失血量=术后第4~5天失血总量-显性失血量,股骨转子间骨折病人术前存在血液浓缩采用系数0.9进行校正,术前尽可能询问其身高和体质量,骨折病人由于卧床而无法测量,部分病人可根据身高计算体质量,≥60岁男性标准体质量(kg)=身高(cm)*0. 65-48.7,≥60 岁女性标准体质量(kg)=身高(cm)*0.56-33.4。
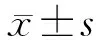
2 结果
钛板组手术时间为(70.6±11.2) min,PFNA组手术时间为(50.5±10.1) min,2组比较差异有统计学意义(P<0.05)。2组病人总失血量、显性失血量、隐性失血量,术后第1天隐性失血量、术后第2~3天隐性失血量比较,差异均有统计学意义(P<0.05);术后第4~5天隐性失血量比较,差异无统计学意义(P>0.05)。2组内部,隐性失血量与显性失血量比较,差异均有统计学意义(P<0.05)。对于阶段性隐性失血量,2组内术后3个时间段比较,术后第4~5天与术后第1天、术后2~3天比较,差异均有统计学意义(P<0.05)。见表1。
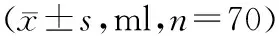
表1 2组病人失血量比较
注:与钛板组比较,*P<0.05;与同组术后第4~5天隐性失血量比较,△P<0.05;与同组显性失血量比较,#P<0.05
3 讨论
股骨转子间骨折病人多为老年病人,多数病人存在不同程度的心脑血管系统、呼吸系统、泌尿系统、内分泌系统疾病,机体代偿能力有限,对手术的耐受性差,外伤和手术都会造成不同程度的失血,而对围手术期失血的处理显著影响着病人的预后,随着外科手术技术的进步及骨科器械的改进,微创手术逐渐普及,术中显性失血量越来越少,隐性失血逐渐成为围手术期失血的主要原因。隐性失血常会导致病人处于不同程度的贫血状态,造成抵抗力降低,长时间卧床使病人易患呼吸、泌尿系统感染,褥疮,形成下肢深静脉血栓等,严重影响病人的预后。
本研究显示,2组病人隐性失血量明显多于显性失血量,PFNA组尤其如此,股骨转子间骨折病人在围手术期,隐性失血是病人失血的主要原因。在总失血量方面,PFNA组少于钛板组,但是PFNA组的隐性失血量明显多于钛板组,隐性失血在总失血量中所占比例非常高,约95%。可见,临床医生不能只通过术中出血量和术后引流量来判断病人失血总量,应该术后密切观察病人生命体征,及时复查血常规以了解病人实际状态,进而及时采取相应措施预防并发症的发生。
隐性失血的原因和机制目前尚不完全明确。原因主要考虑以下几方面:(1)外伤:股骨转子间骨折为干骺端骨折,为松质骨,骨折后骨折断面出血较多,骨折周围软组织丰富,组织间隙较大,骨折后大量血液流入组织间隙。(2)手术:骨折复位、扩髓、软组织剥离等都会造成出血,尤其是扩髓后髓腔持续出血是隐性失血的重要原因。(3)药物:股骨转子间骨折病人需要长期卧床,深静脉血栓形成的概率较高,深静脉血栓一旦形成将严重影响病人的预后,因此,股骨转子间骨折病人在术前、术后常规抗凝治疗,抗凝治疗影响正常的凝血机制,造成围手术期隐性失血增多。(4)基础疾病:股骨转子间骨折病人多为老年病人,存在不同程度的高血压、心脑血管疾病、糖尿病等,部分病人长期应用抗血小板聚集的药物造成隐性失血增加,部分病人术中血压仍旧较高,造成失血增加。隐性失血机制主要考虑两个方面,一是血液进入周围组织间隙。Erskine等[6]认为隐性失血的主要原因是由于围手术期血液大量进入组织间隙以及积留在关节腔内造成,许多病人术后可以观察到患肢肿胀及瘀斑形成[7]。McManus等[8]通过放射性同位素标记的红细胞,发现术后大量被标记的红细胞进入组织间隙,造成Hb水平下降。二是溶血。Pattison等[9]认为,术后隐性失血由溶血所致。
手术治疗是股骨转子间骨折临床首选治疗方案, 股骨近端解剖锁定板和PFNA是目前常用的髓外和髓内固定系统,手术方式是影响隐性失血的重要因素之一,Morritt等[10]研究了不同手术方式对股骨转子间骨折病人隐性失血量的影响,发现髓内钉固定术后隐性失血量最大。本实验中PFNA组术后隐性失血量多于钛板组,与上述研究结果一致。PFNA虽然手术切口小,手术时间短,术中失血少,但是更容易引起隐性失血和术后贫血[10-11],所以在选择最佳的治疗方案时,除了要考虑病人的一般状况、骨折类型、病人期望值外,还应该考虑不同的手术方式的失血量对病人预后的影响。
本研究结果还显示,术后隐性失血主要发生在术后3 d内,术后3 d内的隐性失血量占总的隐性失血量的80%以上,可见,术后3 d内应密切观察病人生命体征,及时复查血常规,及时纠正贫血,避免不必要的并发症的发生。
综上所述,隐性失血是股骨转子间骨折病人围手术期主要失血原因,不同手术方式病人术中、术后失血量不同,PFNA存在大量的隐性失血,应该引起临床医生的关注,股骨转子间骨折病人术后隐性失血主要发生在术后3 d内,所以术后3 d内要密切观察病人生命体征,及时复查血常规,及时纠正贫血,避免不必要的并发症发生。
[1] Xu Y,Geng D,Yang H, et al. Treatment of unstable proximal femoral fracture: comparison of the proximal femoral nail antirotation and gamma nail 3[J]. Orthopedics,2010,33(7):473.
[2] Cole PA,Bhandari M.What’s new in orthopaedic trauma[J]. J Bone Joint Surg Am,2004, 86-A(12):2782-2795.
[3] Sehat KR,Evans R,Newman JH. How much blood is really lost in total knee arthroplasty? Correct blood loss management should take hidden loss into account[J].Knee,2000,7(3):151-155.
[4] Gross JB.Estimating allowable blood loss:corrected for dilution[J].Anesthesiolongy,1983,58(3):277-280.
[5] Nadler SB,Hidalgo JH,Bloch T. Prediction of blood volume in normal human adults[J].Surgery,1962,51(2):224-232.
[6] Erskine JG,Fraser C,Simpson R,et al.Blood loss with knee joint replacement [J]. J R Coll Surg Edinb,1981,26(5):295-297.
[7] Sehat KR,Evans RL,Newman JH. Hidden blood loss following hip and knee arthroplasty.Corrent management of blood loss should take hidden loss into account [J].J Bone Joint Surg Br,2004,86(4):561-565.
[8] McManus KT, Velchik MG, Alavi A, et al. Non-invasive assessment of postoperative bleeding in TKA patients with Tc-99m RNCs [J].J Nuclear Med,1987,28(8):565-567.
[9] Pattison E, Protheroe K, Pringle RM, et al. Reduction in haemoglobin after knee joint surgery[J].Ann Rheum Dis,1973,32(6):582-584.
[10]Morritt DG,Morritt AN,Kelley SP,et al.Blood ordering protocol based on proposed surgical implant in fractured neck of femur patients [J].Ann R Coll Surg Engl,2005,87(6):445-448.
[11]Foss NB, Kehlet H. Hidden blood loss after surgery for hip fracture [J]. J Bone Joint Surg Br,2006,88(8):1053-1059.
067000河北省承德市, 承德医学院附属医院创伤骨一科(石利涛);风湿免疫科(周维娜); 脊柱外一科(王金铸);067000河北省承德市,承德市隆化县医院骨二科(刘彦博)
王金铸,Email:2712486278@qq.com
R 687.3
B
10.3969/j.issn.1003-9198.2017.03.021
2016-03-31)
