B细胞激活因子在慢性淋巴细胞白血病中的表达及临床意义
2017-03-13杨舒曹磊樊卫飞蒲骁麟王琳许菊青刘苏瑶王峻
杨舒 曹磊 樊卫飞 蒲骁麟 王琳 许菊青 刘苏瑶 王峻
B细胞激活因子在慢性淋巴细胞白血病中的表达及临床意义
杨舒 曹磊 樊卫飞 蒲骁麟 王琳 许菊青 刘苏瑶 王峻
目的 研究B细胞激活因子 (B cell activating factor,BAFF)在慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)病人中的表达以及与CLL预后指标的相关性,探讨其在CLL预后中的意义。 方法 采用实时定量逆转录聚合酶链反应(PCR)技术检测CLL 病人外周血单个核细胞及正常人外周血B细胞中BAFF基因 mRNA表达水平,运用循环阈值(cycle threshold,Ct)比较法进行相对定量分析。 结果 BAFF在101例CLL病人中的表达水平明显高于正常对照组(P<0.0001);Binet分期早期(A期)组BAFF mRNA表达水平明显高于Binet分期晚期(B/C期)组(P=0.048),ZAP-70表达阳性组BAFF mRNA表达水平明显高于ZAP-70表达阴性组(P=0.041)。中位随访时间为27.9月(1~72月),69例病人诊断后接受化疗,BAFF低表达组病人获得较短的无治疗生存时间(treatment-free survival,TFS),提示BAFF mRNA低表达是TFS的不良预后因素(P=0.017)。 结论 CLL病人存在BAFF基因的高表达,BAFF基因表达水平与Binet分期、ZAP-70阳性表达明显相关,对预后有一定影响。
慢性淋巴细胞白血病; B细胞激活因子; 预后
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是一种单克隆的B淋巴细胞增殖性疾病,以外周血、骨髓、淋巴结及其他淋巴组织中成熟的淋巴细胞计数升高为主要临床特征。病人在诊断时常常没有任何疾病症状[1],中位生存时间从数月至数十年不等[2],临床病程具有高度的异质性,至今CLL无法治愈。B细胞激活因子(B cell activating factor,BAFF)是1999年被发现的肿瘤坏死因子超家族(tumor necrosis factor superfamily,TNFSF)成员[3],主要作用是促进B淋巴细胞存活、分化增殖、抗原呈递以及免疫球蛋白(immunoglobulin,Ig)类别转换和重组[4-5]。BAFF基因缺乏可导致免疫功能低下,过量表达又可导致自身反应性B细胞的大量出现。国外报道显示BAFF在多发性骨髓瘤、B细胞淋巴瘤及CLL中均有异常表达,提示其在疾病的发生发展中起到一定的作用。
本研究从临床角度,采用实时定量逆转录PCR(quantitative reverse transcription-polymerase chain reaction,qRT-PCR)技术分别检测CLL病人及正常人外周血单个核细胞(peripheral blood mononuclear cells,PBMC)混合后CD19磁珠纯化形成的“pool”中BAFF基因的表达水平,并分析BAFF基因表达与年龄、性别、Binet分期、ZAP-70表达、CD38表达、IGHV突变,以及分子遗传学等指标的相关性,探讨其对CLL疾病预后的影响及临床意义。
1 材料与方法
1.1 研究对象 2007年1月至2012年10月江苏省老年医院及南京医科大学第一附属医院收治的101例CLL病人,其中男76例(67.3%),女25例(22.1%),中位年龄63岁(45~88岁)。中位随访时间27.9月(1~72月),全部病人均未接受过化疗或已结束化疗≥6月。临床分期根据Binet分期,其中A期33例(32.7%)、B期30例(29.7%)、C期38例(37.6%)。我们将Binet分期A期定义为Binet分期早期组,Binet分期B期和C期合称Binet分期晚期组。所有CLL病人外周血进行单个核细胞分离、RNA提取、cDNA合成。另将江苏省老年医院及南京医科大学第一附属医院体检中心年龄匹配(50~86岁,中位年龄61岁)、无CLL或其他肿瘤史的正常人外周血 60 份(2~3 ml/份),混合为一个“pool”,提取PBMC,并经CD19磁珠纯化为CD19+B细胞。
1.2 检测方法 采用qRT-PCR技术,SYBR Green 荧光染料法检测CLL 病人外周血单个核细胞及正常人外周血B细胞中BAFF mRNA表达水平,运用循环阈值(cycle threshold,Ct)比较法进行相对定量分析,上述基因的相对表达量以公式2(-△Ct)表示,该实验在美国ABI公司的7300型号定量PCR仪上进行,使用7300 SDSv 2.0 软件进行数据处理和分析,通过ROC曲线分析法确定BAFF mRNA表达高低2组的分界值;采用 PCR 联合 DNA序列测定免疫球蛋白重链可变区(immunoglobulin heavy-chain variable region,IGHV)突变状态(IGHV基因突变率>2%为有突变,≤2%为无突变);应用间期荧光原位杂交(fluorescence in situ hybridization,FISH)技术检测病人细胞遗传学异常del(17p13)、del(11q22.3);多参数流式细胞术检测 CLL 细胞 CD38 和 ZAP-70表达(CD38阳性和ZAP-70阳性的CLL病人预后差,其中ZAP≥20%定义为阳性,CD38≥30%定义为阳性);其他临床指标正常值范围:血清乳酸脱氢酶(lactate dehydrogenase,LDH):110~250 U/L,血清β2微球蛋白(β2-microglobulin,β2-MG):1~3 mg/L,血清胸苷激酶1(thymidine kinase 1,TK1):0~2 pmol/L。
1.3 统计学分析 采用SPSS 17.0软件及GraphPad Prism 5.0软件进行统计学分析,不同分组间基因表达水平的差异采用Mann-WhitneyU检验,Kaplan-Meier法计算无治疗生存时间(treatment-free survival,TFS),Log-rank法进行差异性检验,P<0.05为差异有统计学意义。TFS定义为病人从诊断至开始治疗或随访截止的时间。
2 结果
2.1 病人特征 101例CLL病人中≥60岁者62例(61.9%),<60岁者39例(38.1%)。Binet分期早期组33例(32.7%),晚期组68例(67.3%)。中位随访时间27.9月(1~72月),中位TFS为8.65月(1~72月),69例病人在随访期间具有治疗指征,接受针对CLL的治疗。
2.2 BAFF mRNA在CLL病人及正常对照间的差异表达 101例CLL病人全部表达基因BAFF mRNA,表达水平中位值为[0.044318(1.224941×10-4~0.406126)],明显高于正常人的“pool”经多次检测得到的BAFF表达中位值0.002648(0.001161~0.005758),差异有统计学意义 (P<0.0001),见图1。
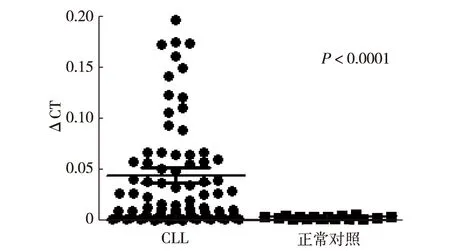
图1 qRT-PCR检测CLL病人和对照人群BAFF mRNA表达水平
2.3 BAFF mRNA与CLL其他预后因素的关系 Binet分期早期组BAFF mRNA表达水平明显高于Binet分期晚期组(P=0.048),ZAP-70表达阳性组BAFF mRNA表达水平明显高于ZAP-70表达阴性组(P=0.041)。而BAFF mRNA表达水平与病人性别、年龄、血清LDH水平、β2-MG水平、TK1水平、CD38表达、IGHV基因突变、del(17p13)、del(11q22.3)无明显相关性,见表1。
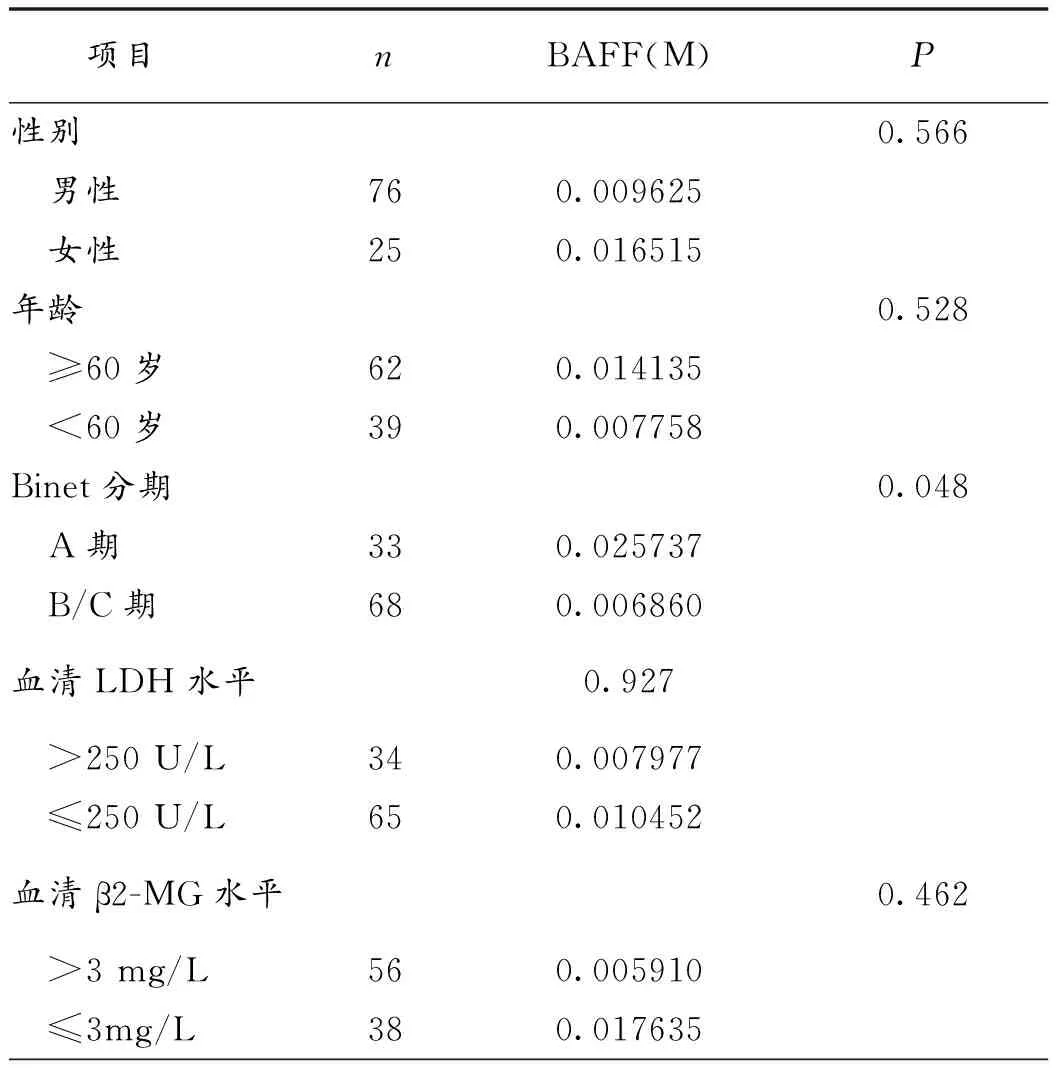
表1 不同组别中BAFF mRNA 表达的差异
续表:
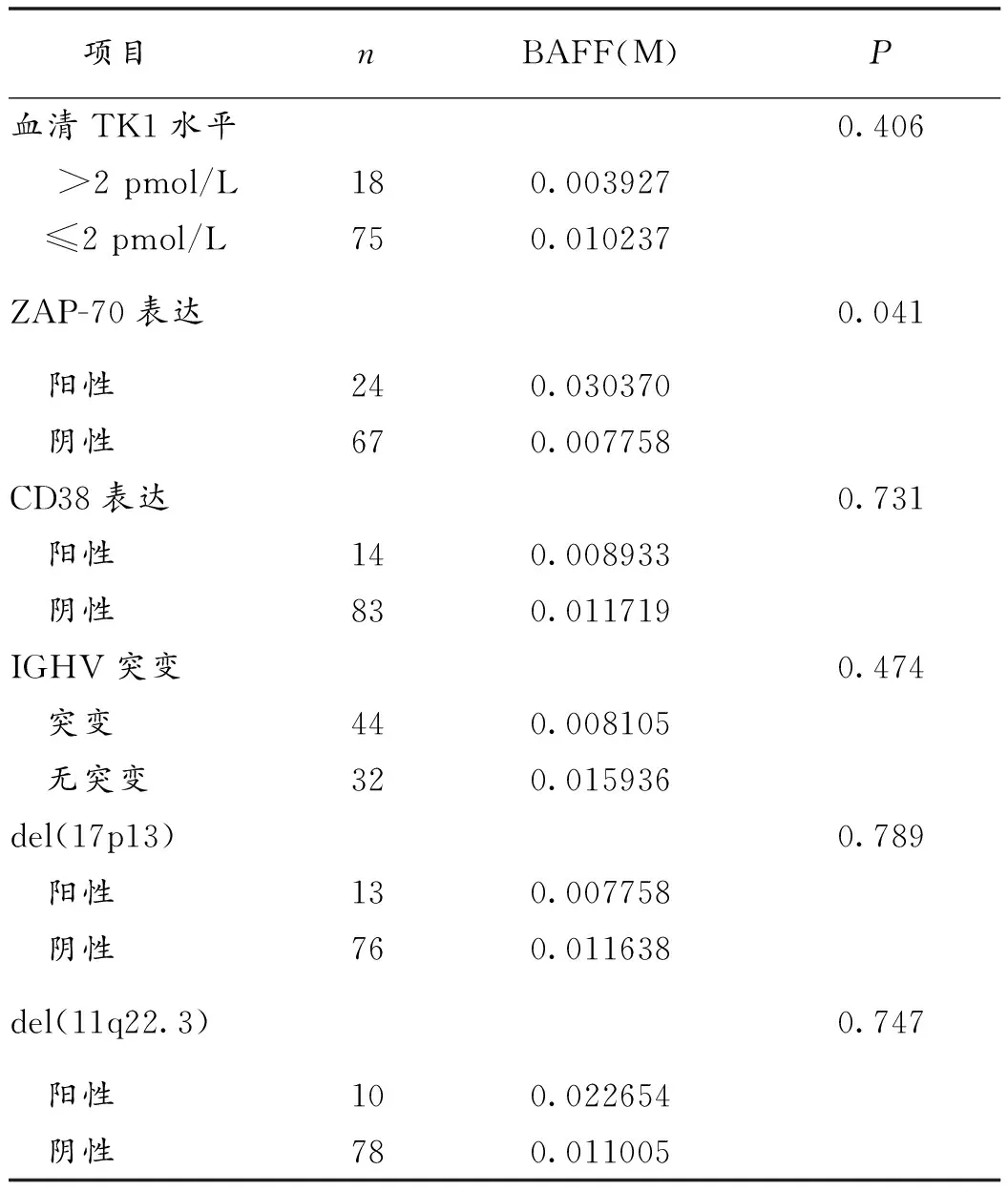
项目nBAFF(M)P血清TK1水平0.406 >2pmol/L180.003927 ≤2pmol/L750.010237ZAP-70表达0.041 阳性240.030370 阴性670.007758CD38表达0.731 阳性140.008933 阴性830.011719IGHV突变0.474 突变440.008105 无突变320.015936del(17p13)0.789 阳性130.007758 阴性760.011638del(11q22.3)0.747 阳性100.022654 阴性780.011005
2.4 BAFF mRNA表达水平对CLL病人TFS的影响 BAFF mRNA表达与Binet分期存在明显相关性,故ROC曲线分析以Binet分期早期和晚期为标准,将101例CLL病人分成2组,曲线下面积(area under curve,AUC)为0.630(95%CI为0.520~0.740,P=0.036),BAFF mRNA的最佳分界值为0.012847,灵敏度为65.6%,特异性为63.8%,见图2。中位随访时间为27.9月(1~72月),中位TFS为8.65月(1~72月),69例病人在随访期间具有治疗指征,接受针对CLL的治疗。单因素分析TFS与BAFF mRNA水平的关系,结果显示BAFF低表达是影响病人TFS的不良因素(P=0.017)(图3),低表达组与高表达组中位TFS分别为4月(95%CI:1.07~6.93月)和26月(95%CI:7.94~44.07月)。

图2 ROC曲线分析Binet分期确定BAFF mRNA表达高/低的最佳分界值
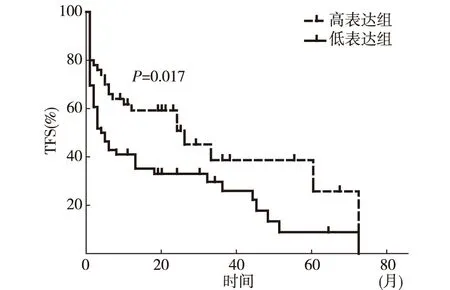
图3 BAFF mRNA表达的TFS曲线图
3 讨论
CLL是一组预后异质性较大的成熟B淋巴细胞增殖性疾病,侵入血液、骨髓和外周淋巴器官如淋巴结,免疫表型通常表现为CD5+CD23+CD19+CD20dim CD22/CD79dimsIgdimFMC7-。CLL是西方国家中最常见的成人白血病类型,中位发病年龄约72岁,男女比例约2∶1[2],病人在诊断时常常没有任何疾病症状[1]。CLL在亚洲及非洲地区较少见,中位发病年龄为65岁[6]。该疾病在发病形式、疾病进展、治疗反应和生存期方面具有明显的个体差异,对治疗的反应及预后与IGHV突变状态、ZAP70、CD38 以及遗传学特征相关。迄今为止,CLL的发病机制尚未研究清楚,不同的指标对病人预后的判断仍存在着差异,因此,寻求更好的预后指标仍是CLL疾病研究的热点。
CLL病人外周血肿瘤细胞处于G0/G1,表现出静止期细胞的基因表达谱[7],增殖活性低下,但却因肿瘤微环境的作用产生CLL细胞凋亡缺陷而大量聚集,形成CLL病人外周血高瘤负荷,并直接导致各类细胞周期特异性化疗药物及增殖期细胞毒药物对于CLL细胞的“束手无策”。CLL细胞微环境是一个由间充质细胞、基质细胞及其分泌的各种细胞因子交互作用构成的综合体,促进CLL细胞的存活,阻止其凋亡[8]。BAFF是CLL微环境中一个重要因子,由单核细胞、巨噬细胞、树突细胞、中性粒细胞、活化的T细胞、呵护样细胞(nurse-like cells,NLC)、骨髓间充质干细胞(bone marrow stromal cells,BMSC)、星形胶质细胞等分泌产生[9]。BAFF是一类Ⅱ型跨膜蛋白[10],在B细胞的生长发育、抗体类型的转换以及体液免疫方面具有重要的调节作用。而BAFF的过度表达有可能参与自身反应性B细胞的产生和自身免疫耐受的破坏,导致自身免疫性疾病或肿瘤。动物模型提示过表达BAFF的转基因小鼠成熟B细胞数量大大增加,同时伴有脾脏增大,浆细胞和自身抗体水平升高,以及Bcl-2的过度表达。BAFF基因敲除(BAFF-/-)小鼠表现为外周B细胞大量减少,B细胞发育在T1向T2转换阶段被阻断,滤泡区及边缘区B细胞的完全缺失,血清免疫球蛋白水平降低[11]。
既往研究认为BAFF主要由肿瘤微环境细胞如单核细胞、巨噬细胞、树突细胞等分泌产生,膜结合型BAFF经剪切释放成为可溶性BAFF片段,发挥主要生物学活性。Novak等[12]首次证实BAFF mRNA阳性表达的CLL细胞可检测出低水平的膜表面BAFF蛋白,而BAFF mRNA阴性的CLL细胞膜表面BAFF蛋白表达阴性,因此有理由推测CLL细胞具有自分泌BAFF功能。本试验采用qRT-PCR技术分别检测101例CLL病人及60名正常人PBMC中BAFF mRNA表达水平,结果显示CLL病人BAFF mRNA表达水平明显高于正常对照人群,差异有统计学意义;进一步统计发现CLL细胞BAFF mRNA高表达水平与Binet早期分期、ZAP-70阳性表达有明显相关性;生存分析显示,高表达BAFF mRNA的CLL病人较低表达者拥有较长的TFS,提示CLL细胞中BAFF mRNA高表达是预后良好的指标。由于CLL病人平均生存期较长,本次试验中位随访时间较短,随访观察期间病人死亡率极低,且101例病人未采用统一的化疗方案,因此未进行总生存时间(overall survival,OS)的统计分析。Kern等[13]通过Western blotting技术证实CLL细胞较正常B细胞存在较高的胞内BAFF蛋白水平,流式细胞术分析结果显示,CLL细胞膜表面BAFF表达同样高于正常B细胞。而Bojarska-Junak等[14]利用流式细胞术检测胞内BAFF含量得到了相似的结果。同时,Nishio等[15]证实CLL病人NLC膜表面BAFF表达量远远高于CLL细胞本身。结合本试验结果及既往文献报道,我们推测CLL细胞本身能够自分泌产生BAFF,但可能不是循环中BAFF的主要来源。虽然外源性BAFF的加入,可以使CLL细胞获得更长久的生存,规避自发性及药物性凋亡,但多数报道表明CLL病人血清中可溶性BAFF水平低于正常人。不久前Pontikoglou等[16]发现,作为BAFF来源的另一辅助细胞,CLL病人BMSC较正常供者BMSC分泌BAFF的能力明显减弱。这可能是造成CLL病人血清BAFF水平低于正常人的关键原因之一。因此,我们推测由于CLL微环境中相关辅助细胞的旁分泌功能异常,造成循环中BAFF水平的整体下调,进一步导致CLL细胞代偿性BAFF自分泌生成增多,激活下游的NF-κB等信号通路[17]。
综上所述,我们通过qRT-PCR方法,发现 CLL细胞中存在BAFF基因的高表达,其中BAFF表达与TFS显著相关。进一步的研究需要明确BAFF对肿瘤发生、发展的作用,为有效治疗CLL提供新的思路。
[1] Hallek M,Cheson BD, Catovsky D, et al. International Workshop on Chronic Lymphocytic Leukemia. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines[J]. Blood, 2008,111(12):5446-5456.
[2] Eichhorst B, Dreyling M, Robak T, et al. Chronic lymphocytic leukemia: ESMO Clinical Practice Guidelinesfor diagnosis, treatment and follow-up[J]. Ann Oncol, 2011,22 (Suppl 6):vi50-vi54.
[3] Shu HB, Hu WH, Johnson H. TALL-1 is a novel member of the TNF family that is down-regulated by mitogens[J]. J Leukoc Biol, 1999,65(5): 680-683.
[4] Assi LK, Wong SH, Ludwig A, et al. Tumor necrosis factor alpha activates release of B lymphocyte stimulator by neutrophils infiltrating the rheumatoid joint[J]. Arthritis Rheum, 2007,56(6):1776-1786.
[5] Xu LG, Wu M, Hu J, et al. Identification of downstream genes up-regulated by the tumor necrosis factor family member TALL-1[J]. J Leukoc Biol, 2002,72(2): 410-416.
[6] Steven H, Swerdlow, Elias Campo, et al. WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues[M]. 4th Edition,New York: WHO Publications Center, 2008:180.
[7] Dighiero G, Travade P, Chevret S, et al. B-cell chronic lymphocytic leukemia: present status and future directions. French Cooperative Group on CLL[J]. Blood, 1991,78(8):1901-1914.
[8] Burger JA, Ghia P, Rosenwald A, et al. The microenvironment in mature B-cell malignancies: a target for new treatment strategies[J]. Blood, 2009,114(16):3367-3375.
[9] Kalled SL. Impact of the BAFF/BR3 axis on B cell survival, germinal center maintenance and antibody production[J]. Semin Immunol, 2006,18(5):290-296.
[10]Kalled SL, Ambrose C, Hsu YM. The biochemistry and biology of BAFF, APRIL and their receptors[J]. Curr Dir Autoimmun, 2005,8(8):206-242.
[11]Schiemann B, Gommerman JL, Vora K, et al. An essential role for BAFF in the normal development of B cells through a BCMA-independent pathway[J]. Science, 2001,293(5537):2111-2114.
[12]Novak AJ, Bram RJ, Kay NE, et al. Aberrant expression of B-lymphocyte stimulator by B chronic lymphocytic leukemia cells: a mechanism for survival[J]. Blood, 2002,100(8):2973-2979.
[13]Kern C, Cornuel JF, Billard C, et al. Involvement of BAFF and APRIL in the resistance to apoptosis of B-CLL through an autocrine pathway[J]. Blood, 2004,103(2):679-688.
[14]Bojarska-Junak A, Hus I, Chocholska S, et al. BAFF and APRIL expression in B-cell chronic lymphocytic leukemia: correlation with biological and clinical features[J]. Leuk Res, 2009,33(10):1319-1327.
[15]Nishio M, Endo T, Tsukada N, et al. Nurselike cells express BAFF and APRIL, which can promote survival of chronic lymphocytic leukemia cells via a paracrine pathway distinct from that of SDF-1alpha[J]. Blood, 2005,106(3):1012-1020.
[16]Pontikoglou C, Kastrinaki MC, Klaus M, et al. Study of the quantitative, functional, cytogenetic, and immunoregulatory properties of bone marrow mesenchymal stem cells in patients with B-cell chronic lymphocytic leukemia[J]. Stem Cells Dev, 2013,22(9):1329-1341.
[17]Endo T, Nishio M, Enzler T, et al. BAFF and APRIL support chronic lymphocytic leukemia B-cell survival through activation of the canonical NF-kappaBpathway[J]. Blood, 2007,109(2):703-710.
Expression and significance of BAFF in chronic lymphocytic leukemia
YANGShu,FANWei-fei,PUXiao-lin,WANGLin,XUJu-qing,LIUSu-yao,WANGJun.
DepartmentofOncology,JiangsuProvinceGeriatricHospital,Nanjing210024,China;CAOLei.DepartmentofHematology,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
Objective To investigate the expression of B cell activating factor (BAFF) in chronic lymphocytic leukemia (CLL), and to explore the association with clinical and laboratory features and the prognosis. Methods The level of BAFF mRNA was quantified using qRT-PCR with SYBR Green by ABI 7300 in peripheral blood mononuclear cells (PBMC) from CLL patients and purified CD19+B cells from healthy donors. The relative expression level of mRNA was analyzed by cycle threshold method. Results The expression level of BAFF was higher in 101 CLL patients than that in healthy donors (P<0.0001). BAFF expression was significantly higher in early Binet stage than that in advanced stage (P=0.048), also higher in ZAP-70 positive patients than that in ZAP-70 negative patients (P=0.041). Sixty- nine patients received therapy after initial diagnosis, with a median follow-up of 27.9 months (range, 1-72 months). Survival analysis showed that the patients with low BAFF expression had shorter TFS time than those with high BAFF expression(P=0.017). Conclusions The expression level of BAFF gene increases in CLL patients. BAFF expression is correlated with Binetstage and ZAP-70 expression, indicating a significant prognosis in CLL.
chronic lymphocytic leukemia; B cell activating factor; prognosis
210024江苏省南京市,江苏省老年医院肿瘤科(杨舒,樊卫飞,蒲骁麟,王琳,许菊青,刘苏瑶,王峻);210029江苏省南京市,南京医科大学第一附属医院血液科(曹磊)
王峻,Email:madam_wangjun@163.com
R 733.7
A
10.3969/j.issn.1003-9198.2017.03.011
2016-03-22)
