表面复合修饰纳米超顺磁性材料固定化α-淀粉酶性能研究
2017-03-08孙宁,胡飞
孙 宁,胡 飞
(华南理工大学食品科学与工程学院,广东广州 510640)
表面复合修饰纳米超顺磁性材料固定化α-淀粉酶性能研究
孙 宁,胡 飞*
(华南理工大学食品科学与工程学院,广东广州 510640)
以复合修饰的纳米超顺磁性Fe3O4颗粒聚集体为载体固定化α-淀粉酶,比较分析固定化α-淀粉酶及游离α-淀粉酶的酶学性能。研究固定化及游离α-淀粉酶的最适温度、最适pH、操作稳定性及基本动力学等。结果表明,固定化α-淀粉酶最适pH为7,最适温度为60 ℃。固定化α-淀粉酶与游离α-淀粉酶相比,具有更好的温度和酸碱的耐受性。固定化α-淀粉酶重复催化反应10次,相对酶活力仍剩余72.09%,重复操作的半衰期为18.97次,具有良好的操作稳定性。固定化α-淀粉酶的米氏常数Km值为45.31 mg/mL,亲和性弱于游离α-淀粉酶。
α-淀粉酶,超顺磁性,固定化,酶学性能
固定化酶因可回收利用,方便分离,且比游离酶具有更广泛的环境适应性等优势,故在工业生产中具有广泛应用[1]。固定化酶的性能取决于固定化酶所使用的载体材料的性质和固定化方法。近几十年,各种有关固定化酶技术和载体材料的研究都取得了重大发展,固定化酶的载体材料包括高分子材料[2]、无机材料[3]以及复合材料[4]等。磁性纳米载体作为一种新型的复合材料,可以在外加磁场的作用下方便快捷的实现酶的分离回收,因此引起了人们的极大关注。此类载体的核心由磁性纳米颗粒组成,外面包被有一层有机或无机分子的壳,同时通过表面修饰的方法可以在载体表面引入多种反应性功能基团(如羟基、氨基、巯基等),从而连接酶,实现酶的固定化[5]。
α-淀粉酶(α-1,4-D-葡萄糖-葡萄糖苷水解酶,E.C.3.2.1.1),普遍分布在动物、植物和微生物中[6]。它以随机作用方式切断淀粉、糖原、寡聚或多聚糖分子内的α-1,4葡萄糖苷键,产生麦芽糖、低聚糖和葡萄糖等[7],是工业生产中应用最为广泛的酶制剂之一[8-9]。
低共熔试剂是由两种或多种成分按一定化学计量比混合,通过氢键能够自组装形成的一类常温下为液态的低共熔混合物,因其无毒、低成本、原子利用率高,所以,被认为是一种新型的绿色溶剂[9]。利用符合绿色化学理念的低共熔试剂和二氧化硅对Fe3O4纳米颗粒进行复合修饰,Fe3O4颗粒聚集体形成核-壳稳定性结构,同时又具有表面活性基团,能有效与酶结合[10]。
本文以复合修饰的纳米超顺磁性Fe3O4颗粒聚集体为载体,制备出具有磁响应性的固定化α-淀粉酶,比较分析固定化α-淀粉酶及游离α-淀粉酶的酶学性能,为α-淀粉酶的工业化应用提供借鉴。
1 材料与方法
1.1 材料与仪器
硝酸铁、硫酸亚铁、氨水(NH3·H2O,v/v,25%~28%)、无水乙醇、甲醇、尿素、乙二醇、甘油、正硅酸乙酯(TEOS)、柠檬酸、十二水合磷酸氢二钠 广东光华科技股份有限公司;氯化胆碱、戊二醛(v/v,25%)、可溶性淀粉 天津科密欧化学试剂有限公司;碘、碘化钾 由上海银碘化工有限公司,均为分析纯;α-淀粉酶 上海阿拉丁有限公司。
pHS-25型酸度计 上海虹益仪器仪表有限公司;JJ-2增力电动搅拌器 江苏省金坛市医疗器械厂;752N紫外可见分光光度计 广州市化兴科学仪器有限公司;BAS124S分析天平 赛多利斯科学仪器(德国)有限公司;PTFE水热合成反应釜 上海耀冠仪器有限公司;DHG-9030A电热恒温鼓风干燥箱 巩义市予华仪器有限责任公司;kQ-250DE超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 SiO2包覆Fe3O4超顺磁性纳米颗粒(Fe3O4@ SiO2) 采用水热法制备[11]Fe3O4超顺磁性纳米颗粒,再用溶胶凝胶法[12]将SiO2包覆Fe3O4超顺磁性纳米颗粒即得。
1.2.2 低共熔试剂对SiO2包覆Fe3O4超顺磁性纳米颗粒表面修饰(Fe3O4@SiO2-DES) 按表1称取氯化胆碱和氢供体试剂,在100 ℃水浴下加热,不断搅拌,至溶剂澄清透明为止(约20 min),即得低共熔点试剂DES1、DES2、DES3。
取1 mL DES和3 mL甲醇混合均匀,将0.1 g SiO2包覆Fe3O4超顺磁性纳米颗粒(Fe3O4@ SiO2)加入到上述DES混合液中,超声波10 min后,搅拌2 h,磁铁吸引分离,用水、无水乙醇交替洗涤至中性,45 ℃烘箱中烘干[13]。

表1 低共熔试剂原料配比Table 1 List of raw materials ratio for deep eutectic solvents
注:DES1、DES2和DES3为制备的3种低共熔试剂缩写。
1.2.3 复合修饰颗粒交联法固定化α-淀粉酶 采用戊二醛交联法固定化α-淀粉酶,称取10 mg复合修饰的磁性纳米颗粒,洗涤,用磁铁分离,将洗涤后的颗粒分散在2 mL 5%的戊二醛溶液中超声波处理10 min,室温下振荡交联反应1 h,弃去上清液,用磷酸缓冲液洗涤至无游离戊二醛,加入4 mL浓度为146.2 μg/mL酶液,室温下搅拌固定化3 h,磁铁吸引分离,取上清液检测酶活力,用10~20 mL磷酸缓冲液洗涤至无酶洗出。
1.2.4 酶活力及固载量测定 淀粉酶活力测定方法参照GB/T24401-2009[14]的方法。相对酶活力(%)指在同组实验中以固定化酶的活力最高值为100%,其它值与最高值的活力之比。
10 mg的复合修饰载体颗粒在不同酶浓度(2.92、5.85、29.24、54.48、146.2、584.8 μg/mL)下固定,通过初始酶浓度(C初始酶)与固定化后的酶浓度(C初始酶)的测定,得复合修饰颗粒固载量。在酶浓度为146.2 μg/mL固定化酶,测固定化酶相对酶活力。其中,酶浓度参照考马斯亮蓝法测定[15],可以用下面公式进行计算:
固载量(μg/10 mg载体)=(C初始酶-C剩余酶)×V
其中,式中V为酶液体积。
1.2.5 复合修饰颗粒聚集体固定化α-淀粉酶的酶学特性 酶学特性均以固载能力较佳的复合修饰颗粒为载体固定化α-淀粉酶为研究对象。
1.2.5.1 最适pH和pH稳定性 10 mg载体固定化α-淀粉酶在pH4、5、6、7、8、9磷酸缓冲液下,以1 mg/mL淀粉液为底物,温度60 ℃的条件下,测定酶活力,考察最适pH。固定化酶在以上不同pH缓冲液中的30 ℃水浴条件下保温2 h后降温至室温,测定酶活力,考察酶在不同pH下的稳定性。同时使用游离α-淀粉酶作为对比。
1.2.5.2 最适温度和温度稳定性 10 mg载体固定化α-淀粉酶分别在温度50、55、60、65、70 ℃,1 mg/mL淀粉液为底物,pH为6的条件下,测定酶活力,考察最适作用温度。固定化酶在pH6.0缓冲液的30、45、60、75、90 ℃水浴中保温2 h后,降温至室温,测定酶活力,考察酶在不同温度下的稳定性。同时使用游离α-淀粉酶作为对比。
1.2.5.3 固定化α-淀粉酶催化水解的基本动力学 以可溶性淀粉溶液为底物,分别配制浓度为0.2、0.25、0.5、1、2、4、5、6、8、10 mg/mL的底物溶液,测定底物浓度变化,计算酶解速率,分析酶催化反应动力学变化趋势与规律,同时作Lineweaver-Burk双倒数图,获取游离酶和固定化酶的特征Km参数。
1.2.5.4固定化α-淀粉酶的操作稳定性 在连续测定条件下,固定化酶的活性下降为最初活性的一半时所经历的次数称为固定化酶的操作半衰期[16]。
固定化α-淀粉酶在60 ℃下,pH6.0磷酸缓冲液,1 mg/mL淀粉液催化反应5 min,反应结束后,磁性分离,测定酶活力。磁性分离后的固定化酶再用于重复相同条件下的催化反应,依次类推,共催化10个批次,分别测定每次结束后酶活力。以首次酶活力为100%,计算每次反应结束后酶活力的相对百分比,评价固定化酶的重复使用性。
酶在使用过程中,有热失活和自水解失活现象,两种失活状况可用以下的公式表示:
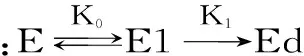
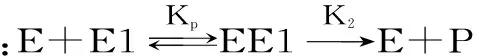
式(1)
α=e-kdt
式(2)
其中,残余酶活α,原酶E,部分失活的酶E1,无活性的酶Ed,产物P,k1和k2分别是热失活和自水解速率常数,CE0为酶的初始浓度,kd和kb分别是热失活和自水解的表观速率常数。
在较低的酶浓度下,自水解对酶失活的影响可以忽略,式(1)可简化为式(2)。以残余酶活的负对数与重复使用次数作图,图中直线的斜率即为操作条件下酶失活速率常数。
1.3 数据处理
每个样品设三个平行,采用Origin 8.5软件进行数据分析,测定结果以平均值±标准差表示。
2 结果与分析
2.1 复合修饰颗粒固定化α-淀粉酶比较分析
由图1可知,三种复合修饰颗粒在不同酶浓度下固载的酶量,随酶蛋白浓度的增加,固载量均先快速增加,在146.2 μg/mL处后趋于平稳,增加速率缓慢,在酶蛋白浓度为584.8 μg/mL时,DES1、DES2和DES3三种复合修饰颗粒固载酶量分别为145.2、79.78、183.2 μg/10 mg。DES1,DES2和DES3在146.2 μg/mL酶蛋白浓度处固定化淀粉酶的相对酶活力分别74.89%、38.19%、100%,可以看出DES3表面修饰的复合颗粒具有更大固载酶量和相对酶活力。所以,以此类低共熔试剂对纳米超顺磁性Fe3O4颗粒进行表面化学修饰,可使表面引入充分的-NH2、-OH等功能性基团,既能发挥其极性和低挥发性,又能提高载体与酶结合效率。

图1 三种DES修饰的固载酶量及相对酶活力Fig.1 Adsorption capacity and relativeactivity of immobilized amylase注:a.10 mg载体固载酶量;b.146.2 μg/mL酶浓度固定化酶相对酶活力。
2.2 最适pH和pH稳定性
由图2可知,游离酶和固定化酶分别在pH6、7时相对酶活力最大,即游离酶和固定化酶的最适pH分别为6和7。两种酶在pH低于5或高于8环境下活力均急剧下降,在pH5~8范围内变化较平缓,固定化酶在此范围内相对活力基本保持不变,维持在97.5%以上,低于游离酶活力下降幅度,说明游离酶比固定化酶对pH更为敏感,适用范围较窄,即偏离最适pH,酶活力下降较大。
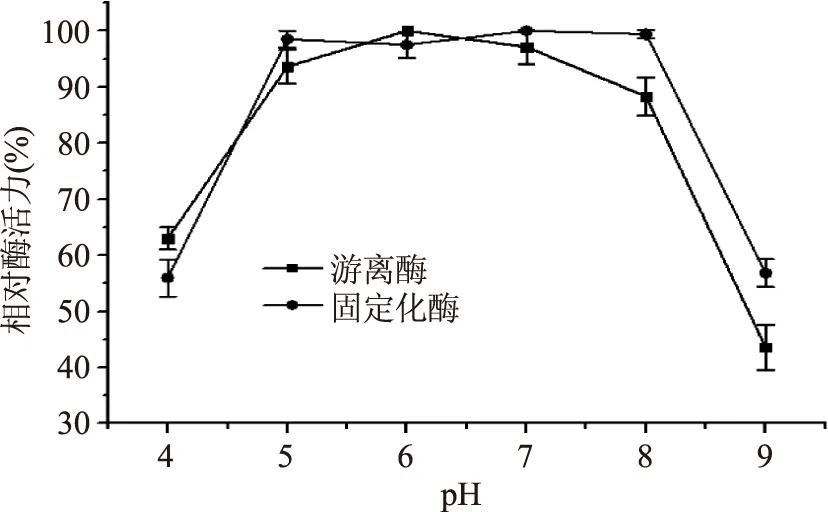
图2 pH对游离酶和固定化酶活力的影响Fig.2 Effect of pH on relative activity of free and immobilized enzyme
由图3可知,固定化酶在pH4保温2 h后,酶活力下降明显低于游离酶,在pH9处的活力下降也较游离酶略低,说明固定化酶有较强的酸碱耐受性。结合图2~图3,固定化酶具有更宽的pH适用性和较强的酸碱耐受性。这是因为复合修饰的颗粒载体固定化酶,使酶的结构改变,部分反应活性中心和酸碱敏感性中心被掩藏而对酸碱较为迟钝,进而保持较大的活性。
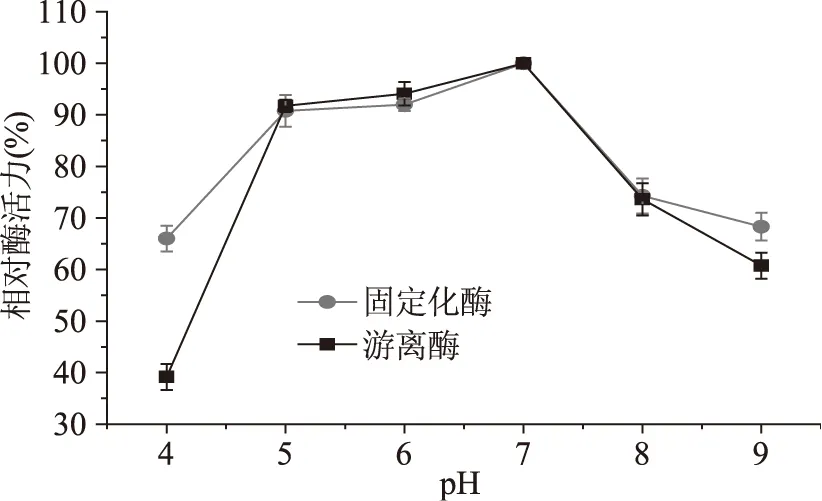
图3 游离酶和固定化酶活力的pH稳定性Fig.3 The pH stability of free and immobilized enzyme
2.3 最适温度和温度稳定性
由图4可知,游离酶与固定化酶在温度60 ℃时相对酶活力最大,偏离此温度都有显著的下降,表明游离酶与固定化酶的最适温度均为60 ℃。在50~60 ℃范围内,固定化酶相对酶活力变化较平缓,可保持86.2%以上,远高于游离酶的58.0%。在60~70 ℃范围内,固定化酶下降幅度仍小于相应的游离酶。
由图5可知,在30~90 ℃各温度下保温处理后,固定化酶的相对酶活均高于游离酶,固定化酶随温度升高酶活力下降较游离酶缓慢,且均保持在47.8%以上,游离酶的相对酶活力下降较大。

表2 固定化酶和游离酶的V-[S]及Lineweaver-Burk曲线方程Table 2 Equations of V-[S]and Lineweaver-Burk curves
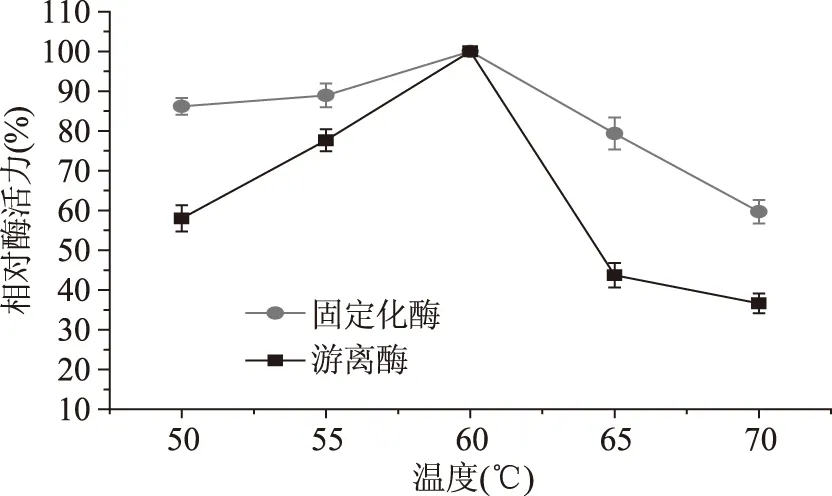
图4 温度对游离酶和固定化酶活力的影响Fig.4 Effect of temperature on relative activity of free and immobilized enzyme
说明酶经固定化后对温度的耐受性增加,热稳定性提高,这是由于固定化可以提高酶分子的刚性,从而提高其耐热性。Chen等[17]也得到了类似的结果。
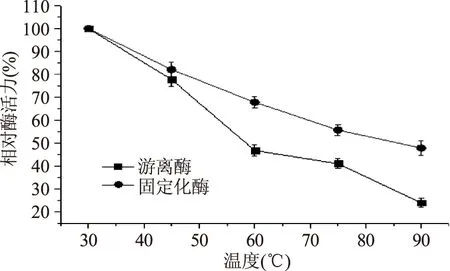
图5 游离酶和固定化酶活力的温度稳定性Fig.5 The temperature stability of free and immobilized enzyme
2.4 固定化α-淀粉酶的基本动力学
图6和表2两种固定化酶和游离酶的V-[S]图可知,固定化酶与游离酶的酶解速度均随淀粉浓度的增加而增加。游离酶的酶解速度与底物浓度高度线性相关,而固定化酶则体现出不同的变化规律。在底物浓度0~5 mg/mL范围内,变化趋势拟合为二次函数模型。在5~10 mg/mL范围内,与底物浓度线性相关,为一次函数关系,且固定化酶酶解速度均较游离酶大,表明在较高的底物浓度时固定化酶具有更好的催化速度。
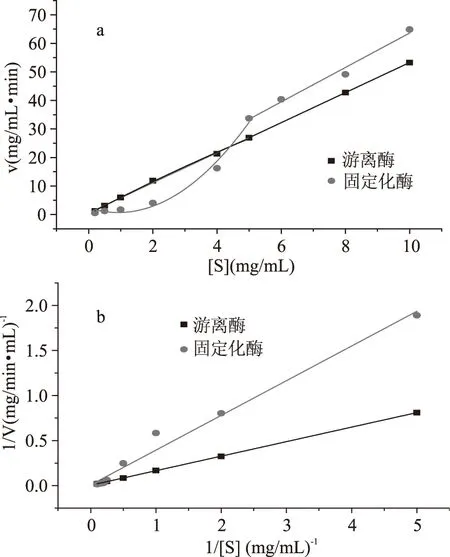
图6 固定化酶和游离酶的V-[S](a)及Lineweaver-Burk(b)曲线Fig.6 The V-[S](a)and Lineweaver-Burk(b)curves of free and immobilized enzyme
利用双倒数作图法以1/V对1/[S]绘制Lineweaver-Burk曲线,结果如图6和表2,Km曲线所示。通过公式:1/V=(Km/Vmax)(1/[S])+1/Vmax可获取特征参数Km。游离酶和固定化酶的Km值分别为38.38、45.31 mg/mL。固定化酶Km值增大说明固定化酶的亲和力降低,酶固定化后较普遍存在的现象[18]。这是由于固定化后,酶分子不能自由运动,载体的存在增大了酶周围的空间位阻,酶与载体结合使酶空间结构发生改变所致。
2.5 固定化酶的操作稳定性
由图7可知,重复催化反应10次,固定化酶活力下降较平稳,操作4次后可维持90%以上的相对酶活力,10次后仍有72.09%的相对酶活力。根据拟合方程计算,酶失活速率常数为0.039,操作半衰期为18.97次,误差在2.1%内。因此,经复合修饰后交联法固定化酶,酶与载体的结合效果较好,酶不易从载体上脱落导致酶活降低,复合修饰的纳米超顺磁性Fe3O4颗粒为载体固定化α-淀粉酶重复使用较稳定。
3 结论
以复合修饰的纳米超顺磁性Fe3O4颗粒为载体固定化α-淀粉酶,DES3修饰的载体具有较强的固载酶能力。通过对酶的温度、pH、操作稳定性及动力学性质的研究,结果表明,固定化α-淀粉酶最适pH为7,最适温度为60 ℃;固定化α-淀粉酶与游离酶相较,具有更强的温度和酸碱的耐受性。
固定化α-淀粉酶的催化水解速度在较低的底物浓度下可通过指数函数回归方程表征相互间变化规律,在5~10 mg/mL底物浓度下,符合一次函数关系,具有更大的酶解速度。固定化酶Km值为45.31 mg/mL,亲和性比游离酶弱,经重复催化反应10次,酶活力仍剩余72.09%,重复操作的半衰期为18.97次,具有良好的操作稳定性。
[1]朱启忠,丁姝婷,李玉婷. 不同载体对淀粉酶固定化的比
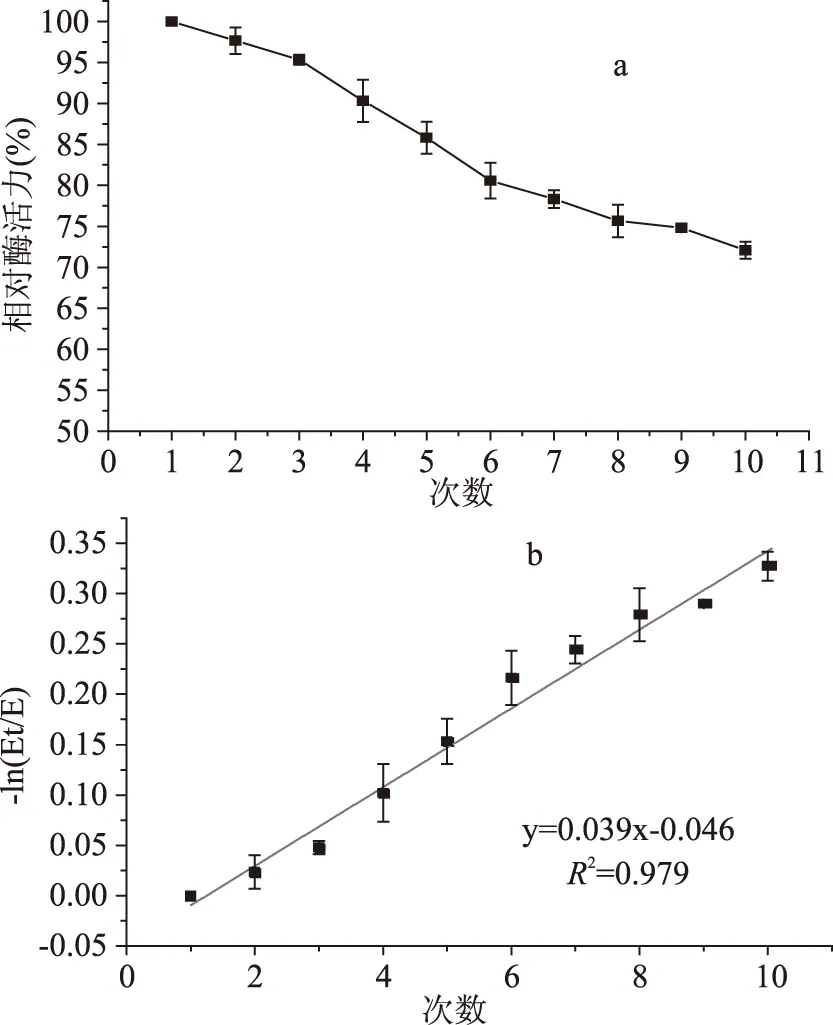
图7 固定化酶的循环操作稳定性Fig.7 The recycle stability of immobilized enzyme注:a:连续操作10循环固定化酶的相对酶活力变化曲线;b:-ln(Et/E)与循环次数曲线。
较研究[J]. 资源开发与市场,2012(3):196-198.
[2]吴汉福,杜海良,龚晓莹,等. 用于酶固定化的高分子载体材料研究进展[J]. 云南化工,2008,35(3):46-48.
[3]闵丹丹,何文,杜晓永,等. 酶固定化无机载体材料的研究进展[J]. 山东陶瓷,2011,34(5):11-16.
[4]田程程. 新型多功能纳米复合材料的合成及其催化性能研究[D]. 广州:华东理工大学,2014.
[5]刘健. 多功能磁性纳米复合材料的合成、表征及其在生物检测和催化反应中的应用[D]. 兰州:兰州大学,2014.
[8]魏述众.生物化学[M].北京:中国轻工业出版社,2007:224-226.
[9]Abbott A P,Capper G. Novel solvent properties of choline chloride/urea mixtures[J]. Chem Commun,2003:70-71.
[10]Arruebo M,Galrn M,Navascus N,et al.Development of magnetic.nanostructured silica-based materials as potential vectors for drug delivery applications[J].Chem Mater,2006,18(7):191-199.
[11]王永亮,李保强,周玉. 超顺磁性Fe3O4纳米颗粒的合成及应用[J]. 材料科学与工艺,2009(3):402-405,409.
[12]刘婧婧. 单孔中空SiO2及Fe3O4@SiO2微球的制备研究[D].广州:华南理工大学,2014.
[13]孙宁,胡飞.超顺磁性颗粒表面复合修饰及用于固定化α-淀粉酶载体的效果[J]. 农业工程学报,2016,32(11):290-294.
[14]孙静,耿慧莉,莫德馨.中温α-淀粉酶活性的定量测定[J]. 教学仪器与实验,2009(11):44-45.
[15]李娟,张耀庭,曾伟,等. 应用考马斯亮蓝法测定总蛋白含量[J]. 中国生物制品学杂志,2000(2):118-120.
[16]张树政. 酶制剂工业(上)[M]. 北京:科学出版社,1984:375-377.
[17]Chen Y H,Chi M C,Wang T F,et al. Preparation of Magnetic Nanoparticles and Their Use for Immobilization of C-Terminally Lysine-TaggedBacillussp. TS-23α-Amylase[J]. Applied Biochemistry & Biotechnology,2012,166(7):1711-1722.
[18]Netto C G C M,Toma H E,Andrade L H. Superparamagnetic nanoparticles as versatile carriers and supporting materials for enzymes[J]. Journal of Molecular Catalysis B Enzymatic,2013,s85-86(1):71-92.
Magnetic nanoparticles composite-modified by deep eutectic solvents and silica for immobilization ofα-amylase
SUN Ning,HU Fei*
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
The composite-modified nano-superparamagnetic Fe3O4particle aggregates as the carrier,α-amylase was immobilized by method of covalent linkage. The application performance of immobilizedα-amylase and freeα-amylase were studied. The temperature,pH value,the operation stability and the basic kinetics of them were compared,respectively. The results showed that optimal pH value and temperature of immobilizedα-amylase were 7 and 60 ℃,general similar with that of freeα-amylase. Compared with the freeα-amylase,immobilizedα-amylase had better resistance of acid,alkali and temperature. After 10 recycles,relative activity of immobilized enzyme was still remaining 72.09%,half-life period deduced 18.97 times. Immobilizedα-amylase had better operation stability. Kmof immobilizedα-amylase was 45.31 mg/mL,and the affinity was weaker than freeα-amylase.
α-amylase;superparamagnetic;immobilization;enzymatic property
2016-06-17
孙宁(1989-),女,硕士,主要从事谷物科学与工程方面的研究,E-mail:1214031666@qq.com。
*通讯作者:胡飞(1972-),男,博士,副教授,主要从事谷物科学与工程方面的研究,E-mail:g95216@163.com。
国家自然科学基金资助项目(31271824)。
TS201.3
A
1002-0306(2017)02-0231-05
10.13386/j.issn1002-0306.2017.02.036
