HZSM-5催化酯化反应的实验教学改进研究
2017-03-08李福颖张丽华王仁章
李福颖,牛 玉,张丽华,王仁章
随着人们对环境保护理念的深入理解,高能耗、高污染的生产方式逐步被禁止。多相催化技术[1,2]正被越来越多地使用在不同种类的化学品生产过程中,这种新工艺过程可以有效解决产物分离,减少有毒废物排放和副产物生成,降低环境污染风险。目前,使用固体酸代替传统液体酸的催化合成工艺受到广泛关注[3,4],大量研究发现,固体酸在克服液体酸不足的同时仍保持较高催化活性。虽然固体酸催化剂制备及其应用在科学研究方面方兴未艾,但在有机化学实验教学中的研究和应用较少。本世纪初,教育界尤其是化学学科领域工作者,纷纷提出绿色化学、无害化学、清洁化学等理念[5],并提出要将绿色化学的理念植入实验教学当中。有机化学实验是化学、化工、环境、生物等专业的必修基础实验课之一,因此,改进实验所用催化剂,对于树立学生环保、减排意识,减少实验室环境污染物排放,降低污染物治理成本具有积极的现实意义。
羧酸与醇在少量酸性催化剂(如浓硫酸)存在下,加热,脱水生成酯的反应叫酯化反应。酯化反应常用浓硫酸、磷酸等质子酸催化剂,是基础有机化学实验中较为重要的内容之一[6-8]。随着酯类化合物在食品工业、纺织工业、树脂、涂料及合成橡胶等领域总需求量的不断上升,改进酯化反应的合成方法势在必行。传统的实验以浓硫酸为催化剂,往往由于浓硫酸的强氧化性和腐蚀性使得反应物碳化,存在副反应多、反应物与生成物分离难、反应产率低等诸多问题[9]。虽然近几年有一些关于酯化反应合成实验的探讨,例如使用NaHSO4、FeCl3、SnCl2等作催化剂的报道,但由于以上均相催化剂易溶于反应物或水,增加了反应后的处理难度[10-12]。为此,本文以乙酸正丁酯(butyl acetate)的合成为例,探讨HZSM-5固体酸代替浓硫酸作为催化剂进行实验改进,结合该实验课程的特点,植入绿色化学的概念,引导学生理解绿色化学的内涵。以期解决酯化反应耗时、高成本、多废液、难分离、产量低等问题,为增强学生环保意识,减少实验室危化物排放提供可借鉴的经验。
1 实验原理及目的
1.1 实验原理
(1)传统浓H2SO4催化合成乙酸正丁酯
乙酸和正丁醇在浓硫酸催化条件下的主反应如下:

同时还存在正丁醇分子内脱水的副反应:

此外,还存在正丁醇的醚化、炭化、磺化等副反应。
(2)HZSM-5固体酸催化合成乙酸正丁酯
乙酸和正丁醇在HZSM-5固体酸催化条件下的反应如下:
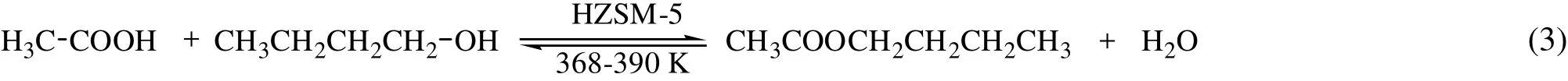
不存在正丁醇分子内脱水、醚化、炭化、磺化等副反应。
1.2 实验目的
(1)了解酯化反应的合成机理以及乙酸正丁酯的制备方法;
(2)了解平衡移动原理在可逆反应中提高产率的方法。
(3)巩固简单蒸馏基本操作。
(4)掌握共沸蒸馏分水法的原理和分水器的使用方法。
(5)对比探讨固体酸催化剂的绿色意义。
2 实验仪器、试剂与装置
球形冷凝管、分水器、三颈圆底烧瓶、温度计、电热套、铁架台、铁夹及十字头、橡胶水管、电子天平、分液漏斗、锥型瓶;浓H2SO4、乙酸、无水正丁醇、HZSM-5固体酸、Na2CO3(10%)、饱和NaCl溶液、无水MgSO4、沸石、蒸馏水、pH试纸。所使用试剂均为分析纯。乙酸正丁酯的制备装置如图1所示。
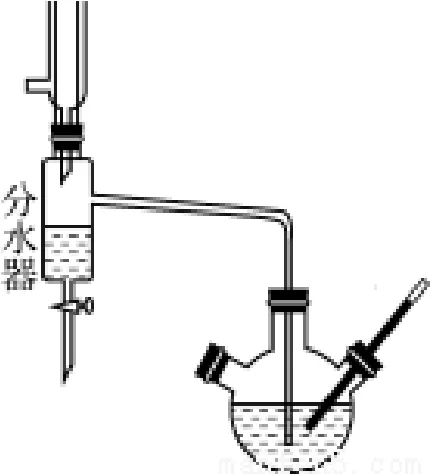
图1 回流分水装置
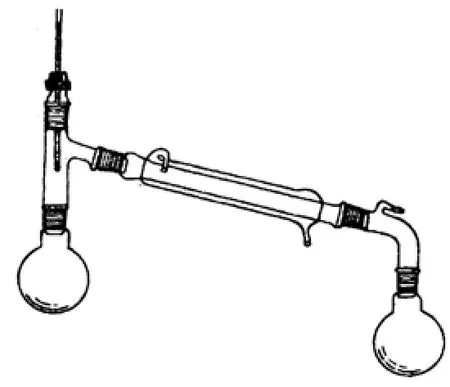
图2 蒸馏装置
3 实验内容
3.1 传统浓硫酸催化合成乙酸正丁酯
① 在50 mL三颈烧瓶中加入8.9 g无水正丁醇和7.81 g乙酸,缓慢滴加3滴浓H2SO4,边加边摇晃,以免局部炭化;还应加入2粒沸石,防止爆沸。
② 为能随时将生成的水从反应体系中除去,以促进酯化反应平衡正向进行,从而提高产率,特使用回流分水装置(如图1所示)。为避免加热导致的反应物蒸发,分水器中需预先加入蒸馏水,使上层酯中的醇能够回流至三颈圆底烧瓶中继续参与反应,水的液面应低于支管口1 cm。
③ 接通冷凝水,使用电热套加热反应体系,控制冷凝管中液滴的流速为1~2 d/s,反应过程中保持分水器中水层液面的高度不变,不断将水分出直至液面不再上升,即反应完成,随即停止加热,记录分出的水量。反应液温度由368 K上升至390 K,回流时间约40 min。
④ 冷却后,将分水器中的酯层和圆底烧瓶中的反应液都移入分液漏斗中。向分液漏斗中加入 10 mL蒸馏水洗涤,以除去乙酸及少量的正丁醇,分去下层水层;再向分液漏斗中慢慢加入10 mL10%的Na2CO3溶液振荡洗涤,因为有CO2气体放出,所以洗涤时要注意震荡力度不宜过猛,否则会导致溶液乳化难以分层;再用pH试纸检验反应液酸性,洗涤至反应液呈中性,分去下层水溶液。分液漏斗中的有机层用10 mL饱和NaC1溶液洗涤,分去下层水溶液;再将上层有机层倒入干燥的锥型瓶中,用1.5 g无水MgSO4干燥,再将液体过滤至50 mL的蒸馏烧瓶中(MgSO4不得倒入)。
⑤ 连接好干燥的蒸馏装置(如图2所示),在烧瓶的滤液中加入2粒沸石,收集397~399 K的馏分即为乙酸正丁酯。
3.2 HZSM-5固体酸催化合成乙酸正丁酯
回流反应和精制过程的步骤与上述①~③和⑤相同,只是采用0.5ɡ预处理过的HZSM-5(823 K焙烧2 h)代替浓H2SO4。且反应液不需经过10%的Na2CO3溶液中和、饱和NaC1溶液洗涤的步骤④,只需过滤固体酸催化剂,并且HZSM-5催化剂可经过滤回收、再生、循环使用。

表1 不同催化剂合成乙酸正丁酯实验结果比较
3 结果讨论
在制备乙酸正丁酯实验教学中,分别使用浓H2SO4和HZSM-5进行对比实验,结果发现:两种催化剂反应时间接近,产率有所提高,实验效果较明显。使用浓H2SO4的传统方法,由于浓H2SO4的高沸点,易使反应液温度升高而导致副反应;且反应液经过碱液中和、NaCl溶液洗涤和分离等操作步骤,不仅耗时且产率降低。通过酯化反应的实验教学改进探索,得出HZSM-5固体酸催化剂具有稳定性好、实验操作简便、成本低、便于购买、安全无毒、可重复使用等优点,并可以有效避免温度过快升高和副反应的发生;且规避了碱液中和、NaCl溶液洗涤等操作程序,使学生直观感受到绿色化学的现实意义,对树立学生环保意识具有非常好的促进作用。
在科研反哺教学的呼声下,结合固体酸催化酯化的科研成果,改进了基础有机化学实验中乙酸正丁酯的制备实验,锻炼学生实验操作技能,培养实验创新能力。通过改革催化剂体系,在教学过程中使学生认识到绿色化学在教学、生产中的应用,对培养创新型人才具有较好的作用和实际意义。
[1] WRJackson,EM Campi,MTWHearn.Green chemistry:challenges and opportunities[M].John Wiley&Sons,Inc.,2017.
[2] H Duan,DWang,Y Li.Green chemistry for nanoparticle synthesis[J].Chemical Society Reviews,2015,44(16):5778.
[3] K Saravanan,B Tyagi,RSShukla,HC Bajaj.Esterification of palmitic acid with methanol over template-assisted mesoporous sulfated zirconiasolid acid catalyst[J].Applied Catalysis B:Environmental,2015,172-173:108-115.
[4]Corma A.Inorganic solid acids and their use in acid-catalyzed hydrocarbon reactions[J].Chemical Reviews,1995,95(3):559-614.
[5] 刘倩,丁玉洁.浅谈绿色化学理念在大学化学教学中的渗透及实施[J].成都师范学院学报,2016,32(3):111-113.
[6] 杨大强.实施绿色化学理念培养学生科学素养[J].化学教与学,2016(8):32-33.
[7] 王满刚,张麟文,孙豫.绿色化学理念在大学有机化学实验教学中的实践与探索[J].教育教学论坛,2016(2):238-239.
[8] 杨廷海,牟志刚,刘维桥,等.绿色化学在高校化学实验教学中的实践与探索[J].合肥师范学院学报,2014(6):99-100.
[9] 乔桂艳.化学实验教学与绿色化学教育[J].教育科学,2016(6):00013.
[10] CaràPD,Pagliaro M,Elmekawy A,et al.Hemicellulose hydrolysis catalysed by solid acids[J].Catalysis Science&Technology,2013,3(8):2057-2061.
[11]徐文祥.绿色化学理念下的化工专业有机化学实验教学改革分析[J].化工设计通讯,2016,42(4):167.
[12]蔡佳利,陈红,陈朝晖,等.树立绿色化学理念改革化学实验教学[J].高等教育研究,2014,31(4):23-27.
