水貂中大肠杆菌、肺炎克雷伯氏菌和不动杆菌三重荧光PCR方法的建立
2017-03-03,,,
,,,
(1. 山东大学生命科学学院,山东济南 250100;2. 山东省动物疫病预防与控制中心,山东济南 250022;3. 威海市动物疫病预防控制中心,山东威海 264200)
水貂中大肠杆菌、肺炎克雷伯氏菌和不动杆菌三重荧光PCR方法的建立
王贵升1,2,尹斐斐3,田夫林2,王金宝1
(1. 山东大学生命科学学院,山东济南 250100;2. 山东省动物疫病预防与控制中心,山东济南 250022;3. 威海市动物疫病预防控制中心,山东威海 264200)
依据 GenBank 中大肠杆菌、肺炎克雷伯氏菌和不动杆菌的部分已知序列,选取大肠杆菌的uidA基因、肺炎克雷伯氏菌的khe基因和不动杆菌的secE基因,利用Primer Premier 5设计引物,选出扩增序列的3对引物及相应的Taqman探针,uidA、khe、secE探针5'端分别标记FAM、HEX、CY5荧光发射基因,3'端标记BHQ1淬灭荧光基因。通过优化反应条件,建立一种同时检测大肠杆菌、肺炎克雷伯氏菌和不动杆菌的诊断方法。特异性和敏感性试验显示,该方法能特异地检测大肠杆菌、肺炎克雷伯氏菌和不动杆菌,其最低检测限分别为2×10-1CFU/µL、9.2×10-1CFU/µL和4.3×10-1CFU /µL。整个检测扩增在2小时内完成。该结果表明本试验所建立的三重荧光定量PCR方法的灵敏度、重复性及特异性均较好,可用于同时快速检测三种病原菌。
大肠杆菌;肺炎克雷伯氏菌;不动杆菌;荧光定量PCR
近年来,随着毛皮动物养殖业的蓬勃发展,其产业发展与资源约束的矛盾日趋严重,随之也带来了多种动物共患病的易发、高发和频发,抗生素滥用,以及饲料源耐药基因扩散等问题,而细菌性疫病已经成为制约产业发展的关键问题之一。尤其是大肠杆菌、肺炎克雷伯氏菌、不动杆菌能够穿过毛皮动物的血脑屏障,致死率很高,给养殖户带来严重的经济损失[1-4]。因此,为了提高诊断检测的准确性和及时性,建立快速检测和鉴定大肠杆菌、肺炎克雷伯氏菌和不动杆菌这三种细菌的方法具有重要意义。
1 材料与方法
1.1菌株来源
文中所涉及的肺炎克雷伯菌(Klebsiella pneumonia)、大肠杆菌(Escherichia coli)、不动杆菌(Acinetobacter)、绿脓杆菌(Pseudomonas aeruginosa)、 弗式柠檬酸杆菌(Freundii Citrobacter)、沙门氏菌(Salmonella)均为2012年1月至2014年7月从发病水貂的肝、肺、脑中分离鉴定的。以上菌株除了肺炎克雷伯氏菌阳性对照保存于中国微生物菌种保藏普通微生物中心(登记入册编号11222)外,其余均保存在山东省动物疫病预防与控制中心。
1.2主要试剂与仪器
TSA琼脂、TSB肉汤培养基,10×PCR 反应液、Taq酶、MgCl2(25 mmol/L)、dNTP(25 mmol/L),均购自宝生物工程(大连)有限公司;细菌DNA柱式提取试剂盒,购自北京森康生物技术开发有限公司。
细胞计数板;显微镜;生化培养箱;荧光定量PCR仪(罗氏公司生产);Centrifuge 5417R台式冷冻离心机(德国Eppendorf公司生产);生物安全柜(海尔公司生产)。
1.3引物及探针设计
分别选取大肠杆菌、肺炎克雷伯氏菌和不动杆菌的基因保守区,设计出相应引物及探针(表1)。引物和探针均由上海生工生物工程技术服务有限公司合成,使用前用灭菌超纯水配成10 µmol/L的浓度,-20 ℃保存备用。
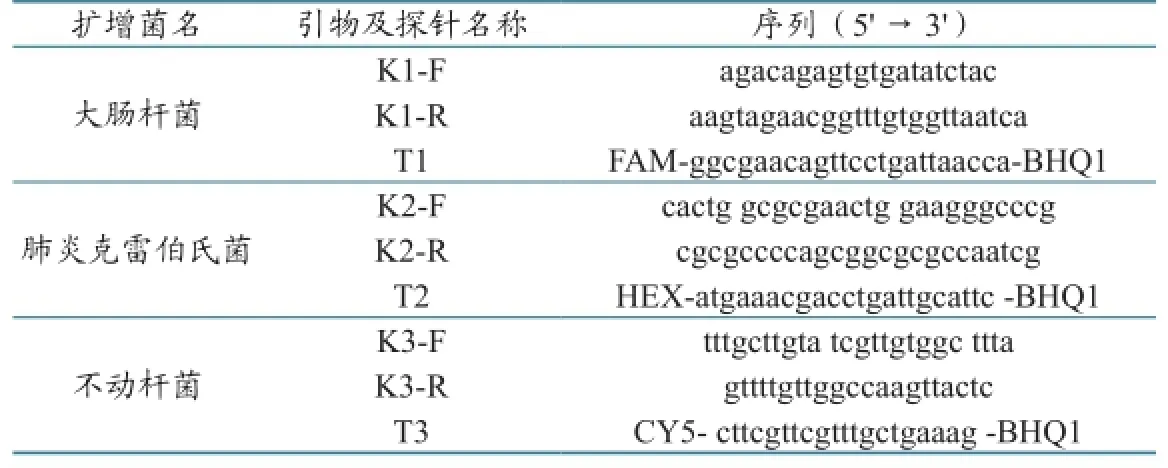
表1 引物及探针信息
1.4核酸提取
参照北京森康生物技术开发有限公司生产的细菌DNA柱式提取试剂盒说明书提取核酸。
1.5荧光PCR体系建立
反应条件的优化,建立25 µL检测体系,10 µmol/L引物及探针的加入量分别为0.6 µL、0.8 µL、1 µL、1.2 µL 、1.5 µL;25 mmol/L MgCl2的加入量分别为1 µL、1.2 µL、1.4 µL、1.6 µL、1.8 µL、2 µL;25 mmol/L dNTP的加入量分别为0.5 µL、1 µL、1.5 µL 、2 µL、2.5 µL;Taq酶的加入量分别为0.1 µL、0.2 µL、0.3 µL、0.4 µL、0.5 µL。反应程序的优化中分别试验退火步骤为50 ℃ 1 min、55 ℃ 1 min、60 ℃ 1 min、65 ℃ 1 min。
1.6菌液浓度的调整
选取经鉴定纯化的水貂源大肠杆菌、肺炎克雷伯氏菌和不动杆菌各1株,分别挑单个菌落于10 mL无菌试管中过夜摇菌,得原菌液,做10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8十进位倍比稀释。取稀释好的10-6、10-7、10-8倍三种细菌的菌液各200 µL,接种于TSA琼脂上,用无菌的涂布器均匀涂布后,每个稀释度、每种细菌做3个重复,待平板干燥后放于37 ℃烘箱中培养12 h,然后进行菌落计数。取3组细菌计数的平均数为最终活菌计数的结果,乘以稀释倍数,再除以0.2。
1.7荧光PCR特异性试验
选取经鉴定纯化的水貂源大肠杆菌、肺炎克雷伯氏菌和不动杆菌各1株,分别挑单个菌落于10 mL无菌试管中过夜摇菌,得原菌液,各取200 µL于1.5 mL离心管中,共3份菌液。同时将实验室保存的3株绿脓杆菌、3株弗式柠檬酸杆菌、3株沙门氏菌,共9株细菌,复苏于TSA琼脂上,培养出单个菌落后,挑取单个菌落于装有TSB肉汤的10 mL离心管中,过夜摇菌。将3株绿脓杆菌、3株弗式柠檬酸杆菌、3株沙门氏菌的核酸及大肠杆菌、肺炎克雷伯氏菌和不动杆菌菌液,采用北京森康生物技术开发有限公司的柱式提取试剂盒提取核酸,运用建立好的荧光PCR方法进行检测。
1.8荧光PCR灵敏性试验
各取1.7中复苏并稀释到10-2、10-3、10-4、10-5、10-6、10-7、10-8的大肠杆菌菌液、肺炎克雷伯氏菌菌液、不动杆菌的菌液200 µL各1份,放入1.5 mL离心管中,共21份200 µL菌液。采用北京森康生物技术开发有限公司的柱式提取的试剂盒,参照说明书提取21份菌液的核酸。将稀释浓度相同的3种细菌的核酸各取10 µL后充分混合,最后形成7份不同稀释度的3种细菌混合核酸。把不同稀释度的3种细菌混合核酸作为荧光定量PCR反应的模板,荧光定量PCR反应采用15 µL反应液,10 µL模板,共25 µL的体系。
1.9荧光PCR重复性试验
取1.7中复苏的3种菌液(原菌液)各200 µL,即取10株大肠杆菌菌液各200 µL于10个不同的1.5 mL离心管中,10株肺炎克雷伯氏菌菌液各200 µL于10个不同的1.5 mL离心管中,10株不动杆菌菌液各200 µL于10个不同的1.5 mL离心管中。采用北京森康生物技术开发有限公司的柱式提取的试剂盒,参照说明书提取30份菌液的核酸。在10株大肠杆菌的核酸、10株肺炎克雷伯氏菌的核酸、10株不动杆菌的核酸中,各随机挑选其中的1株,将3种细菌的核酸混合,最后形成10份3种细菌混合核酸。把3种细菌混合核酸作为荧光定量PCR反应的模板,荧光定量PCR反应采用15 µL反应液,10 µL模板,共25 µL的体系。
2 结果
2.1反应条件的优化
摸索反应条件,建立了25 µL的反应体系:10 µmol/L的K1-F 1 µL;10 µmol/L的K1-R 1 µL;10 µmol/L的 T1 1 µL;10 µmol/L的 K2-F 1 µL;10 µmol/L的K2-R 1 µL;10 µmol/L的T2 1 µL;10 µmol/L的K3-F 1.1 µL;10 µmol/L的K3-R 1.1 µL;10 µmol/L的T3 1.1 µL;10×PCR 2.2 µL;25 mmol/ L的MgCl21.8 µL;25 mmol/L的dNTP 2 µL;Taq酶 0.3 µL;核酸10 µL。
优化后的程序为:第一阶段,预变性50 ℃ 2 min,95 ℃ 3 min;第二阶段,95 ℃ 15 sec,60 ℃ 60 sec,共40个循环,最后40 ℃ 10 sec。在第二阶段每次循环的退火延伸时收集荧光。
2.2菌液浓度的测定
大肠杆菌菌液稀释到10-6、10-7、10-8这3个稀释度的细菌平均数分别为392 CFU、40 CFU、5 CFU,乘以稀释倍数,再除以0.2,菌液浓度分 别 为1.96×109CFU/mL、2.00×109CFU/mL、2.50×109CFU/mL,最终得出原菌液浓度为2.15×109CFU/mL。肺炎克雷伯氏菌菌液稀释到10-6、10-7、10-8这3个稀释度的细菌平均数分别为184 CFU、21 CFU、3 CFU,菌液浓度分别为9.20×108CFU/mL、1.05×109CFU/mL、1.50×109CFU/mL,最终得出原菌液浓度为1.16 CFU/mL。不动杆菌菌液稀释到10-6、10-7、10-8这3个稀释度的细菌平均数分别为397 CFU、43 CFU、5 CFU,菌液浓度分别为1.99×109CFU/mL、2.15×109CFU/mL、2.50×109CFU/mL,最终得出原菌液浓度为2.21 CFU/mL。
2.3荧光PCR特异性试验
分别用大肠杆菌、肺炎克雷伯氏菌和不动杆菌做阳性对照,去离子水做阴性对照,同时选取绿脓杆菌、弗式柠檬酸杆菌和沙门氏菌各3株做试验样品。结果显示:该方法能够特异地检测出大肠杆菌、肺炎克雷伯氏菌和不动杆菌(图中显示为S型曲线),3株绿脓杆菌、3株弗式柠檬酸杆菌、3株沙门氏菌均未检测出扩增曲线(图1~3),说明该检测方法具有良好的特异性。
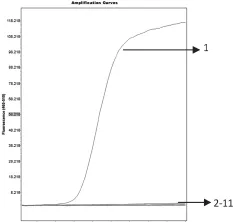
图1 大肠杆菌的特异性
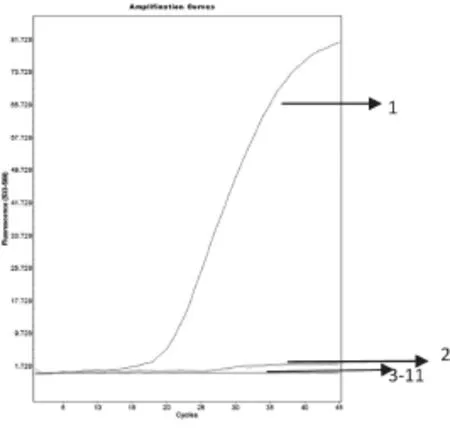
图2 肺炎克雷伯氏菌的特异性
2.4荧光PCR阳性结果重复性试验
重复检测大肠杆菌、肺炎克雷伯氏菌、不动杆菌各10株,均出现特异性S型扩增曲线,且CT值均未超过28,表明检测结果均为阳性。阳性结果变异系数=标准差/平均值,变异系数为7.4%,可见三重荧光PCR对大肠杆菌、肺炎克雷伯氏菌、不动杆菌阳性结果的重复性试验比较稳定(图4~6)。
2.5荧光PCR灵敏度试验
试验结果显示:此方法对大肠杆菌、肺炎克雷伯氏菌和不动杆菌检测到的最小菌落个数分别为40 CFU、184 CFU和86 CFU(图7~9)。

图4 大肠杆菌的重复性
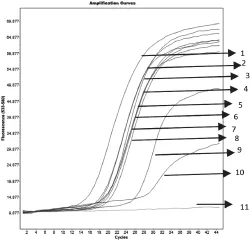
图5 肺炎克雷伯氏菌的重复性
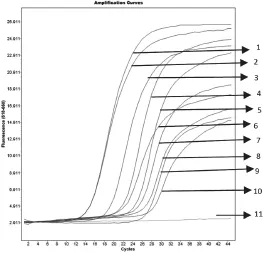
图6 不动杆菌的重复性
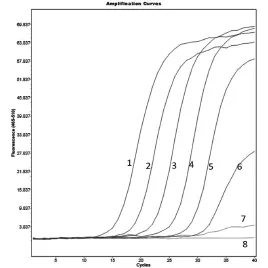
图7 大肠杆菌的灵敏度
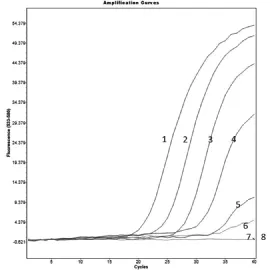
图8 肺炎克雷伯氏菌的灵敏度
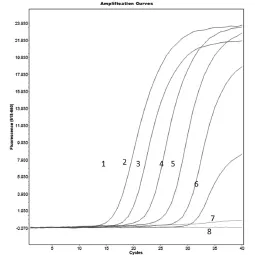
图9 不动杆菌的灵敏度
3 讨论
实时荧光定量PCR在PCR扩增过程中,通过荧光信号,对PCR进程进行实时检测,具有高度特异性、灵敏性等特点[5],被广泛应用于医疗、药物研究、病原菌的检测[6-7]。此方法避免了电泳及成像拍照等步骤,减少了交叉污染[8-9]。
在常规的细菌培养中,大肠杆菌、肺炎克雷伯氏菌和不动杆菌在普通培养基上的菌落形态相似,眼观不易分辨;采用经典细菌形态观察方法,发现涂片镜检下的菌体特点相似,很难区分;采用细菌的生化鉴定和16sRNA鉴定,约需3~4天时间。同时,16sRNA鉴定还需要测序,成本也较高。普通的PCR鉴定,灵敏度差,有时不能直接从样品中检测出细菌。本研究所建立的检测方法具有很好的扩增曲线,结果判定直观醒目,能为临床快速检测诊断奠定基础。但本方法由于灵敏度较高,所以操作过程中仍需要小心操作,避免污染,一旦发生气溶胶污染,则需开窗通风,排出污染性气溶胶。
[1]陈思,吕文雪,许皓,等. 引起毛皮动物肺炎的主要病原微生物及特征[J]. 中国毛皮动物科学研究进展,2014(2):164-169.
[2]钟世勋,迟珊珊,王振,等. 山东规模化养殖场毛皮动物多重感染病原学分析[J]. 中国兽医学报,2014,34(11):1770-1777.
[3]张振兴. 我国毛皮动物养殖概况及存在的问题[J].经济动物学报,2005,9(4):187-190.
[4]钟世勋,朱瑞良,崔国林,等. 山东部分地区毛皮动物肺炎雷伯氏菌的分离鉴定及系统发育分析[J]. 中国预防兽医学报,2013,35(4):285-289.
[5]周晓丽,朱国坡,李雪华,等. 实时荧光定量PCR技术原理与应用[J].中国畜牧兽医,2010(2):87-89.
[6]周成江,周立社,吴刚,等. 实时荧光定量PCR的研究进展及其应用[J]. 包头医学院学报,2007(2): 204-207.
[7]韩熹,朱莉莎,姚建垣. 实时荧光定量PCR分析技术的应用[J].生命科学仪器, 2005(2):51-52.
[8]陈旭,齐凤坤,康立功,等. 实时荧光定量PCR技术研究进展及其应用[J].东北农业大学学报,2010(8):148-155.
[9]徐楠楠,胡桂学. 实时荧光定量PCR技术的研究进展及应用[J].黑龙江畜牧兽医,2011(21):24-27.
(责任编辑:朱迪国)
Establishment of Triple Fluorescent Quantitative PCR for Escherichia coli,Klebsiella pneumoniae and Acinetobacter in Minks
Wang Guisheng1,2,Yin Feifei3,Tian Fulin2,Wang Jinbao1
(1. College of Life Science,Shandong University,Jinan,Shandong 250100;2. Shandong Animal Disease Prevention and Control Center ,Jinan,Shandong 250022;3. Weihai Animal Disease Prevention and Control Center,Weihai,Shandong 264200)
According to the partially known sequences of Escherichia coli,Klebsiella pneumoniae and Acinetobacter in GenBank,the uidA gene of Escherichia coli,khe gene of Klebsiella pneumoniae and secE gene of Acinetobacter were selected. Then 3 pairs of primers and Taqman probes of which 5' end were labeled with fl uorophores(FAM,HEX,CY5)respectively ,and 3' end marked with BHQ1 quenchers were designed by Primer Premier 5. By optimizing the reaction conditions,a diagnostic method which could detect Escherichia coli,Klebsiella pneumoniae and Acinetobacter simultaneously was established. Experiments of speci fi city and sensitivity showed that this method could speci fi cally detect the above three genes,while the lowest detection limits were 2×10-1CFU/µL,9.2×10-1CFU/µL and 4.3×10-1CFU /µL,respectively. The whole ampli fi cation was completed within two hours. In conclusion,a triple quantitative PCR with good sensitivity,reproducibility and speci fi city was established ,it could be used for rapid and simultaneous detection of the three pathogens.
Escherichia coli;Klebsiella pneumoniae;Acinetobacter; fl uorescent quantitative PCR
S851.3
:A
:1005-944X(2017)02-0096-05
10.3969/j.issn.1005-944X.2017.02.028
山东省毛皮动物产业技术体系创新团队项目(SDAIT-18-011-05)
王金宝
