ITS2序列分析在白花蛇舌草鉴定中的应用研究
2017-02-28陈怡君郭晓辉高芳
陈怡君++++++郭晓辉++++++高芳雪++++++王爱华++++++李鋆++++++李外++++++刘萍
[摘要] 目的 对白花蛇舌草和它的混伪品进行分子生物鉴定,保证该药材的临床药效和使用安全。 方法 提取白花蛇舌草及其混伪品的DNA,使用引物进行PCR扩增,获取ITS2序列的片段,将扩增得到的产物进行双向测序,运用Condon Code Aligner软件进行校对拼接,去除低质量区。用HMMer注释法保留ITS2序列全长。运用MEGA 5.1软件对真伪品序列进行分析,计算真伪品的遗传距离,构建邻接(NJ)树评估真伪品之间的亲缘关系。采用ITS2数据库预测ITS2二级结构。 结果 白花蛇舌草与混伪品的ITS2序列存在明显差异。 结论 运用ITS2序列能准确有效鉴别出白花蛇舌草和混淆品。
[关键词] 白花蛇舌草;混伪品;ITS2;分子鉴定
[中图分类号] R282.12 [文献标识码] A [文章编号] 1673-7210(2016)11(b)-0021-04
[Abstract] Objective To ensure the clinical efficacy and safety of Hedyotis diffusa, identify Hedyotis diffusa and its mix adulterants by molecular biological assay. Methods The polymerase chain reaction (PCR) technique which used DNA templates of Hedyotis diffusa and its mix adulterants and ITS2 sequence primers was performed to obtain the ITS2 regions. The amplification products were sequenced bi-directionally. Sequences were assembled by the CodonCode Aligner. ITS2 sequences of plants were obtained integrally by HMMer annotation method and analyzed by MEGA5.1 to calculate genetic distance among Hedyotis diffusa and its mix adulterants. The neighbor-joining (NJ) phylogenetic tree was constructed to evaluate genetic relationship of plants. ITS2 secondary structures were predicted by ITS2 database. Results There was distinct difference on ITS2 sequences between Hedyotis diffusa and its adulterants. Conclusion ITS2 sequence can be used as a effective marker for identifying Hedyotis diffusa and its adulterants.
[Key words] Hedyotis diffusa; Adulterants; ITS2; Molecular identification
白花蛇舌草為茜草科耳草属植物白花蛇舌草(Oldenlandia diffusa)的全草,具有清热解毒、利尿消肿、活血止痛的功效[1]。由于白花蛇舌草在癌症的治疗中效果确切[2],需求剧增,使其生药资源日见贫乏,而出现较多混伪品。常见混伪品伞房花耳草、纤花耳草、松叶耳草等与白花蛇舌草同科属,仅根据植物外在特点难以鉴别,经常会被当成是白花蛇舌草用于临床[3-7]。还有商家为了增加利益,掺杂其他不同科属的漆姑草(石竹科漆姑草属)、舌雀草(石竹科繁缕属)在白花蛇舌草中,导致白花蛇舌草的质量下降[8-9]。为保证白花蛇舌草的用药安全和疗效确切,它的准确鉴别是目前一项十分紧迫的任务。近年来,DNA条形码研究在物种鉴定和植物分类领域体现出较高的准确率,成为热点研究方向[10-11]。此项技术的核心在于通过比较一段通用DNA序列,对物种在基因水平进行鉴定和高效识别,同传统的显微鉴别、理化鉴别、色谱鉴别相比较,DNA条形码技术重复性好、稳定、快速、准确,更为重要的是它深入到分子水平,反映了物种的遗传特性,这种鉴别方式更加可靠[12-13]。有学者对多种植物样本进行研究后,提出将DNA条形码之一的ITS2序列用于植物鉴定的标准序列[14-16]。ITS2因其长度较短,扩增效率高,不同的物种突变位点多,表现出较高的物种分辨率,很适合用于植物鉴定[17-18]。
本研究以白花蛇舌草药材及纤花耳草、松叶耳草、伞房花耳草、漆姑草、雀舌草等混伪品作为研究对象获得ITS2序列,稳定、准确地鉴别白花蛇舌草药材及其混伪品,为保障该药材品种的临床疗效提供了新的鉴定技术手段。
1 材料与方法
1.1 试剂与仪器
植物基因组DNA提取试剂盒(CW0531,北京康为世纪生物科技有限公司);2×Es Taq MasterMix(康为世纪生物科技有限公司);引物(华大基因科技有限公司合成);VeritiTM96 PCR仪(杭州博日科技有限公司);电泳仪(DYY-8C,北京白晶生物科技有限公司);核酸/蛋白质凝胶图像分析管理系统(GSG-2000,中国珠海黑马医学仪器有限公司);DNA分析仪(3730xl,Applied Biosystems)。
1.2 植物材料
材料信息见表1,包括实验样品及GenBank下载序列,其中,白花蛇舌草和混伪品实验样品采自海南、苏州、广东等地,由解放军总医院刘萍主任药师鉴定,凭证标本保存于解放军总医院海南分院药剂科中药标本室。
1.3 植物DNA提取、PCR扩增和测序
将白花蛇舌草和3种混伪品的干燥植物分别用研钵碾成粉末,各取30 mg置离心管中,按照试剂盒说明书提取DNA。收集DNA溶液,-20℃冰箱保存。正向引物为ITS2F:5'-ATGCGATACTTGGTGTGAAT-3',反向引物为ITS3R:5'-GACGCTTCTCCAGACTACAAT-3'[19]。PCR反应体系包括25 μL 2×ES Taq Master Mix,2 μL正向引物ITS2F,2 μL反向引物ITS3R,9 μL超纯水,12 μL模板(基因组DNA),体系配制共为50 μL。使用PCR仪进行扩增,扩增程序:Step1:94℃变性5 min;Step2:94℃变性30 s,56℃退火30 s,72℃延伸45 s(进行40个循环);Step3:72℃延伸10 min。PCR产物在0.7%的琼脂糖凝胶上电泳跑胶,获得单一条带后,将PCR产物送至华大基因貿易有限公司利用DNA分析仪进行双向测序。
1.4 数据处理
运用Codon Code Aligner 6.02(Condon Code Co.,USA)对测序峰图进行校对拼接,除去序列两侧低质量区和切除引物。对GenBank下载的和拼接后得到的ITS2序列用HMMer注释法切5.8 S和28 S端,保留ITS2的全长[20]。然后用软件MEGA 5.1比较序列变异,计算遗传距离和构建邻接(NJ)树。采用Koetschan等[21]建立的ITS2数据库预测ITS2二级结构。
2 结果
2.1 序列峰图
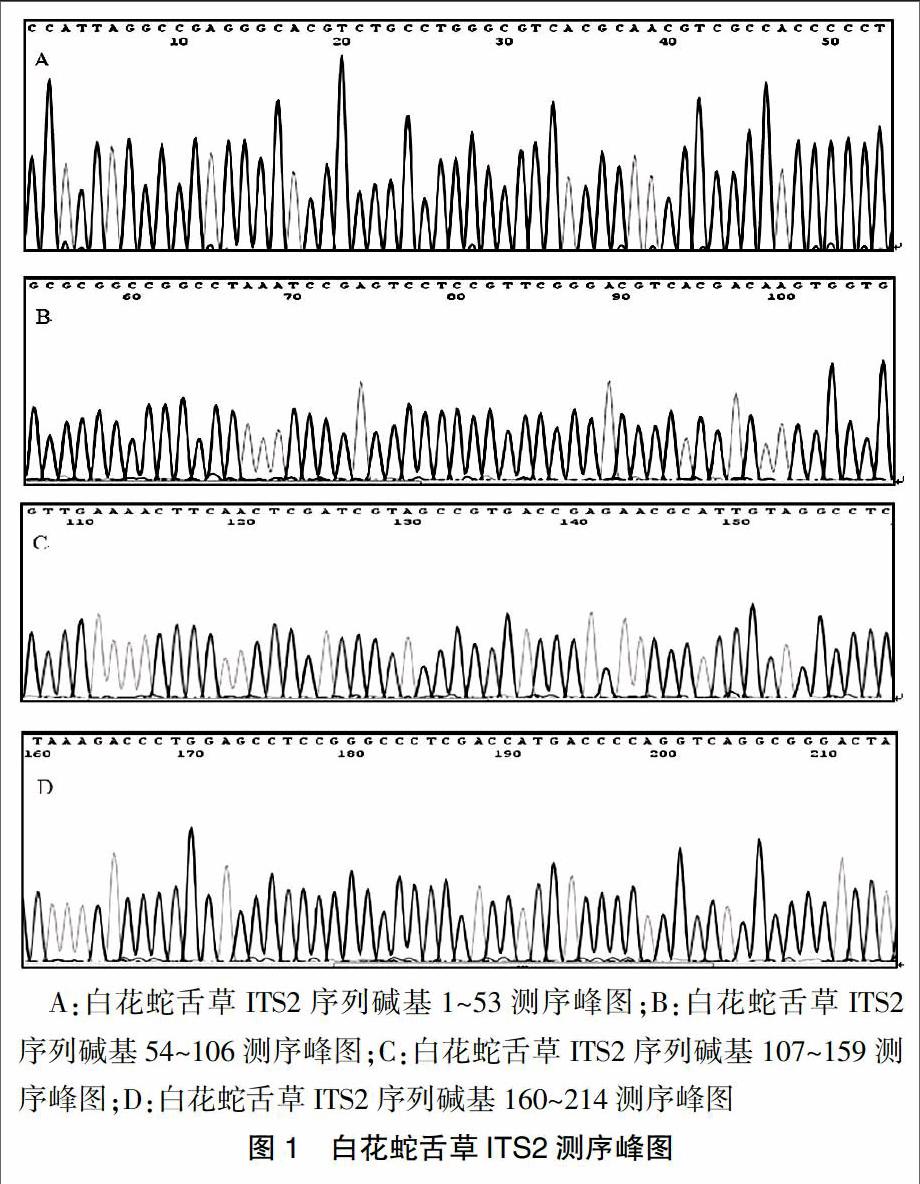
白花蛇舌草(凭证标本号BHS15101)的ITS2序列测序峰见图1,序列长度为214 bp,其中质量为QV≥20的碱基为214 bp,质量较好,没有含PolyA(≥5个单碱基重复)和PolyT结构,CG含量为65.9%。
2.2 白花蛇舌草种内序列比对
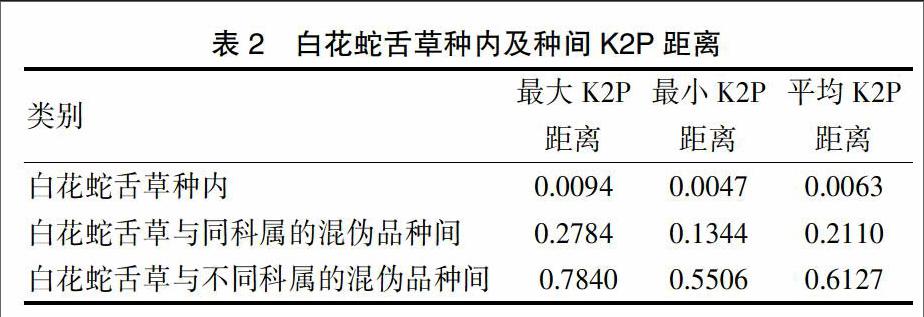
3条白花蛇舌草ITS2序列,比对后序列长度均为214 bp,GC含量为65.9%~66.8%,均值为66.37%。有2处单碱基变异,为73位点处T-C变异和173位点处T-G变异,白花蛇舌草种内ITS2序列的平均K2P距离为0.0063,最大的K2P距离为0.0094。
2.3 白花蛇舌草与其混淆品序列比对
本实验白花蛇舌草与其混淆品共15个样品的ITS2序列的长度范围为213~223 bp,GC含量范围为57.7%~69.0%。所有样品ITS2序列比对后长度为251 bp,其中变异位点为131个,信息位点为107个。白花蛇舌草种内及种间K2P距离见表2。
从表中可以看出白花蛇舌草与同科属的伞房花耳草、纤花耳草和松叶耳草的种间K2P距离平均值为0.2110,最大K2P距离为0.2784,变异相对较小,其中白花蛇舌草与纤花耳草的遗传距离最近,最大K2P距离为0.1453;而白花蛇舌草与不同科属的混伪品雀舌草和漆姑草种间K2P距离平均值为0.6127,最小K2P距离为0.5506,变异较大。
2.4 白花蛇舌草与其混伪品的邻接树
从构建的NJ树可以看出,来自不同序列的白花蛇舌草聚为一支。同一科属的白花蛇舌草、伞房花耳草、纤花耳草、松叶耳草聚在一起,其中白花蛇舌草与纤花耳草、松叶耳草亲缘关系比较近,与纤花耳草最近,与遗传距离的计算结果相一致,伞房花耳草独立为一支。不同科属的石竹科雀舌草和漆姑草独立聚为一支。见图2。
2.5 ITS2序列二级结构分析
白花蛇舌草与其混淆品的二级结构见图3,可以看出,白花蛇舌草与其5个混淆品在二级结构上有明显的差异。主要差异存在于螺旋Ⅰ和螺旋Ⅲ,还有基部的角度不同。白花蛇舌草二级结构螺旋Ⅰ区存在5个环,其中间有个大颈环。白花蛇舌草二级结构螺旋Ⅰ区、Ⅲ区茎环数量、大小和位置与其他混淆品也存在明显不同。白花蛇舌草二级结构螺旋Ⅲ和螺旋Ⅳ区的夹角与伞房花耳草、松叶耳草、漆姑草、雀舌草的夹角也不同。纵观在这种结构差异上,伞房花耳草、漆姑草、雀舌草比松叶耳草、纤花耳草表现更明显,这种亲缘关系的远近与NJ树的结果一致。说明白花蛇舌草与混伪品在ITS2序列二级结构上存在差异。
3 讨论
本实验研究了正品的白花蛇舌草与外形相似的混淆品伞房花耳草、纤花耳草、松叶耳草、雀舌草、漆姑草在ITS2序列上的差异,结果显示这种差异不仅体现在ITS2序列碱基种类、数量上,更体现在ITS2序列科属差异大小和二级结构上。
白花蛇舌草的种内变异位点和遗传距离明显少于种间变异位点和遗传距离。而在种间遗传距离中,白花蛇舌草与同科属混淆品的遗传距离小于与不同科属的遗传距离。同样在构建的NJ树中,同科属的白花蛇舌草、纤花耳草、伞房花耳草、松叶耳草聚在一起,不同科属的漆姑草、雀舌草独立聚为一支。这些结果表明,利用ITS2序列不仅能成功地将白花蛇舌草与其混伪品区分开,还证明了ITS2序列在同科属植物间的差异是明显小于不同科属植物间差异的。耿超等[22]的建泽泻鉴定研究中也有类似发现,通过遗传距离和构建的NJ树发现建泽泻与泽泻科泽泻属物种距离较近,与泽泻科其他属及其混伪品之间遗传距离较远。这些研究进一步力证了ITS2序列在物种间突变位点多,表现出较高的分辨率。
本文还进行了ITS2序列二级结构分析,结果显示白花蛇舌草与伞房花耳草、漆姑草、雀舌草ITS2序列结构上的差异比与松叶耳草、纤花耳草结构差异表现更明显,且这种亲缘关系的远近与NJ树的结果一致。说明ITS2序列二级结构的差异也可成为白花蛇舌草鉴别点之一。虽然高婷等[23]的藤梨根分子鉴定证明了藤梨根与其常见混伪品的ITS2二级结构也存在明显差异,但未就科属间的细致差异进行深入探索。
从遗传距离、构建的NJ树以及ITS2序列二级结构的结果发现,纤花耳草和白花蛇舌草的亲缘关系最近,这就表明白花蛇舌草中很容易掺杂纤花耳草,二者有效成分和功效上的差异还有待研究。
本文對于ITS2序列能否用于白花蛇舌草鉴定做了细致精准的探索,结果表明ITS2序列在白花蛇舌草和混伪品间种间变异大,分辨率高,因此利用其碱基和结构上的差异能够快速、准确鉴别出白花蛇舌草和它的混伪品。ITS2序列在中药材鉴定中具有很大的应用价值。
[参考文献]
[1] 左琳,满其倩,容蓉,等.白花蛇舌草抗肿瘤有效成分及其机制最新研究进展[J].辽宁中医杂志,2015,42(10):1963-1964.
[2] 毛宇,徐芳,徐小娟,等.白花蛇舌草抗肿瘤成分及其作用机理研究进展[J].现代预防医学,2015,42(17):3128-3132.
[3] 薛运浩.全草类中药金钱草、紫花地丁、白花蛇舌草、药用青蒿、半枝莲的正品及其易混品的性状鉴别[J].中医临床研究,2015,7(26):40-41.
[4] 陈彩莲,朱流财.白花蛇舌草与水线草的鉴别及化学成分的含量测定[J].湖北中医杂志,2011,33(6):69-71.
[5] 李志俊,王金梅,刘宇琴.白花蛇舌草与常见伪品的鉴别[J].甘肃医药,2012,31(6):463-465.
[6] 王新凤,马传江,曹广尚.白花蛇舌草及其混淆品中5种抗肿瘤核苷类成分含量测定[J].中国中医药信息杂志,2016,23(7):92-94.
[7] 姚志红,周先强,温丽荣,等.UPLC 指纹图谱结合化学计量学的白花蛇舌草真伪鉴别研究[J].中药材,2016,39(4):737-742.
[8] 黄柳娜,赖茂祥,陈庆淑,等.白花蛇舌草真伪鉴定研究进展[J].广西中医学院学报,2012,15(1):94-96.
[9] 芦柏震,侯桂兰,周佳佳.白花蛇舌草与4种混伪品的辨别[J].中医药学刊,2006,24(8):1566-1566.
[10] 辛天怡,雷美艳,宋经元.中药材DNA 条形码鉴定研究进展[J].中国现代中药,2015,17(2):170-176,184.
[11] 方辉,张桦,姚正培,等.基于ITS2序列探讨不同果翅颜色梭梭的系统发育关系[J].新疆农业科学,2015,52(10):1822-1827.
[12] 陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志, 2013,38(2):141-148.
[13] Li X,Yang Y,Henry RJ,et al. Plant DNA barcoding: from gene to genome [J]. Biol Rev Camb Philos Soc,2015,90(1):157-166.
[14] Chen SL,Yao H,Han JP,et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species [J]. PLoS ONE,2010,5(1):e8613.
[15] Chen S,Pang X,Song J,et al. A renaissance in herbal medicine identification: from morphology to DNA [J]. Biotechnol Adv,2014,32(7):1237-1244.
[16] 费希同,巨苗苗,林源,等.ITS2序列在植物DNA条形码鉴定中的应用[J].亚热带植物科学,2014,43(4):339-342.
[17] 罗亚皇,刘杰,高连明,等.DNA条形码在生态学研究中的应用与展望[J].植物分类与资源学报,2013,35(6):761-768.
[18] 陈士林.中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015:6-14.
[19] 汤欢,向丽,赵莎,等.应用DNA条形码ITS2序列对市售药材黄柏的鉴定研究[J].世界科学技术中医药现代化,2016,18(2):184-190.
[20] Keller A,Schleicher T,Schultz J,et al. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation [J]. Gene,2009,430(1-2):50-57.
[21] Koetschan C,Frster F,Keller A,et al. The ITS2 Database Ⅲ sequences and structures for phylogeny [J]. Nucleic Acids Res,2010,38(Database issue):D275-D279.
[22] 耿超,谷巍,吴启南,等.基于ITS2序列的建泽泻及其混伪品鉴定研究[J].南京中医药大学学报,2016,32(2):181-185.
[23] 高婷,朱珣之.基于ITS2序列的中药材藤梨根DNA分子鉴定[J].世界科学技术中医药现代化,2016,18(2):214-220.
