左卡尼汀对心力衰竭大鼠PPAR—α及三磷酸腺苷的影响
2017-02-28王玲张美丹李若林
王玲++++++张美丹++++++李若林++++++刘杰++++++侯善荣
[摘要] 目的 研究左卡尼汀(LC)對心力衰竭大鼠过氧化物酶体增殖剂激活受体-α(PPAR-α)及三磷酸腺苷(ATP)的影响。 方法 将SD雄性成年大鼠60只随机分为4组:正常对照组、心力衰竭模型组、LC低浓度组、LC高浓度组,每组15只。心力衰竭模型组和LC低、高浓度组给予异丙肾上腺素[3 mg/(kg·d)]连续腹腔注射5 d建造慢性心力衰竭模型。LC低、高浓度组在首次注射异丙肾上腺素的同时给予LC腹腔注射[80、160 mg/(kg·d)]。6周后行心脏彩超检查,取组织行病理切片检查,采用酶联免疫吸附测定法(ELISA)检测大鼠血清脑钠肽(BNP)水平,化学比色法检测大鼠心肌ATP水平,免疫印迹法(Western blot)检测PPAR-α蛋白表达。 结果 心脏彩超示LC低、高浓度组心功能较心力衰竭模型组明显改善,且LC高浓度组较LC低浓度组改善明显(P < 0.05)。与心力衰竭模型组比较,LC低、高浓度组血清BNP水平显著降低(P < 0.05),心肌ATP水平及PPAR-α蛋白表达明显升高(P < 0.05),且LC高浓度组较LC低浓度组的差异更为显著(P < 0.05)。 结论 LC可能通过影响PPAR-α表达来改善心力衰竭心脏结构改变,改善大鼠心肌细胞能量代谢,延缓心力衰竭的发生、发展,其效应呈剂量相关性。
[关键词] 慢性心力衰竭;左卡尼汀;过氧化物酶体增殖剂激活受体-α;能量代谢
[中图分类号] R541.6 [文献标识码] A [文章编号] 1673-7210(2016)11(b)-0017-04
[Abstract] Objective To investigate the effects of L-carnitine on PPAR-α and ATP of heart failure (HF) rats. Methods A total of 60 senior male SD rats were randomized to divided into four groups with 15 animals in each group, including normal control group, HF model group, low-dose L-carnitine group, and high-dose L-carnitine group. HF model group, low-dose L-carnitine group and high-dose L-carnitine group were induced by intraperitoneal injection of Isoproterenol [3 mg/(kg·d)] for 5 days. Low and high-dose groups would be given Isoproterenol and intraperitoneal injection of L-carnitine[80, 160 mg/(kg·d)] simultaneously in the first time. Echocardiography was performed in all experimented SD rats to observe the pathological changes in the myocardium, besides, all rats were taken tissue pathological slices after 6 weeks. The serum BNP level was detected with ELISA and the ATP concentration in myocardial was detected with Chemocolorimetry, and PPAR-α protein expression was measured with Western blot. Results Compared with HF model group, the results of echocardiograph showed that heart function of SD rats in low and high-dose L-carnitine groups were improved significantly, and high-dose L-carnitine group was improved significantly than low-dose L-carnitine group (P < 0.05). Compared with HF model group, serum BNP levels were lower significantly in low and high-dose L-carnitine groups (P < 0.05), ATP concentration and expression of PPAR-α protein of myocardium were higher significantly in low and high-dose L-carnitine groups (P < 0.05), the difference in high-dose L-carnitine group was more significant than that in low-dose L-carnitine group (P < 0.05). Conclusion L-carnitine may improve the result of myocardial remodeling and cellular energy metabolism to delay the process of the development of the rats with HF by affecting the expression of PPAR-α, the effect is dose-related.
[Key words] Chronic heart failure; L-carnitine; PPAR-α; Energy metabolism
心力衰竭目前是各种心血管疾病的终末期表现和最主要的死因,慢性心力衰竭发生时,会出现心肌脂肪酸的利用障碍,导致心肌细胞能量生成减少,进而恶化心功能。改善心肌能量代谢能够显著降低心力衰竭患者的全因死亡率及心力衰竭住院率。左卡尼汀(L-carnitine,LC)是改善能量代谢的药物,它通过运载游离脂肪酸进入线粒体,辅助细胞的能量代谢[1-2],同时可以减少线粒体的氧化应激反应及氧化磷酸化,加快线粒体的利用率[3-4]。本研究通过建立大鼠慢性心力衰竭模型,观察不同浓度LC对心肌组织三磷酸腺苷(ATP)及过氧化物酶体增殖剂激活受体-α(PPAR-α)水平的影响,探讨其改变心力衰竭心脏结构、提高能量代谢、改善心功能的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 雄性成年SD大鼠60只,4周龄,体重280~300 g,购自济南朋悦实验动物繁育有限公司,合格证号:SCXK(鲁)20140007。适应性喂养1周,随机分为4组:正常对照组、心力衰竭模型组、LC高浓度组、LC低浓度组,每组15只。
1.1.2 主要药品与试剂 LC粉针(晋城海斯制药有限公司,批号:H20141372);异丙肾上腺素注射液(上海禾丰制药有限公司,批号:100166-201004);大鼠BNP ELISA试剂盒(上海西唐生物科技有限公司);大鼠ATP测定试剂盒(北京百奥莱博科技有限公司);兔抗鼠PPAR-α抗体(武汉博士德生物工程有限公司)。
1.2 实验方法
1.2.1 实验动物模型建立 采用腹腔注射异丙肾上腺素法[3 mg/(kg·d),5 d]建造慢性心力衰竭模型,LC低、高浓度组在首次注射异丙肾上腺素的同时分别给予LC腹腔注射[80、160 mg/(kg·d)]。正常对照组和心力衰竭模型组给予同等体积的生理盐水腹腔注射,连续6周。造模成功标准:造模6周后,①随机选取两只大鼠取心肌组织,苏木精-伊红(HE)染色,光镜下观察心肌组织变性坏死,符合慢性心力衰竭的心肌病理学改变;②心脏彩超检测左室射血分数(LVEF)、左室收缩末期内径(LVESD)及左室舒张末期内径(LVEDD),与对照组比较,差异有统计学意义(P < 0.05),提示造模成功。
1.2.2 心脏彩色多普勒检测 各组动物末次给药后禁食禁水24 h,10%水合氯醛(4 mL/kg)腹腔注射麻醉,固定,胸部備皮,二维切面心超引导下,分别测量LVEF、LVESD及LVEDD,每组原始数据取连续3个心动周期的平均值。
1.2.3 标本留取 心脏彩色多普勒检测结束后,打开胸腔,于心尖波动最明显处穿刺采血2 mL,静置2 h,待血液凝固后,3000 r/min离心20 min,取上层血清分别保存于-20℃低温冰箱保存,采用酶联免疫吸附测定法(ELISA)测定血清脑钠肽(BNP)水平。取出心脏,生理盐水反复冲洗,取左室前壁组织浸泡于4%多聚甲醛溶液中,留待做HE染色,余组织存放于-80℃冰箱中冻存,用化学比色法检测心肌组织ATP及免疫印迹法(Western blot)检测PPAR-α蛋白。
1.2.4 病理学观察 取待测左室前壁组织,4%多聚甲醛溶液中固定12 h,脱水,经石蜡包埋,连续切片,HE染色,光镜下进行病理学观察。
1.2.5 ELISA 检测大鼠血清BNP,-20℃取出保存好的血清,按照ELISA试剂盒说明进行操作。
1.2.6 化学比色法 检测大鼠心肌组织ATP水平,取部分剩余心肌组织称重后,加生理盐水,煮沸10 min后冷却,再以4000 r/min离心10 min,取上清液,用分光光度计测定。
1.2.7 Western blot 检测PPAR-α蛋白的表达,4组细胞处理后,孵育48 h,-80℃冰箱取出各组大鼠心肌组织,常规方法提取蛋白质,测定蛋白浓度,经电泳、转膜、封闭后,用PPAR-α多克隆抗体(1∶400)4℃孵育过夜,洗膜后加入二抗辣根过氧化酶(HRP)-IgG(1∶1000),室温孵育2 h,洗膜后ECL化学发光法显色,X线片显影,IPP7.0分析条带吸光度。
1.3 统计学方法
采用SPSS 19.0软件进行统计学处理,计量资料以均数±标准差(x±s)表示,采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 一般情况
实验过程中,心力衰竭模型组大鼠死亡5只,正常对照组大鼠死亡1只,LC低浓度组大鼠治疗期间死亡4只,LC高浓度组死亡2只。与正常对照组相比,心力衰竭模型组和LC低、高浓度组大鼠均出现体重减轻、呼吸浅快、精神欠佳、进食及活动减少等症状。
2.2 心脏彩色多普勒结果
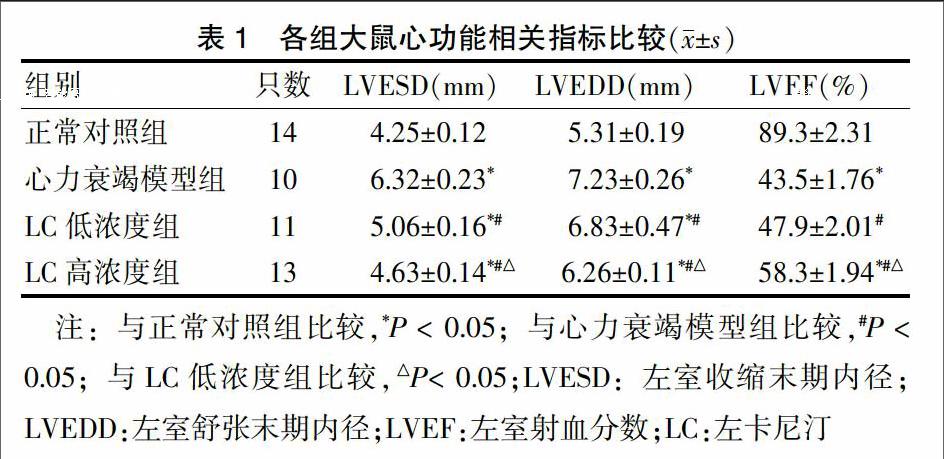
与正常对照组比较,心力衰竭模型组、LC低浓度组、LC高浓度组LVESD和LVEDD均明显增大(P < 0.05),LVEF明显降低(P < 0.05)。与心力衰竭模型组比较,LC低、高浓度组LVESD和LVEDD均显著减小(P < 0.05),LVEF显著升高(P < 0.05),且LC高浓度组较LC低浓度组差异更明显(P < 0.05)。见表1。
2.3 心肌组织病理学改变
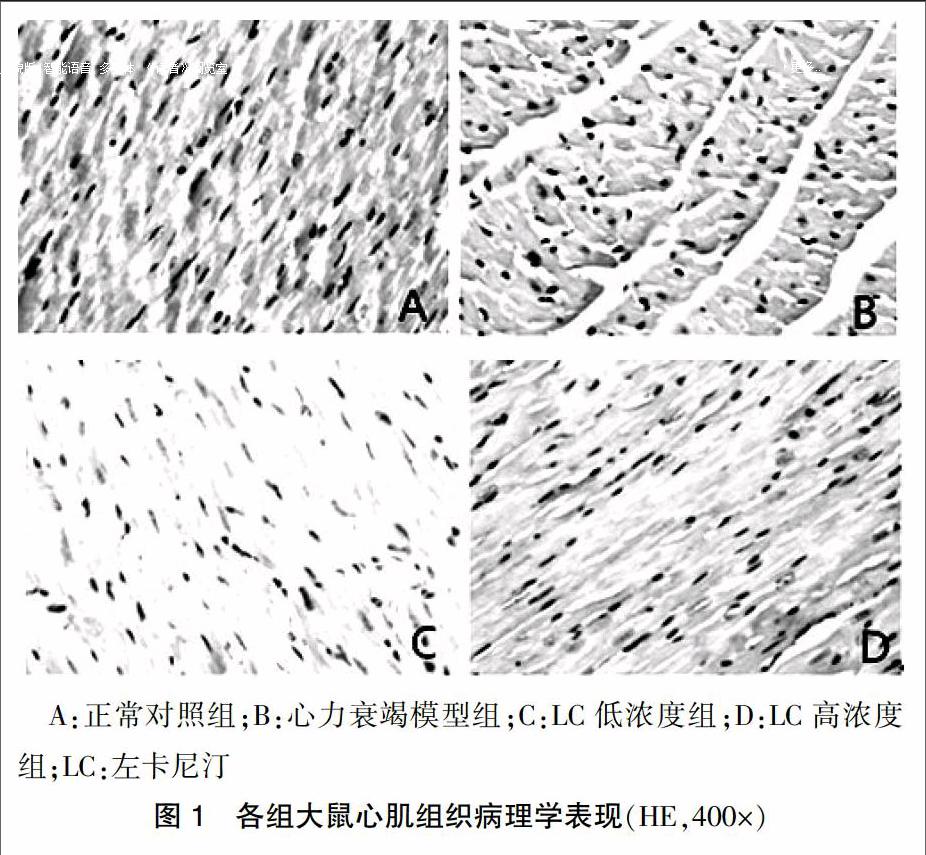
光学显微镜下观察,正常对照组心肌细胞纹理清晰,形态正常;心力衰竭模型组可见心肌细胞纹理不清,排列紊乱,心肌纤维断裂,间质纤维化;LC低浓度组以条索状小灶性坏死与健存心肌交错为主,无片状坏死;LC高浓度组可见轻微纤维化和变性等改变。见图1。
2.4 血清BNP與心肌组织ATP水平
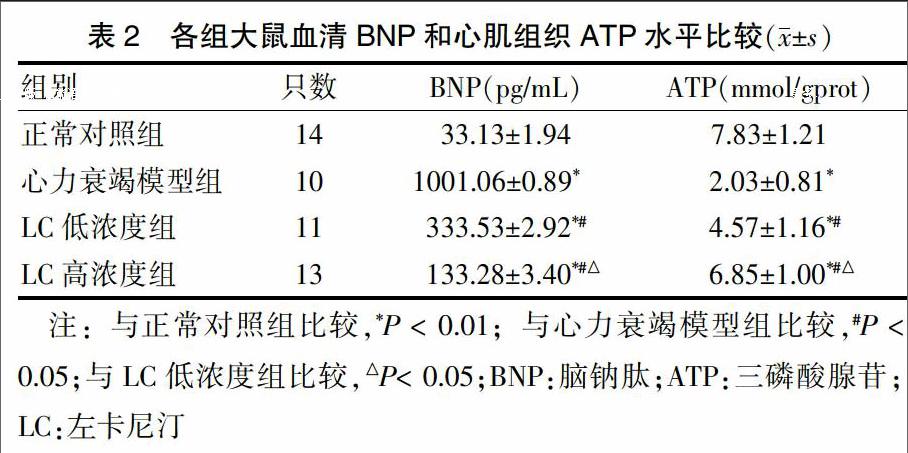
与正常对照组比较,心力衰竭模型组及LC低、高浓度组的血清BNP水平明显增高,ATP水平明显降低,差异有高度统计学意义(P < 0.01)。与心力衰竭模型组比较,LC低、高浓度组血清BNP水平降低,ATP水平升高,差异有统计学意义(P < 0.05),且LC高浓度组较LC低浓度组差异更明显(P < 0.05)。见表2。
2.5 心肌组织PPAR-α蛋白表达
与正常对照组[(0.790±0.030)mmol/gprot)]比较,心力衰竭模型组PPAR-α表达[(0.450±0.025)mmol/gprot]明显降低(P < 0.01)。与心力衰竭模型组比较,LC低、高浓度组PPAR-α表达[(0.630±0.040)、(0.670±0.022)mmol/gprot]升高(P < 0.05),且LC高浓度组较LC低浓度组升高更为明显(P < 0.05)。见图2。
3 讨论
心力衰竭是各种心脏病的终末阶段,近几年对心力衰竭病因及其发病机制的研究已经有了很大的进展[5-7],但死亡率仍很高。因此,对提高慢性心力衰竭患者的生存率依旧是我们需要深入研究的重要课题。BNP是诊断心力衰竭最为准确、最为敏感的指标,而且它能反映心力衰竭的严重程度。本实验的心力衰竭组大鼠BNP水平明显高于正常对照组,差异有统计学意义,提示心力衰竭模型组大鼠心功能较正常对照组大鼠明显下降,表示成功制备了大鼠心力衰竭模型。
已有研究表明细胞凋亡是心力衰竭的核心问题[8-9],而其中的能量代谢越来越受到更大的关注[10-11]。所以,改善心力衰竭患者的心肌能量代谢问题未来可能会成为治疗心力衰竭的新靶点。正常心肌细胞是由脂肪酸(FA)和葡萄糖氧化代谢供能,分别占心肌能量需求的60%~80%和20%~35%[12]。由于FA是心肌细胞能量代谢的主要来源,因此FA氧化途径较其他氧化途径对心脏功能的影响就显得更为重要。心力衰竭时FA代谢减少,心肌细胞的能量产生和利用均会出现障碍,使心肌收缩和舒张能力发生障碍,进而加剧心功能恶化[13]。
心力衰竭时心肌细胞线粒体中PPAR-α的表达是下降的[14-15],本实验通过Western blot检测PPAR-α蛋白的表达,结果显示心力衰竭组大鼠较正常对照组明显下降,差异有统计学意义,也验证了上述研究。PPAR-α能促进心肌细胞对FA的摄取、活化和代谢[16],以增加心肌FA利用率[17-18],从而提高心肌细胞能量代谢,改善心功能。在临床工作中,国内外已有文献充分证明了应用LC能提高心脏病患者的心功能,对多种原因导致的心功能不全都有治疗作用。例如Xu在2010年发现LC能显著提高由肺动脉高压所致右心功能不全患者的运动耐力、心脏收缩功能;同年,Serati等在对仅有舒张功能不全患者的研究中发现每天应用1500 mg的LC,连续3个月后,心脏彩超发现实验组心脏舒张功能显著提高,左心房明显缩小,由心力衰竭导致的呼吸困难症状也较对照组明显减轻[19-21]。本研究通过给予LC调节能量代谢,研究其对心力衰竭大鼠PPAR-α水平及ATP的影响,来探讨LC是否能通过影响PPAR-α水平来改善心力衰竭心肌细胞能量代谢,从而改善心力衰竭大鼠的心功能。本实验发现LC可显著降低大鼠血浆中BNP水平并提高ATP及PPAR-α水平,心脏彩超显示LC低、高浓度组心功能降低较心力衰竭模型组明显改善,表明LC能通过改善心肌能量代谢来明显改善心力衰竭大鼠的心功能。
综上所述,LC能改善心力衰竭大鼠心肌能量代谢,延缓心力衰竭的发生、发展,其机制可能与调控PPAR-α水平有关。但就目前的研究而言,LC通过激活PPAR-α进而改善心肌细胞能量代谢的具体作用机制还不清楚,需要在今后作进一步的探索和研究。
[参考文献]
[1] Abdoli N,Azarmi Y,Eghbal MA,et al. Mitigation of statins-induced cytotoxicity and mitochondrial dysfunction by L-carnitine in freshly-isolated rat hepatocytes[J]. Res Pharm Sci,2015,10(2):143-151.
[2] Marcovina SM,Sirtori C,Peracino A,et al. Translating the basic knowledge of mitochondrial functions to metabolic therapy:role of L-carnitine[J]. Translat Res,2013,161(2):73-84.
[3] Elinos-Calderon D,Robledo-Arratia Y,Perez-De La Cruz V,et al. Early nerve ending rescue from oxidative damage and energy failure by L:-carnitine as post-treatment in two neurotoxic models in rat:recovery of antioxidant and reductive capacities[J]. Exp Brain Res,2009,197(3):287-296.
[4] Musicco C,Capelli V,Pesce V,et al. Rat liver mitochondrial proteome:changes associated with aging and acetyl-L-carnitine treatment[J]. Proteomics,2011,74(11):2536-2547.
[5] Georgiadi A,Lichtenstein L,Degenhardt T,et al. Induction of cardiac Angptl4 by dietary fatty acids is mediated by peroxisome proliferator-activated receptor beta/delta and protects against fatty acid-induced oxidative stress[J]. Circ Res,2010,106(11):1712-1721.
[6] Robciuc MR,Skrobuk P,Anisimov A,et al. Angiopoietin-like 4 mediates PPAR delta effect on lipoprotein lipase-dependent fatty acid uptake but not on beta-oxidation in myotubes[J]. PLoS One,2012,7(10):e46212.
[7] 阿布都外里·熱合曼,艾斯卡尔·沙比提,木拉提·阿布都热合曼,等.心力衰竭的辅助循环装置治疗的新进展[J].北京生物医学工程,2015,34(2):208-212.
[8] Robinson E,Grieve DJ. Significance of peroxisome proliferator-activated receptors in the cardiovasacular system in health and disease[J]. Pharmacol Ther,2009,122(3):246-263.
[9] Kim T,Yang Q. Peroxisome-proliferator-activated receptors regulate redox signaling in the cardiovascular system[J]. World J Cardiol,2013,5(6):164-174.
[10] van Bilsen M,van Nieuwenhoven FA,van der Vusse GJ,et al. Metabolic remodelling of the failing heart:beneficial or detrimental[J]. Cardiovasc Res,2009,81(3):420-428.
[11] Sergi G,Veronese N,Fontana L,et al. Pre-frailty and risk of cardiovascular disease in elderly men and women:the Pro.V.A. study[J]. J Am Coll Cardiol,2015,65(10):976-983.
[12] 郭彩霞,马丽红,沈启明,等.心复力颗粒对阿霉素致心力衰竭大鼠PPARα及ET-1的影响[J].医学研究杂志,2015,44(5):41-44.
[13] Miyamoto T,Takeishi Y,Tazawa S,et al. Fatty acid metabolism assessed by 125I-iodophenyl 9-methylpentadecanoic acid(9MPA)and expression of fatty acid utilization enzymes in volume-overloaded hearts[J]. Eur J Clin Invest,2004,34(3):176-181.
[14] Young ME,Laws FA,Goodwin GW,et al. Reactivation of peroxisome proliferator-activated receptor alpha is associated with contractile dysfunction in hypertrophied rat heart[J]. J Biol Chem,2001,276(48):44390-44395.
[15] Lai L,Leone TC,Keller MP,et al. Energy metabolic reprogramming in the hypertrophied and early stage failing heart:a multisystems approach[J]. Circ Heart Fail,2014,7(6):1022-1031.
[16] Lee MJ,Kee KH,Suh CH,et al. Capsaicin-induced apoptosis is regulated by endoplasmic reticulum stress-and calpain-mediated mitochondrial cell death pathways[J]. Toxicology,2009,264(3):205-214.
[17] Jia Z,Xue R,Liu G,et al. HMGB1 is involved in the protective effect of the PPAR alpha agonist fenofibrate against cardiac hypertrophy[J]. PPAR Res,2014,2014:541394.
[18] Tuunanen H,Engblom E,Naum A,et al. Free fatty acid depletion acutely decreases cardiac work and efficiency in cardiomyopathic heart failure[J]. Circulation,2006,114(20):2130-2137.
[19] DiNicolantonio JJ,Lavie CJ,Fares H,et al. L-carnitine in the secondary prevention of cardiovascular disease:systematic review and meta-analysis[J]. Mayo Clin Proc,2013,88(6):544-551.
[20] Ferrari R,Merli E,Cicchitelli G,et al. Therapeutic effects of L-carnitine and propionyl-L-carnitine on cardiovascular diseases:a review[J]. Ann N Y Acad Sci,2004,1033:79-91.
[21] Tarantini G,Scrutinio D,Bruzzi P,et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction[J]. Cardiology,2006,106(4):215-223.
