水稻抗稻瘟病基因Pi25、Pi56(t)、Pit和Pita的分子鉴定
2017-03-18梅文强刘佩钎洪博文穆换青秋丙子沙
梅文强刘佩钎+洪博文+穆换青+秋丙子+沙爱华+郭嗣斌

摘要:根据抗病基因在抗病材料和感病材料中的SNP位点设计引物,通过PCR扩增或CAPS标记,对16份水稻材料中的4个抗病基因Pi25、Pi56(t)、Pit和Pita进行了鉴定。结果表明,9份水稻材料中携带Pi25,6份材料中携带Pita,1份材料中携带Pit(杂合型),无材料携带Pi56(t)。
关键词:稻瘟病;抗病基因;分子鉴定
中图分类号:S338 文献标识码:A 文章编号:0439-8114(2016)24-6604-04
DOI:10.14088/j.cnki.issn0439-8114.2016.24.070
稻瘟病菌(Magnaporthe oryzae)引起的稻瘟病是一种世界性的稻作病害,在世界各个水稻生产国每年都有不同程度的发生[1],每年因稻瘟病导致的生产损失约占总产量的10%~15%[2]。稻瘟菌小种具有高度的变异性,随着抗性基因的持续利用,病原菌群体遗传结构会不断发生变化,出现新的生理小种,从而导致小种专化抗性丧失,多数抗性品种在种植几年后会逐渐丧失抗病性[3]。因此,鉴定和发掘新的抗病基因是有效解决稻瘟病的新途径。
随着水稻品种稻瘟病抗性基因的不断鉴定,截至2014年,在不同的稻种资源中鉴定的稻瘟病主效抗病基因超过86个,微效基因(Quantitative trait loci,QTL)约350个[4,5],分布于水稻的12条染色体。这些已鉴定的稻瘟病抗性基因绝大部分都是显性的,其中45%来源于粳稻,51%来源于籼稻,剩下4%来源于野生稻[6,7]。虽然通过发掘和鉴定抗病基因能够使水稻品种对稻瘟病的抗性不断增强,但由于稻瘟菌生理小种的高度变异性,所以有必要鉴定更多的稻瘟病抗性基因,并将这些抗病基因进行聚合。
现代分子生物学和分子标记技术的发展,使得研究者可以采用方便快捷的方法鉴定植物材料中是否存在抗病基因,如单核苷酸多态性(Single nucleotide polymorphisms,SNP)和酶切扩增多态性序列(Cleaved amplified polymorphic sequence,CAPS)。SNP的原理是两条相邻的寡核苷酸与模板退火,只有当其在接合处与模板完全匹配时才会在聚合酶的作用进行扩增,因而等位基因特异性寡核苷酸能够探察多态性位点碱基的性质[8]。CAPS原理在于不同的单核苷酸多态性序列对应着不同的限制性核酸内切酶(RE)识别和切割不同位点,稻瘟病抗病基因和感病基因之间SNP的差异导致RE切割得到不同大小的片段,由此可以判断水稻材料的抗或感病性[9]。
本研究选择16份部分携带有稻瘟病抗病基因Pi1、Pi2、Pi9、Pi24、Pi25的水稻材料,采用PCR方法或CAPS标记鉴定这些材料中是否还含有新的抗病基因Pi25、Pi56(t)、Pit、Pita,以便拓宽这些材料在稻瘟病抗病育种中的应用。
1 材料与方法
1.1 材料
试验材料为广西农业科学院提供的16份水稻材料,编号为505、506、507、508、509、510、511、512、513、514、515、516、517、518、谷梅2号、三黄占。已知510、511和512携带Pi1,513和514携带Pi2,505、509、517和518携带Pi9,谷梅2号携带Pi24、Pi25,其他材料抗病基因未知。
1.2 方法
1.2.1 引物设计 以文献[10]报道的编号为ta5和t256引物对检测Pit和Pit(a)基因。其中敏感引物对序列分别为ta5-SF/R和t256-SF/R,抗性引物对序列为ta5-RF/R和t256-RF/R。检测Pi56(t)的引物对分别为CRG4-1F/R、CRG4-3F/R,采用文献[9]报道的引物序列。检测Pi25的引物对为CAP1F/R,采用文献[11]报道的引物序列。引物序列信息见表1。
1.2.2 基因组DNA提取、PCR扩增及酶切 用CTAB法提取水稻基因组DNA,1%的琼脂糖凝胶检测水稻基因组DNA。CAP1、CRG4、t256、ta5 4对引物的PCR扩增体系均为:2 μL DNA模板、0.5 U Taq聚合酶、2 μL 10×PCR缓冲液、1.6 μL dNTPs(2.5 mmol/L)、0.5 μL正向引物(10 μmol/L)和0.5 μL反向引物(10 μmol/L),ddH2O补足至20 μL。PCR反应程序:94 ℃预變性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。CRG4、t256和ta5引物的PCR扩增产物直接取10 μL在1%琼脂糖凝胶上电泳检测。取10 μL CAP1 PCR扩增产物加入2 μL酶切缓冲液,1 μL HincⅡ限制性内切酶,补ddH2O 7 μL至20 μL体系,37 ℃酶切4 h后,取10 μL酶切产物在2%琼脂糖凝胶上电泳检测。电泳结束后,用凝胶成像系统照相。
2 结果与分析
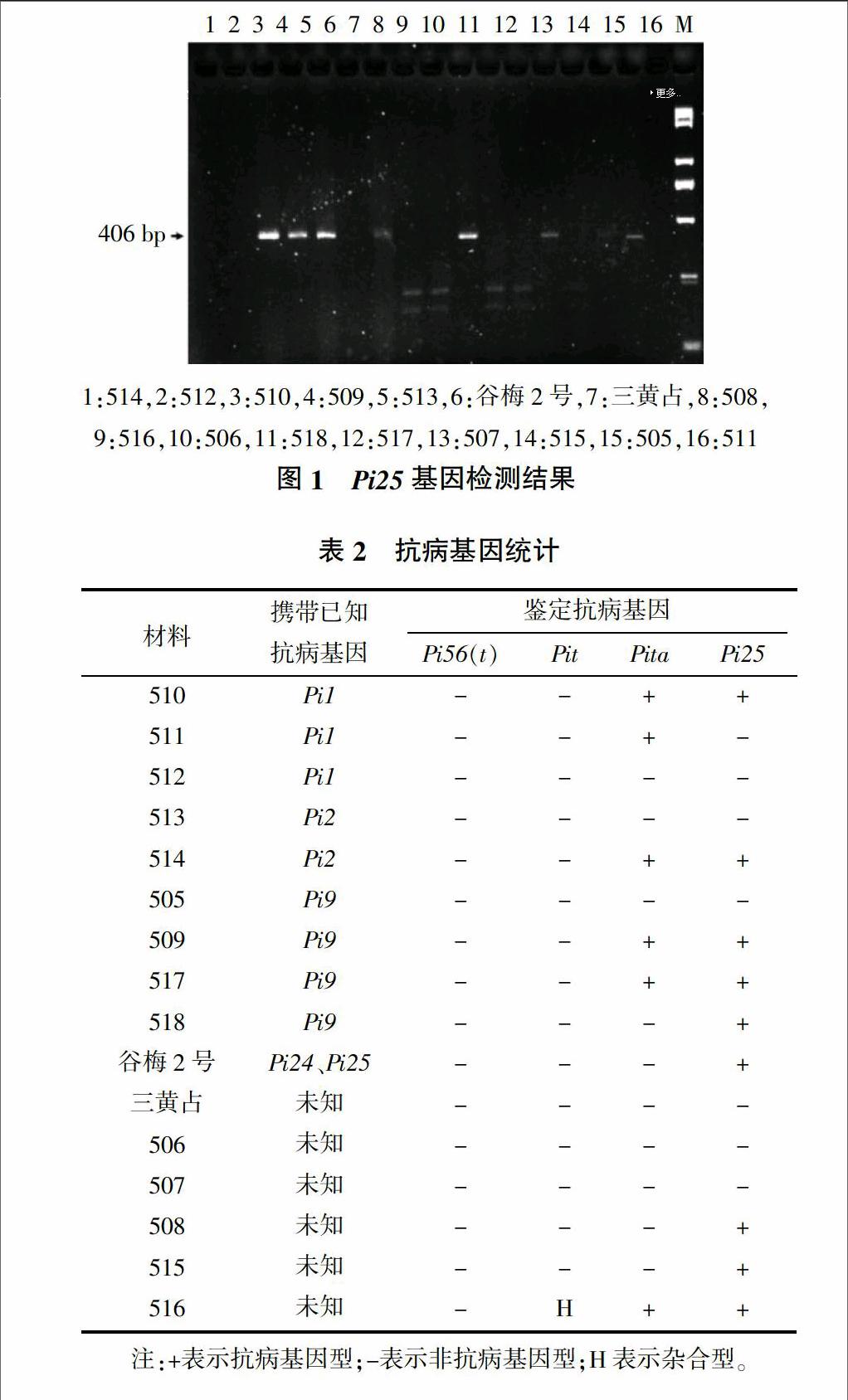
2.1 Pi25基因的检测
CAP1引物PCR扩增产物片段大小为406 bp。PCR产物用HincⅡ酶切,抗病基因位点可以切开,而感病基因位点无法切开。根据酶切产物的带型,就可以确定是否携带有Pi25抗病基因。从图1可以看出,16份水稻材料中508、516、517、518 4份材料PCR产物可以被HincⅡ酶切成小片段,另外,509、510、514、515、谷梅2号PCR产物也可以被HincⅡ识别酶切,因此这9份材料中携带有Pi25抗病基因(表2)。
2.2 Pi56基因的检测
通过两对引物组合CRG4-1和CRG4-3鉴定Pi56抗病和感病基因型。CRG4-1引物组合PCR扩增出2 kb产物为抗病基因型,扩增出1 521 bp为感病基因型。CRG4-3引物组合无PCR扩增产物为抗病基因型,扩增出725 bp为感病基因型。两对引物必须组合相互印证,才能确定是否为抗病基因型或感病基因型。从图2中可以看出,有的材料扩增出1 521 bp片段,有的扩增出725 bp片段,没有同时满足既扩增出2 kb片段又无725 bp片段的材料,故未从16份水稻材料中鉴定出Pi56(t)抗病基因型(表2)。
2.3 Pit基因的检测
通过t256抗病引物组合t256-R/RF和感病引物组合t256-R/SF对16份水稻材料进行Pit基因的鉴定,根据对应于抗病基因位点或感病位点基因引物扩增的相应片段,就可以确定是否携带有Pit抗病基因。由图3可以看出,16份水稻材料中仅有516中用抗病引物组合扩增出322 bp片段,但同时感病引物组合也扩增出322 bp片段(泳道17、18),故516中携带Pit杂合基因,其余材料均不含抗病基因(表2)。
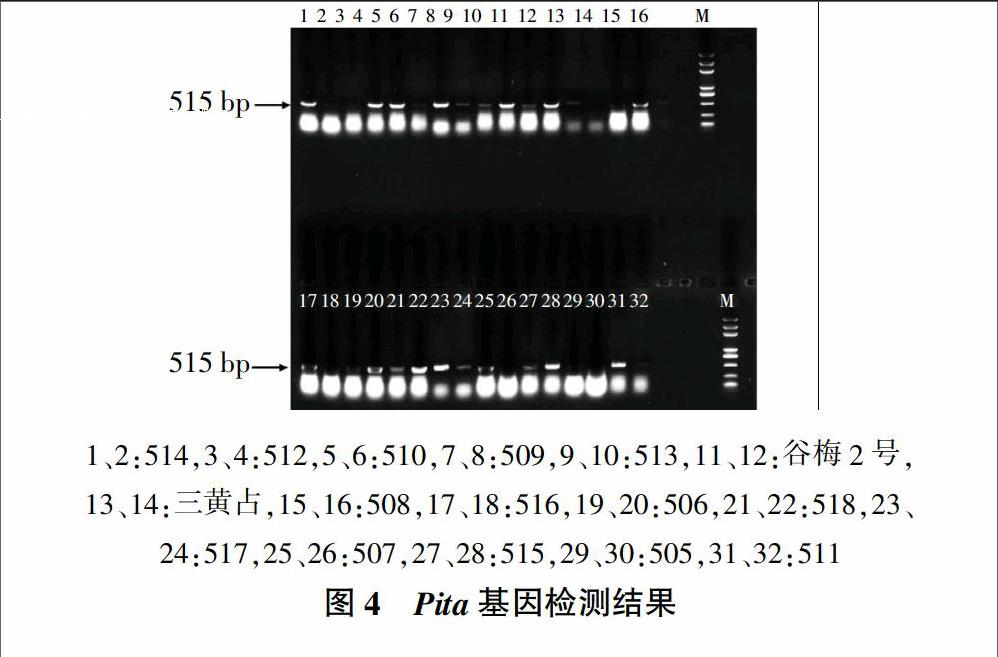
2.4 Pita基因的检测
通过ta5抗病引物组合ta5-R/RF和感病引物组合ta5-R/SF对16份水稻材料进行Pita基因的鉴定,根据对应于抗病基因位点或感病位点基因引物扩增的相应片段,就可以确定是否携带有Pita抗病基因。16份材料中509、510、511、514、516和517中仅抗病引物组合可以扩增出515 bp片段(图4),为携带纯合抗病基因型,其余材料中有些仅感病基因型引物可以扩增出产物,有些感病基因型引物和抗病基因型引物均能扩增,但抗病基因型引物扩增较弱,可能为杂合型或非特异性扩增,将这些材料都记为非抗病基因型(表2)。
3 小结与讨论
稻瘟病在世界范围内对水稻生产造成严重危害的病害,控制稻瘟病较好的方法是发掘广谱稻瘟病抗性基因或主效QTL,通过聚合育种,得到广谱持久抗病的水稻品种[11],因此,抗性基因分析以及抗源筛选就显得尤为重要[12-15]。本研究通过对16份水稻材料进行抗病基因的基因型分型和鉴定,确定了这16份材料是否携带抗病基因以及抗病基因的类型。
4个基因的引物中,用来检测Pi25的CAPS标记和用于检测Pit的引物t256扩增效果较好,能清晰地鉴别抗病基因型和感病基因型。用于检测 Pi56(t)的引物对CRG4-1和CRG4-3能准确地判定感病基因型(2对引物分别扩增出1 521 bp和725 bp为感病基因型),但鉴别抗病基因型效果稍差(CRG4-1扩增得到2 kb产物而CRG4-3扩增无725 bp产物为抗病基因型),因为三黄占为抗病基因Pi56(t)的供体,用CRG4-1和CRG4-3引物对从三黄占中均未得到PCR扩增产物,不能判定其为抗病基因型,故用这两对引物组合未能从16份材料中鉴定出抗病基因型。究其原因,可能与PCR扩增条件或其他一些未知因素影响有关。用于鉴别Pita的引物对ta5在本研究中效果也不太好,用此引物对除了能明确判定6份材料为携带纯合抗病基因型外,因为一些非特异扩增的影响,导致其他一些材料无法判定为杂合抗病基因型或感病基因型。
利用4個抗病基因的引物组合成功地从16份水稻材料中鉴定出6份材料携带Pita抗病基因型、9份材料携带Pi25抗病基因型和1份材料携带Pit抗病基因。当然,这些仅仅是从分子水平的初步鉴定结果,这些材料中的抗病基因是否发挥作用,还需要用相应的稻瘟病菌生理小种接种后进一步鉴定。
参考文献:
[1] DEANR A,TALBOT N J,EBBOLE D J,et al.The genome sequence of the rice blast fungus Magnaporthegrisea[J].Nature,2005,434:980-986.
[2] 孙国昌,杜新法,陶荣祥,等.水稻稻瘟病防治策略和21世纪研究进展[J].植物病理学报,1998,28(4):289-292.
[3] 沈 瑛,朱培良,袁筱萍.中国稻瘟病菌的遗传多样性[J].云南农业大学学报,1993,23(3):203-204.
[4] LIU Y,LIU B,ZHU X Y,et al.Fine-mapping and molecular marker development for Pi56(t),a NBS-LRR gene conferring broad-spectrum resistance to Magnaportheoryzae in rice[J].TheorAppl Genet,2013,126:985-998.
[5] BALLINI E,MOREL J,DROC G,et al. A genome-wide meta-anaiysis of rice blast resistance genes and quantitative trait loci provides new insights into partial and complete resistance[J].Molecular Plant-Microbe Interaction,2008,21(7):859-868.
[6] 杨勤忠,林 菲,冯淑杰,等.水稻稻瘟病抗性基因的分子定位及克隆研究进展[J].中国农业科学,2009,42(5):1601-1615.
[7] SHARMA T R,RAI A K,GUPTA S K,et al.Rice blast management through host-plant resistance retrospect and prospect[J].Agricultural Research,2012,1(1):37-52.
[8] 张 羽,张晓娟,杨凤娇,等.水稻稻瘟病抗性基因Pi-ta的SNP检测方法[J].中国水稻科学,2013,27(3):325-328
[9] 王惠梅,陈 洁,施勇烽,等.稻瘟病抗性基因Pi25特异性CAPS 标记的开发与验证[J].作物学报,2012,38(11):1960-1968.
[10] HAYASHI K,YOSHIDA H,ASHIKAWA I. Development of PCR-based allele-specific and InDel marker sets for nine rice blast resistance genes[J].Theor Appl Genet,2006,113:251-260.
[11] 廖新华,梁 斌,王建军,等.云南稻种抗稻瘟病品种资源的抗谱研究[J].植物病理学报,2000,30(1):90.
[12] 杜晓宇,刘建国.南充市稻瘟病重发成因分析及治理对策研究[J].现代农业科技,2008(19):151-152,155.
[13] 万贤宗.宣州区2008年杂交中稻穗颈瘟流行原因浅析[J].安徽农学通报,2009,15(1):150-151.
[14] 杨健源,陈 深,曾列先,等.稻瘟病主效抗性基因对广东省籼稻稻瘟病菌的抗性评价[J].中国水稻科学,2008,22(2):190-196.
[15] 梁康迳,黄利兴,游年顺,等.水稻系列不育系对稻瘟病的抗性分析[J].福建农林大学学报(自然科版),2010,39(5):449-454.
