离子液体[Bmim][NTf2]对CO2在碳酸二乙酯中溶解性能的强化
2017-02-28邢潇赵志军汤志刚张少峰费维扬梁向峰李红伟郭栋
邢潇,赵志军,汤志刚,张少峰,费维扬,梁向峰,李红伟,郭栋
(1河北工业大学化工学院,天津 300130;2化学工程联合国家重点实验室,清华大学化学工程系,北京 100084;3中国科学院过程工程研究所绿色过程与工程重点实验室,北京 100190)
离子液体[Bmim][NTf2]对CO2在碳酸二乙酯中溶解性能的强化
邢潇1,2,赵志军2,汤志刚2,张少峰1,费维扬2,梁向峰3,李红伟2,郭栋2
(1河北工业大学化工学院,天津 300130;2化学工程联合国家重点实验室,清华大学化学工程系,北京 100084;3中国科学院过程工程研究所绿色过程与工程重点实验室,北京 100190)
采用恒定容积法在温度范围308.15~328.15 K、压力范围0~3 MPa条件下测定了CO2在碳酸二乙酯(DEC)、离子液体[Bmim][NTf2]以及二者不同质量分数配比混合溶剂中的溶解度,并用COSMO-RS模型研究了离子液体的加入对DEC蒸气分压的影响。实验表明,在相同实验条件下CO2在[Bmim][NTf2]中的溶解度大于在DEC中的溶解度。[Bmim][NTf2]的加入可强化CO2在DEC中的溶解性能,在相同温度下CO2在混合溶剂中的溶解度随[Bmim][NTf2]质量分数增加而增大,在相同浓度的混合溶剂中CO2的溶解度随温度升高而降低。COSMO-RS模型计算表明,DEC的蒸气分压下降的分数随混合溶剂中离子液体质量分数增加而增大,而对于相同质量分数配比的混合溶剂温度对DEC的蒸气分压影响较小。
离子液体;碳酸二乙酯;二氧化碳;物理吸收;模拟
引 言
温室气体CO2的大量排放给环境造成了严重影响,已引起世界各国的极大关注[1-6]。特别是近百年来,由于化石燃料的大量使用,温室气体排放已经远远超过工业化前几千年的总和,1850年至今,大气中CO2浓度从280 cm3·m-3上升到370 cm3·m-3,全球近地面气温升高0.6~1.0℃[7]。预计到2100年,大气中CO2的浓度将上升到570 cm3·m-3,温度将升高1.9℃[8]。最新数据表明,2015年全球CO2排放量较2014年下降0.6%,约357亿吨,我国排放量较2014年则下降3.9%,变为世界第二大CO2排放国[9]。因此,对化石燃料燃烧过程中产生的CO2进行减排具有重要意义[10]。针对CO2集中排放源如电厂烟气而言,CO2捕集方式有燃烧后捕集技术、富氧燃烧分离技术和燃烧前捕集技术[7],其中燃烧前捕集技术主要用于整体气化联合循环(IGCC)发电系统,受到了广泛关注[11-12]。
目前,CO2吸收分离的方法大致可分为溶剂吸收法、吸附法、膜法、生物法等,其中溶剂吸收法是较为普遍和成熟的工业化脱碳技术[13]。溶剂吸收法分为化学性溶剂吸收法和物理性溶剂吸收法两种。化学性溶剂吸收法具有CO2吸收量大、工艺操作成熟简单的优点,但存在溶剂损耗较大且对设备腐蚀较为严重的缺陷[14-15];物理性溶剂吸收法具有能耗相对较低、操作性强等优势,更适合于CO2分压高的燃烧前脱碳技术[16]。现有物理性吸收溶剂,如碳酸丙烯酯、聚乙二醇二甲醚,涉及的工艺普遍存在设备投资大、溶剂成本和解吸能耗相对较高等缺点[17-18],因此很有必要研发高效、经济、绿色的物理性吸收溶剂。本课题组前期研究发现碳酸二乙酯比碳酸二甲酯吸收CO2效果好,但缺点是其沸点较低(约为125.8℃)[19],解吸时损失严重。
离子液体(ionic liquids)是由有机阳离子和无机或有机阴离子构成的液体,是在室温或室温附近温度下呈液态的盐类。离子液体以其独特的低挥发性、高溶解性和选择性及阴阳离子组合的可设计性[20],在较大温度、压力范围内能有效进行CO2捕集,同时能降低能耗,具有工业化捕集应用的潜力[21-22],缺点是成本较高、黏度大[23-24]。因此,在碳酸酯类溶剂中引入离子液体有望实现提高CO2吸收容量,减少溶剂损失,同时降低吸收CO2的经济成本。
本工作采用恒定容积法,在温度范围308.15~328.15 K、压力范围0~3 MPa条件下测定了CO2气体在碳酸二乙酯、离子液体[Bmim][NTf2]以及二者不同质量分数配比混合溶剂中的溶解度,利用COSMO-RS模型计算程序初步研究添加离子液体量与降低DEC蒸气分压的关系。现阶段实现COSMO-RS模型计算主要通过COSMOtherm软件或ADF (Amsterdam Density Functional)软件。关于离子液体COSMO-RS模型的计算细节请参阅北京化工大学雷志刚团队配套ADF软件编写的用户操作指南(https://www.scm.com/documentation/ Tutorials/COSMO-RS/Ionic_Liquids)。
1 实验系统
1.1 实验试剂
碳酸丙烯酯(PC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、琥珀酸二乙酯(DES)、离子液体[Bmim][NTf2]等化学试剂以及CO2气体的物性参数见表1。
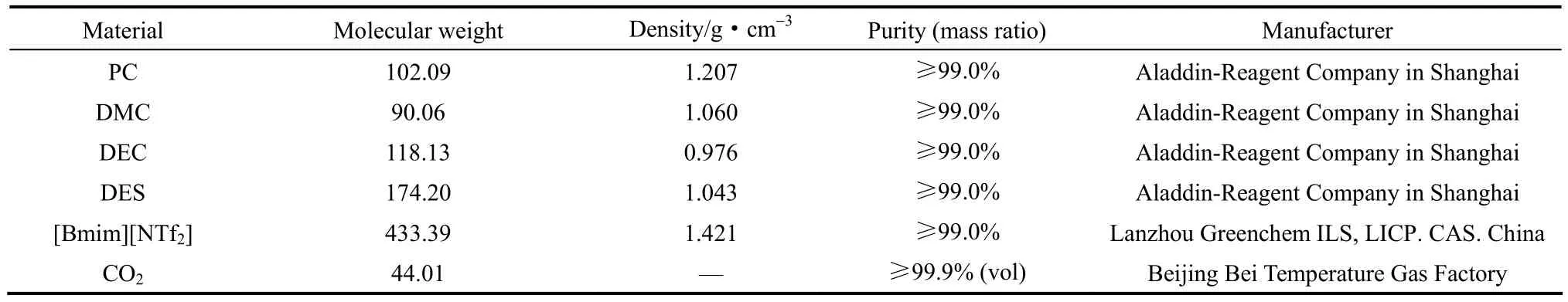
表1 实验原料的物性参数Table 1 Parameters of materials
1.2 实验装置
采用恒定容积法测定了CO2在4种碳酸酯、离子液体[Bmim][NTf2]以及[Bmim][NTf2]与DEC的混合溶剂中的溶解性能。实验装置如图1所示,主要由气体室和平衡釜组成,气体室体积为161.36 ml,平衡釜体积为 62.02 ml,最高操作压力均为15 MPa。整套装置采用循环水域加热,温度和压力测量分别采用Pt-100铂电阻温度传感器和0.5%扩散硅芯片压力传感器,测量的数据通过采集系统将传感器输出的模拟信号转换成数字信号,由计算机对其进行存储、处理,可在线监测气体室和平衡釜内的温度和压力。
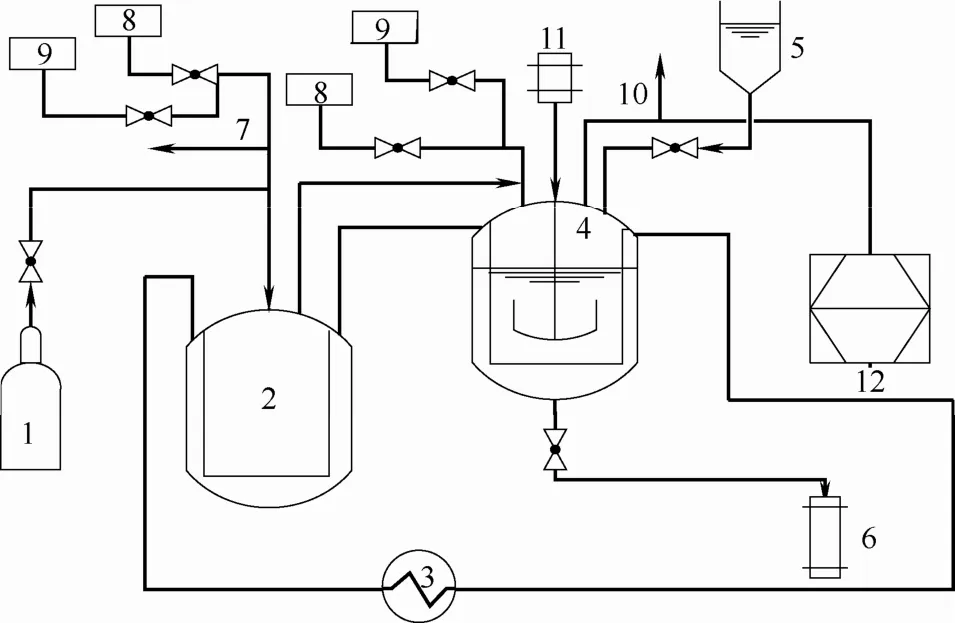
图1 实验装置Fig.1 Schematic diagram of experimental apparatus
1.3 实验步骤
打开恒温系统,使整套系统的温度恒定在所需的实验温度。将整套装置抽真空后,CO2气体由气体钢瓶注入到气体室内,稳定10 min,记录气体缓冲室的温度、压力。向平衡釜内注入一定体积的溶剂,准确记录进液量,打开电磁搅拌器,调整到适当的搅拌速率。打开气体室和平衡釜之间的连通阀,使一部分 CO2气体进入平衡釜,再次记录气体室的温度和压力。当平衡釜内的温度、压力恒定30 min保持不变时表明平衡釜达到汽液平衡,记录平衡数据。向平衡釜内再次充入更高压强的气体,重复进气步骤,进行下一平衡点的测定。实验结束后,打开泄液阀排出料液,清洗平衡釜,进行下一组实验。
1.4 实验装置可靠性的检验
为了验证实验装置的可靠性,两次测定了CO2气体在溶剂碳酸丙烯酯(PC)中的溶解度,并与文献值[25]进行对比,如图2所示。从图中可以看出:在温度297.81 K、压力高达3 MPa的条件下,CO2气体在PC中的溶解度与文献值的相对误差都小于3%,分别为 2.7%、2.6%,说明该装置可以准确测定CO2气体在液体中的溶解度。
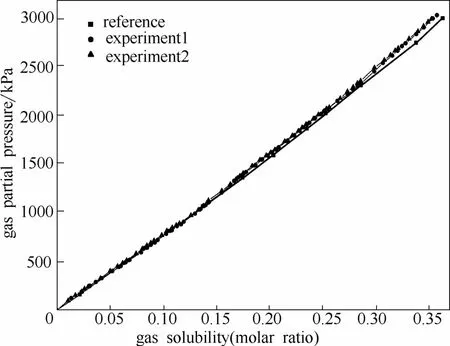
图2 CO2在PC中的实验值与文献值[25]的比较Fig.2 Comparison of experimental and reported values[25]of CO2in PC
1.5 数据处理
气体CO2在液体中的溶解性能可用平衡液相中气体的摩尔分数表示,为了尽可能减少误差,每组数据都取3次测量的平均值进行计算。
当温度一定时,CO2在各种物理溶剂中的溶解度计算方程如式(1)所示

式中,xi为CO2气体在溶剂中的摩尔分数;nl为注入反应釜内的溶剂量,mol;ng为溶剂中所含CO2量,mol。
注入反应釜内溶剂的量nl可用式(2)计算

式中,ρ为溶剂密度,kg·m-3;V为注入的溶剂体积,m3;M为溶剂的摩尔质量,kg·mol-1。
溶解的CO2物质的量ng可通过式(3)计算

式中,n1为进气前气体室中总气体量,mol;n2为进气后气体室中总气体量,mol;nE为平衡状态下反应釜内气相中的CO2量,mol。以上所需数据均可由pVT数据通过SRK方程求得。
反应釜内CO2的平衡分压pE可由式(4)得到

式中,pA为达到溶解平衡时反应釜内总压,MPa;p′为惰性气体分压,MPa;p″为平衡温度下溶剂的饱和蒸气压,MPa。
测定不同CO2平衡分压pE及其对应的CO2溶解度x,即得到特定温度下的汽液平衡曲线。
为了减小系统误差对汽液平衡数据准确性的影响,引入合成标准不确定度对计算结果进行修正。根据恒定容积法的实验原理可知系统误差主要包括温度、压力以及体积误差3部分[25],因此CO2气体溶解度在测量过程中的整体误差可由式(5)计算
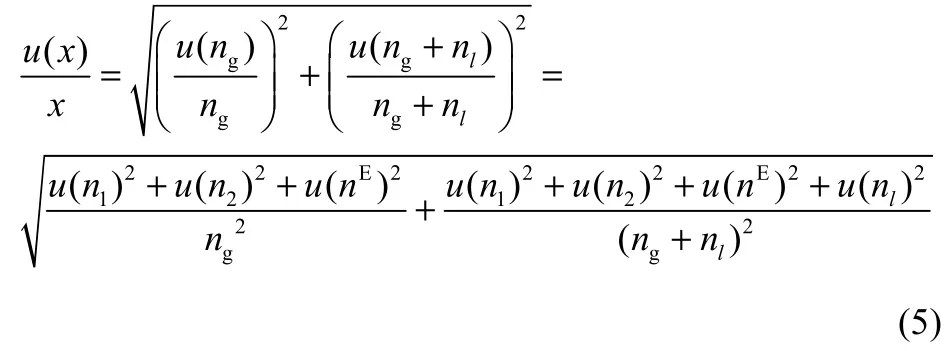
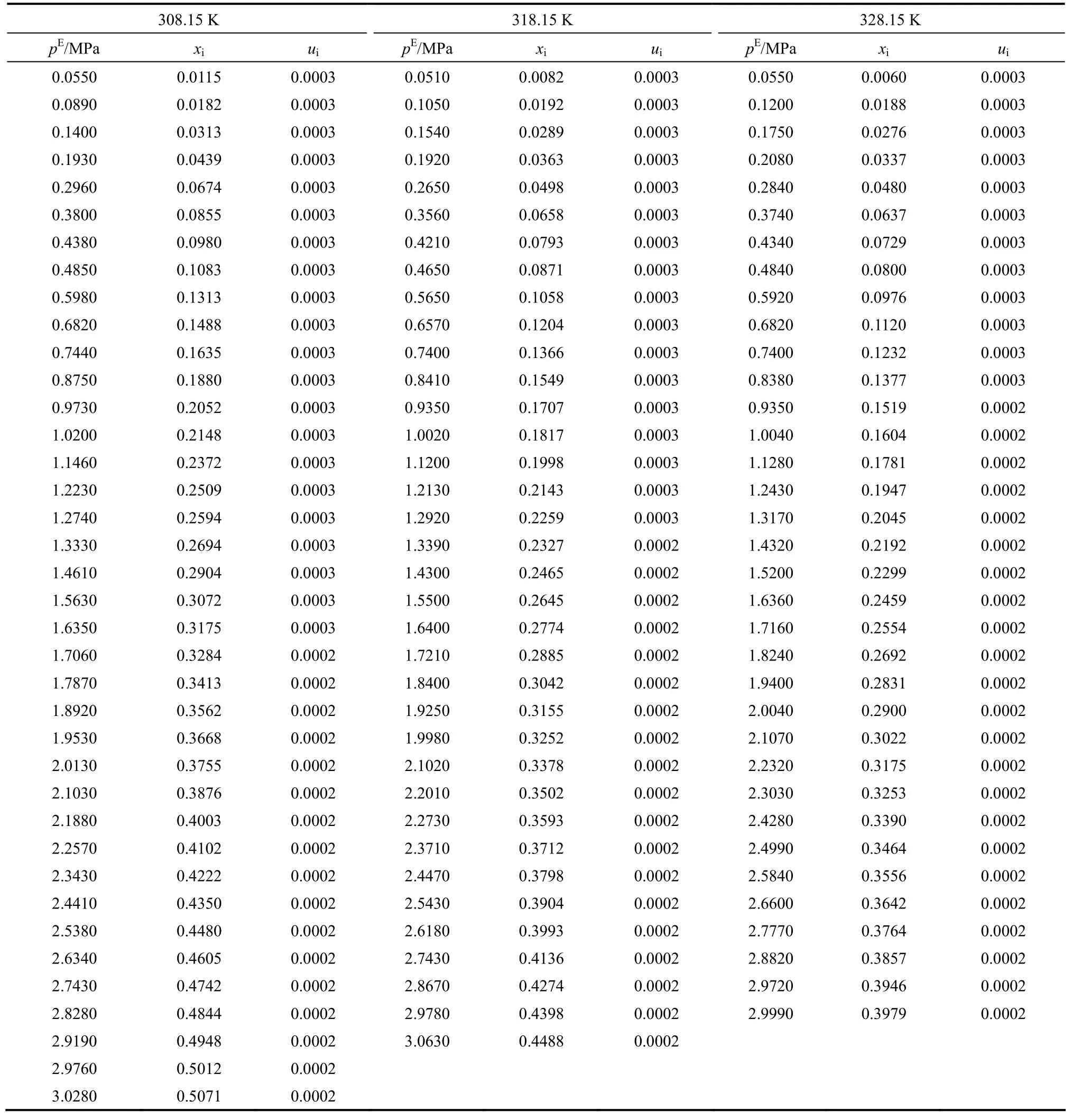
表2 CO2在纯DEC中的溶解性能Table 2 Mole fraction (xi), equilibrium partial pressure of CO2(pE), and uncertainties (ui) for binary mixture CO2+ DEC from 308.15 to 328.15 K
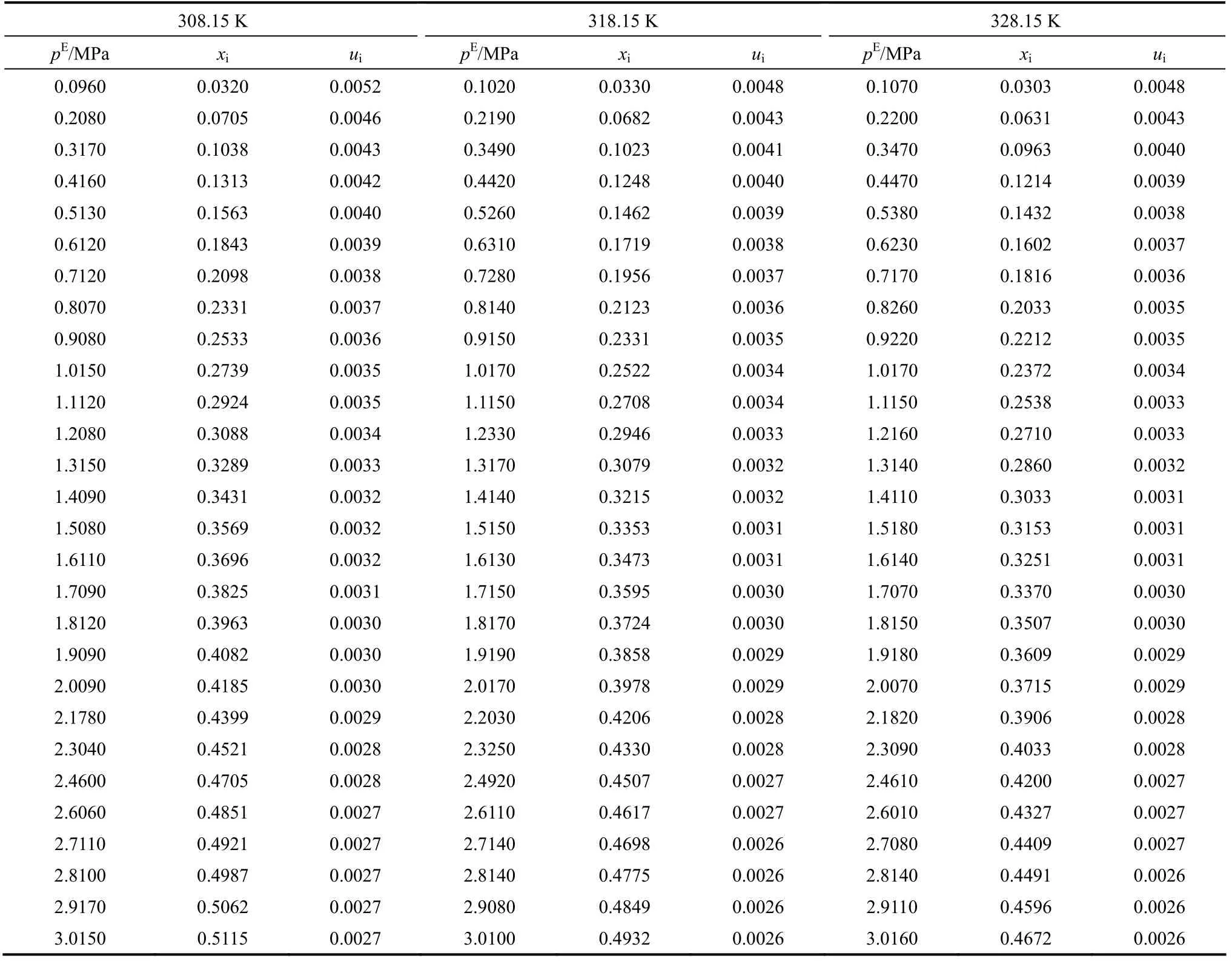
表3 CO2在[Bmim][NTf2]溶剂中的溶解性能Table 3 Mole fraction (xi), equilibrium partial pressure of CO2(pE), and uncertainties (ui) for binary mixture CO2+ [Bmim][NTf2] from 308.15 to 328.15 K
其中u(n1)、u(n2)、u(nE)均可由式(6)得到
式(6)中,温度测量系统误差为u(T) =0.1 K,气体室压力测量系统误差为u(p1)=u(p2)= 0.01 MPa,反应釜压力测量系统误差为u(pE)=0.001 MPa。
反应釜内注入溶剂量的系统误差u(nl)为

式中,ρ为溶剂的密度,kg·m-3;M为溶剂的摩尔质量,kg·mol-1;溶剂体积测量系统误差u(V)=0.05 ml。
修正后CO2气体在溶剂中的溶解度x可表示为

式中,x为CO2在溶剂中溶解度的拟合值,xi为CO2在溶剂中溶解度的测量值,u(x)为CO2溶解度的合成标准不确定度。
2 结果与讨论
2.1 4种碳酸酯吸收CO2实验
采用恒定容积法测定了CO2在308.15、328.15 K条件下在碳酸丙烯酯、碳酸二甲酯、碳酸二乙酯、琥珀酸二乙酯等纯溶剂中的溶解情况,压力范围0~3 MPa,如图3所示,图中横坐标表示平衡时CO2在液相中的摩尔分数,纵坐标表示CO2在气相中的平衡分压。
从图3可以看出,在308.15 K和328.15 K、压力范围0~3 MPa条件下,4种碳酸酯在相同压力下溶解CO2的能力从小到大依次是PC < DMC <DEC≤DES。随着温度的升高,CO2在任何一种碳酸酯中的溶解度都下降,而在相同温度下CO2气体在液相中的摩尔分数随平衡压力增大而增大。这是因为CO2在DEC中的溶解度大于在工业化的PC中的溶解度,接近在DES中的溶解度,但其经济成本约为每吨7000元,远低于DES的每吨25000元[19]。因此接下来重点针对DEC溶剂进行修饰,期望以尽可能低的经济成本达到尽可能高的CO2溶解度。
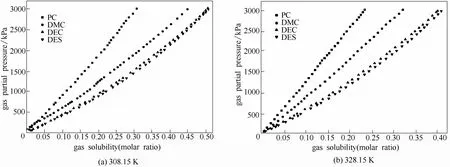
图3 CO2在4种碳酸酯中的溶解度Fig.3 Comparison of solubility of CO2in four carbonates

表4 CO2在质量分数20% [Bmim][NTf2]+80% DEC混合溶剂中的溶解性能Table 4 Mole fraction (xi), equilibrium partial pressure of CO2(pE), and uncertainties (ui) for binary mixture CO2+ 20%(mass) [Bmim][NTf2]+80% (mass) DEC from 308.15 to 328.15 K
2.2 CO2在DEC及离子液体中的溶解性能
采用同样方法测定了CO2在DEC及[Bmim][NTf2]中的溶剂度,结果如表2、表3及图4所示。
从图4可以看出,在温度范围308.15~328.15 K、压力范围0~3 MPa的实验条件下CO2在DEC以及[Bmim][NTf2]中的溶解度均随温度升高而下降;在相同温度下,CO2在DEC中的溶解度随平衡压力增大近似呈线性增高,而在[Bmim][NTf2]中的溶解度随平衡压力增大近似呈指数性增高,与文献[26]报道结果相似。实验结果还表明,在相同温度和压力下CO2在DEC中的溶解度小于在[Bmim][NTf2]中的溶解度,在相同压力下温度越高CO2在二者中的溶解度差越大。
2.3 CO2在混合物中的溶解性能
通过以上分析得知:CO2在DEC中的溶解性能接近DES,而且价格便宜,缺点是吸收量偏小、解吸时因挥发损失严重,而离子液体[Bmim][NTf2]热力学性质稳定且吸收量较DEC大,因此二者的混合溶剂有望实现提高对CO2的吸收能力同时减小溶剂损失的目的。因此接下来进一步研究了CO2在不同质量分数的混合溶剂中的溶解性能,具体如表4~表6和图5所示。
从表4~表6和图5可以看出,相同压力、相同质量分数配比条件下,CO2在3种不同混合溶剂中的溶解度均随温度升高而下降;相同温度、相同压力条件下,CO2在混合物中的溶解度随离子液体质量分数增加而增加。
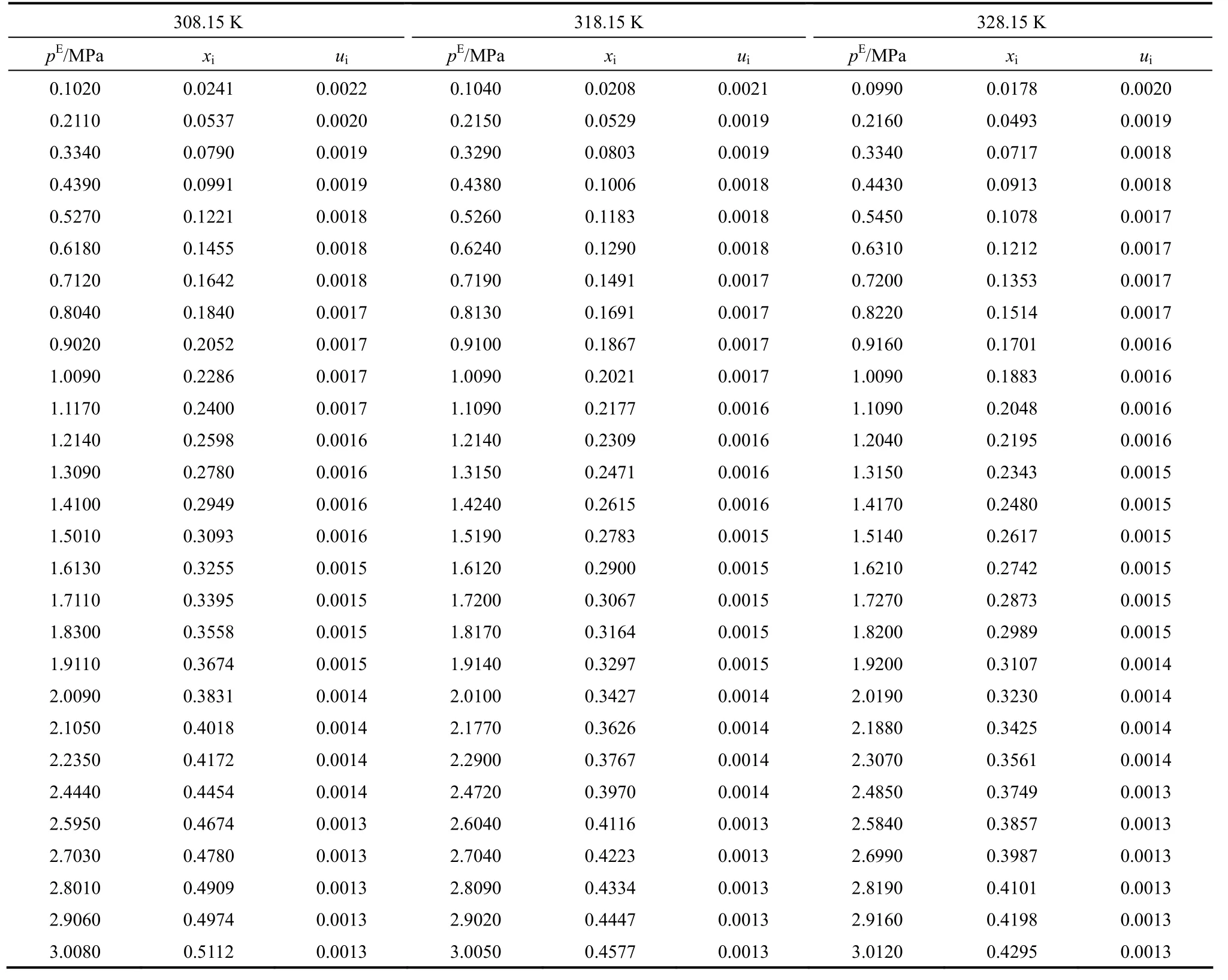
表5 CO2在质量分数50% [Bmim][NTf2]+50% DEC混合溶剂中的溶解性能Table 5 Mole fraction (xi), equilibrium partial pressure of CO2(pE), and uncertainties (ui) for binary mixture CO2+ 50%(mass) [Bmim][NTf2]+50% (mass)DEC from 308.15 to 328.15 K

图4 CO2在DEC以及[Bmim][NTf2]中的溶解度Fig.4 Comparison of solubility of CO2in DEC and [Bmim][NTf2]
2.4 离子液体对DEC蒸气分压的影响
在DEC和[Bmim][NTf2]的混合溶剂中DEC蒸气分压计算如式(9)所示

其中DEC的活度系数可由COSMO-RS[27-29]模型计算得到,计算结果见表7。
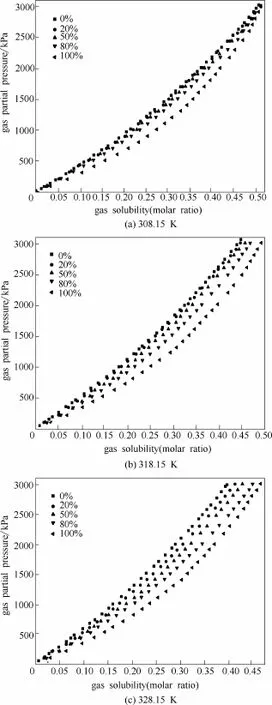
图5 CO2在DEC和 [Bmim][NTf2]不同质量配比的混合溶剂体系中的溶解性能Fig.5 Comparison of CO2solubility in mixture of DEC and [Bmim][NTf2] with different mass ratio at different temperature and pressure
由表7中的活度系数值计算得到了3种温度下不同质量比的混合溶剂中DEC在气相中的蒸气分压下降分数,见表8。
从表8可以看出:DEC蒸气分压下降的分数随离子液体在混合溶剂中质量分数增加而增大,例如温度为308.15 K时DEC蒸气分压下降的分数由混合溶剂中离子液体质量分数为w=0.2时的12.43%上升到w=0.8时的66.41%;对于相同质量分数配比的混合溶剂,随着温度的上升,DEC蒸气分压下降的分数略有下降,例如w=0.8时 DEC蒸气分压下降的分数由308.15 K的 66.41%下降到328.15 K的65.88%。
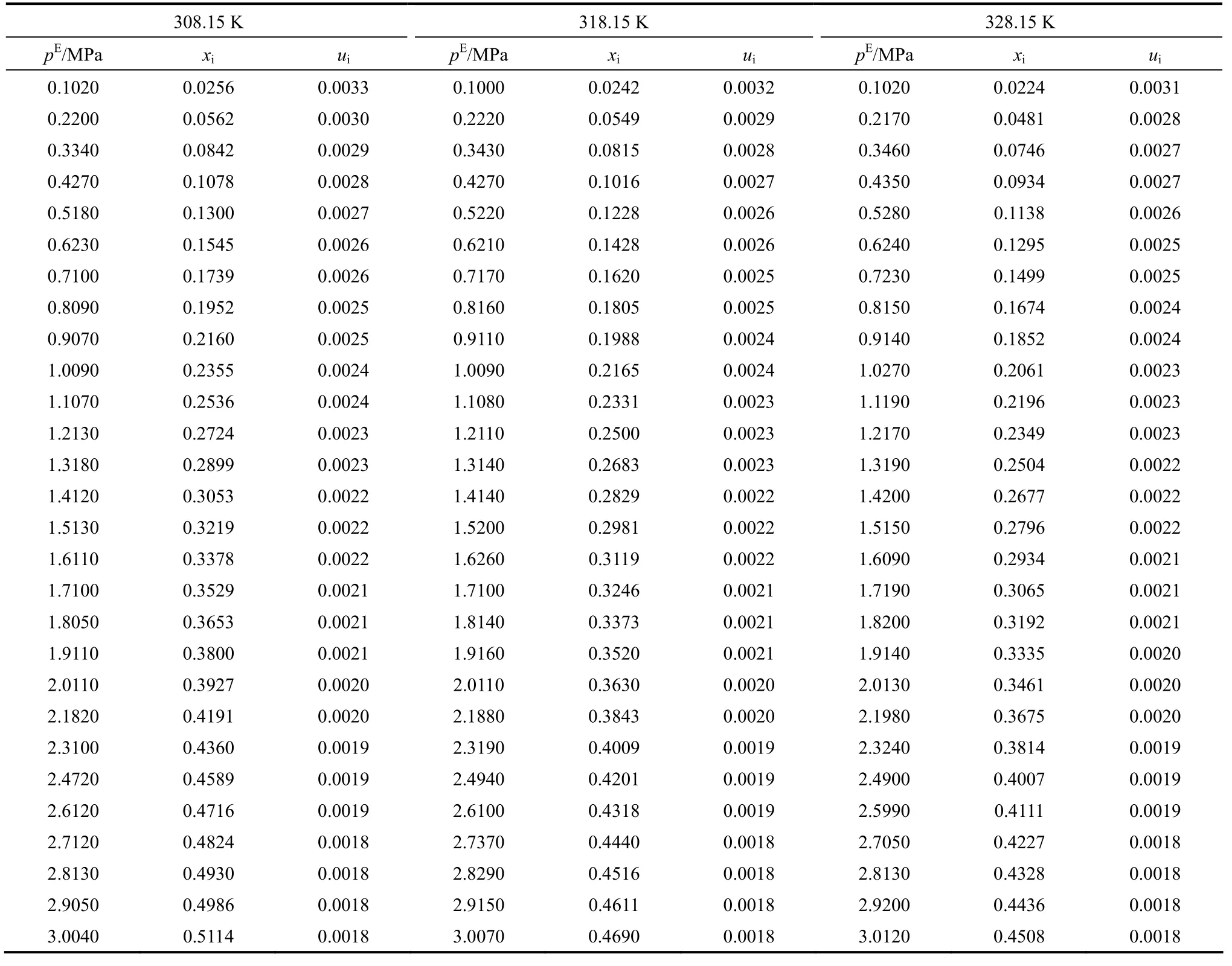
表6 CO2在质量分数80% [Bmim][NTf2]+20% DEC混合溶剂中的溶解性能Table 6 Mole fraction (xi), equilibrium partial pressure of CO2(pE), and uncertainties (ui) for binary mixture CO2+ 80%(mass)[Bmim][NTf2]+20%(mass)DEC from 308.15 to 328.15 K

表7 不同温度、不同配比下DEC的活度系数Table 7 Activity coefficient of acetone at different temperature and various contents

表8 不同温度、不同配比下DEC蒸气分压下降分数Table 8 Decrease rate of vapor pressures of mixtures in comparison with pure DEC at different temperature and various contents
3 结 论
采用恒定容积法在温度范围308.15~328.15 K,压力范围0~3 MPa的实验条件下研究了CO2在DEC、[Bmim][NTf2]及二者不同质量分数配比混合溶剂中的溶解性能,得到如下结论。
(1)在相同温度和压力下,CO2在DEC中的溶解度小于在[Bmim][NTf2]中的溶解度,而且温度越高CO2在两者中溶解度差越大。
(2)在相同温度和压力下,CO2在混合溶剂中的溶解度随[Bmim][NTf2]质量分数增加而增大。
(3)COSMO-RS模型计算结果表明,DEC的蒸气分压随离子液体在混合溶剂中质量分数增加而下降,而对于相同质量分数配比的混合溶剂温度升高对DEC蒸气分压影响较小。
[1] GISLASON S R, OELKERS E H. Carbon storage in basalt[J].Science, 2014, 344(6182): 373-374.
[2] DATTA S J, KHUMNOON C, LEE Z H,et al.CO2capture from humid flue gases and humid atmosphere using a microporous coppersilicate[J].Science, 2015, 350(6258): 302-306.
[3] SENEVIRATNE S I, DONAT M G, PITMAN A J,et al.Allowable CO2emissions based on regional and impact-related climate targets[J].Nature, 2016, 529(7587):477-483.
[4] LEE J H, LEE H J, LIM S Y,et al.Combined CO2-philicity and ordered meso-porosity for highly selective CO2capture at high temperatures[J].J. Am. Chem. Soc., 2015, 137(22): 7210-7216.
[5] LIMA F V, DAOUTIDIS P, TSAPATSIS M. Modeling, optimization and cost analysis of an IGCC plant with a membrane reactor for carbon capture[J].AIChE J., 2016, 62(5): 1568-1580.
[6] YU J W, WANG S J. Development of a novel process for aqueous ammonia based CO2capture[J]. Int. J. Greenh. Gas Control, 2015, 39: 129-138.
[7] STEWART C, HESSAMI M A. A study of methods of carbon dioxide capture and sequestration––the sustainability of a photosynthetic bioreactor approach[J]. Energy Conv. Manag., 2005, 46(3): 403-420.
[8] KHATRI R A,CHUANG S S C, SOONG Y,et al.Thermal and chemical stability of regenerable solid amine sorbent for CO2capture[J]. Energy Fuels, 2006, 20(4): 1514-1520.
[9] JACKSON R B, CANADELL J G, QUÉRÉ C L,et al.Reaching peak emissions[J]. Nat. Clim. Chang., 2016, 6(1): 7-10.
[10] ZHAO Z J, DONG H F, HUANG Y,et al.Ionic degradation inhibitors and kinetic models for CO2capture with aqueous monoethanolamine [J]. Int. J. Greenh. Gas Control, 2015, 39: 119-128.
[11] PADUREAN A, CORMOS C C, AGACHI P S. Pre-combustion carbon dioxide capture by gas-liquid absorption for integrated gasification combined cycle power plants[J]. Int. J. Greenh. Gas Control, 2012, 7: 1-11.
[12] GIUFFRIDA A, ROMANO M C, LOZZA G. Thermodynamic analysis of air-blown gasification for IGCC applications[J]. Appl. Energy, 2011, 88(11): 3949-3958.
[13] ZHANG X P, ZHANG X C, DONG H F,et al.Carbon capture with ionic liquids: overview and progress[J]. Energy Environ. Sci., 2012, 5(5): 6668-6681.
[14] LEPAUMIER H, PICQ D, CARRETTE P L. New amines for CO2capture(Ⅱ): Oxidative degradation mechanisms[J].Ind. Eng. Chem. Res., 2009, 48(20): 9068-9075.
[15] FARAMARZI L, KONTOGEORGIS G M, MICHELSEN M L,et al.Absorber model for CO2capture by monoethanolamine[J]. Ind. Eng. Chem. Res., 2010, 49(8): 3751-3759.
[16] RAYER A V, HENNI A, TONTIWACHWUTHIKUL P. High pressure physical solubility of carbon dioxide (CO2) in mixed polyethylene glycol dimethyl ethers (Genosorb 1753)[J]. Can. J. Chem. Eng., 2012, 90(3): 576-583.
[17] HOCHGESA G. Rectisol and puriso[J].Industrial and Engineering Chemistry, 1970, 62(7): 37-43.
[18] 桂霞, 王陈魏, 云志, 等. 燃烧前CO2捕集技术研究进展[J]. 化工进展, 2014, 33(7): 1895-1901. GUI X, WANG C W, YUN Z,et al.Research progress of pre-combustion CO2capture[J]. Chemical Industry and Engineering Progress, 2014, 33(7): 1895-1901.
[19] 崔敬杰. 中高压二氧化碳连续吸收解吸工艺研究[D]. 北京: 清华大学, 2014. CUI J J. Research on the continuous CO2absorption and desorption process under high pressure [D]. Beijing:Tsinghua University, 2014.
[20] SUN H, ZHOU X Q, XUE Z M,et al.Theoretical investigations on the reaction mechanisms of amine-functionalized ionic liquid [aEMMIM][BF4] and CO2[J]. Int. J. Greenh. Gas Control, 2014, 20: 43-48.
[21] BRENNECKE J E, GURKAN B E. Ionic liquids for CO2capture and emission reduction[J]. J. Phys. Chem. Lett., 2010, 1(24): 3459-3464.
[22] DAI C N, WEI W J, LEI Z G,et al.Absorption of CO2with methanol and ionic liquid mixture at low temperatures[J]. Fluid Phase Equilib., 2015, 391: 9-17.
[23] ZHAO Y S, ZHANG X P, ZENG S J,et al.Density, viscosity, and performances of carbon dioxide capture in 16 absorbents of amine plus ionic liquid + H2O, ionic liquid + H2O, and amine + H2O systems[J]. J. Chem. Eng. Data, 2010, 55(9): 3513-3519.
[24] HARPER N D, NIZIO K D, HENDSBEE A D,et al.Survey of carbon dioxide capture in phosphonium-based ionic liquids and end-capped polyethylene glycol using DETA (DETA = diethylenetriamine) as a model absorbent[J]. Ind. Eng. Chem. Res., 2011, 50(5): 2822-2830.
[25] GUI X, TANG Z G, FEI W Y. CO2capture with physical solvent dimethyl carbonate at high pressures[J]. J. Chem. Eng. Data, 2010, 55(9): 3736-3741.
[26] SAFAROV J, HAMIDOVA R, STEPHAN M,et al.Carbon dioxide solubility in 1-butyl-3-methylimidazolium-bis(trifluormethylsulfonyl) imide over a wide range of temperatures and pressures[J]. J. Chem. Thermodyn., 2013, 67: 181-189.
[27] ZHANG, X C, LIU Z P, WANG W C. Screening of ionic liquids to capture CO2by COSMO-RS and experiments[J]. AIChE J., 2008, 54(10): 2717-2728.
[28] LEI Z G, QI X X, ZHU J Q,et al.Solubility of CO2in acetone, 1-butyl-3-methylimidazolium tetrafluoroborate, and their mixtures[J]. J. Chem. Eng. Data, 2012, 57(12): 3458-3466.
[29] 乞晓曦. 常温下丙酮改性溶剂吸收CO2/H2的研究[D]. 北京: 北京化工大学, 2013. QI X X. Research on the modification of acetone as solvent for absorbing carbon dioxide or hydrogen[D]. Beijing: Beijing University of Chemical Technology, 2013.
Solubility enhancement of CO2in diethyl carbonate by ionic liquid 1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl) imide
XING Xiao1,2, ZHAO Zhijun2, TANG Zhigang2, ZHANG Shaofeng1, FEI Weiyang2, LIANG Xiangfeng3, LI Hongwei2, GUO Dong2
(1School of Chemical Engineering,Hebei University of Technology,Tianjin300130,China;2State Key Laboratory of Chemical Engineering,Department of Chemical Engineering,Tsinghua University,Beijing100084,China;3Key Laboratory of Green Process and Engineering,Institute of Process Engineering,Chinese Academy of Sciences,Beijing100190,China)
CO2solubility in diethyl carbonate (DEC), ionic liquid 1-butyl-3-methylimidazolium bis(trifluoromethylsulfonyl) imide ([Bmim][NTf2]), and their mixtures at various mass ratio were measured isovolumetrically at temperature of 308.15—328.15 K and pressure of 0—3 MPa. Effect of [Bmim][NTf2] on DEC vapor pressure was studied using COSMO-RS model. The experimental results showed that CO2solubility in DEC and [Bmim][NTf2] increased with increasing pressure at constant temperature but decreased with increasing temperature at constant pressure. CO2solubility in DEC was lower than that in [Bmim][NTf2] under same conditions, which could be enhanced by adding [Bmim][NTf2] to DEC. CO2solubility in mixture of [Bmim][NTf2] and DEC increased with increasing mass ratio of [Bmim][NTf2] at constant temperature while CO2solubility in mixtures of constant mass ratios decreased with increasing temperature. COSMO-RS simulation showed thatpercentage of DEC vapor pressure drop increased with increasing mass ratio of [Bmim][NTf2] whereas DEC vapor pressure changed a little at temperature of 308.15—328.15 K for mixtures of same mass ratio.
ionic liquids; diethyl carbonate; carbon dioxide; physical absorption; simulation
ZHAO Zhijun, zhaozj@mail.tsinghua.edu.cn; ZHANG Shaofeng, shfzhang@hebut.edu.cn
TQ 028. 1
:A
:0438—1157(2017)02—0542—10
10.11949/j.issn.0438-1157.20161033
2016-07-22收到初稿,2016-08-24收到修改稿。
联系人:赵志军,张少峰。
:邢潇(1992—),男,硕士研究生。
北京市自然科学基金项目(2164062);中国科学院过程工程研究所绿色过程与工程重点实验室开放基金课题项目(LGPE-2014-01);化学工程联合国家重点实验室开放课题项目(SKL-ChE-15A01)。
Received date: 2016-07-22.
Foundation item: supported by the Natural Science Foundation of Beijing (2164062), the Key Laboratory of Green Process and Engineering, Institute of Process Engineering (LGPE-2014-01) and the State Key Laboratory of Chemical Engineering (SKL-ChE-15A01).
