组蛋白乙酰化修饰失衡在苯肾上腺素诱导小鼠心肌肥厚中的调控作用*
2017-02-28罗孝美孙慧超
彭 昌, 罗孝美, 李 硕, 孙慧超
(遵义医学院 1附属医院儿内科, 2基础医学院生理教研室,贵州 遵义 563000; 3重庆医科大学附属儿童医院心内科,重庆 400010)
组蛋白乙酰化修饰失衡在苯肾上腺素诱导小鼠心肌肥厚中的调控作用*
彭 昌1△, 罗孝美2, 李 硕1, 孙慧超3
(遵义医学院1附属医院儿内科,2基础医学院生理教研室,贵州 遵义 563000;3重庆医科大学附属儿童医院心内科,重庆 400010)
目的: 探讨苯肾上腺素诱导小鼠心肌肥厚的组蛋白乙酰化调控机制,为防治肥厚性心肌病提供新的思路。方法: 选取健康C57BL/6小鼠,苯肾上腺素皮下注射建立小鼠心肌肥厚模型,实时荧光定量聚合酶链反应(real-time PCR)和染色质免疫共沉淀技术(chromatin immunoprecipitation, ChIP)分别检测心脏核转录因子GATA结合蛋白4(GATA binding protein 4, GATA4) mRNA表达水平及其启动子区组蛋白H3第27位赖氨酸乙酰化(H3K27ac)水平,Western blot检测小鼠心肌组织组蛋白H3K27ac、心房钠尿肽(atrial natriuretic peptide, ANP)及α-肌球蛋白重链(α-myosin heavy chain, α-MHC)的表达,HE染色及超声心动图观察小鼠心肌肥厚。结果: Western blot及ChIP-qPCR表明小鼠心肌组织组蛋白H3K27ac水平及GATA4启动子区组蛋白H3K27ac水平在苯肾上腺素组显著高于生理盐水对照组(P<0.05),GATA4及ANP的表达水平在苯肾上腺素组也显著高于生理盐水对照组(P<0.05);而组蛋白乙酰化酶抑制剂漆树酸能够降低苯肾上腺素诱导的组蛋白H3K27的高乙酰化,且GATA4 mRNA及ANP蛋白的表达水平在漆树酸处理组也显著降低(P<0.05);HE染色及超声心动图显示苯肾上腺素能够降低左室收缩末期内径(left ventricular end-systolic diameter,LVESD)和左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)并增加左室后壁(left ventricular posterior wall,LVPW)厚度,诱导小鼠心肌肥厚,而漆树酸能够提高LVESD和LVEDD并降低LVPW厚度,从而改善小鼠心肌肥厚。结论: 组蛋白乙酰化修饰失衡参与了苯肾上腺素诱导的小鼠心肌肥厚,而组蛋白乙酰化酶抑制剂漆树酸能够下调苯肾上腺素诱导的组蛋白高乙酰化进而改善小鼠心肌肥厚。
苯肾上腺素; 心肌肥厚; 高乙酰化
肥厚性心肌病是临床中较为常见的心肌病,目前尚无确实有效的治疗方法,其最重要的病变在于心肌重塑和心肌肥厚及其由此诱发的心力衰竭。心肌肥厚是一个复杂的病理生理过程,多种因素均参与其中[1-3]。研究表明[4-6],表观遗传调控在心肌重塑及心肌肥厚中发挥了关键的调控作用。本课题组前期研究发现[7],组蛋白乙酰化修饰失衡参与了孕期酒精暴露致胎鼠心肌肥厚的发生发展。但临床中引起心肌肥厚的常见因素并不是饮酒,苯肾上腺素(phenylephrine,PE)是诱导心肌肥厚模型的常用药物,但其导致心肌肥厚的机制并不完全清楚。因此,本实验通过苯肾上腺素诱导小鼠心肌肥厚模型,从表观遗传的全新角度探讨组蛋白乙酰化调控在心肌肥厚中的作用,为寻求肥厚性心肌病的有效治疗方案提供新的思路。
材 料 和 方 法
1 材料
染色质免疫共沉淀(chromatin immunoprecipita-tion,ChIP)试剂盒购于Merck Millipore;ChIP级抗组蛋白H3第27位赖氨酸乙酰化(H3 lysine 27 acetylation, H3K27ac)单克隆抗体、抗心房钠尿肽(atrial natriuretic peptide, ANP)多克隆抗体和抗α-肌球蛋白重链(α-myosin heavy chain, α-MHC)单克隆抗体购于Abcam;荧光定量PCR试剂盒及逆转录试剂盒购于TaKaRa;SDS-PAGE凝胶试剂盒购于上海碧云天生物科技有限公司,总RNA提取试剂盒购于北京百泰克生物技术有限公司。
2 方法
2.1 实验动物分组、建模及标本制备 选取8~10周SPF级C57BL/6小鼠(由重庆医科大学动物中心提供),随机分为6组:正常(normal)组、生理盐水组(normal saline,NS)、PE组、PE+二甲基亚砜(dimethylsulfoxide,DMSO)组、PE+漆树酸(anacardic acid,AA)组和AA组。苯肾上腺素组每次给予苯肾上腺素20 mg/kg皮下注射(每天2次),连续皮下注射1个月建立心肌肥厚模型;苯肾上腺素+漆树酸组除给予苯肾上腺素外,另给予漆树酸(DMSO稀释)5 mg/kg腹腔注射(每周2次),连续注射1个月,其它对照组给予相应剂量的生理盐水注射。小鼠分笼饲养,自由进食饮水。建模成功后,二氧化碳麻醉处死小鼠,75%乙醇消毒剖开胸腔分离心脏,放入-80 ℃冰箱保存备用。
2.2 ChIP 取小鼠心脏组织50 mg,将其剪碎,预冷PBS清洗后加入终浓度为1%的甲醛交联15 min后匀浆。超声破碎仪将DNA切割至200 ~1 000 bp之间。加入ChIP级抗H3K27ac抗体4 ℃摇床过夜沉淀DNA,65 ℃逆转交联8~10 h,纯化并回收DNA。用核酸蛋白测定仪测定A260/A280比值,以确定ChIP后DNA的纯度和浓度,于-20 ℃保存。
2.3 ChIP-qPCR 选取GATA4基因外显子5’端前1 000 bp序列,针对该序列设计特异性引物。引物用Primer Premier 5.0 软件设计,由宝生物公司合成。将GATA4基因产物进行梯度稀释,运用Bio-Rad CFX96 荧光定量PCR仪扩增,做出标准曲线,得到R2值和扩增效率。GATA4的上游引物序列为5’-TCTTCCACTTCCACACGTACCAA-3’,下游引物序列为5’-CAGAGGGAGTTGGGAGACGTAG-3’,产物大小为158 bp。反应条件为95 ℃ 3 min;95 ℃ 5 s、59 ℃ 15 s、68 ℃ 20 s,45个循环。所得数据用Bio-Rad CFX96荧光定量PCR仪自带基于Pfaffl原理的相对定量数据分析软件分析。
2.4 Real-time PCR 针对GATA4基因CDS核心编码区设计特异性引物,引物用Primer Premier 5.0 软件设计,由宝生物公司合成。将GATA4基因产物进行梯度稀释,运用Bio-Rad CFX96 荧光定量PCR仪扩增,做出标准曲线,得到R2值和扩增效率。GATA4的上游引物序列为5’-TGCCAACTGCCAGACTACCAC-3’,下游引物序列为5’-TCAGGTTCTTGGGCTTCCGT-3’,产物大小132 bp。反应条件为95 ℃ 30 s; 95 ℃ 5 s, 59 ℃ 30 s, 39个循环。选取β-actin作为内参照。
2.5 Western blot检测H3K27ac、ANP和α-MHC的蛋白表达 提取小鼠心肌组织胞浆蛋白和核蛋白,8%或12%SDS-PAGE凝胶分离蛋白,PVDF膜半干转膜后,5%脱脂牛奶封闭1 h分别加入兔来源抗H3K27ac、ANP和α-MHC单克隆抗体(稀释比例为1∶1 000)及GAPDH兔来源多克隆抗体(Abcam;稀释比例为1∶5 000),4 ℃孵育过夜,TBST洗涤3次,每次15 min,然后加入HRP标记山羊抗兔的Ⅱ抗(北京中杉金桥公司; 1∶5 000)脱色摇床上孵育2 h,TBST洗涤3次,每次15 min,运用Bio-Rad图像分析仪进行图像扫描;采用Quantity One 4.4软件进行分析。
2.6 超声心动图及HE染色 10 %水合氯醛腹腔麻醉小鼠后,运用Vevo 770超声仪行小鼠心脏左室收缩末期内径(left ventricular end-systolic diameter,LVESD)、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期后壁(left ventricular end-systolic posterior wall,LVESPW)厚度和左室舒张末期后壁(left ventricular end-diastolic posterior wall,LVEDPW)厚度检查。超声结束后剖开胸腔,取出心脏,置于4 %多聚甲醛溶液中4 ℃固定48 h切片进行HE染色。
3 统计学处理
采用SPSS 23.0统计软件包进行统计学分析。所有数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析,组间均数比较应用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 漆树酸逆转苯肾上腺素诱导的小鼠心肌组织中组蛋白H3K27高乙酰化
Western blot实验结果显示:小鼠心肌组织中组蛋白H3K27ac的水平在苯肾上腺素组显著高于生理盐水组,两者相比差异有统计学意义(P<0.05),而漆树酸处理组组蛋白H3K27ac水平则显著低于苯肾上腺素组(P<0.05),见图1。
2 漆树酸逆转GATA4启动子区苯肾上腺素诱导的组蛋白H3K27高乙酰化
ChIP-qPCR结果表明,心脏核转录因子GATA4启动子区组蛋白H3K27ac水平在苯肾上腺素组高于生理盐水组,差异具有统计学意义(P<0.01),而漆树酸能够显著降低心脏核转录因子GATA4启动子区组蛋白H3K27ac水平(P<0.05),见图2。
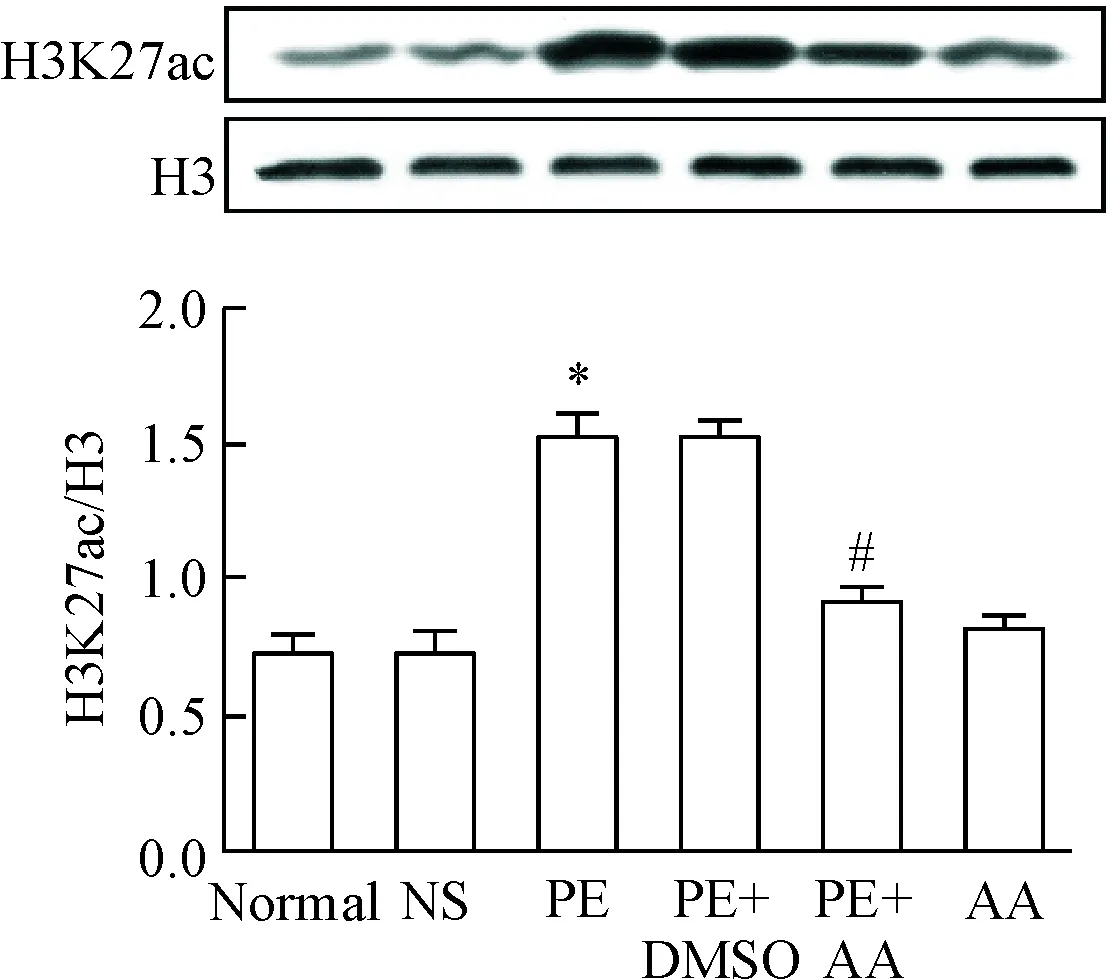
Figure 1.The level of H3K27ac in the myocardial tissues of the mice with different treatments. Mean±SD.n=6.*P<0.05vsNS group;#P<0.05vsPE group.
图1 小鼠心肌组织组蛋白H3K27ac水平的比较

Figure 2.The expression of H3K27ac in the promoter ofGATA4 detected by ChIP using anti-H3K27ac antibody. Mean±SD.n=6.**P<0.01vsNS group;#P<0.05vsPE group.
图2 用H3K27ac抗体进行ChIP检测心脏转录因子GATA4启动子区组蛋白H3K27ac的表达
3 漆树酸下调苯肾上腺素诱导的心脏核心转录因子GATA4 mRNA过表达
Real-time PCR实验结果显示,在小鼠心肌组织中心脏核心转录因子GATA4的mRNA表达水平在苯肾上腺素组处理组显著高于生理盐水组,2组相比差异有统计学意义(P<0.05),而漆树酸+苯肾上腺素组GATA4的mRNA表达量显著低于苯肾上腺素组(P<0.05)。但漆树酸+正常组GATA4的mRNA表达水平与正常组之间的差异并没有统计学显著性,见图3。
4 漆树酸下调苯肾上腺素诱导的心肌肥厚标志物ANP蛋白的过表达
Western blot实验结果显示:心肌肥厚相关基因ANP的表达量在苯肾上腺素组显著高于生理盐水组,2组相比差异有统计学意义(P<0.05);漆树酸处理后的苯肾上腺素组ANP表达量显著低于苯肾上腺素组,差异有统计学意义(P<0.05)。而α-MHC的表达水平在苯肾上腺素组及漆树酸+苯肾上腺素组均没有明显变化,见图4。
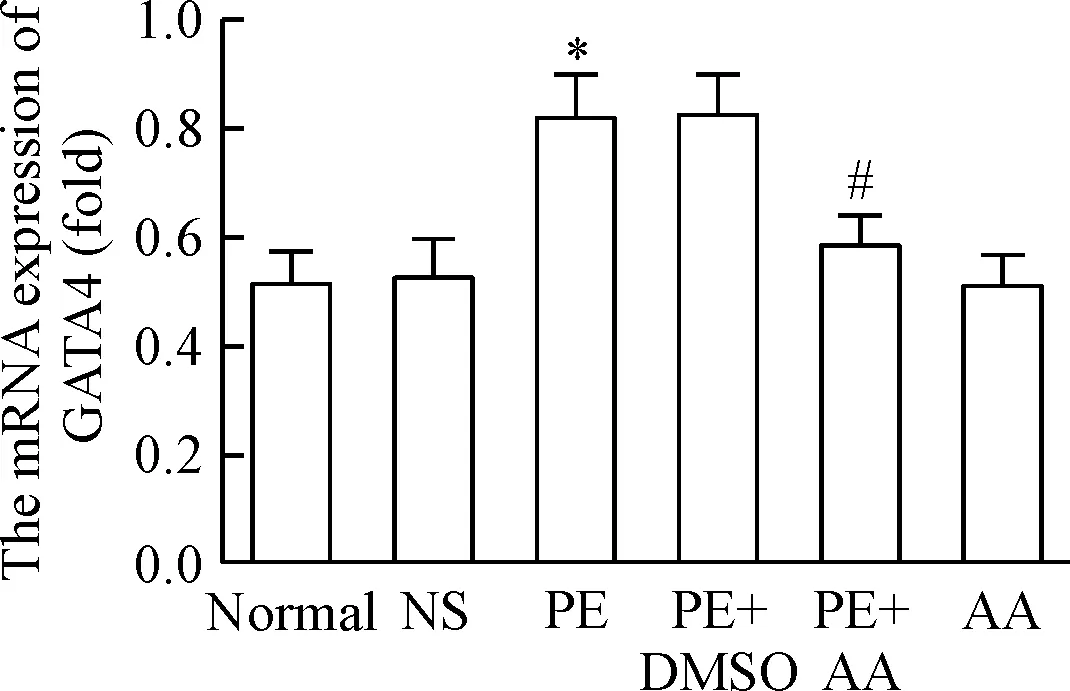
Figure 3.The mRNA expression of heart nuclear transcription factor GATA4 in the mice. Mean±SD.n=6.*P<0.05vsNS group;#P<0.05vsPE group.
图3 小鼠心脏核转录因子GATA4的mRNA表达
5 漆树酸改善苯肾上腺素诱导的小鼠心肌肥厚
HE染色组织切片的观察结果表明,苯肾上腺素处理组小鼠心脏出现明显的心肌肥厚,尤其以左心室及室间隔明显,而漆树酸处理组可以部分改善苯肾上腺素诱导的小鼠心肌肥厚。同时,小鼠心脏超声心动图发现: LVESD和LVEDD在苯肾上腺素组低于生理盐水组,而漆树酸能够部分提高LVESD和LVEDD。同时,超声心动图发现在心脏的收缩末期和舒张末期小鼠LVPW厚度在苯肾上腺素组均较生理盐水对照组明显增厚。此外,小鼠的心脏指数(心脏重量/体重,heart weight/body weight,HW/BW)在苯肾上腺素组也显著高于生理盐水对照组,而漆树酸能够减低左室壁厚度及改善心脏指数,见图5、表1。

Figure 4.The expression of ANP and α-MHC in the myocardial tissues of the mice. Mean±SD.n=6.*P<0.05vsNS group;#P<0.05vsPE group.
图4 小鼠心肌组织中ANP及α-MHC蛋白表达量的比较
讨 论
心肌肥厚是多种心脏疾患的病理过程,是发展为心功能不全或心衰的一个必经阶段[8]。目前对其发生发展的机理并不十分清楚,且尚无有效的治疗手段[9]。研究发现多种因素均参与了该病理过程的发生发展。近年研究证实表观遗传修饰参与了这一病理过程,但表观遗传学研究内容较为广泛,而其中的组蛋白乙酰化修饰是比较重要的一种翻译后调控方式[10-11]。因此,本课题组通过苯肾上腺素诱导小鼠心肌肥厚模型从表观遗传学的组蛋白乙酰化修饰的全新角度探讨心肌肥厚的发生机理。
本研究结果发现在苯肾上腺素诱导的小鼠心肌肥厚模型中,组蛋白H3K27ac水平显著高于生理盐水对照组,且心脏核转录因子GATA4启动子区域的组蛋白H3K27ac水平在苯肾上腺素组也显著增高。国内外研究[12-13]表明心脏核转录因子GATA4在心肌肥厚过程中发挥了重要作用,是一个心肌肥厚的关键转录因子;本实验结果也发现苯肾上腺素处理小鼠心肌组织中GATA4的mRNA表达水平也是显著高于生理盐水对照,且变化水平与组蛋白H3K27ac水平相一致。转录水平的变化并不代表最终下游结构基因的变化。ANP是目前较为公认的心肌肥厚标志物[14-15]。因此,我们进一步检测了ANP的蛋白表达水平,免疫印迹结果发现ANP的蛋白表达水平在心肌肥厚小鼠中也明显增高,而心脏结构蛋白α-MHC在同样的心肌样品中并没有显著变化,表明α-MHC并没有参与苯肾上腺素诱导小鼠心肌肥厚的过程。上述结果提示组蛋白H3K27乙酰化修饰失衡介导的心肌肥厚相关基因的表达异常可能参与了心肌肥厚这一病理过程。但是组蛋白修饰位点繁多(如H3K4、H3K9等),其它位点的修饰是否也参与了苯肾上腺素诱导的心肌肥厚尚有待进一步研究。

Figure 5.The images of HE staining and echocardiography in the heart of the mice.
图5 小鼠心脏HE染色及超声心动图的观察

表1 小鼠超声心动图及心脏指数比较
*P<0.05vsNS group;#P<0.05vsPE group.
为了进一步证实组蛋白乙酰化修饰失衡参与了心肌肥厚的发生发展,组蛋白乙酰化酶特异性抑制剂漆树酸被用于干预苯肾上腺素处理小鼠,结果表明漆树酸处理组小鼠组蛋白H3K27ac水平及GATA4、ANP表达水平与苯肾上腺素组相比均明显降低。与国外报道的组蛋白乙酰化酶抑制剂姜黄素能够逆转心肌肥厚相一致[16]。同时,本研究还从组织切片及心脏功能方面探讨了漆树酸对心肌肥厚的影响,HE染色及超声心动图结果表明组蛋白乙酰化酶抑制剂漆树酸能够显著改善小鼠心脏左室后壁厚度及LVESD和LVEDD,进一步表明组蛋白乙酰化修饰失衡参与了苯肾上腺素诱导的小鼠心肌肥厚的发生,提示组蛋白乙酰化酶抑制剂漆树酸可以作为心肌肥厚防治的候选药物之一。但该组蛋白乙酰化修饰的上游信号通路及哪些组蛋白乙酰化酶的亚型参与了心肌肥厚的发生仍不十分清楚,尚有待进一步研究明确。
[1] Samak M, Fatullayev J, Sabashnikov A, et al. Cardiac hypertrophy: an introduction to molecular and cellular basis[J]. Med Sci Monit Basic Res, 2016, 22:75-79.
[2] 黄金贤, 罗佳妮, 刘培庆, 等. AMPK/PPARα/SCAD信号途径对心肌肥大的调控研究[J]. 中国病理生理杂志, 2014, 30(5):769-778.
[3] 黄秋菊, 黄金贤, 罗佳妮, 等. ERK1/2/PPARα/SCAD信号途径对生理性和病理性心肌肥大的调控[J]. 中国病理生理杂志, 2014, 30(8):1427-1432.
[4] Greco CM, Condorelli G. Epigenetic modifications and noncoding RNAs in cardiac hypertrophy and failure[J]. Nat Rev Cardiol, 2015, 12(8):488-497.
[5] Ooi JY, Tuano NK, Rafehi H, et al. HDAC inhibition attenuates cardiac hypertrophy by acetylation and deacetylation of target genes[J]. Epigenetics, 2015, 10(5):418-430.
[6] 曹珊珊, 李瑞芳, 方伟进, 等. 组蛋白去乙酰化酶8对肾性高血压大鼠心肌肥大的影响[J]. 中国病理生理杂志, 2012, 28(2):253-257.
[7] Peng C, Zhang W, Zhao W, et al. Alcohol-induced histone H3K9 hyperacetylation and cardiac hypertrophy are reversed by a histone acetylases inhibitor anacardic acid in developing murine hearts[J]. Biochimie, 2015, 113:1-9.
[8] Heinzel FR, Hohendanner F, Jin G, et al. Myocardial hypertrophy and its role in heart failure with preserved ejection fraction[J]. J Appl Physiol (1985), 2015, 119(10):1233-1242.
[9] Hamada M, Ikeda S, Shigematsu Y. Advances in medical treatment of hypertrophic cardiomyopathy[J]. J Cardiol, 2014, 64(1):1-10.
[10]Cao Y, Lu L, Liu M, et al. Impact of epigenetics in the management of cardiovascular disease: a review[J]. Eur Rev Med Pharmacol Sci, 2014, 18(20):3097-3104.
[11]Kang SH, Seok YM, Song MJ, et al. Histone deacetylase inhibition attenuates cardiac hypertrophy and fibrosis through acetylation of mineralocorticoid receptor in spontaneously hypertensive rats[J]. Mol Pharmacol, 2015, 87(5):782-791.
[12]蒋青松, 黄燮南, 周岐新, 等. 钙调神经磷酸酶信号通路参与PGF2α诱导的心肌细胞肥大[J]. 中国病理生理杂志, 2007, 23(7):1272-1276.
[13]Mehta G, Kumarasamy S, Wu J, et al. MITF interacts with the SWI/SNF subunit, BRG1, to promote GATA4 expression in cardiac hypertrophy[J]. J Mol Cell Cardiol, 2015, 88:101-110.
[14]Xu WP, Yao TQ, Jiang YB, et al. Effect of the angiotensin II receptor blocker valsartan on cardiac hypertrophy and myocardial histone deacetylase expression in rats with aortic constriction[J]. Exp Ther Med, 2015, 9(6):2225-2228.
[15]Cannon MV, Sillje HH, Sijbesma JW, et al. LXRalpha improves myocardial glucose tolerance and reduces cardiac hypertrophy in a mouse model of obesity-induced type 2 diabetes[J]. Diabetologia, 2016, 59(3):634-643.
[16]Li HL, Liu C, de Couto G, et al. Curcumin prevents and reverses murine cardiac hypertrophy[J]. J Clin Invest, 2008, 118(3):879-893.
(责任编辑: 林白霜, 罗 森)
Role of histone acetylation modification imbalance in regulation of cardiac hypertrophy induced by phenylephrine
PENG Chang1, LUO Xiao-mei2, LI Shuo1, SUN Hui-chao3
(1DepartmentofPediatrics,TheAffiliatedHospital,2DepartmentofPhysiology,SchoolofBasicMedicalSciences,ZunyiMedicalCollege,Zunyi563000,China;3DepartmentofHeartCenter,Children’sHospitalofChongqingMedicalUniversity,Chongqing400010,China.E-mail:pengchang_2006@126.com)
AIM: To investigate the regulatory mechanism of histone acetylation on cardiac hypertrophy induced by phenylephrine, and to provide a new idea for preventing and curing hypertrophic cardiomyopathy.METHODS: Phenylephrine was given by continuous subcutaneous injection for modeling cardiac hypertrophy in C57BL/6 mice. The le-vel of histone H3 lysine 27 acetylation (H3K27ac) in the promoter of cardiac nuclear transcription factorGATA4 and the mRNA expression of GATA4 were identified by chromatin immunoprecipitation (ChIP) and real-time PCR, respectively. Meanwhile, the protein expression of histone H3K27ac, atrial natriuretic peptide (ANP) and α-myosin heavy chain (α-MHC) was determined by Western blot. Cardiac hypertrophy in the mice was observed by HE staining and echocardiography. RESULTS: The results of Western blot showed that the level of histone H3K27ac in phenylephrine group was significantly increased compared with normal saline group (P<0.05), and ChIP-qPCR data showed that the level of histone H3K27ac in the promoter ofGATA4 was increased significantly in the same samples (P<0.05). The expression levels of GATA4 mRNA and ANP protein in phenylephrine group were apparently increased compared with normal saline group (P<0.05). However, histone acetylase inhibitor anacardic acid attenuated histone H3K27 hyperacetylation induced by phenylephrine, and downregulated the over-expression of GATA4 and ANP in the heart of the mice (P<0.05). HE staining and echocardiography data showed that phenylephrine apparently increased left ventricular posterior wall thickness and decreased left ventricular end-systolic diameter and left ventricular end-diastolic diameter, while anacardic acid also reversed these indexes that mentioned above and attenuated cardiac hypertrophy induced by phenylephrine in the mice.CONCLUSION: Histone acetylation modification imbalance is involved in cardiac hypertrophy induced by phenylephrine, and the histone acetylase inhibitor anacardic acid decreases histone hyperacetylation induced by phenylephrine and attenuates car-diac hypertrophy in the mice.
Phenylephrine; Cardiac hypertrophy; Hyperacetylation
1000- 4718(2017)02- 0227- 06
2016- 08- 30
2016- 11- 23
国家自然科学基金资助项目(No. 81560040);遵义医学院博士启动基金资助项目(院字(2015)4号);遵义医学院与科技学院大学生创新训练项目(遵医科院【2015】3108号)
R363.2
A
10.3969/j.issn.1000- 4718.2017.02.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0851-28608344; E-mail: pengchang_2006@126.com
