番茄红素对原代小鼠皮质神经元的保护作用及机制研究*
2017-02-28黄翠芹范冲竹甘丹卉赵佳仪陆大祥
黄翠芹, 李 勤, 范冲竹, 甘丹卉, 李 安, 赵佳仪, 王 珍, 陆大祥
(暨南大学医学院病理生理学系,脑科学研究所,国家中医药管理局三级科研实验室,广东 广州 510632)
番茄红素对原代小鼠皮质神经元的保护作用及机制研究*
黄翠芹, 李 勤▲, 范冲竹, 甘丹卉, 李 安, 赵佳仪, 王 珍, 陆大祥△
(暨南大学医学院病理生理学系,脑科学研究所,国家中医药管理局三级科研实验室,广东 广州 510632)
目的: 观察番茄红素(lycopene)对氧化损伤的原代皮质神经元的保护效应并探讨其作用机制。方法: 采用原代细胞培养技术体外分离培养小鼠皮质神经元,通过免疫荧光染色法检测微管相关蛋白2 (microtubule-associated protein 2,MAP-2)的表达进行鉴定。将神经元分为4组:正常神经元组、叔丁基过氧化氢(tert-butyl hydroperoxide,t-BHP)处理组、t-BHP+lycopene处理组和lycopene处理组,培养24 h,采用MTT法检测各组神经元的活力;采用流式细胞技术检测各组神经元内ROS的水平;Western blot法检测各组神经元Bax、Bcl-2、caspase-3、cleaved caspase-3及细胞色素C蛋白表达的变化。结果: Lycopene能明显提高t-BHP处理的神经元活性,降低t-BHP处理的神经元内ROS含量,同时上调Bcl-2蛋白的表达,降低Bax、cleaved caspase-3和细胞色素C蛋白的表达(P<0.05)。结论: Lycopene能够对抗t-BHP诱导的原代皮质神经元的损伤,抑制神经元凋亡,其机制可能与降低神经元内ROS的水平及上调Bcl-2的表达有关。
番茄红素; 脑皮质神经元; 叔丁基过氧化氢; 氧化应激
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性的神经退行性疾病,临床上表现为记忆、认知功能减退、行为异常和语言功能障碍[1]。其病理特点为神经元细胞外β-淀粉样蛋白聚集形成老年斑、细胞内异常磷酸化的Tau蛋白聚集形成神经纤维缠结、神经元的缺失和脑血管淀粉样变性[2]。随着全球人口老龄化增加,阿尔茨海默病发病率正逐年上升,由阿尔茨海默病所导致的经济负担和社会问题也日益严重,如今已成为全人类共同面临的巨大挑战之一。番茄红素(lycopene)是一种含有 11个共扼双键及2个非共扼双键的类胡萝卜素,是一种抗氧化剂,具有极强的清除自由基的能力,其淬灭单线态氧的速率常数是维生素E的100倍[3]。研究发现,番茄红素不仅具有抗癌、抑癌、降低胆固醇、预防心血管疾病与动脉硬化的作用,还具有增强免疫、延缓衰老及神经保护等多种功能[4-7]。叔丁基过氧化氢(tert-butyl hydroperoxide, t-BHP)是一种稳定的氧化损伤试剂,在体外实验中可引起氧化应激,导致细胞内ROS水平升高,线粒体功能障碍,DNA损伤及神经元凋亡等[8-9]。这些现象与AD的氧化应激损伤机制相符。近年来,t-BHP诱导的神经元常被用于模拟神经退行性疾病的细胞模型。因此,本研究以原代培养的小鼠皮层神经元为研究对象,运用 t-BHP建立神经元氧化损伤模型,研究lycopene对t-BHP诱导的原代皮质神经元的保护作用及其相关机制,从而提升番茄红素在阿尔茨海默病防治方面的运用价值。
材 料 和 方 法
1 动物
C57新生小鼠(24 h内),SPF级,雌雄不限,购买于南方医科大学实验动物中心,许可证编号:44002100007299。
2 主要试剂
番茄红素(纯度≥95%)购买于广东省药品检验所;Neurobasal培养液、B27添加剂、多聚赖氨酸、Hanks平衡盐溶液、胰蛋白酶、谷氨酰胺、高糖培养基和DMEM/F12 培养基均购自Gibco;t-BHP购自Sigma;微管相关蛋白(microtubule-associated protein 2, MAP-2)、胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、Bax、Bcl-2、caspase-3、cleaved caspase-3及细胞色素C蛋白的Ⅰ抗购自CST; TIRTC标记山羊抗兔以及FITC标记的山羊抗小鼠Ⅱ抗购自北京博奥森生物技术有限公司;ROS检测试剂盒购自碧云天;其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1 原代小鼠皮层神经元的分离和培养 用12.5 mg/L多聚赖氨酸包被96孔培养板、24孔培养板以及6孔培养板,于超净台中过夜。实验前,用灭菌的去离子水洗板,晾干备用。75%的乙醇消毒新生鼠头部,冰冻麻醉,无菌条件下打开颅腔取出脑组织置于盛有5 mL高糖培养基的皿中,分离出皮质,用精细镊在显微镜下去除脑膜和血管后,将皮质移入无菌的盛有2 mL高糖培养基的玻璃瓶中,以上步骤均在4 ℃条件下进行。使用眼科剪将皮质剪碎至直径0.5 mm左右,向组织内加入1 mL 0.125%的胰蛋白酶,消化10 min,加入5 mL添加血清的DMEM/F12培养基终止其消化,轻柔吹打数次,组织悬液通过200目筛网进行过滤,收集滤液,离心1 000 r/min、5 min,弃上清。向细胞沉淀中加入DMEM/F12完全培养基(含 10% FBS)制成细胞悬液,台盼蓝染色计数,调整细胞密度为每孔2×104细胞接种于96孔培养板中,每孔1.5×105细胞接种于24孔培养板中,每孔7×105细胞接种于6孔培养板中,置于37 ℃、5% CO2、饱和湿度的培养箱中培养。接种4 h时,用原代神经元Neurobasal完全培养基(含2% B27)全量换液。培养第3天,原代神经元完全培养基半量换液。培养第7天的细胞用于实验。
3.2 MAP-2免疫荧光染色鉴定神经元 培养第7天的神经元,弃去培养基,用PBS洗2次,每次3 min。多聚甲醛溶液室温固定神经元30 min,弃多聚甲醛后PBS洗细胞2次。0.1% Triton X-100室温透化处理细胞10 min(24孔板每孔加入500 μL,6孔板每孔加入1 000 μL)。0.1% BSA 室温封闭60 min。采用抗体稀释液稀释MAP-2的Ⅰ抗至工作浓度(1∶100),置于湿盒内,4 ℃冰箱孵育过夜。第2天,除去Ⅰ抗,用PBS洗3次,每次5 min。标记的Ⅱ抗用封闭液稀释至工作浓度(1∶200),湿盒内室温孵育Ⅱ抗60 min。除去Ⅱ抗,用PBS洗细胞3次,每次5 min。滴加DAPI试剂,室温10 min,PBS 洗3次,每次5 min。抗荧光封片剂封片后,荧光显微镜下观察结果并拍照。
3.3 MTT检测神经元活力 将神经元以每孔2×104的密度接种于96孔板中。第7天分为对照组及不同浓度番茄红素组,每组6个复孔。继续培养24 h后吸出培养基,每孔加终浓度为5 g/L的MTT溶液,继续置于培养箱中孵育4 h。吸出培养基,每孔加入150 μL DMSO,振荡10 min,在Bio-Rad 酶标仪570 nm 波长处测定各孔吸光度(A)值,对该值进行数据分析,评价细胞活力,实验重复3 次。
3.4 氧化损伤模型的建立 将神经元以每孔2×104的密度接种于96孔板中,第7天换液时按照以下方式进行分组:对照组及不同浓度t-BHP组,每组6个复孔,加入t-BHP继续培养24 h后吸出培养基。按上述3.3步骤,MTT检测细胞活力,确定t-BHP作用浓度。
3.5 实验分组 将原代皮质神经元以每孔7×105的密度接种于6孔板中。第7 天换液时分为4组,对照组(正常神经元组):不加任何处理因素;模型组(t-BHP处理组):加入t-BHP作用于原代皮层神经元24 h;t-BHP+lycopene处理组:加入番茄红素预保护4 h 后,再加入t-BHP共作用于原代皮层神经元24 h;lycopene处理组:番茄红素作用原代皮质神经元24 h。
3.6 流式细胞术检测神经元内ROS的水平 将原代皮质神经元以每孔7×105的密度接种于6孔板中。第7天换液时分为对照组、t-BHP处理组、t-BHP+lycopene处理组和lycopene处理组,培养24 h后,弃去培养基,PBS洗2次,每孔加入1 mL胰酶,轻柔吹打使之悬浮于消化液中,然后加入含有血清的DMEM/F12 培养基终止消化。收集消化好的细胞进行离心,1 000 r/min离心5 min。弃去上清,各组加入由无血清DMEM/F12配制的终浓度为10 μmol/L的DCFH-DA 荧光探针,置于37 ℃孵育15 min,无血清DMEM/F12洗3次,1 000 r/min 离心5 min,弃上清,最后用300 μL PBS重悬细胞,流式细胞仪检测。实验重复3次。
3.7 Western blot 检测细胞内蛋白表达 按照步骤3.5方法处理各组细胞后,弃去旧培养基,用预冷的PBS洗2次,每孔加入80 μL细胞裂解液,冰上裂解30 min,每10 min用细胞刮刮1次细胞,使裂解液与细胞充分混匀,收集混合液,12 000 r/min、4 ℃离心15 min,收集上清液,BCA法测定蛋白浓度。加入相应的loading buffer后,100 ℃变性10 min,分装后放入-80 ℃冰箱待用。以上样品,每组取20 μg蛋白上样,以12% SDS-PAGE分离蛋白,用半干转法将蛋白质转移至PVDF膜;5%的脱脂奶粉室温封闭1 h;分别加入兔抗小鼠Bax、Bcl-2、caspase-3、cleaved caspase-3及细胞色素C蛋白的Ⅰ抗(1∶1 000稀释),4 ℃孵育过夜;TBST溶液洗涤3次,每次10 min,加入辣根过氧化物酶标记的羊抗兔Ⅱ抗(1∶5 000稀释),室温孵育1 h;TBST溶液洗涤3次,每次10 min;用增强化学发光法显色、曝光;使用Quantity One软件对结果进行分析;以β-actin或GAPDH为内参照进行校正。实验重复3次。
4 统计学处理
使用SPSS 13.0统计软件进行统计学分析,数据用均数±标准差(mean±SD)表示,组间比较用单因素方差分析(one-way AN0VA),组间两两比较用Turkey法检验,以P<0.05为差异有统计学意义。
结 果
1 原代皮质神经元的培养与鉴定
采用细胞免疫荧光法对体外培养7 d的新生小鼠原代皮质神经元进行MAP-2染色鉴定,MAP-2为神经微管结合蛋白,是神经元的特异性标志物,可见所培养的细胞90%以上都为神经元,纯度较高,可用于后续实验,见图1。
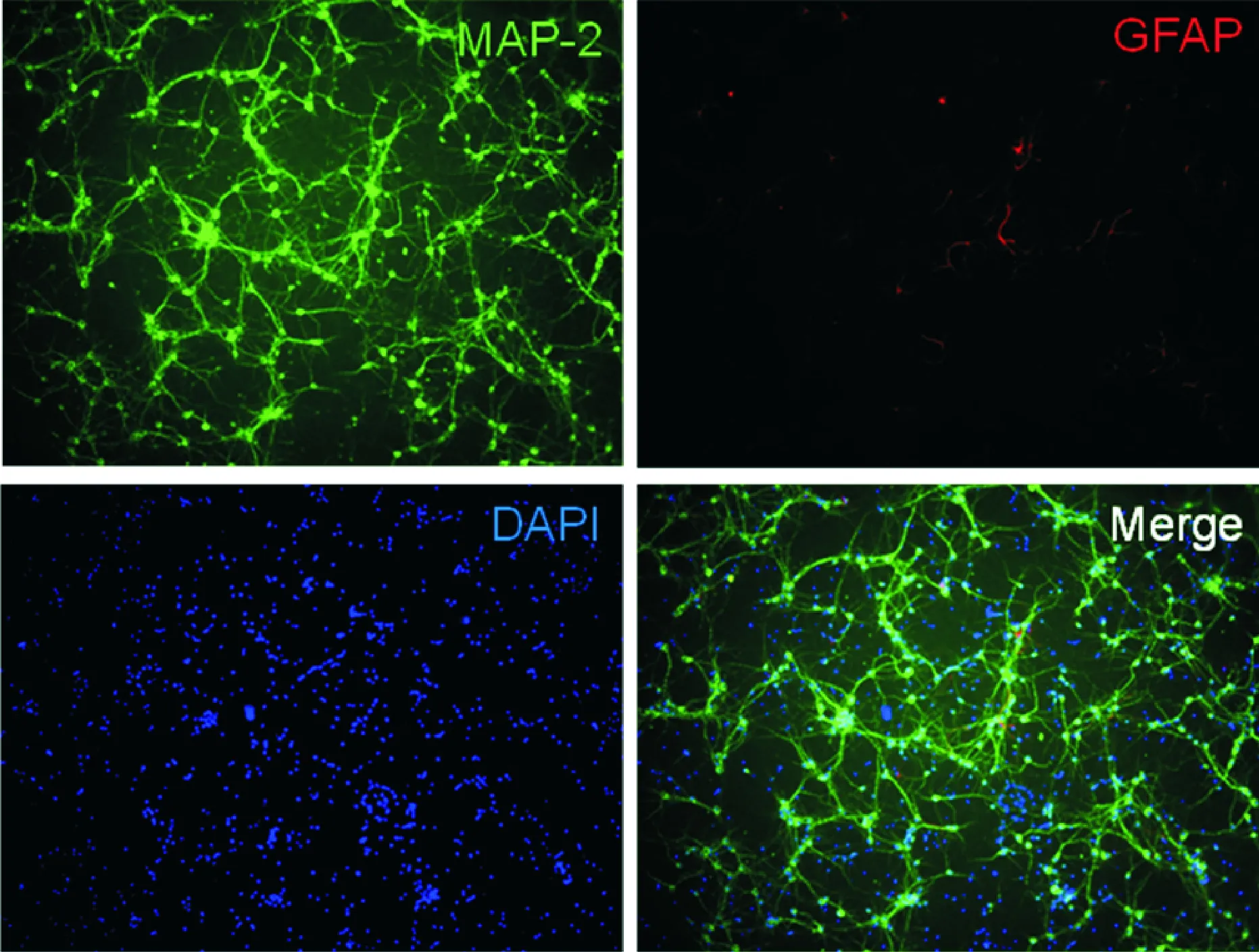
Figure 1. Neuron identification. Analysis of MAP-2 protein expression and DAPI in primary mouse cerebrocortical neurons by immunofluorescence (×200).
图1 免疫荧光法检测原代小鼠皮质神经元中MAP-2蛋白的表达
2 MTT结果
采用MTT法检测不同浓度的t-BHP和lycopene作用于原代皮质神经元24 h后细胞活性的变化。结果显示:随着t-BHP浓度的升高,神经元的活性逐渐下降,当t-BHP浓度为10 μmol/L时神经元的活性为对照组的50.6%±1.0%(P<0.05);在8 μmol/L浓度范围内,随着lycopene浓度的升高,神经元的活性有所增加,但与对照组比差异无统计学意义。在lycopene浓度为4 μmol/L时,细胞活性最高,同时用光学显微镜观察发现,4 μmol/L的lycopene可逆转10 μmol/L t-BHP损伤的神经元形态恢复至接近正常组;根据上述结果,确定以10 μmol/L t-BHP为模型的损伤浓度,4 μmol/L lycopene为药物保护浓度,见图2。
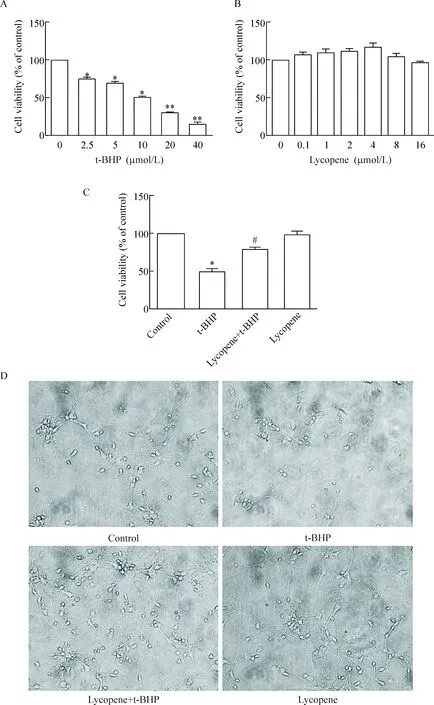
Figure 2.The effects of t-BHP and lycopene on primary mouse cerebrocortical neurons. A: neurons were treated with t-BHP at various concentration for 24 h and cell viability was examined by MTT assay; B: neurons were treated with lycopene at various concentration for 24 h and cell viability was examined by MTT assay; C: neurons were treated with t-BHP (10 μmol/L) or/and lycopene for 24 h and cell viability was examined by MTT assay; D: effects of lycopene on t-BHP-induced cell viability observed by microscopy (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vst-BHP group.
图2 MTT法和光学显微镜观察lycopene对t-BHP诱导神经元损伤的影响
3 流式细胞术检测神经元内ROS的结果
以DCFH-DA为荧光探针采用流式细胞术检测神经元内ROS的水平,与对照组比较,t-BHP处理组的ROS水平明显升高(P<0.05);与t-BHP处理组比较,lycopene+t-BHP组的ROS水平显著下降(P<0.05)。这一结果提示lycopene可以对抗t-BHP引起的ROS水平的升高,见图3。
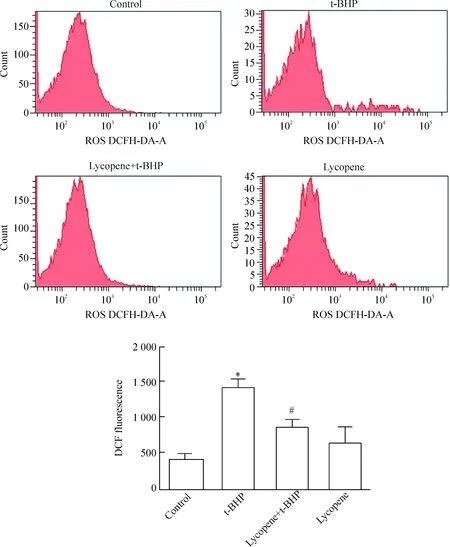
Figure 3. ROS production in primary mouse cerebrocortical neurons detected by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vst-BHP group.
图3 流式细胞术检测神经元内ROS的水平
4 Western blot实验结果
Western blot检测发现新生小鼠原代皮质神经元t-BHP损伤后线粒体凋亡途径相关凋亡蛋白表达明显增加,而抗凋亡蛋白降低。t-BHP处理组Bax和Bcl-2的比值较对照组增加(P<0.05),加入lycopene后,Bax/Bcl-2比值显著下降;活化的凋亡执行蛋白caspase-3 (cleaved caspase-3)在t-BHP处理组表达增加,与对照组比较差异有统计学意义(P<0.05),而加入lycopene后,其表达显著降低,与t-BHP处理组比较差异有统计学意义(P<0.05)。同时还发现t-BHP组中细胞色素C蛋白表达显著增加且与对照组比较差异有统计学意义(P<0.05),加入lycopene后可使其表达下降,与t-BHP处理组比较差异有统计学意义(P<0.05)。以上结果表明lycopene可以下调t-BHP诱导的神经元Bax的表达、上调Bcl-2的表达、降低caspase-3的活化水平,见图4。
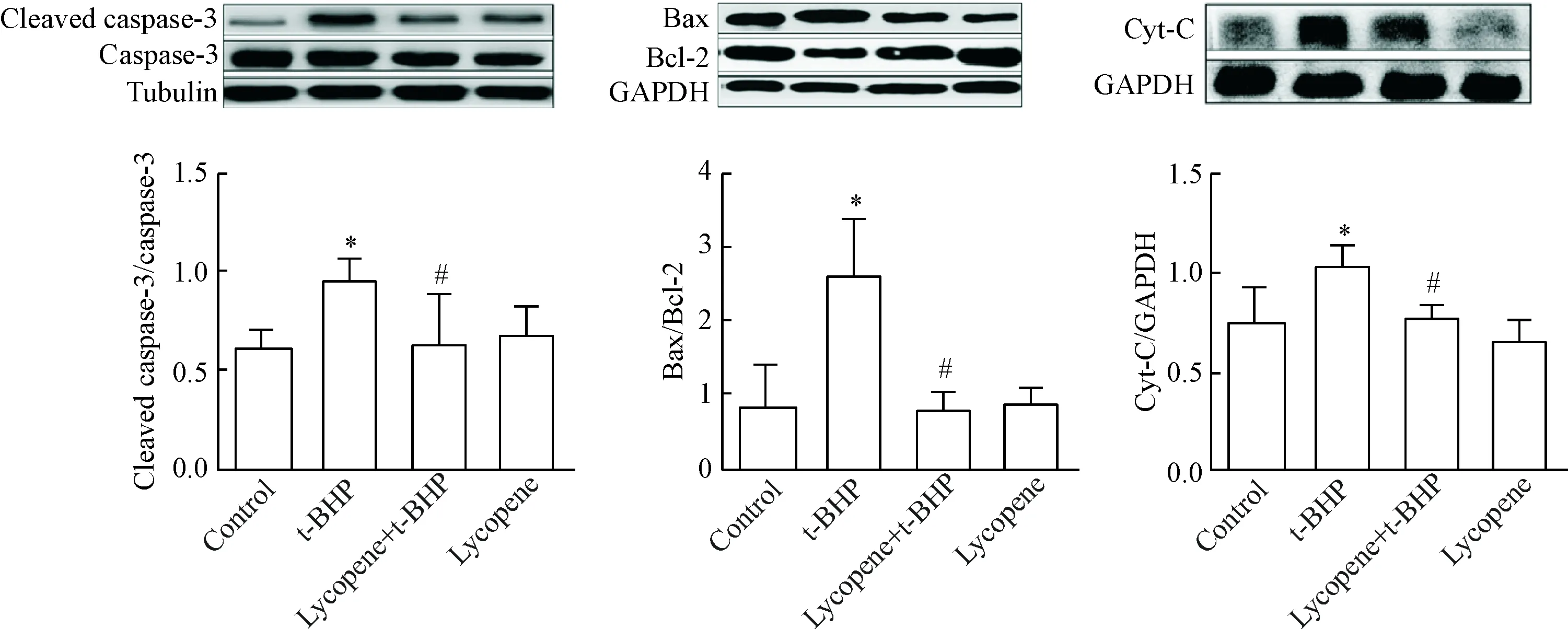
Figure 4. Effects of lycopene on Bax, Bcl-2, caspase-3, cleaved caspase-3 and cytochrome C (Cyt-C) protein expression in primary mouse cerebrocortical neurons. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vst-BHP group.
图4 Western blot法检测各组凋亡相关蛋白Bax、Bcl-2、caspase-3、cleaved caspase-3和细胞色素C的表达变化
讨 论
阿尔茨海默病是一类严重威胁人类健康的神经系统退行性疾病。现普遍认为氧化应激及其引发的线粒体功能障碍是许多神经系统退行性疾病发生和发展的主要因素[10]。神经系统退行性疾病的共同特征是神经细胞凋亡和坏死[11]。线粒体是控制细胞凋亡的中心和产生氧自由基的主要场所,氧自由基可以导致线粒体膜脂质体过氧化,功能蛋白结构变异变性以及线粒体 DNA 突变断裂、DNA 解聚和分子交联等氧化损伤[12],致使线粒体功能障碍,进而促进线粒体呼吸链大量 ROS 的生成和线粒体抗氧化系统功能的降低,形成恶性循环,最终线粒体凋亡途径被激活,导致大量神经细胞的凋亡和坏死[13]。
氧化损伤引起的神经元丢失与神经退行性疾病有密切关系[14]。大量实验证实神经退行性疾病中,神经元丢失过多是由于凋亡通路被激活后诱发凋亡所致[15]。其中Bcl-2 家族蛋白质是线粒体凋亡途径的主要调控因子,上调Bcl-2 成为抑制神经退行性疾病的细胞凋亡相关药物的一类重要靶标。在凋亡通路中,半胱氨酸蛋白酶成员caspase-3 一直被认为是凋亡发生的执行者,大量实验证实caspase-3 被抑制后细胞能够抵抗来自多种损伤引起的细胞凋亡[16-17]。同时,当线粒体功能障碍时,线粒体膜通道孔开放致使线粒体膜通透性改变,细胞色素C可以从线粒体内膜释放到细胞浆中,因此,细胞素色C是线粒体介导细胞凋亡途径不可缺少的重要因子,其释放也是线粒体功能受损的重要标志[18-19]。Lycopene是一种天然类胡萝卜素,是高效的抗氧化剂和自由基清除剂。Lycopene在多种细胞中验证能够减少细胞凋亡,例如Aβ1-42引起的神经元凋亡、MPP + 诱导的SH-SY5Y 细胞凋亡及TMT诱导神经元凋亡等[20-26]。本课题以原代培养的小鼠皮质神经元为研究对象,运用t-BHP建立神经元氧化损伤模型,探讨lycopene对t-BHP诱导损伤的神经元的保护作用及其机制。结果观察到lycopene可以对抗t-BHP诱导的神经元的氧化损伤和凋亡,显著降低神经元内ROS的水平,有效抑制线粒体对细胞色素C的释放和caspase-3的活化,同时降低Bax/Bcl-2的比值。综上结果表明,lycopene对抗t-BHP诱导的神经元的氧化损伤作用与阻断线粒体凋亡途径密切相关。
根据上述实验结果,本研究初步证明了lycopene能够对抗t-BHP诱导的原代皮质神经元的氧化损伤,抑制神经元凋亡,从而发挥其对神经元的保护作用,在防治以氧化应激损伤为靶点的神经退行性疾病方面具有潜在的应用价值。
[1] Bishop NA, Lu T, Yankner BA. Neural mechanisms of ageing and cognitive decline[J]. Nature, 2010, 464 (7288):529-535.
[2] Mufson EJ, Mahady L, Waters D, et al. Hippocampal plasticity during the progression of Alzheimer's disease[J]. Neuroscience, 2015, 12(15):51-67.
[3] Dimascio P, Kaiser S, Sies H. Lycopene as the most efficient biological carotenoid singlet oxygen quencher[J]. Arch Biochem Biophys, 1989, 274(2):532-538.
[4] Wertz K, Siler U, Goralczyk R. Lycopene: modes of action to promote prostate health[J]. Arch Biochem Biophys, 2004, 430(1):127-134.
[5] Wang X, Lv H, Gu Y, et al. Protective effect of lycopene on cardiac function and myocardial fibrosis after acute myocardical infarction in rats via the modulation of p38 and MMP-9[J].Mol Histol, 2014, 45(1):113-120.
[6] Durairajanayagam D, Agarwal A, Ong C, et al. Lycopene and male infertility[J]. Asian J Androl, 2014, 16(3):420-425.
[7] Qu M, Li L, Chen C, et al. Lycopene prevents amyloid β-induced mitochondrial oxidative stress and dysfunctions in cultured rat cortical neurons [J]. Neurochem Res, 2016, 41(6):1354-1364.
[8] Ghosh N, Ghosh R, Mandal SC. Antioxidant protection: a promising therapeutic intervention in neurodegenerative disease[J]. Free Radic Res, 2011, 45(8):888-905.
[9] Eisenberg-Lerner A, Bialik S, Simon HU, et al. Life and death partners: apoptosis, autophagy and the cross-talk between them[J]. Cell Death Differ, 2009, 16(7):966-975.
[10]Casetta I, Govoni V, Granieri E. Oxidative stress antioxidants and neurodegenerative diseases[J]. Curr Pharm Des, 2005, 11(16):2033-2052.
[11]Friedlander RM. Apoptosis and caspases in neurodegenerative diseases[J]. New England Journal of Medicine, 2003, 348(14):1365-1375.
[12]Simon HU, Haj-Yehia A, Levi-Schaffer F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis, 2000, 5(5):415-418.
[13]Rego AC, Oliveira CR. Mitochondrial dysfunction and reactive oxygen species in excitotoxicity and apoptosis: implications for the pathogenesis of neurodegenerative diseases[J]. Neurochem Res, 2003, 28(10):1563-1574.
[14]Li WZ, Li WP, Zhang W, et al. Protective effect of extract of Astragalus on learning and memory impairments and neurons apoptosis induced by glucocorticoids in 12-month-old male mice[J]. Anat Rec (Hoboken), 2011, 294(6):1003-1014.
[15]Wines-Samuelson M, Schulte EC, Smith MJ, et al. Characterization of age-dependent and progressive cortical neuronal degeneration in presenilin conditional mutant mice[J]. PLoS One, 2010, 5(4):e1019.
[16]Fuentealba RA, Liu Q, Kanekiyo T, et al. Low density lipoprotein receptor-related protein 1 promotes anti-apoptotic signaling in neurons by activating Akt survival pathway[J]. J Biol Chem, 2009, 284(49):34045-34053.
[17]Gui C, Wang JA, He AN, et al. Heregulin protects me-senchymal stem cells from serum deprivation and hypoxia-induced apoptosis[J]. Mol Cell Biochem, 2007, 305(1-2): 171-178.
[18]Liyanage NP, Manthey KC, Dassanayake RP, et al. Helicobacter hepaticus cytolethal distending toxin causes cell death in intestinal epithelial cells via mitochondrial apoptotic pathway[J]. Helicobacter, 2010, 15(2):98-107.
[19]Ventéo L, Bourlet T, Renois F, et al. Enterovirus-related activation of the cardiomyocyte mitochondrial apoptotic pathway in patients with acute myocarditis[J]. Eur Heart J, 2010, 31(6):728-736.
[20]Yi F, He X, Wang D. Lycopene protects against MPP+-induced cytotoxicity by maintaining mitochondrial function in SH-SY5Y cells[J]. Neurochem Res, 2013, 38(8):1747-1757.
[21]Qu M, Li L, Chen C, et al. Lycopene protects against trimethyltin-induced neurotoxicity in primary cultured rat hippocampal neurons by inhibiting the mitochondrial apoptotic pathway[J]. Neurochemistry International, 2011, 59(8):1095-1103.
[22]Qu M, Li L, Chen C, et al. Protective effects of lycopene against amyloid-induced neurotoxicity in cultured rat cortical neurons[J]. Neurosci Lett, 2011, 505(3):286-290.
[23]Chen W, Mao L, Xing H, et al. Lycopene attenuates Aβ1-42secretion and its toxicity in human cell andCaenorhabditiselegansmodels of Alzheimer disease[J]. Neurosci Lett, 2015, 608(11):28 -33.
[24]Feng C, Luo T, Zhang S, et al. Lycopene protects human SH-SY5Y neuroblastoma cells against hydrogen peroxide-induced death via inhibition of oxidative stress and mitochondria-associated apoptotic pathways[J]. Mol Med Rep, 2016, 13(5):4205-4214.
[25]Sachdeva AK, Chopra K. Lycopene abrogates Aβ1-42-mediated neuroinflammatory cascade in an experimental model of Alzheimer’s disease[J]. J Nutr Biochem, 2015, 26(7):736-744.
[26]张婵娟, 赵佳仪, 黄翠芹, 等. 叶黄素抑制叔丁基过氧化氢诱导的视网膜神经节细胞凋亡[J]. 中国病理生理杂志, 2016, 32(6):1043-1050.
(责任编辑: 林白霜, 罗 森)
Lycopene protects primary mouse cerebrocortical neurons against t-BHP-induced damageinvitro
HUANG Cui-qin, LI Qin, FAN Chong-zhu, GAN Dan-hui, LI An, ZHAO Jia-yi, WANG Zhen, LU Da-xiang
(DepartmentofPathophysiology,InstituteofBrainResearch,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicine,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:ldx@jnu.edu.cn)
AIM: To investigate the protective effect of lycopene on primary mouse cerebrocortical neurons exposed to tert-butyl hydroperoxide (t-BHP) and its mechanisms ofinvitro. METHODS: Primary cerebrocortical neurons of newborn C57 mice were extracted and divided into normal group, t-BHP group, lycopene+t-BHP group and lycopene group. The neuronal damage was induced by t-BHP exposure for 24 h, and the cell viability was examined by MTT assay. ROS content was measured by flow cytometry, and the protein levels of Bax, Bcl-2, caspase-3, cleaved caspase-3 and cytochrome C were examined by Western blot. RESULTS: The primary mouse cortical neurons expressed MAP-2 protein. Lycopene at concentration of 4 μmol/L reversed the decrease in cell viability. Flow cytometry revealed that lycopene treatment attenuated ROS content under the condition of t-BHP exposure. In addition, the protein level of Bcl-2 was increased, and the expression of Bax, cleaved caspase-3 and cytochrome-C was suppressed in lycopene+t-BHP group. CONCLUSION: The protective effect of lycopene on cortical neurons with t-BHP-induced injury may be involved in the mechanism of neuronal antioxidative response by down-regulating caspase-3 and Bax/Bcl-2 through the mitochondrial apoptotic pathway.
Lycopene; Cerebrocortical neurons; Tert-butyl hydroperoxide; Oxidative stress
1000- 4718(2017)02- 0208- 07
2016- 11- 14
2016- 12- 02
国家自然科学基金资助项目(No.81471236)
R363
A
10.3969/j.issn.1000- 4718.2017.02.003
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-85228071; E-mail: ldx@ jnu.edu.cn
▲并列第1作者
