补阳还五汤对实验性自身免疫性脑脊髓炎单核巨噬细胞的免疫调控作用*
2017-02-28田倩倩李艳花尉杰忠王晓庆张红珍刘建春郭文娟刘春云杨春彦肖保国马存根
田倩倩, 李艳花, 尉杰忠, 王晓庆, 张红珍, 刘建春, 郭文娟, 刘春云, 杨春彦, 肖保国, 马存根, △
(1山西中医学院“2011”协同创新中心/神经生物学研究中心,山西 太原 030024; 2大同大学脑科学研究所,山西 大同 037009; 3复旦大学华山医院神经病学研究所,上海 200025)
补阳还五汤对实验性自身免疫性脑脊髓炎单核巨噬细胞的免疫调控作用*
田倩倩1, 李艳花2, 尉杰忠2, 王晓庆1, 张红珍1, 刘建春1, 郭文娟1, 刘春云2, 杨春彦1, 肖保国3, 马存根1, 2△
(1山西中医学院“2011”协同创新中心/神经生物学研究中心,山西 太原 030024;2大同大学脑科学研究所,山西 大同 037009;3复旦大学华山医院神经病学研究所,上海 200025)
目的: 探讨补阳还五汤(BYHWD)治疗实验性自身免疫性脑脊髓炎(EAE)的有效性及对单核巨噬细胞免疫调控的作用及机制。方法: 雌性C57BL/6小鼠用小鼠髓鞘少突胶质细胞糖蛋白35-55肽段(MOG35-55)免疫制作慢性EAE模型,随机分为生理盐水处理组和BYHWD组。在免疫后第3天开始分别予以生理盐水和BYHWD灌胃,500 μL/d,持续观察临床症状和体质量变化。免疫后17 d各组统一处死部分动物,HE染色观察炎性细胞浸润情况,髓鞘染色观察脊髓髓鞘脱失比例,流式细胞术检测脾细胞M1型和M2型巨噬细胞表型;免疫荧光组织化学染色和Western blotting检测脊髓巨噬细胞iNOS、TNF-α、arginase及IL-10的表达。结果: BYHWD推迟EAE起病,减轻EAE症状,抑制中枢神经系统脊髓的炎性浸润和髓鞘脱失,促进脊髓及脾组织中M1型巨噬细胞转化为M2型。结论: BYHWD干预可缓解EAE行为学和病理学的改变,其作用机制可能与其诱导巨噬细胞极性转化相关。
补阳还五汤; 实验性自身免疫性脑脊髓炎; 巨噬细胞
多发性硬化(multiple sclerosis,MS)是中枢神经系统(central nervous system,CNS)的慢性自身免疫炎症性疾病,以脑白质内神经髓鞘脱失、轴突变性及炎性细胞浸润为主要病理特征[1]。目前因有效性低、严重的慢性毒性以及较高的处理成本等毒副作用的影响,MS仍缺乏有效的治疗方法[2]。中药是多种天然药物成分的复合体,以多靶点、多途径、整体调节、协同作用强、毒副作用小为特点,能有效改善患者临床症状,延缓疾病进程,调节免疫功能,弥补西医的不足[3]。
实验性自身免疫脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是目前国际公认的研究MS的动物模型。近年来,祖国医学对MS及EAE进行积极的理论与实践探索认为[4],本虚标实是本病的主要特征,肝肾阴虚、脾肾阳虚为本虚,痰、血瘀、湿、热合而为标实。其中,气虚血瘀证作为MS的常见证型之一,益气活血能明显改善临床症状,降低致残率,提高生活质量。
补阳还五汤(Buyang-Huanwu decoction,BYHWD)作为中医临床常用方剂,源自清代著名医家王清任的《医林改错》,由生黄芪4两、当归尾2钱、赤芍1.5钱、川芎1钱、地龙1钱、桃仁1钱和红花1钱组成,具有益气养血、活血通络之功效。药理研究发现BYHWD可改善微循环、血液流变学和血流动力学,抗炎抗氧化,调节免疫,还具有神经保护作用[5]。本研究应用BYHWD对EAE小鼠进行干预,探讨BYHWD对EAE小鼠单核巨噬细胞的免疫调控机制。
材 料 和 方 法
1 实验动物
8~10周龄C57BL/6小鼠,体质量18~20 g,购自北京维通利华公司,经山西大同大学伦理委员会批准,所进行的实验遵守国际动物实验委员会指导方针。实验前小鼠在无病原菌动物房清洁级饲养(25 ℃左右),12 h明暗交替,相对湿度40%~60%,自由饮食喂养1周。
2 实验药物
药物补阳还五汤按王清任《医林改错》原方,由生黄芪120 g、当归尾6 g、赤芍4.5 g、川芎3 g、地龙3 g、桃仁3 g和红花3 g组成。药材购自太原同仁堂药店,并由山西中医学院专家鉴定合格。以上药物加水浸泡2 h,加10倍量水(约1 500 mL),煎煮2次,第1次60 min,第2次30 min,过滤,2次滤液合并,静置过夜;次日将药液离心(1 500 r/min、5 min),取上清浓缩至80~100 mL,相当于生药2 kg/L,置冷,4 ℃冷藏备用。
3 主要试剂和仪器
小鼠髓鞘少突胶质细胞糖蛋白35-55肽段(myelin oligodendrocyte glycoprotein peptide fragment 35-55,MOG35-55)由上海强耀生物科技有限公司合成;百日咳毒素(pertussis toxin,PTX)购自Alexis;完全弗氏佐剂(complete Freund’s adjuvant,CFA)购自Sigma;结核分枝杆菌(tuberculosis bacilli,TB)、Flour-488-CD11b、PE-CD16/32和PE-CD206购自Becton Dickinson;β-actinⅠ抗购自CST;CD68Ⅰ抗购自eBioscience;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)购自ENZO;精氨酸酶1(arginase-1,Arg-1)购自BD;肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)购自PeproTech;白细胞介素10 (interleukin-10,IL-10)购自eBioscience;HRP标记的山羊抗兔、山羊抗小鼠、山羊抗大鼠Ⅱ抗及BCA蛋白定量试剂盒购自碧云天生物技术有限公司。凝胶成像分析仪购自Bio-Rad;荧光显微镜购自Olympus;冰冻切片机购自Leica;流式细胞仪为BD FACS Calibur产品。
4 主要方法
4.1 EAE模型建立及分组 42只8~10周龄雌性C57BL/6小鼠应用随机数字表按平均体质量随机分为EAE对照组、补阳还五汤组,每组各21只。MOG35-55溶解于生理盐水中,百日咳毒素溶于完全弗氏佐剂;采用针管混合器将等体积2种溶液充分混合,制成油包水样乳白色混悬液,静置后无分层为合格。在脊柱背侧中线两侧,分4点皮下注射(每只0.1 mL)。在免疫当日和48 h后,各组小鼠每只分别每次腹腔注射PTX 300 ng。
4.2 补阳还五汤对所建动物模型进行干预 EAE小鼠分为生理盐水对照组和补阳还五汤组。从免疫后第3天开始灌胃给药,EAE对照组予以生理盐水,补阳还五汤组每只给予补阳还五汤500 μL(按平均体重20 g计算,相当于35.60~44.53 g/kg)。每日给药1次,每组12只动物持续给药至免疫后28 d,9只动物于免疫后第17天处死。
4.3 行为学观察及标本采集 给药期间持续观察动物的症状与体质量。采用国际通用的5分评分制对小鼠进行临床症状评分:无任何临床症状为0分;尾部张力消失,可见轻度步态笨拙为1分;一侧后下肢无力,被动翻身后可以恢复为2分;双后肢瘫痪,被动翻身后不能恢复,但给予刺激后可以挪动为3分;双侧后肢瘫痪伴前肢瘫痪为4分;濒死状态或死亡为5分。症状介于两者评分之间者以±0.5分计。
免疫后17 d,采用0.3%戊巴比妥钠每只0.2 mL腹腔注射麻醉后取脾脏,制备成单个核细胞悬液;用生理盐水进行心脏灌注,至肝脏发白,各组5只动物快速冰上解剖脊髓组织,匀浆后提取蛋白,定量后采用Western blotting技术检测iNOS、Arg-1、TNF-α和IL-10(抗体均以1∶1 000稀释)的蛋白水平;各组其余4只动物用4%多聚甲醛灌流进行体内组织固定,然后分离脊髓,OCT包埋剂包埋,于液氮中冷冻,做厚度为10 μm的冰冻切片,进行髓鞘、HE及免疫组化染色。
4.4 髓鞘染色 取脊髓切片于95%乙醇中浸泡15 min,浸于Luxol固蓝(Luxol fast blue, LFB)液中,57 ℃孵育24 h,于95%乙醇溶液浸洗10 min,去离子水浸洗5 min,0.05%碳酸锂快速浸洗10 s,70%乙醇分化至灰质与白质能够清晰辨别,去离子水浸洗5 min,梯度乙醇脱水各2 min,二甲苯透明2次,各5 min,中性树胶封片,光镜下观察。
4.5 HE染色 将脊髓切片水中浸泡2 min,苏木精染色4 min,快速水洗,0.5%盐酸乙醇分化15 s,0.5%伊红30 s,快速水洗,梯度乙醇脱水各2 min,二甲苯透明2次,各5 min,中性树胶封片,光镜下观察。
4.6 免疫组化实验 脊髓的冰冻切片置于湿盒中1% PBS冲洗 5 min、3次;敷Ⅰ抗CD68、iNOS、Arg-1、TNF-α和IL-10(1∶1 000)后4 ℃过夜;1% PBS冲洗每次5 min×3次;敷育相对应的荧光Ⅱ抗(1∶10 000),避光放置2 h; 1% PBS冲洗3次;甘油封片,镜检。
4.7 Western blotting实验 用组织裂解液在4 ℃条件下充分裂解脊髓组织蛋白,并用BCA法测定蛋白含量。制备蛋白上样缓冲液样品,用10% SDS-PAGE分离蛋白。电泳完毕后,将分离好的蛋白凝胶用湿式转移法转移到硝酸纤维膜(稳流220 mA,2 h),5%脱脂奶粉封闭2 h,加入抗iNOS、Arg-1、TNF-α、IL-10(1∶1 000)及抗β-actin(1∶10 000)的抗体,4 ℃过夜;次日洗涤后孵育相对应的HRP偶联Ⅱ抗(1∶10 000)室温2 h。洗膜后进行化学发光反应,用Bio-Rad凝胶成像分析仪检测条带,Image Lab 3.0软件进行灰度值比较,并进行统计学分析。
4.8 流式细胞术检测脾细胞的M1型和M2型巨噬细胞表型 小鼠脾细胞悬于50 μL 1% BSA-PBS缓冲液中,分别加1 μL Flour-488-CD11b、PE-CD16/32和PE-CD206抗体,室温避光20 min。PBS洗2次各加500 μL PBS,上流式细胞仪检测。
5 统计学处理
统计分析采用GraphPad Prism统计分析软件进行数据处理,计量资料采用均数±标准差(mean±SD)表示,两两比较使用t检验。以P<0.05为差异有统计学意义。
结 果
1 BYHWD缓解EAE小鼠发病程度
8周龄C57BL/6小鼠被免疫后,在免疫后第3天给予BYHWD灌胃治疗,临床观察症状评分及体重直到第28天。EAE对照组小鼠自免疫后第10天起逐步发病。观察到小鼠精神萎靡不振、食欲减退、体重减轻及皮毛不光整,尾部及四肢肌力下降甚至出现瘫痪,临床症状评分最高可达4.5分。与EAE对照组相比,补阳还五汤组起病时间明显推迟(P<0.01),临床症状评分明显降低,见图1A。同时,随着临床症状评分的加重,EAE对照组小鼠的体重呈明显下降趋势,而补阳还五汤治疗组小鼠体重下降不明显,见图1B。
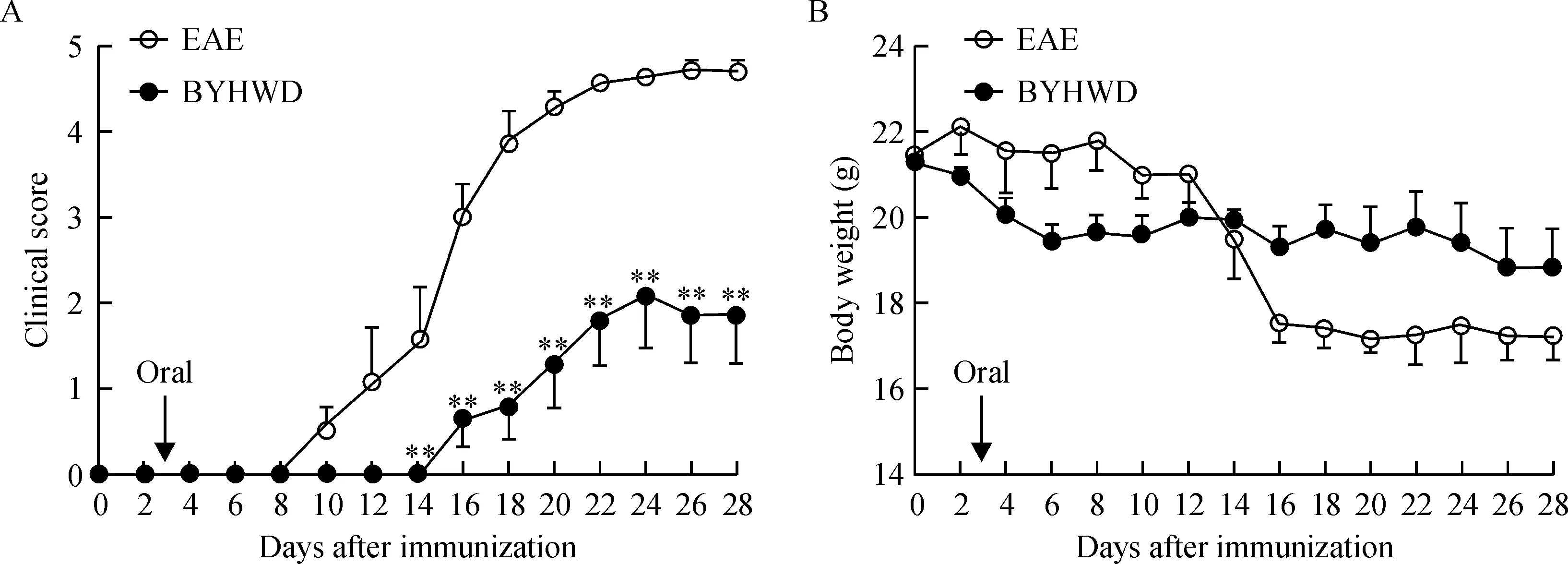
Figure 1.BYHWD delayed the onset of EAE and attenuated the severity of EAE. A: clinical score; B: body weight. Mean±SD.n=21.**P<0.01vsEAE.
图1 BYHWD缓解EAE小鼠临床症状和体重丢失
2 BYHWD减少脊髓白质髓鞘脱失
LFB染色显示EAE对照组脊髓白质出现大面积髓鞘脱失,而BYHWD组髓鞘脱失面积明显减少。EAE对照组髓鞘脱失与白质面积比值为(45.98±10.96)%,BYHWD组为(1.88±0.66)%,差异有统计学显著性(P<0.05),见图2。

Figure 2.The demyelination in the spinal cord of the mice in EAE group and BYHWD group with Luxol fast blue staining. The pixel area (%) of demyelination in white matter was calculated by Image-Pro Plus software. 1: the demyelinating area of spinal cord in EAE group; 2: the demyelinating area of spinal cord in BYHWD group. Mean±SD.n=4.*P<0.05vsEAE group.
图2 EAE组和BYHWD组小鼠的脊髓脱髓鞘
3 BYHWD抑制脊髓组织中炎性细胞浸润
大量巨噬细胞侵入中枢在EAE和MS发生发展过程中扮演重要角色,因此,本课题利用HE染色和CD68免疫荧光染色分析了脊髓组织的炎性细胞浸润情况。结果显示:临床症状较重的EAE对照小鼠脊髓白质区呈现大量炎性细胞浸润,尤以腰膨大处炎性细胞浸润更为明显,HE染色结果显示EAE对照组脊髓白质区炎性浸润细胞占整个脊髓面积的比值为(1.43±0.46)%,BYHWD组炎性细胞浸润明显减少,仅为(0.45±0.43)%,差异有统计学显著性(P<0.05);与脊髓HE染色一致,免疫荧光染色EAE对照组脊髓白质区域CD68+巨噬细胞浸润明显,而BYHWD明显抑制CD68+巨噬细胞的浸润(P<0.05),见图3。
4 BYHWD促进脊髓组织中M1型巨噬细胞转化为M2型
巨噬细胞按照其表型和分泌的细胞因子功能可分为以分泌促炎因子为主、发挥促炎功能的M1型巨噬细胞及以降低炎性反应、促进组织修复为主的M2型巨噬细胞。免疫组化结果显示,M1型巨噬细胞促炎因子iNOS和TNF-α在EAE组脊髓白质区浸润明显,成大片点状分布;而在BYHWD组仅有零星阳性浸润,与对照组相比数量明显减少(P<0.05)。Arg-1和IL-10作为M2型巨噬细胞抑炎因子,它们的表达在BYHWD治疗组的阳性分布比较密集,与EAE对照组比较具有明显差异(P<0.05)。脊髓Western blotting实验的结果与免疫组化结果相一致,见图4。
5 BYHWD使脾脏组织中巨噬细胞从M1型转化为M2型
脾脏作为全身最大的外周免疫器官,是参与免疫反应的重要基地。流式细胞术的结果表明,与EAE组相比,BYHWD也可抑制脾脏M1型巨噬细胞表面标志CD16/32的表达(P<0.05),使脾脏M2型巨噬细胞表面标志CD206表达呈增高趋势(P<0.05);BYHWD组CD16/32与CD206表达比值明显低于EAE对照组,差异有统计学显著性(P<0.05)。同时对冰冻脾组织切片行免疫组化染色,结果显示与脊髓组织染色结果一致,EAE小鼠经BYHWD治疗后,可显著抑制iNOS的表达,同时促进Arg-1的表达(P<0.05),见图5。
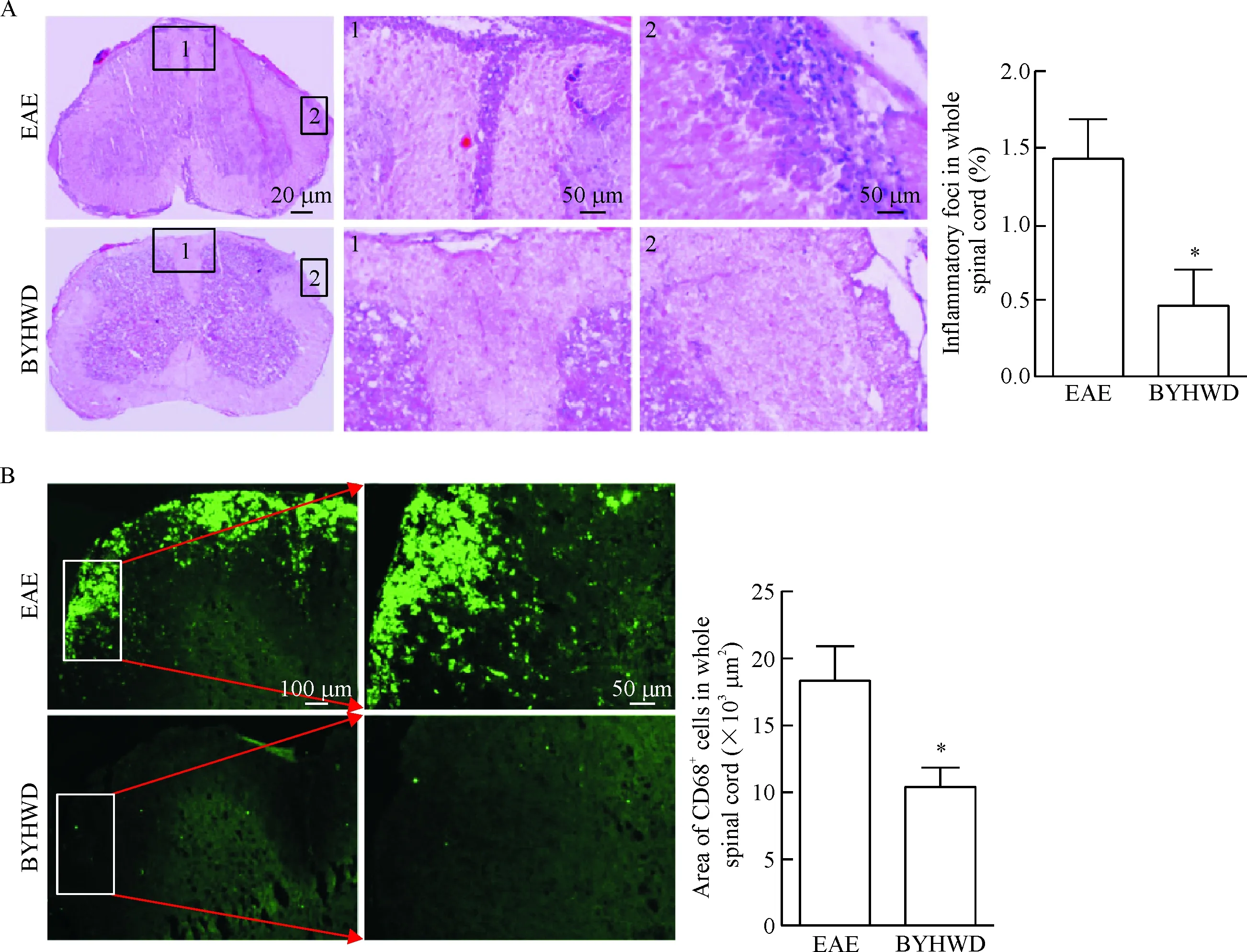
Figure 3.BYHWD inhibited macrophage infiltration in spinal cord of EAE mice. A: HE staining, a number of inflammatory cells in whole spinal cord were calculated by Image-Pro Plus software; 1: posterior root of spinal cord; 2: lateral region of the white matter of the spinal cord. B: the expression of CD68 in the spinal cord of the mice in EAE group and BYHWD group. The number of CD68+cells in whole spinal cord were calculated by Image-Pro Plus software. Mean±SD.n=4.*P<0.05vsEAE group.
图3 BYHWD抑制EAE小鼠脊髓组织中巨噬细胞浸润
讨 论
BYHWD是清代王清任所创气虚血瘀理论的代表方剂,出自《医林改错·卷下·瘫痿论》[6],方中重用生黄芪四两为君药补气扶正以固本,桃仁、红花各一钱、赤芍一钱半兼顾血瘀,归尾二钱、川芎一钱养血行气而不伤正,针对久病入络加用地龙搜剔通络[7]。药理学研究发现,其有效成分黄芪甲苷、阿魏酸、芍药苷、红花黄色素、川芎嗪等[8],具有抗炎抑炎、免疫调节、神经保护等作用[9-10]。
MS 是由髓鞘特异性CD4+T 细胞介导的、发生于中枢神经系统常见的慢性炎性脱髓鞘自身免疫性疾病,临床上以“萎证”居多。其确切病因尚不清楚,目前比较公认的是在髓鞘的自身免疫、感染性因子、性别、环境因素和遗传背景等多种因素作用下,自身免疫系统对CNS 进行攻击,导致髓鞘破坏,继而造成对运动、感觉、视觉等的损伤[11]。由本文结果可以看出,BYHWD 的治疗可以降低EAE 疾病的严重程度,延迟EAE 小鼠的发病时间;病理学研究发现,BYHWD 治疗后能够显著抑制脊髓白质髓鞘脱失,促进髓鞘再生。这显示了BYHWD治疗EAE 的良好效果。
巨噬细胞与EAE的发展有密切关系,它有抗原提呈能力,能分泌炎性细胞因子,参与髓鞘脱失和轴突的损伤。在已有的实验研究中发现,在EAE的发生发展中,巨噬细胞具有关键作用[12]。
巨噬细胞根据其功能分化为致炎性的M1 型巨噬细胞和抗炎性的M2 型巨噬细胞[13]。M1 型巨噬细胞的标志有CD16/32、CD40、IL-12、iNOS 等,M2型巨噬细胞的标志为CD206、IL-10、Arg-1、CD14、CD23等[14-15]。M1/M2型巨噬细胞的平衡是炎性反应程度的重要指标[16]。研究证实,M1/M2的失衡在EAE发生发展过程中起着重要作用,表现为M1细胞占优势介导炎性免疫反应。如果抑制M1细胞,降低促炎细胞因子的分泌,或者促进M2细胞的分化,则能缓解EAE发病严重程度[15]。TNF-α作为重要的细胞炎性因子在EAE 的发生和发展中发挥着重要作用,其升高水平与疾病的严重程度密切相关[17]。在EAE 动物模型中TNF-α表达增加,可以加重EAE的炎症反应症状,本实验结果与之一致。郭小彬等[18]通过测定实验动物血清TNF-α的表达,显示EAE 症状随着血清TNF-α的表达的增高而逐渐加重。在杨春彦等[19]、章培军等[20]的实验中也证实,在EAE的发展过程中,通过药物可抑制促炎细胞因子IL-1β、IL-6、TNF-α和IFN-γ的释放,同时促进抗炎因子IL-10的表达来缓解临床症状。这些均预示着巨噬细胞的极性转化在EAE发生发展过程中起着重要的作用。
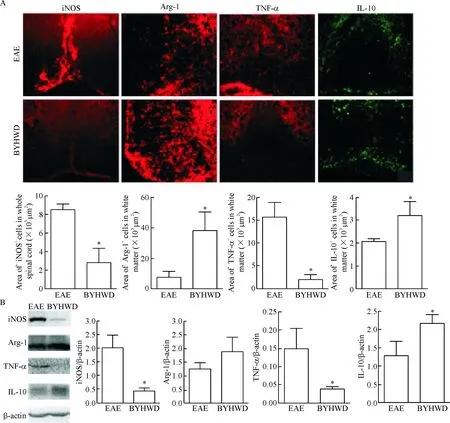
Figure 4.BYHWD promoted the polarization of M1 macrophages into M2 in spinal cord tissue of EAE mice. The expression of iNOS, Arg-1, TNF-α and IL-10 in the spinal cord of EAE group and BYHWD group was measured by immunofluorescence (A, ×20) and Western blotting (B). Mean±SD.n=4~5.*P<0.05vsEAE group.
图4 BYHWD促进脊髓组织中M1型巨噬细胞转化为M2型
我们之前的一系列研究也表明fasudil作为治疗EAE的有效药物之一,体外实验的结果证实可直接促进M1炎症型巨噬细胞向M2型转化[21],并且体内实验也证实了其可使表达高氧化应激产物和促炎症因子的M1型巨噬细胞向抑制免疫炎症反应和促进组织修复作用的M2型巨噬细胞转化[22]。我们对新合成药物WAR5的研究也发现,WAR5化合物与fasudil的作用机制具有相似性,即可诱导M1炎症型巨噬细胞向M2抗炎型巨噬细胞分化[23]。本实验通过BYHWD干预EAE结果显示其可抑制巨噬细胞/小胶质细胞的iNOS、TNF-α及CD16/32,而增加抗炎型M2细胞Arg-1、IL-10和CD206的表达。这种细胞极性转化,可以显著改善组织内的炎症微环境,减少对神经组织的损伤,进而改善临床疗效[24-25]。
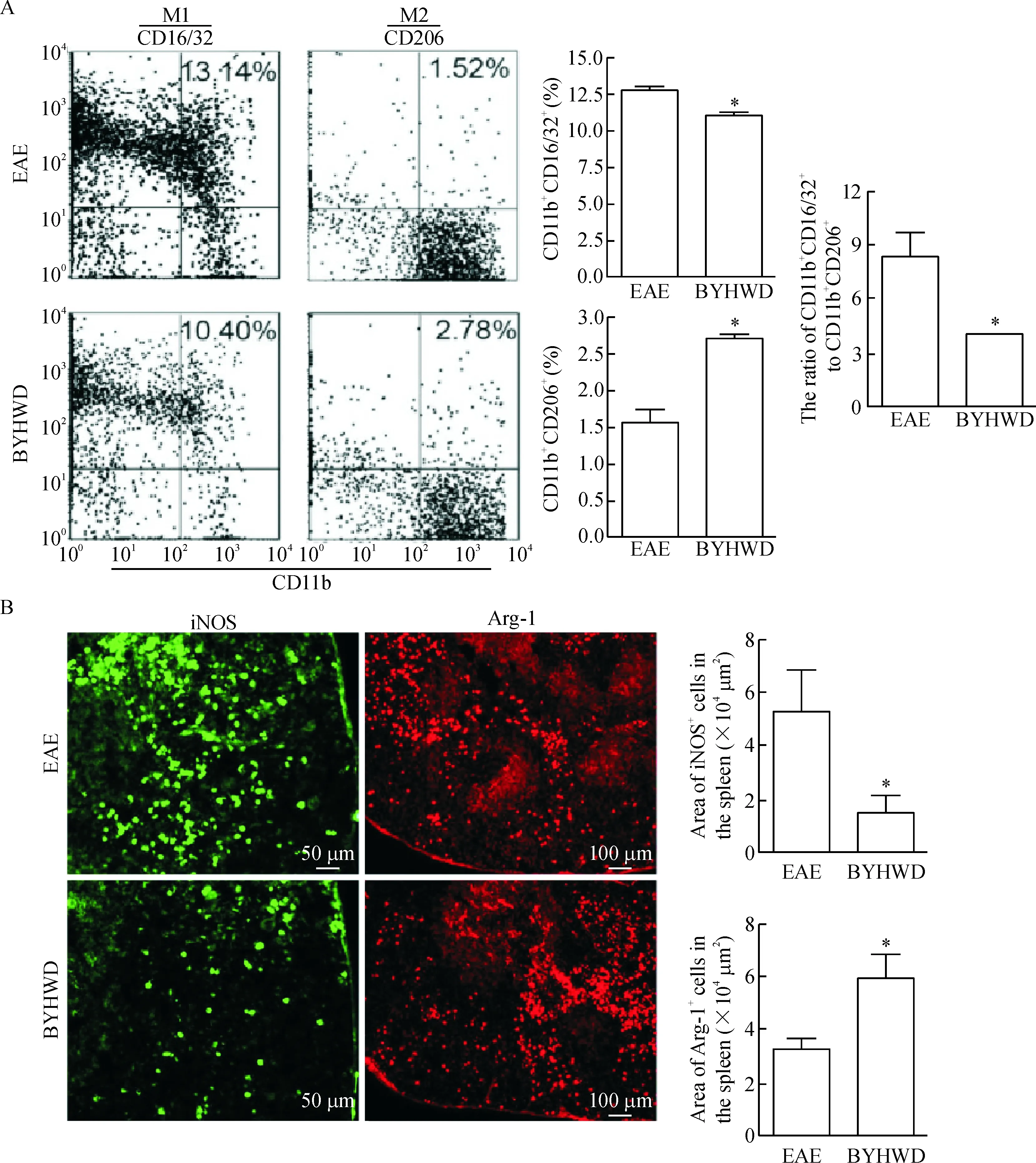
Figure 5. BYHWD promoted the polarization of M1 macrophages into M2 in the spleen of EAE mice. A: the cells were stained with macrophage marker CD11b and M1/M2 markers, and the polarization of M1/M2 was analyzed using flow cytometry. Representative dot plots from 1 of 3 experiments with the similar results are showed. The results are expressed as the percentage of double positive cells in four-quadrant diagram. B: the expression of iNOS and Arg-1 in the spleen of the mice in EAE group and BYHWD group was measured by immunofluorescence. Mean±SD.n=4~5.*P<0.05vsEAE group.
图5 BYHWD使脾脏组织中巨噬细胞从M1型转化为M2型
综上所述,BYHWD治疗EAE可明显改善临床症状、抑制炎症反应,可能与其诱导炎症性M1型巨噬细胞向抗炎性的M2表型转化、从而抑制中枢及外周神经系统的炎症反应有关。这也为MS的干预治疗提供了新的途径。
[1] 李 蕊, 胡学强. 多发性硬化的治疗进展[J]. 实用医院临床杂志, 2013, 10(3): 1-6.
[2] Mondal S,Pahan K. Cinnamon ameliorates experimental allergic encephalomyelitis in mice via regulatory T cells: implications for multiple sclerosis therapy[J]. PLoS One, 2015, 10(1):e0116566.
[3] 孙 宇, 王水英, 程晓东. 中医药治疗多发性硬化的临床研究进展[J]. 医学综述, 2013, 19(12):2196-2198.
[4] 郑子安, 钟相根, 贾 旭, 等. 多发性硬化中医辨治与研究思路探讨[J]. 吉林中医药, 2012, 32(11):1092-1094.
[5] 付 振, 张念平, 时晓东, 等. 补阳还五汤的药理研究[J]. 中国医学创新, 2010, 7(6):178-179.
[6] 王清任. 医林改错[M]. 上海:上海科技出版社, 1965:31-32.
[7] 杜全宇, 杨 昆, 王 飞. 补阳还五汤的临床研究进展[J]. 中国当代医药, 2015, 22(29):16-20.
[8] 刘俊娥, 张继平. 补阳还五汤药效物质基础的研究进展[J]. 中医药信息, 2012, 29(5):117-119.
[9] 杨春彦, 李艳花, 辛延乐, 等. 黄芪皂苷对多发性硬化作用的研究进展[J]. 山西大同大学学报:自然科学版, 2015, 31(6):48-50, 53.
[10]王晓庆, 刘建春, 田倩倩, 等. 芍药苷对细胞免疫调节作用的研究进展[J]. 中华中医药学刊, 2016, 34(6):1306-1308.
[11] Kostic M, Stojanovic I, Marjanovic G, et al. Deleterious versus protective autoimmunity in multiple sclerosis[J]. Cell Immunol, 2015, 296 (2): 122-132.
[12]Mensah-Brown EP, Shahin A, AI Shamisi M, et al. Early influx of macrophages determines susceptibility to experimental allergic encephalomyelitis in Dark Agouti (DA) rats[J]. J Neuroimmunol, 2011, 232(1-2):68-74.
[13]Wynn TA, Chawla A, Pollard JW. Origins and hallmarks of macrophages: development, homeostasis, and disease[J]. Nature, 2013, 496(7446):445-455.
[14]Marchetti V, Yanes O, Aguilar E, et al. Differential macrophage polarization promotes tissue remodeling and repair in a model of ischemic retinopathy[J]. Sci Rep, 2011, 1:76.
[15]Kou PM, Babensee JE. Macrophage and dendritic cell phenotypic diversity in the context of biomaterials[J]. J Biomed Mater Res A, 2011, 96(1):239-260.
[16]Mikita J, Dubourdieu-Cassagno N, Deloire MS, et al. Altered M1/M2 activation patterns of monocytes in severe relapsing experimental rat model of multiple sclerosis. Ame-lioration of clinical status by M2 activated monocyte admi-nistration[J]. Mult Scler, 2011, 17(1):2-15.
[17]Fontes LB, Dos Santos Dias D, de Carvalho LS, et al. Immunomodulatory effects of licochalcone A on experimental autoimmune encephalomyelitis[J]. J Pharm Pharmacol, 2014, 66(6):886-894.
[18]郭小彬, 李文妍, 朱 岚, 等. EAE大鼠血清中TNF-α、IFN-γ的检测及意义[J]. 中国医学工程, 2015, 23(9):6-7, 9.
[19]杨春彦, 李艳花, 辛延乐, 等. 补阳还五汤对致脑炎性T细胞的免疫调节作用研究[J]. 山西中医学院学报, 2015, 16(6):4-7, 10.
[20]章培军, 郭敏芳, 邢雁霞, 等. 黄芪糖蛋白对实验性自身免疫性脑脊髓炎小鼠的免疫调节作用[J]. 细胞与分子免疫学杂志, 2016, 32(1):54-58.
[21]张海飞, 郭敏芳, 孟 健, 等. 法舒地尔对LPS刺激小胶质细胞表型演变的影响[J]. 细胞与分子免疫学杂志, 2012, 28(8):818-821.
[22]Liu C, Li Y, Yu J, et al. Targeting the shift from M1 to M2 macrophages in experimental autoimmune encephalomyelitis mice treated with fasudil[J]. PLoS One, 2013, 8(2):e54841.
[23]丁智斌, 张 辉, 杨兴旺, 等. 新型Rho激酶抑制剂WAR5治疗EAE的初步研究[J]. 中国病理生理杂志, 2014, 30(9):1610-1615.
[24]李艳花, 刘春云, 章培军, 等. Fasudil对实验性自身免疫性脑脊髓炎小鼠小胶质细胞和星形胶质细胞的作用[J]. 细胞与分子免疫学杂志, 2012, 28(12):1242-1249.
[25]于婧文, 李艳花, 张 辉, 等. 新型Rho激酶抑制剂FSD-C11化合物抑制EAE的作用研究[J]. 中国神经免疫学和神经病学杂志, 2015, 22(3):156-161.
(责任编辑: 陈妙玲, 罗 森)
Immunoregulatory effect of Buyang-Huanwu decoction on monocyte-macrophages in mice with experimental autoimmune encephalomyelitis
TIAN Qian-qian1, LI Yan-hua2,YU Jie-zhong2, WANG Xiao-qing1, ZHANG Hong-zhen1, LIU Jian-chun1, GUO Wen-juan1, LIU Chun-yun2, YANG Chun-yan1, XIAO Bao-guo3, MA Cun-gen1, 2
(1“2011”CollaborativeInnovationCenter/ResearchCenterofNeurobiology,ShanxiUniversityofTraditionalChineseMedicine,Taiyuan030024,China;2InstituteofBrainScience,DatongUniversity,Datong037009,China;3InstituteofNeurology,HuashanHospital,FudanUniversity,Shanghai200025,China.E-mail:macungen2001@163.com)
AIM: To explore the therapeutic effect of Buyang-Huanwu decoction (BYHWD) on experimental autoimmune encephalomyelitis (EAE) and its immunoregulatory effect on monocyte-macrophages. METHODS: Chronic EAE was induced by myelin oligodendrocyte glycoprotein peptide fragment 35-55 (MOG35-55) in the female C57BL/6 mice, which were randomly divided into saline group and BYHWD group. On day 3 after immunization, the mice in BYHWD group were orally administrated with BYHWD, while normal saline was given to the control mice. The clinical score and body mass were recorded every other day. At day 17 after immunization, the mice were sacrificed and spinal cords were obtained for HE staining and myelin staining. The M1 and M2 macrophage phenotypes of splenic cells were detected by flow cytometry and immunofluorescence staining. The protein expression of iNOS, TNF-α, arginase and IL-10 in the spinal cord macrophages was determined by Western blotting. RESULTS: BYHWD delayed the onset of EAE, reduced the clinical scores of EAE, inhibited the inflammatory cell infiltration and demyelination in the spinal cord, and promoted the conversion of M1 macrophages into M2 phenotype in the spinal cord and spleen. CONCLUSION: BYHWD intervention attenuates the behavioral and pathological changes in the EAE mice, and its mechanism may be related to the macrophage conversion.
Buyang-Huanwu decoction; Experimental autoimmune encephalomyelitis; Macrophage
1000- 4718(2017)02- 0200- 08
2016- 06- 27
2016- 10- 19
国家自然科学基金资助项目(No. 81473577);山西省自然科学基金资助项目(No. 2013011052-4);山西省国际科技合作项目(No. 2013081058);山西省回国留学人员重点科研资助项目(2014-重点7);山西中医学院“2011”培育计划项目(No. 2011PY-1)
R363; R392
A
10.3969/j.issn.1000- 4718.2017.02.002
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0351-3179809; E-mail: macungen2001@163.com
