赤霞珠葡萄浆果质量对酿酒品质的影响
2017-02-24吴明辉陈为凯何非王羽西刘鑫杨哲朱燕溶石英段长青王军
吴明辉,陈为凯,何非,王羽西,刘鑫,杨哲,朱燕溶,石英,段长青,王军*
(中国农业大学食品科学与营养工程学院/葡萄与葡萄酒研究中心,北京 100083)
赤霞珠葡萄浆果质量对酿酒品质的影响
吴明辉,陈为凯,何非,王羽西,刘鑫,杨哲,朱燕溶,石英,段长青,王军*
(中国农业大学食品科学与营养工程学院/葡萄与葡萄酒研究中心,北京 100083)
为了明晰葡萄浆果质量对其构成和酿酒品质的影响,连续两年将采收期的赤霞珠葡萄浆果称重并测量浆果直径,分析浆果质量分布与浆果体积和密度的关系;将浆果按照质量分成6个级次,分析各质量级次浆果的组织构成、可滴定酸、可溶性固形物及酚类物质和香味物质的变化。结果表明:有59%(2013年)~64%(2012年)的浆果质量分布在0.76~1.25 g之间;浆果体积与质量呈正相关;浆果质量对浆果密度无影响;浆果质量与果皮质量、种子数量、单粒种子质量、种子总质量呈正相关;质量较小的浆果,其相对果皮质量较高、相对种子质量较低;随着浆果增大,其果汁的可溶性固形物含量下降,果皮的总酚、花色苷、黄酮醇及黄烷醇含量下降;浆果大小对苹果酸、酒石酸也有影响;浆果大小对检测的香气物质含量影响不明显。
浆果大小;果实构成;酿酒品质;有机酸;酚类化合物;香味化合物
葡萄酒品质的差异很大程度上取决于酿酒葡萄浆果品质(成熟度、大小)的一致性[1-3]。优质葡萄酒的原料首要的是具有均一的成熟度和合适的浆果大小。成熟不充分的葡萄浆果带给葡萄酒的是生青味,而过熟的葡萄浆果带给葡萄酒的是果酱味[4];小粒浆果的果皮薄[5]、种子少,不耐浸渍;而大粒浆果的成熟度差、果皮相对质量小,影响葡萄酒质量的风味物质含量低。因此,大小和成熟度相对均一的葡萄浆果对葡萄酒的质量、风格影响极大。
葡萄浆果的一致性包括其成熟度的一致性、着色及大小的一致性,果皮厚度、种子大小及数量等因素,这些因素的差异性可以概括为葡萄浆果成熟的一致性和构成的一致性[6]。浆果的异质性最主要体现在浆果大小和成熟度的差异上。
决定红葡萄酒颜色、酒体和香味的化合物主要存在于浆果的果皮中。葡萄酒的呈色物质主要来自葡萄果皮中的花色苷,而且葡萄酒的颜色还与葡萄酒的pH、辅色作用、单体黄烷-3-醇、黄酮醇和羟基肉桂酸等有关[7-8];葡萄酒的苦味和收敛性则与葡萄果皮和种子中的单宁有关[9]。如果将葡萄浆果视为一个完美的球体,则果皮质量与其表面积(4πr2)呈正相关,浆果质量与其体积(4πr3/3)呈正相关,果皮/浆果质量比与浆果直径呈负相关。因此,小粒浆果的果皮与浆果质量比更大,葡萄浆果和葡萄酒中的酚类化合物含量更多[10-12]。小粒浆果的比表面积较大,有利于果皮中酚类化合物的浸出[13]。此外,浆果大小对种子与浆果质量比也有影响,从而影响葡萄酒中的酚类化合物含量与构成[10,14]。所以在酿酒生产实践中,有目的的增加浆果均一性的穗选和粒选工艺,提高溶质含量的抽汁和添加白葡萄皮渣工艺[15-16],均有助于酿酒质量的提高。
酿酒葡萄浆果含糖量、花色苷、多酚类物质的增加有利于其酿酒品质,浆果成熟的一致性也是酿造优质葡萄酒的前提。前人研究表明,赤霞珠葡萄的浆果越小,其酿造的葡萄酒颜色越好,可滴定酸、总酚和单体黄烷-3-醇的浓度都高于较大浆果酿造的葡萄酒[17];而在西拉葡萄中,小粒浆果中花色苷和酚类化合物的提取率高于其他大小的浆果,但中等大小的葡萄浆果酿造的葡萄酒品质最佳[18]。
为此,本研究于2012年和2013年调查了河北省怀来县的赤霞珠葡萄,在浆果质量分级的基础上,测量了种子质量、总酸、可溶性固形物以及酚类化合物和香味化合物。以期为减小浆果的异质性,提高浆果品质和优质葡萄酒的酿造研究提供理论依据。
1 材料方法
1.1 标准品和试剂
色谱级的甲醇、甲酸、乙酸和乙腈,购自Fisher公司(Fairlawn,NJ,USA);铑元素(Rh)、福林酚试剂、二甲花翠素-3-O-葡萄糖苷、(+)-儿茶素、槲皮素、没食子酸、酒石酸、苹果酸和香气标准品,购自Sigma公司(St. Louis,MO,USA)。硝酸、双氧水和氢氟酸,购自Merck KGaA公司(Darmstadt,Germany);去离子水(<18 MΩ电阻)由Milli-Q超纯水净化系统(Millipore,Bedford,MA,USA)制备。
1.2 仪器设备
低温离心机(TDL-5-A,上海飞鸽仪器有限公司);超声波清洗机(SG3200HBT,上海冠特超声仪器有限公司);紫外分光光度计(T6,上海普析通用仪器公司);冷冻干燥机(FD-1A-50,北京必瑞克生物科技有限公司);Agilent 1100系列LC/MSD Trap-VL液相色谱-离子阱质谱联用仪(美国Agilent公司);Agilent 1200系列LC/ MSD Trap-VL高效液相色谱-三重四级杆质谱联用仪(美国Agilent公司);0.22 μm微孔滤膜;Agilent 6890 GC和Agilent 5975 MS(美国Agilent公司)气相色谱与质谱联用仪(GC-MS),毛细管柱为HP-INNOwax 60 m×0.25 mm ×0.25 μm(美国J&W Scientif c公司)。
1.3 试验材料
试验材料为赤霞珠葡萄,连续调查两年(2012年和2013年)。葡萄园位于河北省怀来县十八家村(北纬40°18′48′,东经115°46′25′),供试植株于2000年定植,自根苗,东西行向,栽植密度2.5 m×0.5 m,葡萄植株采用单蔓直立架形,常规田间管理,短梢修剪。2012-2013年怀来县两年气候数据及采收日期见表1,采样期间的气象数据来自中国气象科学数据共享服务网(http://cdc.cma. gov.cn/home.do)。
1.4 样品采集
除去外侧两行,选取长势正常的葡萄植株,将果穗采集后混合,放入装有冰袋的保温箱中,运回实验室。剪下浆果,称重并分为6个质量级次(≤0.50 g、0.51~0.75 g、0.76~1.00 g、1.01~1.25 g、1.26~1.50 g和>1.50 g),每个质量级次的浆果随机分为3份,作为3个生物学重复。从每一个质量级次的每一个生物学重复的浆果中随机取100粒,分别测定果皮质量、种子数和种子质量。再随机取100粒浆果取汁,测定其可溶性固形物(°Brix)、pH和可滴定酸。随机取各质量级次的每一个生物学重复的浆果200粒,液氮速冻后保存于-40 ℃,用于测定有机酸、酚类物质和香气物质。

表1 2012-2013年4~10月主要气候指标和果实采收日期
1.5 试验方法
1.5.1 果实基本理化指标测定
用游标卡尺(20±0.02)cm测量浆果纵径,按照球体积公式(V=(4/3)πr3)计算浆果体积;根据浆果质量/体积计算浆果密度。用解剖刀切开浆果,取出种子并去除果皮上附着的果肉,吸水纸吸去果汁,称果皮和种子质量。果汁的可溶性固形物含量用手持折光仪(PAL-1,Atago,日本)测定;使用pH计(PB-10,Sartorius,德国)测定果汁的pH值;使用0.05 mol的氢氧化钠测定葡萄汁的可滴定酸质量浓度(g/L);使用带VWD检测器的HPLC(1200 Series,Agilent)检测有机酸(酒石酸和苹果酸)[19]。
1.5.2 酚类化合物的提取
葡萄果皮液氮速冻后,研磨成粉,真空冷冻干燥24 h后,保存于-40 ℃冰箱中,用于提取花色苷,黄烷-3-醇和黄酮醇。
花色苷提取方法参照何建军等[20]。称取0.5 g(0.4990~0.5010 g)葡萄果皮干粉,加入体积分数含2%甲酸的甲醇溶液10 mL,超声避光提取10 min,摇床30 min(转速150 r/min,温度25 ℃),8000 r/min离心10 min,转移上清液于100 mL圆底烧瓶中,旋转蒸发至干,重复提取5次。圆底烧瓶中的残留物用定容剂(A相:B相=90:10)定容至10 mL。
黄烷-3-醇的提取按照梁娜娜等的方法[21],稍作修改。称取0.1 g(0.0950~0.1050 g)葡萄果皮干粉,置于10 mL离心管中,加入1 mL间苯三酚(含0.3 mol/L HCL、50 g/L的间苯三酚以及0.5%的VC甲醇溶液),50 ℃水浴20 min,取出后加入1 mL的乙酸钠水溶液(200 mmol)终止反应,混匀后8000 r/min离心15 min,取出上清液,重复上述步骤3次,合并上清液。
黄酮醇的提取方法:称取0.5 g(0.4990~0.5010 g)葡萄果皮干粉,用提取液(乙醇:水:乙酸=50:49:1,v/v/ v)提取4次(15 mL,15 mL,10 mL,10 mL),每次超声提取35 min,8000 r/min离心10 min,合并上清液于分液漏斗中;在分液漏斗中加入50 mL蒸馏水和40 mL乙酸乙酯,萃取,重复3次。收集乙酸乙酯于40 ℃下旋蒸至干,用2 mL 25%的甲醇水溶液溶解。
1.5.3 酚类化合物的检测
酚类物质的分析和检测分别使用配备VWD检测器(黄酮醇)和配备DAD检测器(黄烷-3-醇和花色苷)的Agilent 1200系列HPLC-MSD Trap-VL液相色谱-离子阱质谱联用仪。
质谱采用电喷雾离子源(ESI);离子扫描范围:100~1000 m/z,正离子模式;雾化气压力为35 psi;干燥气(N2)流速10 L/min,干燥气温度350 ℃;最大累计时间300 ms;Trap ICC:30000 units;CID的MS/MS诱导碰撞能量为1.0 V。花色苷提取物使用0.22 μm水系膜过滤,黄烷-3-醇和黄酮醇提取物使用0.22 μm的有机相膜过滤。
黄烷-3-醇的色谱条件:色谱柱为Zorbax SB C-18(250 mm×4.6 mm,5 μm)。流动相A:0.2%醋酸水溶液,流动相B:乙腈:0.2%醋酸水溶液(4:1,v/v)。梯度洗脱程序:0~20 min,10%B;20~30 min,10%~15%B;30~40 min,15%~20%B;40~50 min,20%~33%B;50~55 min,33%~40%B;55~58 min,40%~100%B;58~63 min,100%B;63~64 min,10%B。流速为1.0 mL/min,柱温25 ℃,检测波长280 nm,进样量25 μL。
花色苷的色谱条件:色谱柱为Kromasil100-5 C18柱(250 mm×4.6 mm,6.5 μm,美国安捷伦公司)。实验的流动相A:水:甲酸:乙腈=92:2:6(v/v/v);流动相B:水:甲酸:乙腈=44:2:54(v/v/v)。洗脱程序:0~18 min,10%~25%B;18~20 min,25%B;20~30 min,25%~40%B;30~35 min,40%~70%B;35~40 min,70%~100%B。流速为1.0 mL/min,柱温50 ℃,检测波长525 nm,进样量30 μL。
黄酮醇的色谱条件:色谱柱为Zorbax SB C-18(250 mm×4.6 mm,5 μm);柱温40 ℃;进样量50 μL;检测波长360 nm;流速为0.63 mL/min。流动相A:乙腈:甲酸:水 = 5:8.5:86.5(v/v/v);流动相B:乙腈:甲醇:甲酸:水=25:45:8.5:21.5(v/v/v/v)。洗脱程序:0~7 min,0%B;7~24.2 min,0%~14.2%B;24.2~27 min,14.2%~15.7%B;27~27.4 min,15.7%~16.3%B;27.4~33.4 min,16.3%~18.8%B;33.4~39 min,18.8%~23.5%B;39~45 min,23.5%~26%B;45~47 min,26%~27.4%B;47~51.6 min,27.4%~32%B;54~61.8 min,33.4%~40%B;61.8~67.8 min,40%~100%B;67.8~78.4 min,100%~0%B。
1.5.4 游离态香气物质的检测
葡萄浆果从-40 ℃冰箱中取出后称取约60 g,用液氮速冻,破碎后挑出种子,加入1 g PVPP(去除多酚、防止样品氧化)和0.5 g G-葡萄糖酸内酯(D-gluconic acid lactone,抑制糖苷酶活性)后低温下迅速破碎成粉末状,4 ℃冰箱静置4 h,迅速在4 ℃、8000 r/min离心10 min,得到澄清葡萄汁,上机检测。
GC-MS条件参考吴玉文等[22]。载气为高纯氦气(He>99.999%),流速为1 mL/min;进样口温度为250 ℃,采用不分流模式,解析时间8 min;升温程序为50 ℃保持1 min,然后以3 ℃/min升温到220 ℃,保持5 min。质谱电离方式为EI,离子源温度为230 ℃,电离能为70 ev,四级杆温度为150 ℃,质谱接口温度为280 ℃,质量扫描范围为30~350 u。采用AMDIS技术解谱,将解出的质谱图和标准品与NIST 08标准谱库对比并计算每个挥发性组分的保留指数,与标样保留指数以及NIST Chemical WebBook和文献收录的极性柱条件下测得的保留指数比较,将定性结果依靠可信度强弱分类并记录详细。
定量方法参考吴玉文[23],采用内标法,内标为4-甲基-2-戊醇。
1.6 数据处理
采用Origin 9.0和SPSS 20对数据进行分析及绘图。
2 结果与分析
2.1 浆果质量与体积和密度的关系
由图1可以看出,对成熟期的赤霞珠浆果来说,浆果质量与其体积成线性正相关,浆果越重其体积越大,两个年份的相关系数均大于0.85,说明通过粒选可以将浆果按照质量进行分类。从浆果质量与其密度的关系可以看出(图1),成熟期的赤霞珠,大部分浆果的密度在1.2~1.7 g/cm3之间,但分布很不集中,说明浆果在成熟度方面存在很大差异。
2.2 浆果质量分布
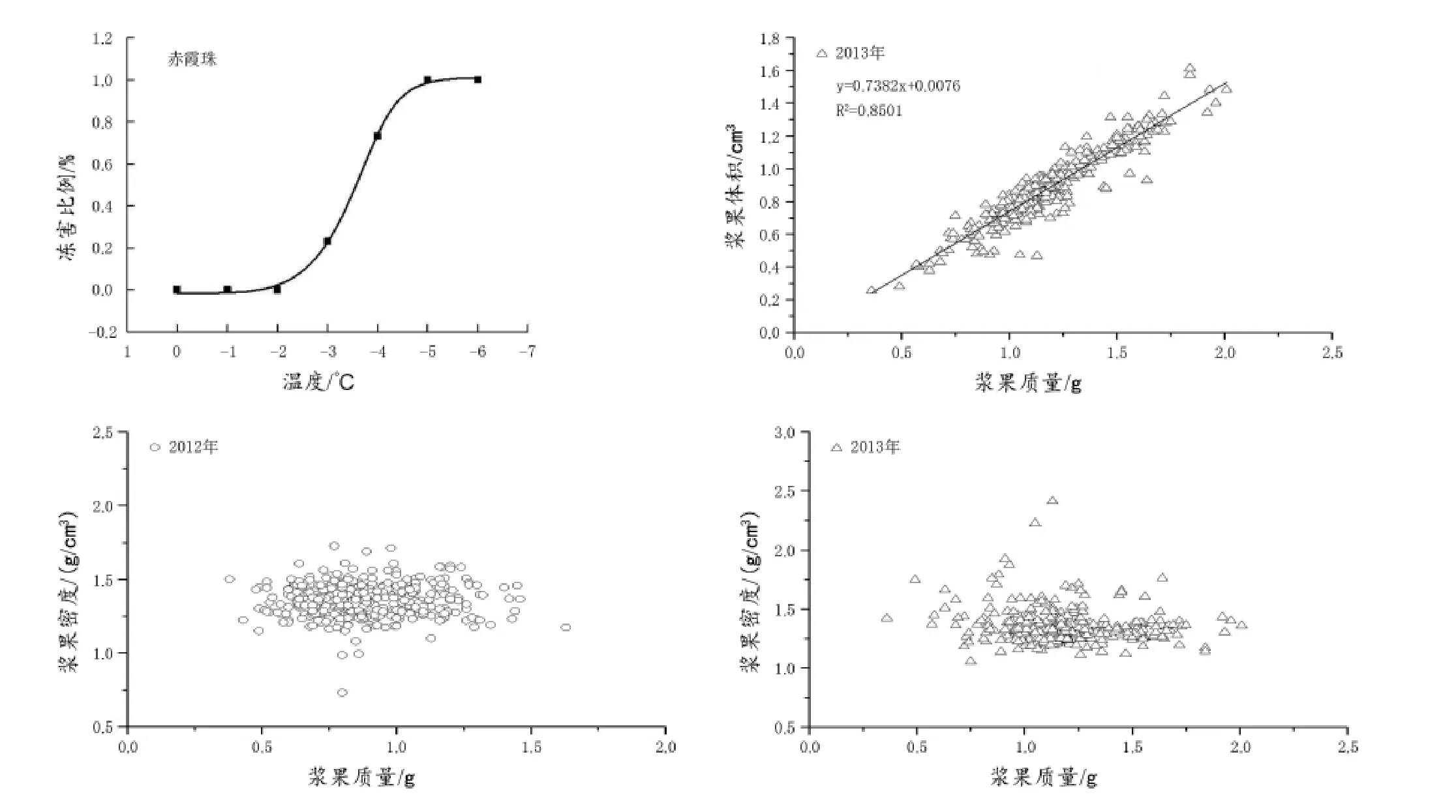
图1 浆果质量与体积、密度关系
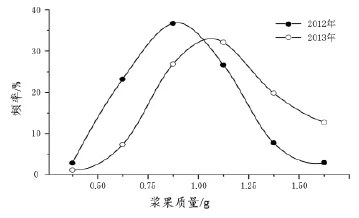
图2 2012年和2013年赤霞珠葡萄浆果的质量分布
对两年采收到的浆果质量按照6个质量级次分类,统计每个质量级次浆果数量的分布频率(图2)。在不考虑环境因素和葡萄栽培管理措施相对一致的情况下,这种频率分布证实,浆果大小的异质性是真实存在的[24-25]。因此,浆果的异质性对酿酒葡萄品质的影响不可忽略。此外,年份对葡萄浆果大小的影响很大。2012年有64%的浆果质量在0.51~0.75 g、0.76~1.00 g、1.01~1.25 g三个质量级次中,其中0.76~1.00 g的浆果所占的比率最高。2013年,三个代表性的质量级次分别为0.76~1.00 g、1.01~1.25 g和1.26~1.50 g ,相应的浆果数量所占的百分比分别为26.9%、32.1%和19.8%。此外,从图2还可以看出,2012年的平均粒质量小于2013年。这些结果表明,年份影响浆果质量的分布,因为2012年的降雨量少(表1),这可能会降低采收时葡萄浆果的大小[26-27]。
2.3 浆果的组织构成

图3 2012年和2013年赤霞珠葡萄浆果质量与果皮、种子间的关系
浆果质量与果皮质量、每浆果种子数量、单粒种子质量、每浆果种子总质量呈正相关(图3)。果皮质量和每浆果种子总质量随浆果质量的增加而增加,且增加较为稳定,两者的相关系数都>0.87。每浆果的种子数量在两年间表现较一致,在较小的3个质量级次中变化不大,大部分为1粒种子,当浆果质量超过1.00 g后,每浆果种子数量迅速增加;每浆果种子数量在>1.50 g级次中最多,2012年达到3.1粒,2013年则为2粒。与此相反,单粒种子质量在较小的质量级次中增加明显,大浆果中较为稳定,接近0.04 g。
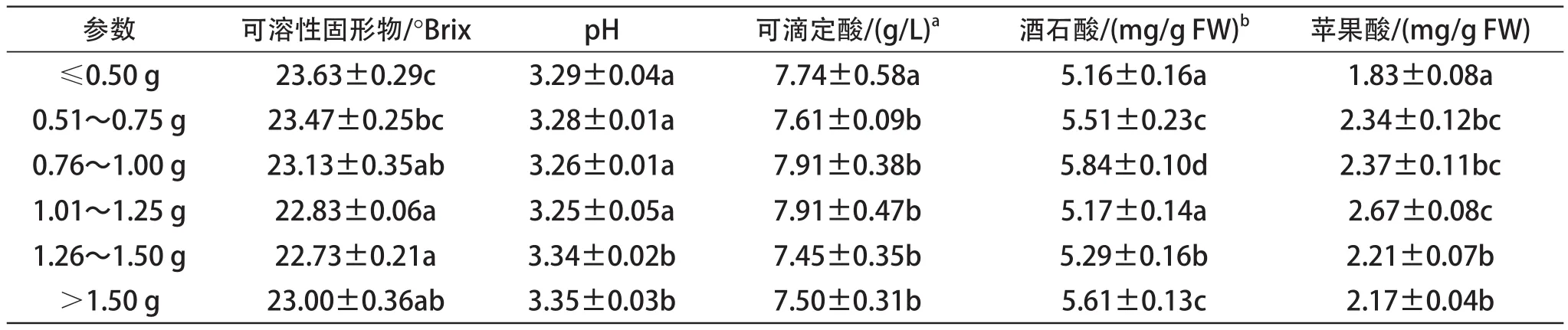
表2 2012年不同质量级次浆果的基本酿造参数的差异

表3 2013年不同质量级次浆果的基本酿造参数的差异
果皮相对质量和种子相对质量呈现出相似的变化趋势,但是不同年份的数值明显不同,这可能与两年的气候条件有关。总体上看,果皮相对质量在12%~20%之间波动,相对种子质量则在4%~8%范围内变化。相对果皮质量随浆果质量增加而呈下降的趋势,这可能与浆果越小、浆果的表面积和体积比越大有关[12]。与此相反,相对种子质量随浆果质量的增大而增大,一方面是由于单粒种子质量的增加,但更多的是由于每粒浆果种子质量的增加[14]。
2.4 浆果的酿酒品质
2.4.1 基本理化指标
葡萄成熟度是决定酿酒葡萄浆果品质的一个重要因素。如表2、表3所示,可溶性固形物含量随浆果质量的增加而呈减少的趋势,虽然2012年采收日期仅比2013年晚一天,但果汁可溶性固形物比2013年高2°Brix。随着浆果质量的增加,可滴定酸呈现先上升后下降的趋势。此外,质量级次为1.01~1.25 g的浆果,其果汁可滴定酸值最大;pH值则呈现完全相反的趋势。
衡量葡萄浆果成熟度的另一个特征是有机酸的组成(苹果酸和酒石酸)。2012年,酒石酸的变化与浆果质量级次之间关系不一致;而2013年则是随着葡萄浆果质量的增加,酒石酸含量减少(表2、表3)。随着浆果质量的增加,苹果酸含量先上升后下降。
2.4.2 酚类化合物
葡萄酒的良好品质与酚类化合物的组分密切相关,尤其是果皮中的花色苷、黄烷-3-醇和黄酮醇对果实的酚类成熟起着重要作用,并影响葡萄酒的颜色、口感和风味[28]。葡萄浆果大小对酚类化合物的影响主要表现在果皮/果肉比的差异性和技术成熟度一致性两个方面。
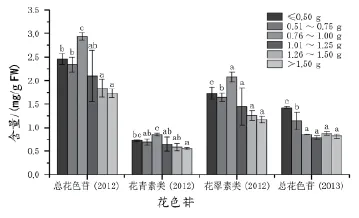
图4 不同质量级次浆果果皮中花色苷含量的差异同组不同字母代表差异显著(p<0.05),下同
小粒浆果的相对果皮重较大,与相对果皮重的结果相比较,果实大小和总花色苷的含量呈现负相关的关系。2012年果实中花色苷的含量在1.74~2.46 mg/g FW间波动,而2013年的花色苷含量则为0.82~1.42 mg/g FW(图4),表明2012年果实的成熟度要高于2013年。但是,果实大小对花色苷组分的影响在各质量级次之间没有显著性,花翠素衍生物的含量随着果实质量的增加而减少,而花青素衍生物的含量基本不变。葡萄汁和葡萄酒中花色苷的可萃性与pH值、发酵酒精度和果实中花色苷的比例有密切的关系。研究表明,小粒浆果中的可溶性固形物较高,葡萄酒的酒精度也大,葡萄酒酿造过程中提取出的花色苷也多[29]。
总黄烷-3-醇的含量与浆果大小呈负相关关系,由浆果质量级次≤0.50 g时的1.00 mg/g FW降低至1.01~1.25 g的0.78 mg/g FW后保持相对恒定,降低了约22%(图5)。葡萄果皮中检测到的黄烷-3-醇有(+)儿茶素(C),(-)表儿茶素(EC),(-)表倍儿茶素(EGC),(-)表儿茶素没食子酸酯4类(ECG)。4类黄烷-3-醇的含量都随着浆果的增大而降低,当浆果质量>1.00 g后,黄烷-3-醇的含量保持相对恒定。其中(-)表倍儿茶素是浆果果皮中最丰富的黄烷-3-醇单体,含量在0.43 mg/g FW以上。相反,(+)儿茶素是果皮中含量最少的黄烷-3-醇,其含量只有0.02 mg/g FW,占总黄烷醇的2%~2.5%。
随着浆果大小的增加,黄酮醇含量并没有明显的下降趋势(图6),槲皮素类、山奈酚类和杨梅酮类黄酮醇含量的变化趋势与总黄酮醇的一致,其≤1.00 g质量级次的浆果中的黄酮醇含量高于其它质量级次。6个质量级次中,0.76~1.00 g质量级次的黄酮醇含量最高,达到112.65 μg/g FW;与其相邻的质量级次1.01~1.25 g的黄酮醇含量则最低,仅有79.82 μg/g FW,降低了29%。
2.4.3 主要香气化合物分析
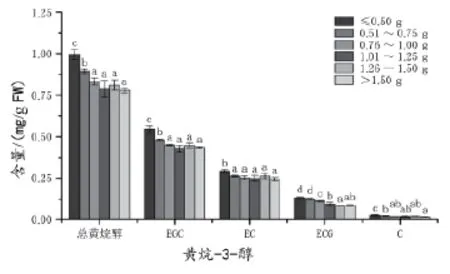
图5 2012年不同质量级次浆果果皮中黄烷-3-醇含量的差异
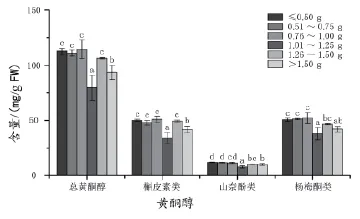
图6 2012年不同质量级次浆果果皮中黄酮醇含量的差异
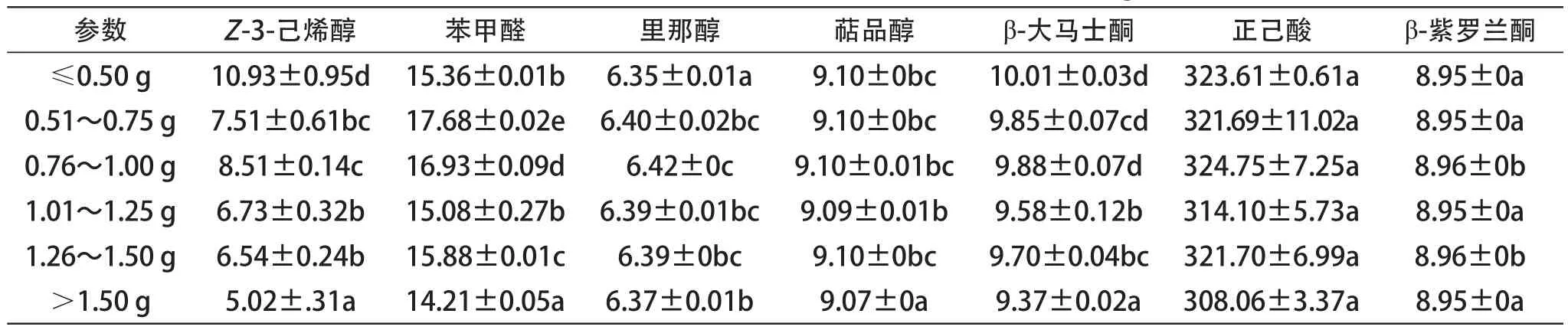
表4 2012年不同质量级次浆果的香味物质游离态含量 (☒g/L)
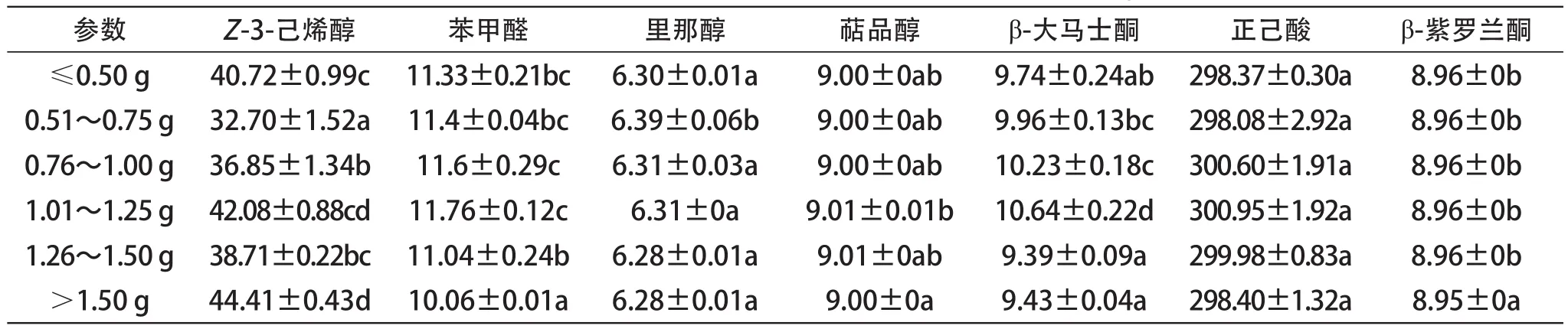
表5 2013年不同质量级次浆果的香味物质游离态含量 (☒g/L)
本研究检测了赤霞珠葡萄中7种典型的香味物质并进行分析(表4、表5)。总体上看,正己酸、里那醇、萜品醇和β-紫罗兰酮随浆果大小变化含量保持稳定,两年间结果相一致;而Z-3-己烯醇、苯甲醛和β-大马士酮等物质的含量随浆果大小变化呈现“动态波动”。在2013年苯甲醛含量基本不随浆果大小变化,而在2012年,在中等果粒(0.76~1.25 g)的苯甲醛含量要显著性高于其余级别的浆果;Z-3-己烯醇含量在2012年随浆果大小增加呈下降趋势,而在2013年除最小级别的果粒外整体呈上升趋势,可见年份对香味物质的积累有很大影响;β-大马士酮是赤霞珠葡萄果实中一种非常重要的C13降异戊二烯类物质,由于其具有非常低的阈值,通常会赋予葡萄及葡萄酒以果香、花香及青香气味[30]。本研究中,β-大马士酮与浆果大小之间并未表现出明显规律,但是从两年数据分析,大果粒级别(>1.25 g)的葡萄果实中β-大马士酮含量显著性偏低,这可能是由于果粒大带来的“稀释作用”引起的。
3 讨论
对成熟的赤霞珠葡萄而言,浆果体积随浆果质量的增加而增加,但是浆果的密度分布却不集中,因此,浆果在成熟度方面的差异很大。2012年和2013年的浆果质量统计表明,中等大小的浆果(0.76~1.25 g)所占的比例是最高的。由图3所示,相对果皮质量随浆果质量的增加而下降,其结果和球体表面积与体积之间的理论关系是相同的。但相对果皮质量在浆果质量级次>1.00 g时基本不再下降,这可能与葡萄浆果不是一个规则的球体有关。随着葡萄浆果体积的增大,浆果的果皮/果肉比值不再受浆果大小的影响,可能是表面积与体积的关系不再遵循理论关系[10]。总体上看,相对果皮质量随浆果质量增加而下降,相对种子质量随浆果质量的增大而增大。这表明小粒浆果中果皮相对于浆果的比例更大,种子相对于浆果的比例更小,这些结果与前人研究相符[10,31-32]。成熟葡萄浆果中,糖分不会在葡萄果皮中积累,而是贮存于浆果果肉中[33-34]。因此,含糖量与浆果大小有关。本研究发现,随着浆果质量增加,可溶性固形物含量下降,这与前人研究结果一致[18,26]。
浆果大小的差异受多方面因素影响,不同因素引起的浆果大小差异对浆果品质的影响也不同。疏穗处理导致的产量降低在使浆果增大的同时,还能提高葡萄浆果中的糖含量、颜色以及花色苷含量[35-36],葡萄浆果的酿酒品质更佳。但也有人发现疏穗处理不能改善葡萄浆果中对葡萄酒品质有利物质的含量[37-38]。水分胁迫和果穗遮光均会使葡萄浆果变小,水分胁迫能增加葡萄浆果中花色苷和多酚的含量,但对种子中多酚含量无影响;而果穗遮光则会导致葡萄浆果中含糖量,花色苷和多酚含量降低,但不影响其可滴定酸和pH值[26,39]。
葡萄浆果中花色苷主要存在于果皮中,而单宁通常存在于果皮和种子中。在浆果的成熟过程中,葡萄浆果和葡萄酒中酚类物质的含量会受到栽培条件和环境因素的影响。此外,浸渍和发酵过程中的提取也会影响其在葡萄酒中的含量[40]。浆果中花色苷含量与浆果质量呈负相关(图4),这与Roby等人[26]的研究结果一致,他们发现果皮中花色苷的含量与浆果质量成反比,相对果皮质量更大的小粒浆果中花色苷含量更多。黄烷醇含量在小浆果中的下降趋势明显,而黄酮醇含量则无明显的变化趋势(图5和图6),但都表现出其含量在小粒浆果中更高。Casassa等[41]也发现小粒浆果酿成的酒中,黄酮醇和黄烷醇的含量更高。在选取的香气物质中,正己酸、里那醇、萜品醇和β-紫罗兰酮等香味物质随浆果大小变化含量保持稳定,两年间结果相一致;而Z-3-己烯醇、苯甲醛和β-大马士酮等物质的含量随浆果大小变化呈现“动态波动”。
4 结论
随着浆果增大,可溶性固形物含量、总酚、花色苷、黄酮醇及黄烷醇含量下降,部分香味物质的含量随浆果大小变化呈现“动态波动”。此外,年份对赤霞珠葡萄的浆果大小和分布也有影响。成熟的赤霞珠葡萄浆果中,有59%(2013年)~64%(2012年)的浆果质量在0.76~1.25 g之间;中等大小的浆果组织结构性较好,酚类物质含量较高,其酿酒品质更佳。
[1] GLADSTONES J. Viticulture and environment[M]. Winetitles, 1992.
[2] HARDIE W J, MARTIN S R. A strategy for vine growth regulation by soil water management[C]//7th Australian wine industry technical conference, Adelaide. Winetitles, Adelaide. 1990: 251-257.
[3] MATTHEWS M A, ANDERSON M M. Reproductive development in grape (Vitis vinifera L.): responses to seasonal water deficits[J]. American Journal of Enology and Viticulture, 1989, 40(1): 52-60.
[4] COOMBE B G, DUNDON R J, SHORT A W S. Indices of sugar—acidity as ripeness criteria for winegrapes[J]. Journal of the Science of Food and Agriculture, 1980, 31(5): 495-502.
[5] MATTHEWS M, KRIEDEMANN P E. Water deficit, yield, and berry size as factors for composition and sensory attributes of redwine[M]. Proceedings of the Australian society of viticulture and oenology 'Finishing the Job'. 2006: 46-54.
[6] DAI Z W, OLLAT N, GOM☒S E, et al. Ecophysiological, genetic, and molecular causes of variation in grape berry weight and composition: a review[J]. American Journal of Enology and Viticulture, 2011, 62(4): 413-425.
[7] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines I. Monomeric anthocyanins and their color expression[J]. Molecules, 2012, 17(2): 1571-1601.
[8] BOULTON R. The copigmentation of anthocyanins and its role in the color of red wine: a critical review[J]. American Journal of Enology and Viticulture, 2001, 52(2): 67-87.
[9] LESSCHAEVE I, NOBLE A C. Polyphenols: factors influencing their sensory properties and their effects on food and beverage preferences[J]. The American Journal of Clinical Nutrition, 2005, 81(S1): 330-335.
[10] BARBAGALLO M G, GUIDONI S, HUNTER J J. Berry size and qualitative characteristics of Vitis vinifera L. cv. Syrah[J]. S. Afr. J. Enol. Vitic, 2011, 32(1): 129-136.
[11] HOLT H E, FRANCIS I L, FIELD J, et al. Relationships between berry size, berry phenolic composition and wine quality scores for Cabernet Sauvignon (Vitis vinifera L.) from different pruning treatments and different vintages[J]. Australian Journal of Grape and Wine Research, 2008, 14(3): 191-202.
[12] MATTHEWS M A, ANDERSON M M. Fruit ripening in Vitis vinifera L.: responses to seasonal water deficits[J]. American Journal of Enology and Viticulture, 1988, 39(4): 313-320.
[13] MATTHEWS M A, NUZZO V. Berry size and yield paradigms on grapes and wines quality[J]. Acta Horticulturae, 2007, 754: 423-436.
[14] ROBY G, MATTHEWS M A. Relative proportions of seed, skin and flesh, in ripe berries from Cabernet Sauvignon grapevines grown in a vineyard either well irrigated or under water deficit[J]. Australian Journal of Grape and Wine Research, 2004, 10(1): 74-82.
[15] GORDILLO B, Cejudo-Bastante M J, Rodríguez-Pulido F J, et al. Impact of adding white pomace to red grapes on the phenolic composition and color stability of syrah wines from a warm climate[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2663-2671.
[16] SINGLETON V L. Effects on red wine quality of removing juice before fermentation to simulate variation in berry size[J]. American Journal of Enology and Viticulture, 1972, 23(3): 106-113.
[17] GIL M, PASCUAL O, Gómez-Alonso S, et al. Influence of berry size on red wine colour and composition[J]. Australian Journal of Grape and Wine Research, 2015, 21(2): 200-212.
[18] MELO M S, SCHULTZ H R, VOLSCHENK C G, et al. Berry size variation of Vitis vinifera L. cv. Syrah: Morphological dimensions, berry composition and wine quality[J]. South African Journal of Enology and Viticulture, 2015, 36(1): 1-10.
[19] WEN Y Q, CUI J, ZHANG Y, et al. Comparison of organic acid levels and L-IdnDH expression in Chinese-type and European-type grapes[J]. Euphytica, 2014, 196(1): 63-76.
[20] HE J J, LIU Y X, PAN Q H, et al. Different anthocyanin profiles of the skin and the pulp of Yan73 (Muscat Hamburg×Alicante Bouschet) grape berries[J]. Molecules, 2010, 15(3): 1141-1153.
[21] LIANG N N, HE F, BI H Q, et al. Evolution of flavonols in berry skins of different grape cultivars during ripening and a comparison of two vintages[J]. European Food Research and Technology, 2012, 235(6): 1187-1197.
[22] WU Y, PAN Q, QU W, et al. Comparison of volatile profiles of nine litchi (Litchi chinensis Sonn.) cultivars from Southern China[J]. Journal of Agricultural and Food Chemistry, 2009, 57(20): 9676-9681.
[23] WU Y, ZHU B, TU C, et al. Generation of volatile compounds in litchi wine during winemaking and short-term bottle storage[J]. Journal of Agricultural and Food Chemistry, 2011, 59(9): 4923-4931.
[24] ROLLE L, TORCHIO F, GIACOSA S, et al. Berry density and size as factors related to the physicochemical characteristics of Muscat Hamburg table grapes (Vitis vinifera L.)[J]. Food Chemistry, 2015, 173: 105-113.
[25] KONTOUDAKIS N, ESTERUELAS M, FORT F, et al. Influence of the heterogeneity of grape phenolic maturity on wine composition and quality[J]. Food Chemistry, 2011, 124(3): 767-774.
[26] ROBY G, HARBERTSON J F, ADAMS D A, et al. Berry size and vine water deficits as factors in winegrape composition: anthocyanins and tannins[J]. Australian Journal of Grape and Wine Research, 2004, 10(2): 100-107.
[27] KENNEDY J A, MATTHEWS M A, WATERHOUSE A L. Effect of maturity and vine water status on grape skin and wine flavonoids[J]. American Journal of Enology and Viticulture, 2002, 53(4): 268-274.
[28] MONAGAS M, Gómez-Cordovés C, Bartolomé B, et al. Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes from Vitis vinifera L. Cv. Graciano, Tempranillo, and Cabernet Sauvignon[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6475-6481.
[29] Romero-Cascales I, Ortega-Regules A, López-Roca J M, et al. Differences in anthocyanin extractability from grapes to wines according to variety[J]. American Journal of Enology and Viticulture, 2005, 56(3): 212-219.
[30] FLAMINI R, TRALDI P. Grape Aroma Compounds: Terpenes, C13-Norisoprenoids, Benzene Compounds, and 3-Alkyl-2-Methoxypyrazines[M]. Mass Spectrometry in Grape and Wine Chemistry, 2010: 95-116.
[31] BINDON K, MYBURGH P, OBERHOLSTER A, et al. Response of grape and wine phenolic composition in Vitis vinifera L. cv. Merlot to variation in grapevine water status[J]. S. Afr. J. Enol. Vitic, 2011, 32(1): 71-88.
[32] PONI S, LIBELLI N. Dimensione dell'acino e qualita dell'uva: una relazione non scontata[J]. Informatore Agrario, 2008, 64(17): 31.
[33] COOMBE B G. Distribution of solutes within the developing grape berry in relation to its morphology[J]. American Journal of Enology and Viticulture, 1987, 38(2): 120-127.
[34] POSSNER D R E, KLIEWER W M. The localization of acids, sugars, potassium and calcium in developing grape berries[J]. Vitis, 1985, 24(4): 229-240.
[35] PETRIE P R, CLINGELEFFER P R. Crop thinning (hand versus mechanical), grape maturity and anthocyanin concentration: outcomes from irrigated Cabernet Sauvignon (Vitis vinifera L.) in a warm climate[J]. Australian Journal of Grape and Wine Research, 2006, 12(1): 21-29.
[36] GUIDONI S, ALLARA P, SCHUBERT A. Effect of cluster thinning on berry skin anthocyanin composition of Vitis vinifera cv. Nebbiolo[J]. American Journal of Enology and Viticulture, 2002, 53(3): 224-226.
[37] KELLER M, MILLS L J, WAMPLE R L, et al. Cluster thinning effects on three deficit-irrigated Vitis vinifera cultivars[J]. American Journal of Enology and Viticulture, 2005, 56(2): 91-103.
[38] LAVEZZI A, RIDOMI A, PEZZA L, et al. Effects of bunch thinning on yield and quality of Sylvoz-trained cv. Prosecco (Vitis vinifera L.)[Veneto][J]. Rivista di Viticoltura e di Enologia (Italy), 1995.
[39] DOKOOZLIAN N K, KLIEWER W M. Influence of light on grape berry growth and composition varies during fruit development[J]. Journal of the American Society for Horticultural Science, 1996, 121(5): 869-874.
[40] KENNEDY J A, Ferrier J, Harbertson J F, et al. Analysis of tannins in red wine using multiple methods: Correlation with perceived astringency[J]. American Journal of Enology and Viticulture, 2006, 57(4): 481-485.
[41] CASASSA L F, LARSEN R C, BEAVER C W, et al. Impact of extended maceration and regulated deficit irrigation (RDI) in Cabernet Sauvignon wines: characterization of proanthocyanidin distribution, anthocyanin extraction, and chromatic properties[J]. Journal of Agricultural and Food Chemistry, 2013, 61(26): 6446-6457.
Influences of the berry weight on wine-making qualitative characteristics of Cabernet Sauvignon
WU Minghui, CHEN Weikai, HE Fei, WANG Yuxi, LIU Xin, YANG Zhe, ZHU Yanrong, SHI Ying, DUAN Changqing, WANG Jun*
(Center for Viticulture and Enology, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
In order to clarify the influences of the berry weight on fruit components and wine grape quality, grape berries at harvest were sampled and detected over two consecutive years as follows: measured the diameter and weight of the berries, analyzed berry weight distribution and the relationship between berry weight and berry size and density; six classes according to berry weight were devided, and determined the changes of the tissue composition of berries, including titratable acidity, total soluble solids, phenolic compounds and aroma compounds of different weight classes. The results showed that 59%(2013)~64%(2012) berries were weighted between 0.76~1.25 g; berry size and berry weight were positively correlated; berry weight had no effect on berry density; berry weight and skin weight, seed number, a single seed weight, total seed weight were positively correlated; the smaller the berry weight, the higher the relative skin weight and the lower relative seed weight; the soluble solids content, total phenol, anthocyanins, flavonols and flavanols of skin decreased as the berry weight increased; berry size also influenced the content of malic acid and tartaric acid; the content of aroma compounds showed no consistent trend with berry size.
berry size; fruit component; wine-making qualitative characteristics; organic acid; phenolic compounds; aroma compounds
S663.1
A
10.13414/j.cnki.zwpp.2017.01.001
2016-10-23
现代农业产业技术体系建设专项资金(CARS-30)
吴明辉(1992-),男,江西吉安人,在读硕士研究生,E-mail: 807066548@qq.com
*通讯作者:王军(1966-),男,教授,河北赤城县人,主要从事葡萄资源评价及鉴定、葡萄花色苷生物合成及调控、葡萄苗木生产等研究,E-mail: jun_wang@cau.edu.cn
