急进高原胃动力紊乱大鼠胃电起搏区Cajal间质细胞和缝隙连接蛋白43的表达
2017-02-22范兴爱杨生岳刘睿年魏廷青
贺 巍, 朱 琳, 范兴爱, 杨生岳, 刘睿年, 魏廷青
(解放军第四医院消化内科,西宁 810007;*通讯作者,E-mail:hewei.1971@163.com)
急进高原胃动力紊乱大鼠胃电起搏区Cajal间质细胞和缝隙连接蛋白43的表达
贺 巍*, 朱 琳, 范兴爱, 杨生岳, 刘睿年, 魏廷青
(解放军第四医院消化内科,西宁 810007;*通讯作者,E-mail:hewei.1971@163.com)
目的 通过观察急进高原大鼠胃动力紊乱发生过程中胃电起搏区Cajal间质细胞(interstitial cell of Cajal,ICC)与缝隙连接蛋白43(Connexin43,Cx43)的表达变化,探讨其机制。 方法 30只SD大鼠以低海拔地区(海拔400 m)为对照组,并以进入高原地区(海拔4300 m)后的时间节点分为3 d和14 d组,每组10只。测定各组大鼠胃电活动数据,电子显微镜观察胃电起搏区ICC的微观结构变化,双重免疫荧光组化法观察同区域ICC与Cx43的表达变化。 结果 急进高原后大鼠胃电活动的明显受损,波幅衰减尤以3 d显著(P<0.05),ICC的微观结构出现明显损伤,缝隙连接变得明显稀疏、松散。双重免疫荧光组织化学染色结果发现,Cx43及ICC细胞的表达于高原3 d明显减低(P<0.05),正常生理功能受损。 结论 ICC细胞受损及其缝隙连接蛋白Cx43的表达异常导致平滑肌运动障碍,可能是胃动力紊乱发生的作用机制之一。
高原病; 胃动力; 胃电起搏区; Cajal间质细胞; Cx43连接蛋白; 大鼠
急进高原胃肠动力紊乱是最常见的急性高原反应之一,一般经7-10 d的高原适应期后可逐渐缓解或消失[1],然而有关急进高原胃肠动力紊乱的发生机制目前尚不完全清楚。ICC细胞是广泛分布胃肠道内的特殊间质细胞,它不但是胃肠基本电节律(basic electric rhythm)的起始点[2,3],同时又在肠神经系统及平滑肌间起着传导信号的作用[4],在胃肠动力调控中发挥重要作用。缝隙连接又称为通讯连接(communication junction),是细胞连接的一种方式,同样是细胞间跨膜信号传导的重要方式之一,而Cx43连接蛋白作为重要的连接蛋白之一,其大量存在于人、大鼠、小鼠、猪及犬的胃肠道壁中[5],发挥信号传导作用。本研究将应用免疫荧光双标记的方法,通过标记ICC细胞和Cx43连接蛋白,观察其表达分布变化,以探讨急进高原胃动力紊乱的发生机制。
1 材料与方法
1.1 主要仪器及试剂
RM6280B生物信号采集处理系统(成都仪器厂),超低温冰箱(-80 ℃)及超低温切片机(美国NUAIR公司),FV1000激光共聚焦显微镜(日本OLYMPUS公司),TecnaiG2分析透射电镜(美国FEI公司),兔抗大鼠多克隆c-kit抗体(美国LifeSpan BioSciences公司),小鼠抗大鼠单克隆抗体、驴抗兔FITC标记单克隆抗体、驴抗小鼠alexa fluor单克隆抗体均购自英国Abcom公司。
1.2 实验动物与分组
6周龄雄性SD大鼠30只,SPF级,体重(200±20)g,许可证号:SCXK(陕)2012-003,购自西安交通大学实验动物中心。以低海拔地区(西安,海拔400 m)为对照组,另以大鼠起运后3 d内进驻实验现场模拟急进高原状态,并以进入高海拔地区(玛多,海拔4 300 m)后的时间节为依据,依达到实验地区后的时间顺序,设置胃动力障碍观测最明显的3 d组[6],恢复期的14 d组,每组10只大鼠。
1.3 胃电生理活动检测
SD大鼠术前12 h禁食,术前6 h禁水,戊巴比妥钠腹腔注射(40 mg/kg)麻醉,在大鼠腹部正中切开,选择胃电起搏区的胃体中部上1/3处浆膜层埋置引导电极[7],测量胃电活动变化,参数设定为:生物电,500 mV,直流,30 Hz,记录波形并分析。
1.4 实验标本的采集与固定
电生理测定完成后,剪开胸腔,经升主动脉插管,快速灌入生理盐水冲洗血液,并沿胃大弯测剪开,于胃体中部上1/3处取0.2 cm×0.1 cm大小组织,3%戊二醛固定,用于电镜染色,后继续经升主动脉先快后慢灌注冷的(4 ℃)4%多聚甲醛的0.1 mol/L磷酸缓冲液(PB,pH7.4)500 ml,注毕立即取全胃置于20%的蔗糖溶液中过夜沉底。
1.5 胃电起搏区ICC细胞微观结构观察
取3%戊二醛固定组织用0.2 mol/L蔗糖磷酸缓冲液漂洗,用2%四氧化锇后固定1 h,丙酮中梯度脱水,在1%醋酸双氧铀中停滞染色1 h,再通过环氧丙烷与环氧树脂。1 mm切片用亚甲蓝染色,在光镜下观察,确定黏膜层、环形肌层、纵行肌层,再次经70 nm超薄切片后用酒精醋酸双氧铀、用柠檬酸盐后染色,保留纵行肌层、环形肌层、黏膜下层、部分黏膜层,用透射电镜观察。
1.6 双重免疫荧光化学法检测ICC及Cx43表达
取固定后胃体中部上1/3处0.4 cm×0.2 cm组织用超低温切片机切片10 μm,使用0.01 mol/L PBS漂洗3次,置入含0.3% Triton X-100的0.01 mol/L PBS中浸泡30 min(室温),经0.01 mol/L PBS液漂洗,进行免疫组织化学荧光染色(以c-kit抗体标记ICC细胞):分别加入兔抗大鼠多克隆c-kit抗体(1∶150)及小鼠抗大鼠单克隆Cx43抗体(1∶200),室温孵育24 h,经0.01 mol/L PBS液漂洗3次后,分别加入荧光二抗,驴抗兔FITC标记单克隆抗体(1∶400)及驴抗小鼠alexa fluor 594单克隆抗体(1∶400),避光室温孵育2 h。经0.01 mol/L PBS洗3次,80%甘油封片,以上过程均需避光操作。各组切片各取10张,在FV1000激光共聚焦显微镜下采用20倍及40倍视野观察,观察每张切片取6-8个视野,并将数字化图像储存。
1.7 统计学分析
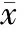
2 结果
2.1 急进高海拔地区后大鼠胃电生理变化
急进高海拔地区后,大鼠胃电的波频及波幅均受损明显,3 d组与低海拔对照组比较显著下降(P<0.05),此后缓慢恢复,其中波频恢复相对较快,14 d组时其波频与低海拔对照组无明显统计学差异(P>0.05),而波幅恢复相对较慢,14 d组胃电波幅仍明显低于低海拔对照组(P<0.05,见表1,图1)。
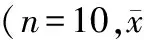

组别波幅(mV)波频(Hz)低海拔对照组1822.91±615.8249.55±0.92高海拔3d组178.77±26.39∗#44.58±0.91∗高海拔14d组511.13±107.95∗49.81±0.35
与低海拔组比较,*P<0.05;与14 d组比较,#P<0.05

A.低海拔对照组;B高海拔3 d组;C 高海拔14 d组图1 大鼠急进高原后胃电活动时程变化Figure 1 Effects of ascending to high altitude on gastric electrical activity in the rats
2.2 急进高原后大鼠胃电起搏区的ICC的微观结构变化
低海拔地区对照组ICC在电镜下观察可见:细胞结构完整,缝隙连接紧密,核周细胞质充盈,细胞器数量较多,细胞内部罕见空泡样改变,无凋亡小体。急进高原地区后,3 d组时ICC细胞微观结构明显受外界环境影响、受损,细胞缝隙连接变得明显松散;细胞内细胞器数量明显减少,线粒体可见明显空泡样肿胀、变性,核周细胞质空泡样改变明显,甚至部分ICC基膜不完整形成空洞;可见核固缩形成,核内可见异染色质,凋亡小体显著增多(见图2)。
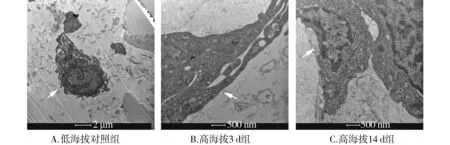
图2 大鼠急进高原后对胃电起搏区ICC细胞微观结构的影响Figure 2 Effects of ascending to high altitude on ultrastructure of ICC in the rats’ gastric pacing location
2.3 急进高原后大鼠胃电起搏区c-kit及Cx43的表达变化
在低海拔对照组ICC主要表达分布于环肌层与纵肌层及其交界部,黏膜下层也可见阳性细胞分布,即位于肌间、肌内以及黏膜下层。急进高原后ICC主要表达分布仍位于肌间、肌内以及黏膜下层,较低海拔组未见明显变化,但3 d组和14 d组c-kit表达量均明显下降(P<0.05)。Cx43的表达变化与ICC表达改变同步,3 d组和14 d组表达量与低海拔对照组相比均明显下降(P<0.05,见表2,图3)。
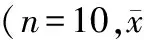
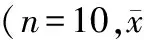

组别c⁃kitCx43c⁃kit/Cx43低海拔对照组44.01±4.5951.41±3.8961.41±3.89高海拔3d组30.70±3.62∗#35.01±3.78∗#45.06±3.56∗#高海拔14d组36.16±3.58∗41.08±4.58∗50.43±4.48∗
与低海拔对照组比较,*P<0.05;与14 d组比较,#P<0.05
3 讨论
消化道平滑肌的蠕动特性与心脏节律类似,具有自发性、节律性的特点,它由慢波,即基本电节律控制。作为胃肠动力基本功能单位的重要组成部分,ICC细胞是慢波的起搏者和传播者[8],引起并调节胃肠平滑肌的自发性、节律性的机械活动,在此过程中ICC细胞居于核心地位,发挥关键性作用,已有研究证实大量胃肠道疾病与ICC细胞的功能异常密切相关[9-11]。Cx43连接蛋白作为一种主要的缝隙连接蛋白,与机体多种病理生理过程密切联系,其表达下降或缺失与多种疾病相关,如:心律失常、胃癌的腹膜转移、功能性消化不良等[12-14]。尤其有研究表明ICC与胃肠道神经元之间、与消化道平滑肌之间以及ICC细胞之间存在大量由紧密并置的质膜形成的缝隙连接,肠神经系统的信号可以通过肠神经系统-ICC-消化道平滑肌形成的网络体系之间的缝隙连接蛋白Cx43,将信号由肠神经通过ICC传递到平滑肌,进而调节胃肠道平滑肌运动[15-17]。
本实验结果表明,急进高原后,伴随大鼠胃电活动的明显受损,特别是其波幅衰减尤为显著(P<0.05),ICC的微观结构出现明显损伤,尤其是缝隙连接变得明显稀疏、松散,提示ICC细胞间及其与平滑肌细胞之间的跨膜信号传导基础受到损伤。双重免疫荧光组织化学染色结果可以发现,ICC细胞的表达也同样于高海拔地区3 d组明显减低(P<0.05),表明其正常生理功能同样受损。Cx43表达变化则与ICC表达改变同步,在高海拔3 d组明显减低(P<0.05),激光共聚焦显微镜下可见其表达于ICC细胞的胞体及突起上的部分减低明显,可能妨碍细胞之间物质信号的传递,尤其是ICC细胞之间及其与平滑肌之间的信号传递,进而引起胃蠕动功能异常。可见急进高原后,作为胃肠电起始者及传播者的ICC细胞本身发生损伤性改变,同时作为信号传播通道的Cx43缝隙连接蛋白也发生功能变化,即胃肠电生理信号的起始、传播的中转站及传播通道均发生损伤性改变,导致正常的电生理信号无法顺利产生并传递至消化道平滑肌,进一步导致胃动力紊乱的发生,可能是急进高原胃动力紊乱形成的重要机制之一。

从上往下分别为低海拔对照组、高海拔3 d组、高海拔14 d组;从左往右分别为c-kit,Cx43,c-kit/Cx43表达图3 大鼠急进高原后对胃电起搏区c-kit及Cx43表达影响 (bar=200 μm)Figure 3 Expression of ICC and Cx43 in rats’ gastric pacing location after ascending to high altitude (bar=200 μm)
[1] 高钰琪.高原军事医学[M].重庆:重庆出版社,2005:106-110.[2] Bielefeldt K,Conklin JL.Intestinal motility duringhypoxia and reoxygenationinvitro[J].Dig Dis Sci,1997,42(5):878-884.
[3] Huizinga JD,Thuneberg L,Vanderwinden JM,etal. Interstitial cells of cajal as targets for pharmacological intervention in gastrointestinal motor disorders[J].Trends Pharmacol Sci,1997,18(10):393-403.
[4] Sanders KM.A case for interstitial cells of Cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract[J].Gastroenterology,1996,111(2):492-515.
[5] Mikkelsen HB,Huizinga JD,Thuneberg L,etal.Immunohistochemical localization of a gap junction protein(connexin43) in the muscularis externa of murine,canine,and human intestine[J].Cell Tissue Res,1993,274(2):249-256.
[6] 朱琳,贺巍,杨生岳,等.急进高原对大鼠胃电活动及胃Cajal间质细胞微观结构和功能的影响[J].山西医科大学学报,2016,47(6):505-519.
[7] 黄裕新,王伟,夏德雨,等.白萝卜提取物促胃动力作用中Cajal间质细胞与P物质的变化[J].胃肠病学和肝病学杂志,2008,17(6):467-469.
[8] Wang XY,Vannucchi MG,Nieuwmeyer F,etal.Changes in interstitial cells of Cajal at the deep muscular plexus are associated with loss of distention-induced burst-type muscle activity in mice infected by Trichinella spiralis[J].Am J Pathol,2005,167(2):437-453.
[9] Velickov A,Mitrovic O,Djordjevic B,etal.The effect of bilberries on diabetes-related alterations of interstitial cells of Cajal in the lower oesophageal sphincter in rats[J].Histol Histopathol,2016,5:11829.
[10] Choi KM,Gibbons SJ,Sha L,etal.Interleukin 10 restores gastric emptying, electrical activity,and interstitial cells of Cajal networks in diabetic mice[J].Cell Mol Gastroenterol Hepatol,2016,2(4):454-467.
[11] 孙金山,王宝西.Cajal间质细胞与胃肠动力疾病[J].中国当代儿科杂志,2006,8(2):164-168.
[12] Wu T,Wu D,Wu,etal.QEffect and mechanism of Irbesartan on occurrence of ventricular arrhythmias in rats with myocardial ischemia through connexin43(cx43)[J].Neuropharmacology,2016,111:34-46.
[13] Tang B,Peng ZH,Yu PW,etal.Aberrant expression of Cx43 is associated with the peritoneal metastasis of gastric cancer and Cx43-mediated gap junction enhances gastric cancer cell diapedesis from peritoneal mesothelium[J].PLoS One,2013,8(9):e74527.
[14] Zhang G,Xie S,Hu W,etal.Effects of electroacupuncture on interstitial cells of Cajal(ICC) ultrastructure and connexin 43 protein expression in the gastrointestinal tract of functional dyspepsia(FD) rats[J].Med Sci Monit,2016,22:2021-2027.
[15] 李卫东,陈云,连至诚.小型猪胃肠道Cajal间质细胞超微结构的研究[J].解剖学研究,2006,28(1):55-57.
[16] Chen JH.Ineffective esophageal motility and the vagus:current challenges and future prospects[J].Clin Exp Gastroenterol,2016,9:291-299.
[17] Müller M,Colcuc S,Drescher DG,etal.Murine genetic deficiency of neuronal nitric oxide synthase (nNOS(-/-) ) and interstitial cells of Cajal (W/W(v)):Implications for achalasia?[J].J Gastroenterol Hepatol,2014,29(10):1800-1807.
Expression of interstitial cell of Cajal and Connexin43 in gastric electrical pacing region of rats after ascending to high altitude
HE Wei*, ZHU Lin, FAN Xing’ai, YANG Shengyue, LIU Ruinian, WEI Tingqing
(DepartmentofGastroenterology,FourthHospitalofPLA,Xining810007,China;*Correspondingauthor,E-mail:hewei.1971@163.com)
ObjectiveTo investigate the gastric pacing interstitial cells of Cajal(interstitial cell of Cajal,ICC)and Connexin43( Cx43) expression in rats after ascending to high altitude, and to explore its mechanism.MethodsThirty SD male rats were divided into three groups(n=10 in each group):low altitude group (Xi’an, 400 m), high altitude(4 300 m) 3 d, 14 d groups. The rats’ gastric electrical activity was measured in different groups. Electron microscope was applied to observe0 the physiological ultrastructure of ICC cells, and the immunofluorescence staining was used to observe the expression of ICC cells and Cx43 in gastric electrical pacing region.ResultsThe amplitude and frequency of gastric electrical activity of rats were the lowest in high altitude 3 d group(P<0.05). The gap junctions and organelles of ICC cells were reduced in high altitude 3 d group, and the apoptotic bodies were observed by electron microscope. The expression of ICC cells and Cx43 was also the lowest in high altitude 3 d group(P<0.05).ConclusionThe damages of ICCs,Cx43 abnormal expression, and the destruction of the gap junction may induce the dysfunctions of intercellular substance exchange and signal transmission,which might partly be responsible for the pathogenesis of gastric motility disorders in high altitude-exposed rats.
mountain sickness; gastric motility; gastric electrical pacing region; interstitial cell of Cajal; Cx43; rat
青海省(应用)基础研究计划资助项目(2013-Z-760)
贺巍,男,1971-10生,硕士,主任医师, E-mail:hewei.1971@163.com
2016-11-04
594.3
A
1007-6611(2017)01-0022-04
10.13753/j.issn.1007-6611.2017.01.005
