耐力训练诱导的肥胖大鼠Irisin抑制脂肪组织FTO表达
2017-02-21王漫卓刘艳环马国栋
王漫卓,苏 文,刘艳环,马国栋
耐力训练诱导的肥胖大鼠Irisin抑制脂肪组织FTO表达
王漫卓,苏 文,刘艳环,马国栋
目的:耐力训练引起的高脂膳食诱导肥胖大鼠Irisin水平变化与脂肪组织FTO表达的关系研究。方法:以雄性SD大鼠为研究对象,将大鼠随机分为对照组(C组)、高脂膳食组(HD)、高脂膳食结合运动组(HDE)和运动训练组(CE组),以跑台训练为运动干预手段,坡度为0°,8.2m/min(相当于53%VO2max),第1次运动15min,第2次运动30min,第3次运动45min,第4次以后每次运动60min,共运动8周,每周5次,测定大鼠体重、脂肪重量、血液Irisin含量、骨骼肌FNDC5mRNA和蛋白表达、脂肪组织FTO和UCP1基因mRNA和蛋白表达。结果:高脂膳食显著引起大鼠体重和脂肪含量增加,血液Irisin水平显著降低,骨骼肌FNDC5表达显著降低,脂肪组织FTO表达显著升高而UCP1表达显著降低;耐力训练可以显著降低高脂膳食引起的体重和脂肪含量的增加,显著升高高脂膳食引起的血液Irisin降低,显著升高高脂膳食诱导的骨骼肌FNDC5表达的降低,显著降低高脂膳食引起的脂肪组织FTO表达的升高,而显著升高高脂膳食诱导的UCP1表达的降低;血液中Irisin水平与脂肪组织中FTOmRNA和蛋白呈中度负相关;高脂膳食与高脂膳食结合运动组,骨骼肌中FNDC5mRNA和蛋白与脂肪组织FTOmRNA和蛋白分别呈中度负相关;运动组FNDCmRNA与脂肪组织FTOmRNA无相关,而蛋白呈中度负相关。结论:耐力训练大鼠可能通过释放Irisin,抑制脂肪组织FTO基因表达,进而增强UCP1表达。
耐力训练;肥胖;III型肌肉纤维蛋白包含蛋白5;脂肪质量与肥胖相关基因;大鼠
据世界卫生组织统计,全世界大约有14亿人口超重,其中约1/3属于肥胖。肥胖危害巨大,可以引起多种疾病,如胰岛素抵抗、代谢综合征、2型糖尿病、高血压、慢性肾病、心血管疾病、癌症、老年痴呆等[1]。肥胖与遗传有密切的关系。最近通过全基因组相关(genome-wide association study)研究发现了一个与肥胖密切相关的基因,即脂肪质量与肥胖相关基因(fat mass and obesity-associated,FTO)[2-4]。当抑制小鼠FTO基因活性后,小鼠出现生长延迟、脂肪组织体积和重量降低、能量消耗加强、抑制高脂膳食引起的肥胖等现象[5]。有趣的是,当在人类脂肪细胞中降低FTO表达时,其解偶联蛋白1(uncoupling protein 1,UCP1)表达显著升高(升高了4倍)[6],与之一致的是,在FTO基因敲除的小鼠脂肪组织中,UCP1也显著表达上调[6]。
2012年Spiegelman教授的实验室在Nature上发表文章,发现了一种新的肌肉因子Irisin,它可以使白色脂肪细胞表达解偶联蛋白1(UCP1,棕色脂肪细胞生物标志蛋白)显著升高,也即使白色脂肪组织“棕色化”[7]。这一发现立刻得到了人们的广泛关注[8]。运动通过PGC-1α诱导III型肌肉纤维蛋白包含蛋白5(fibronectin type III domain containingprotein 5,FNDC5)表达升高,FNDC5 N末端部分可以被蛋白酶切割,切割下1个由110个氨基酸组成的多肽,而这一多肽可以进入血液发挥激素的作用,Spiegelman等将这一多肽命名为Irisin[7]。Irisin的重要功能之一则是白色脂肪“棕色化”。Bostrsm P等用20nM的FNDC5孵育皮下脂肪细胞(白色脂肪),UCP1蛋白mRNA表达显著升高,免疫组化结果显示UCP1(UCP1为棕色脂肪细胞的生物标记物之一)阳性细胞也显著升高,在电子显微镜下,其细胞内线粒体的数量显著增加,整体表现出棕色脂肪细胞的特征,另外,细胞的耗氧量也显著升高[7]。当给予经过7天游泳训练的大鼠腹膜注射FNDC5抗体后,运动引起的皮下脂肪组织中UCP1表达被显著抑制。上述结果充分说明Irisin能够引起白色脂肪“棕色化”[7]。
运动是减肥的有效方式,但目前其机制尚不完全清楚。运动可以引起骨骼肌释放Irisin,进而引起脂肪组织UCP1的表达增加,减少脂肪的沉积[9],而抑制FTO基因表达也会引起脂肪组织UCP1表达的增加,那么Irisin与FTO关系如何?运动是否通过Irisin释放引起FTO基因表达降低,进而引起脂肪组织UCP1表达升高,从而达到减肥的目的?这一假设可为理解运动减肥的机制提供新的理论依据。
1 材料与方法
1.1 实验动物及分组
雄性6周龄SD大鼠48只,购买于北京大学医科部实验动物中心。实验动物随机分为4组:(1)对照组(C,n=12);(2)高脂膳食组(HD,n=12);(3)高脂膳食结合运动组(HDE,n=12);(4)运动组(CE,n=12)。高脂膳食成分依据罗艳蕊等的报道[10]。
1.2 耐力训练模型
跑台运动方案:在50%-70%VO2max运动时,分解脂肪较多[11],因此实验采用Bedford运动模型,该模型据鼠体重/摄氧量回归方程所建立[12],0,8.2m/min (相当于53VO2max),第1次运动15min,第2次运动30min,第3次运动45min,从第4次以后每次运动60min,共运动8周,每周5次。
1.3 实验动物取材
大鼠在实验结束时,禁食12h,麻醉,取血液、骨骼肌和肾周及附睾周围脂肪组织,骨骼肌和脂肪组织立即放于液氮中,然后-20℃冰箱保存,以备测定FNDC5、FTO和UCP1基因mRNA和蛋白表达。
1.4 大鼠脂肪重量的测定
在每一组实验动物结束阶段,麻醉处死大鼠后,取肾周围及附睾周围的脂肪,用电子天平(深圳市华恒仪器有限公司)秤量脂肪的重量。
1.5 血液Irisin的测定
采用ELISA试剂盒测定大鼠血清Irisin浓度,试剂盒购买自Aviscera生物科技公司,严格按照试剂盒操作说明进行操作。
1.6 大鼠骨骼肌FNDC5和脂肪组织FTO与UCP1mRNA表达的测定
用Trizol Reagent试剂盒(Mrcgene产品)与逆转录试剂盒(Ferment产品)参照说明书对脂肪组织FTO与UCP1和骨骼肌FNDC5基因进行逆转录反应。FTO基因引物序列参照文献[13],FNDC5和UCP1自行设计引物:
FTO: 上游:5’- CACTTGGCTTCCTTACCTGACCCCC -3’,下游:5’- GGTATGCTGCCGGCCTCTCGG -3’
FNDC5:上游:5’- CAACGAGCCCAATAACAACA -3’,下游:5’- AGAAGGTCCTCTCGCATTCTC -3’
UCP1:上游:5’-CGGAATTCGAGCCAAGATGGTGAGT-3’,下游:5’-CGGAACGTAGGTCCCAGTGTAGCG-3’
β-actin:上游 5’-TGGTGGGTATGGGTCAGAAGGACTC-3’,下游5’-CATGGCTGGGGTGTTGAAGGTCTCA-3’
1.7 Western blotting
将冷冻的大鼠骨骼肌和脂肪组织磨碎,加入SDS上样缓冲液, 100℃加热5min,用15%的SDS聚丙烯酰胺凝胶进行电泳,然后用电转印,将蛋白转移到PVDF膜上,用1:1000的抗体稀释液进行杂交,FNDC5抗体购自Biorbyt公司(英国)、FTO和UCP1抗体抗体购自Abcam公司(英国)。条带用化学发光系统进行测定。
1.8 统计学分析
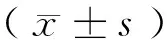
2 实验结果
2.1 大鼠体重变化
大鼠饲喂高脂膳食后,体重显著高于对照组,高脂膳食结合运动后其体重显著低于单纯的高脂膳食组,但依然显著高于对照组,而对照组与单纯运动组未见显著性差异(见图1)。
2.2 大鼠附睾及肾周围脂肪含量变化
大鼠饲喂高脂膳食后,肾周及附睾周的脂肪显著高于对照组,高脂膳食结合运动后其脂肪重量显著低于单纯的高脂膳食组,但依然显著高于对照组,单纯运动组显著高于对照组(见图2)。
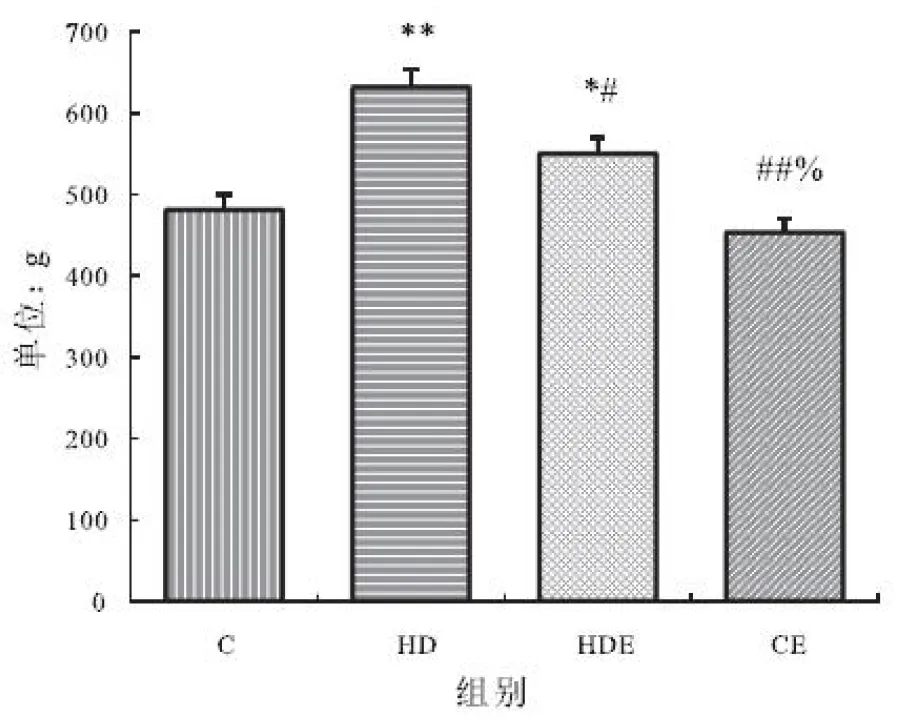
图1 不同组大鼠体重变化(单位:g)
Figure 1 The change of body weight in different groups
注:与对照组比较,*P<0.05,**P<0.01;与HD组比较,#P<0.05,##P<0.01;与HDE组比较;%P<0.05,%%P<0.01。下同。
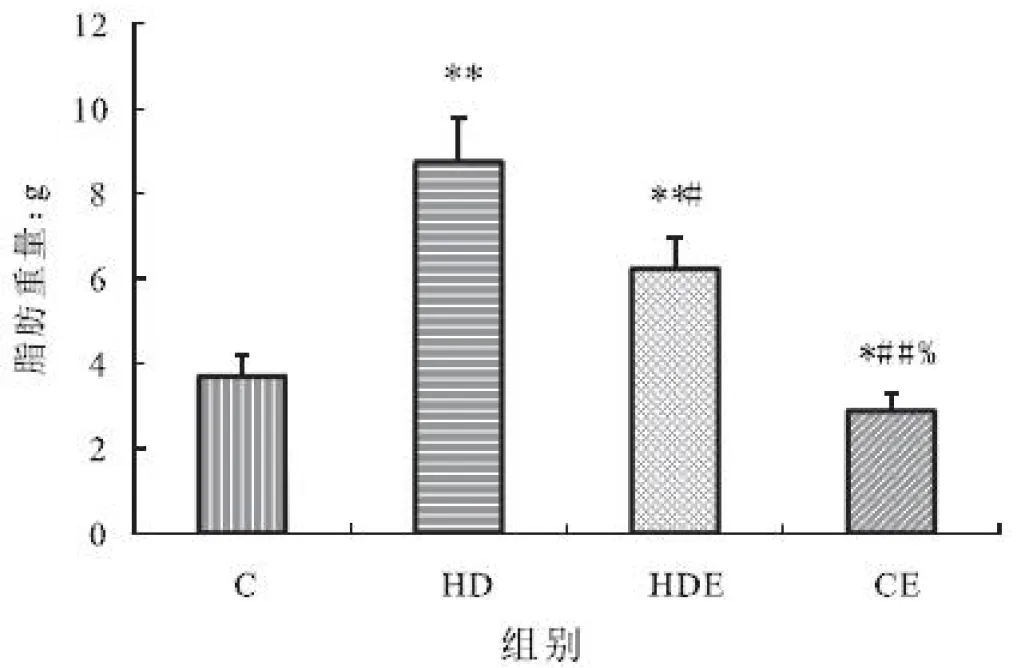
图2 不同组大鼠脂肪重量变化(单位:g)
Figure 2 The change of fat weight in different groups
2.3 大鼠血液Irisin含量变化
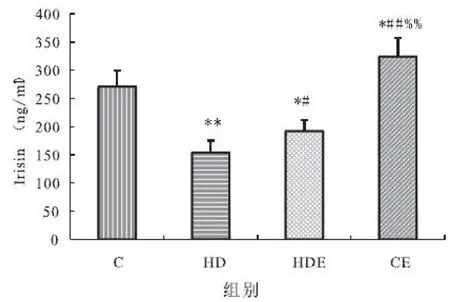
高脂膳食组与高脂膳食结合运动组,血液Irisin水平均显著低于对照组,而单纯运动组显著高于对照组;高脂膳食结合运动组与单纯运动组则显著高于高脂膳食组;单纯运动组显著高于高脂膳食结合运动组(见图3)。
图3 不同组大鼠血液Irisin水平变化(单位:ng/ml)
Figure 3 The change of serum irisin level in different groups
2.4 大鼠脂肪组织FTOmRNA和蛋白表达
大鼠脂肪组织FTOmRNA表达与蛋白表达表现出相同的变化规律。与对照组相比,高脂膳食组与高脂膳食结合运动组均显著升高,而单纯运动组显著降低;与高脂膳食组相比,高脂膳食结合运动组与单纯运动组均显著降低;单纯运动组显著低于高脂膳食结合运动组(见图4 A和B)。
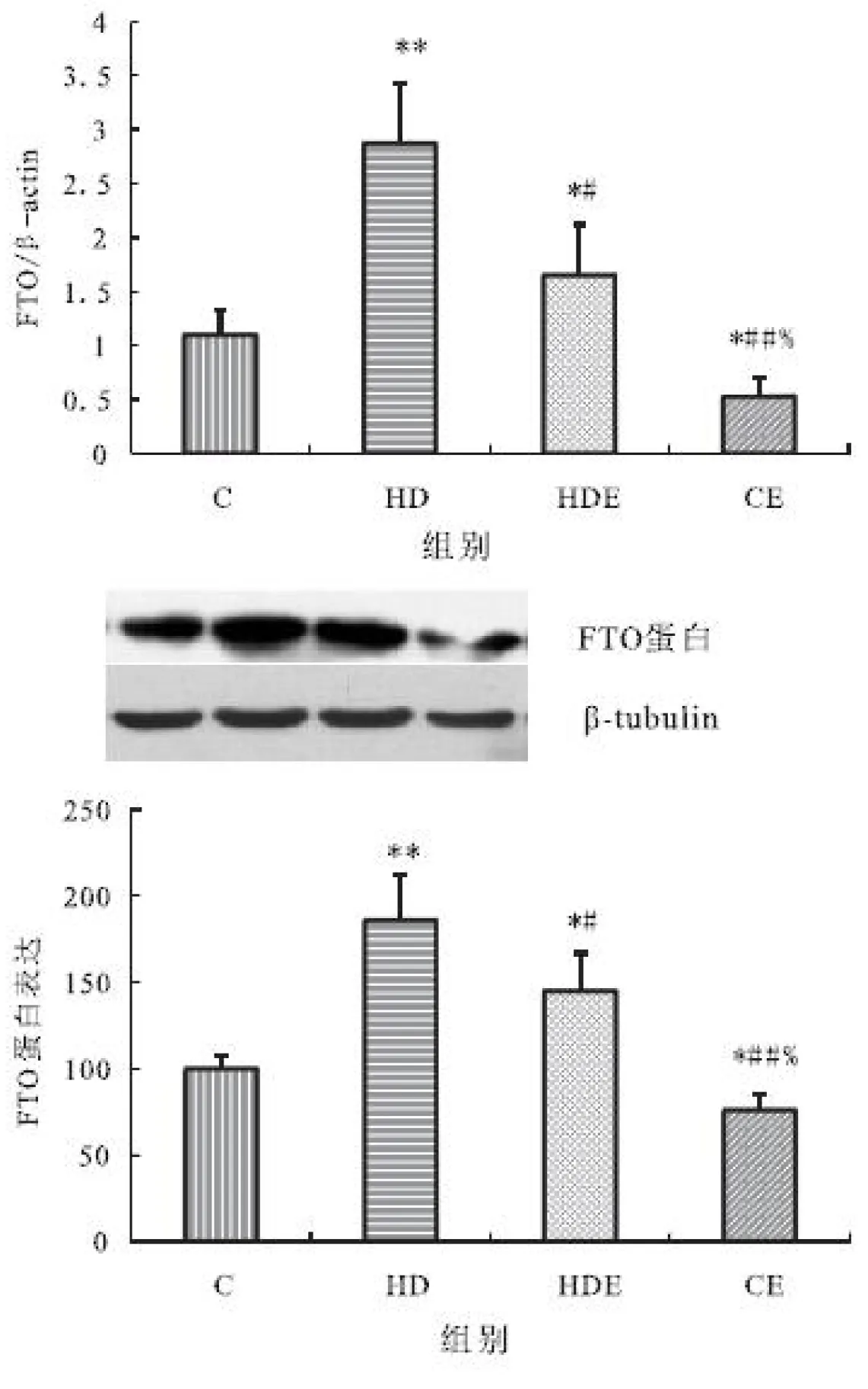
图4 不同组大鼠脂肪FTOmRNA和蛋白表达的变化(A.mRNA表达;B.蛋白表达)
Figure 4 The change of expressions of FTO mRNA and protein in fatty tissue in different groups.(A.mRAN expression;B.protein expression)
2.5 大鼠骨骼肌FNDC5mRNA和蛋白表达
大鼠骨骼肌FNDC5mRNA表达与蛋白表达表现出相同的变化规律。与对照组相比,高脂膳食组与高脂膳食结合运动组均显著降低,而单纯运动组显著升高;与高脂膳食组相比,高脂膳食结合运动组与单纯运动组均显著升高;单纯运动组显著高于高脂膳食结合运动组(见图5 A和B)。
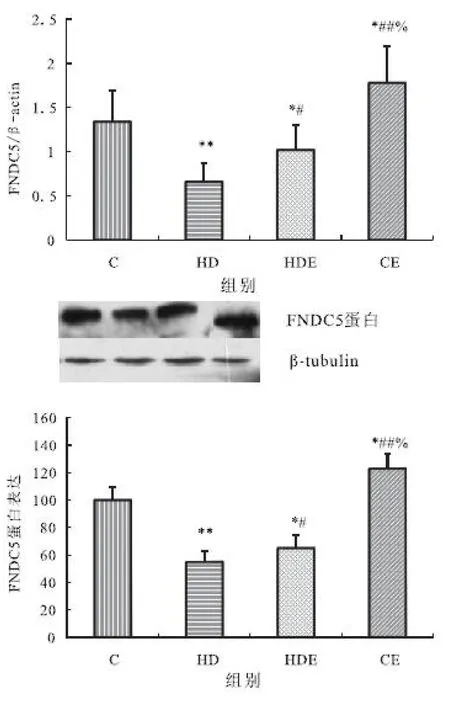
图5 不同组大鼠骨骼肌FNDC5mRNA和蛋白表达的变化(A.mRNA表达;B.蛋白表达)
Figure 5 The change of expressions of FNDC5 mRNA and protein in skeletal muscle in different groups.(A.mRAN expression;B.protein expression)
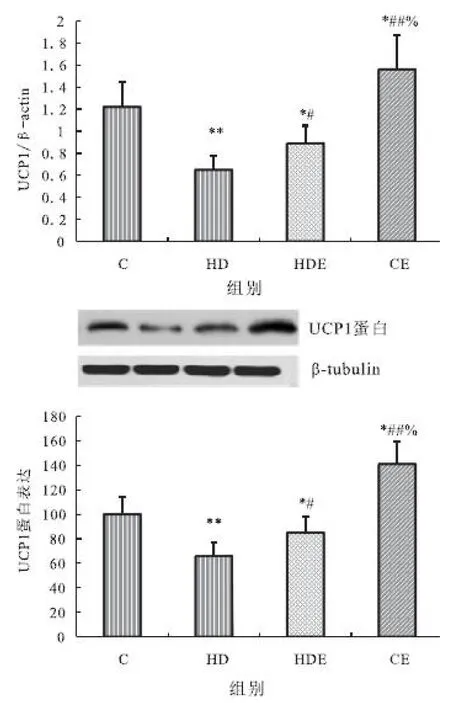
图6 不同组大鼠脂肪组织UCP1mRNA和蛋白表达的变化(A.mRNA表达;B.蛋白表达)
Figure 6 The change of expressions of UCP1 mRNA and protein in fatty tissue in different groups.(A.mRAN expression;B.protein expression)
2.6 大鼠脂肪组织UCP1mRNA和蛋白表达
大鼠脂肪组织UCP1mRNA表达与蛋白表达表现出相同的变化规律。与对照组相比,高脂膳食组与高脂膳食结合运动组均显著降低,而单纯运动组显著升高;与高脂膳食组相比,高脂膳食结合运动组与单纯运动组均显著升高;单纯运动组显著高于高脂膳食结合运动组(见图6 A和B)。
2.7 血液Irisin和骨骼肌FNDC5表达与脂肪组织FTO基因表达的相关性分析
无论是高脂膳食组、高脂膳食结合运动组与单纯运动组,血液中Irisin水平与脂肪组织中FTOmRNA和蛋白呈中度负相关;高脂膳食与高脂膳食结合运动组,骨骼肌中FNDC5mRNA和蛋白与脂肪组织FTOmRNA和蛋白分别呈中度负相关,单纯运动组FNDCmRNA与脂肪组织FTOmRNA无相关,而蛋白呈中度负相关(见表1)。
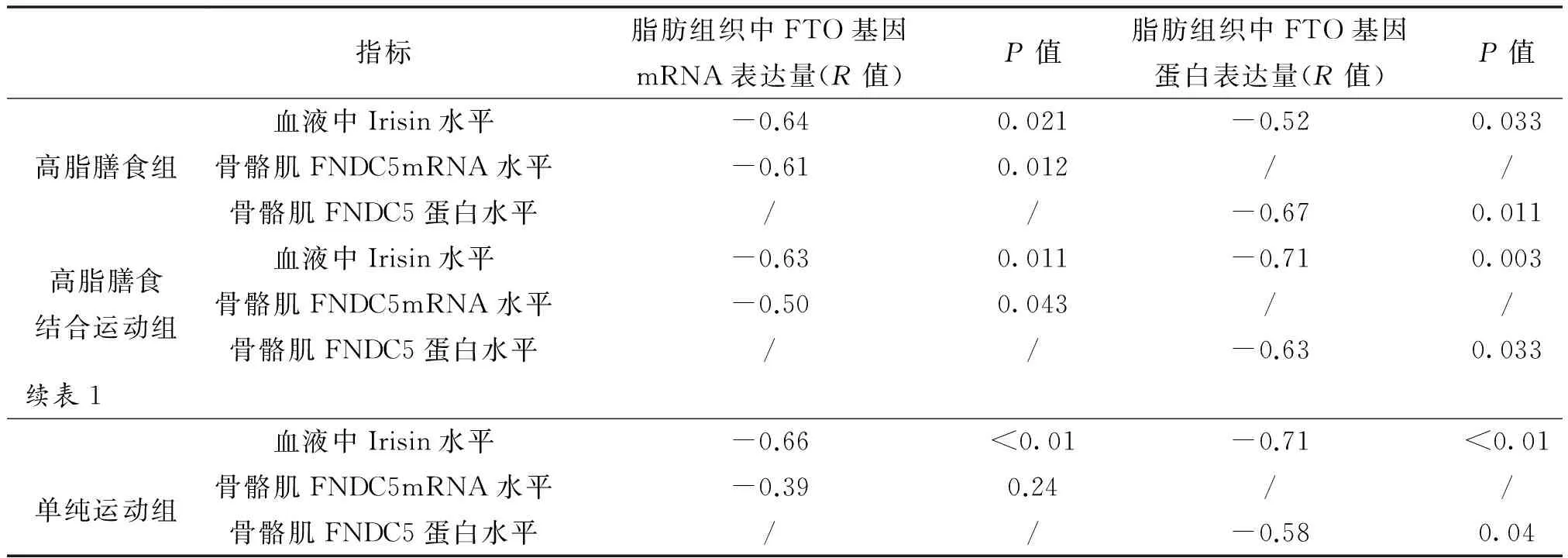
表1 血液、骨骼肌和脂肪组织各指标间的相关关系
3 分析与讨论
肥胖已经成为一个世界性的公共卫生问题,不仅是发达国家,发展中国家同样如此[14]。目前的共识是运动结合饮食控制是最好的方式,然而运动控制肥胖的机制目前尚不完全清楚。
近些年,运动引起的一些肌肉因子受到了高度的关注。运动可以引起骨骼肌PGC-1表达增加,PGC-1可以诱导FNDC5表达升高,FNDC5是一种跨膜蛋白,其细胞膜外面的N末端部分可以被蛋白酶切割,切割下一个由110个氨基酸组成的多肽,而这一多肽可以进入血液发挥激素的作用,Spiegelma等将这一多肽命名为Irisin[7]。Irisin是一个高度保守的序列,在人和鼠类中其氨基酸顺序完全相同[7]。在哺乳动物体内存在白色脂肪组织和棕色脂肪组织,白色脂肪组织主要起到储存的功能,而棕色脂肪组织主要通过产热维持体温或消耗多余的能量维持能量平衡,如果能够使白色脂肪组织“棕色化”,则能够达到减肥的效果[15]。Bostrsm P等[7]和Chen JQ[16]的研究都充分说明Irisin能够引起白色脂肪“棕色化”,进而抑制肥胖的发生。我们的研究发现,当给予大鼠高脂膳食后,大鼠体重和脂肪含量显著增加,血液中Irisin水平与骨骼肌中FNDC5mRNA和蛋白表达均显著降低,脂肪组织UCP1表达显著降低,而当高脂膳食结合运动后,与高脂膳食组比较,大鼠体重和脂肪含量显著降低,血液Irisin水平与骨骼肌中FNDC5mRNA和蛋白表达显著升高,脂肪组织UCP1表达显著升高,这也反证了骨骼肌肌肉因子Irisin会抑制肥胖的发生。
运动可以引起Irisin升高,Bostrom等报道,经过3周的自由轮跑后,小鼠骨骼肌中FNDCmRNA表达显著升高,而且FNDC表达与PGC-1表达一致,另外,经过10周耐力训练,人骨骼肌中FNDC5和PGC-1表达显著升高,并且表现出比例的一致性[7]。我们也得到了相同的结果,大鼠单纯跑台运动8周后,血液Irisin水平与骨骼肌中FNDC5mRNA和蛋白表达均显著高于对照组,而高脂膳食结合运动组血液Irisin水平与骨骼肌中FNDC5mRNA和蛋白表均显著高于高脂膳食组。但关于运动是否引起FNDC5表达升高的研究结果并不一致[17-18],一些研究表明,运动可以引起FNDC5显著升高[7,19-21]。最近,Norheim等[21]比较了急性运动与耐力运动对PCC-1和FNDC5表达的影响,13位年龄在40-65岁的不常运动受试者,经过12周的耐力和力量训练后,PGC-1和FNDC5mRNA表达分别升高了1.2倍和1.4倍,然而急性运动后,PGC-1mRNA表达尽管升高了7.4倍,而FNDC5却未见显著性改变。Timmons等[19]报道,在20-80岁受试者中,无论是经过有氧运动还是抗阻运动均未发现FNDC3基因表达的改变。经过16-20周训练后,猪骨骼肌FNDC3mRNA和蛋白表达均未出现显著升高[22]。有学者认为,运动引起Irisin释放可能与受试者年龄和健康状况有关[23]。另有学者认为,FNDC3表达水平与运动能力有关[24]。笔者认为,以上的差异与受试对象(有些是动物实验,有些是人类实验)、运动方式、运动强度和运动环境等有关。
肥胖与遗传也有密切的关系。有研究表明,FTO基因表达或活性降低会抑制肥胖的发生[5]。Chris Church等[25]研究证实,无论是正常膳食还是高脂膳食,FTO基因的过表达均与体重和脂肪重量呈正相关,体重增加与食物摄入量呈平行关系,这直接证明了FTO表达增加与肥胖有关[26]。Julia Fischer等[5]进一步证明了FTO基因表达与能量平衡及肥胖的关系,其研究表明FTO基因敲除的雄性和雌性鼠脂肪重量别降低了60%和23%,基因敲除的15个月龄小鼠性腺周围的白色脂肪组织几乎完全消失,而性腺周围白色脂肪组织会随年龄增加而增加。当高脂饮食时,FTO基因敲除鼠的体重明显低于对照组,这充分说明FTO基因的低表达能够有效抵御肥胖的形成。我们的研究结果也表明,高脂膳食显著提高脂肪组织FTO基因mRNA和蛋白表达。一些研究证实运动可以降低FTO基因引起的肥胖[27],而另有一些研究证实其作用有限,Kilpelainen T O 等通过meta分析,对以往的研究进行综合,结果表明运动可以降低因FTO变异而引起的肥胖,这说明运动可以降低FTO基因引起肥胖的风险[28],但另有研究发现,耐力训练后,脂肪组织中FTO基因表达未见显著性改变[13]。 我们的结果显示,运动可以降低脂肪组织中FTO基因的表达。
研究证实,当脂肪细胞中降低FTO表达时,UCP1表达升高了4倍[6],与之一致的是,在FTO基因敲除的小鼠脂肪组织中,UCP1也显著表达上调[6]。FTO基因敲除小鼠能量消耗增加与UCP1表达增加一致,这种白色脂肪“棕色化”可能解释了为什么FTO基因敲出会引起能量消耗增加[5],说明FTO基因表达能够升高会引起肥胖增加。而Irisin升高能够提高脂肪组织UCP1表达的升高,说明Irisin能够抑制肥胖[7]。基于以上研究结果及本研究的结果,即FTO基因表达改变与Irisin改变均引起脂肪组织UCP1表达改变的事实,那么运动引起的Irisin的改变与FTO基因之间关系如何?本研究尽管未采取基因敲除或RNA干扰的技术等直接判定Irisin与FTO的关系,但通过相关分析发现,无论是高脂膳食组、高脂膳食结合运动组和单纯运动组,血液Irisin水平与脂肪组织中FTO表达呈中度性负相关,骨骼肌中FNDC5表达与脂肪组织FTO表达也呈中度负相关(单纯运动组FNDC5mRNA表达除外)。根据我们的实验结果,我们推测,运动引起骨骼肌Irisin释放增加,通过血液循环到达脂肪组织,抑制FTO基因表达,进而引起UCP1表达升高,达到减肥的目的。这一假设还需更进一步进行验证。
4 结论
耐力训练可能通过释放Irisin,抑制脂肪组织FTO基因表达,进而增强UCP1表达,增加能量的消耗,从而达到减肥的目的。
[1] Mokdad AH, Ford ES, Bowman BA, et al. Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001[J]. JAMA, 2003,289(1):76-9.
[2] Lein ES, Hawrylycz MJ, Ao N, et al. Genome-wide atlas of gene expression in the adult mouse brain[J]. Nature, 2007,445(7124):168-76.
[3] Huang MC, Kao CF, Chiu CC, et al. The genetic association of FTO variants with metabolic traits in patients with schizophrenia may be modified by antipsychotics[J]. J ClinPsychopharmacol, 2014,34(1):162-5.
[4] Livingstone KM, Celis-Morales C, Lara J, et al. Associations between FTO genotype and total energy and macronutrient intake in adults: a systematic review and meta-analysis[J]. Obes Rev, 2015,16(8):666-78.
[5] Fischer J, Koch L, Emmerling C, et al. Inactivation of the Fto gene protects from obesity[J]. Nature, 2009,458(7240):894-8.
[6] Tews D, Fischer-Posovszky P, Fromme T, et al. FTO deficiency induces UCP-1 expression and mitochondrial uncoupling in adipocytes[J]. Endocrinology, 2013,154(9):3141-51.
[7] Bostrom P, Wu J, Jedrychowski MP, et al. A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2012,481(7382):463-8.
[8] Kelly DP. Medicine.Irisin, light my fire[J]. Science, 2012,336(6077):42-3.
[9] Chen N, AUID- Oho, Li Q, et al. Irisin, an exercise-induced myokine as a metabolic regulator: an updated narrative review[J]. Diabetes Metab Res Rev, 2016,32(1):51-9.
[10] 罗艳蕊, 王建设, 梅涛, 等. 茶多酚及耐力运动对高脂膳食大鼠肝细胞凋亡的影响[J]. 体育科学, 2011,31(8):46-52.
[11] 王瑞元,苏全生. 运动生理学[M].北京:人民体育出版社,2012:180.
[12] Bedford TG, Tipton CM, Wilson NC, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol Respir Environ Exerc Physiol, 1979,47(6):1278-83.
[13] 马国栋, 铁钰, 刘艳环, 等. 耐力训练对大鼠FTO基因表达影响及与摄食量关系研究[J]. 体育科学, 2012,32(6):69-73.
[14] Malik VS, Willett WC, Hu FB. Global obesity: trends, risk factors and policy implications[J]. Nat Rev Endocrinol, 2013,9(1):13-27.
[15] Piya MK, Harte AL, Sivakumar K, et al. The identification of irisin in human cerebrospinal fluid: influence of adiposity, metabolic markers, and gestational diabetes[J]. Am J Physiol Endocrinol Metab, 2014,306(5):E512-8.
[16] Chen JQ, Huang YY, Gusdon AM, et al. Irisin: a new molecular marker and target in metabolic disorder[J]. Lipids Health Dis, 2015,14:2.
[17] Huh JY, Siopi A, Mougios V, et al. Irisin in response to exercise in humans with and without metabolic syndrome[J]. J Clin Endocrinol Metab, 2015,100(3):E453-7.
[18] Tiano JP, Springer DA, Rane SG. SMAD3 negatively regulates serum irisin and skeletal muscle FNDC5 and peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC-1alpha) during exercise[J]. J Biol Chem, 2015,290(12):7671-84.
[19] Timmons JA, Baar K, Davidsen PK, et al. Is irisin a human exercise gene?[J]. Nature, 2012,488(7413):E9-10; discussion E10-1.
[20] Pekkala S, Wiklund PK, Hulmi JJ, et al. Are skeletal muscle FNDC5 gene expression and irisin release regulated by exercise and related to health?[J]. J Physiol, 2013,591(Pt 21):5393-400.
[21] Norheim F, Langleite TM, Hjorth M, et al. The effects of acute and chronic exercise on PGC-1alpha, irisin and browning of subcutaneous adipose tissue in humans[J]. FEBS J, 2014,281(3):739-49.
[22] Fain JN, Company JM, Booth FW, et al. Exercise training does not increase muscle FNDC5 protein or mRNA expression in pigs[J]. Metabolism, 2013,62(10):1503-11.
[23] Huh JY, Mougios V, Kabasakalis A, et al. Exercise-induced irisin secretion is independent of age or fitness level and increased irisin may directly modulate muscle metabolism through AMPK activation[J]. J Clin Endocrinol Metab, 2014:jc20141437.
[24] Lecker SH, Zavin A, Cao P, et al. Expression of the irisin precursor FNDC5 in skeletal muscle correlates with aerobic exercise performance in patients with heart failure[J]. Circ Heart Fail, 2012,5(6):812-8.
[25] Church C, Moir L, McMurray F, et al. Overexpression of Fto leads to increased food intake and results in obesity[J]. Nat Genet, 2010,42(12):1086-92.
[26] Yeo GS. The role of the FTO (Fat Mass and Obesity Related) locus in regulating body size and composition. Mol Cell Endocrinol, 2014,397(1):34-41.
[27] Zou ZC, -J ML, Shi YY, et al. Effect of exercise combined with dietary intervention on obese children and adolescents associated with the FTO rs9939609 polymorphism[J]. Eur Rev Med PharmacolSci, 2015,19(23):4569-75.
[28] Kilpelainen TO, Qi L, Brage S, et al. Physical activity attenuates the influence of FTO variants on obesity risk: a meta-analysis of 218,166 adults and 19,268 children[J]. PLoS Med, 2011,8(11):e1001116.
(编辑 李新)
Endurance Training Induced Irisin Increase Inhibited FTO Expression of Fatty Tissue in Obese Rats
WANG Manzhuo,SU Wen,LIU Yanhuan,MA Guodong
Objective:To investigate the relationship between Irisinincduced by endurance training and FTO expression in fatty tissue in high fat diet-induced obese rats.Methods:Themale SDrats were randomly divided into control, high fat diet group, high fat diet plus exercise group and exercise group.Exercisewas performed on a treadmill, keeping 8.2 m/min at 0% grade corresponding to 53% of maximal oxygen uptake ,for 15,30 , 45 and 60 min for the first,second and third time.Thereafter,exercise intensity and duration were maintained until the end of the eighth week. The rats were exercised for 5 days a week.It analysised the body weight, fat mass, blood Irisin level, FNDC5 expression in skeletal muscle and expressions of FTO and UCP1 in fatty tissue after 8 week treadmill training. Results:High fat diet significantly induced body weight and fat mass increase, blood Irisin level decrease, FNDC5 expression decline in skeletal muscle and FTO expression increase and UCP1 expression decrease in fatty tissue in rats. Endurance training can markedly decrease high fat diet-induced body weight and fat mass increase, increase hight fat diet-induced blood Irisin level decline, promote high fat diet-induced FNDC5 down-regulated expression in skeletal muscle and reduce high fat diet-induced FTO up-regulated expression but increase down-regulated UCP1 expression in fatty tissue. Blood Irisin level was negatively correlated to FTOmRAN and protein significantly in fat tissue in high fat diet, high fat diet plus exercise and exercise groups. FNDC5mRNA and protein in skeletal muscle were markedly negatively correlated to FTOmRNA and protein in fatty tissue respectively in high fat diet group and high fat diet plus exercise group. FNDC5mRNA in skeletal muscle was negatively correlated to FTOmRNA but no significance, however, FNDC5 protein was markedly negatively correlated with FTO protein in exercise group.Conclusion: Endrance training may be induce Irisin release increase, which inhibit FTO expression and then enhance UCP1 expression in fatty tissuein rats.
EnduranceTraining;Obesity;FibronectinTypeIIIDomainContainingprotein5;FatMassandObesity-AssociatedProteinGene;Rats
G804.22 Document code:A Article ID:1001-9154(2017)01-0113-07
山东理工大学青年支持计划项目“耐力训练改善肥胖的FTO机制研究”(110026)。
王漫卓,硕士研究生,研究方向:运动与健康促进,E-mail:mgdtj@sina.com。
山东理工大学体育学院,山东 淄博 255049 School of P.E,Shandong University of Technology, Zibo Shandong 255049
2016-05-31
2016-09-05
G804.22
A
1001-9154(2017)01-0113-07
