器官型脑片培养OGD复氧复糖模型中丁苯酞对于bcl-2/bax、及bim蛋白的调节作用
2017-02-20程树彬郭彦芳李世平张祥建李春岩
董 梅, 程树彬, 郭彦芳, 李 钊, 李世平, 张祥建, 李春岩
器官型脑片培养OGD复氧复糖模型中丁苯酞对于bcl-2/bax、及bim蛋白的调节作用
董 梅1, 程树彬2, 郭彦芳3, 李 钊4, 李世平1, 张祥建1, 李春岩1
目的 观察正丁基苯酞(NBP)对乳大鼠大脑皮质器官型脑片的氧糖剥夺模型(OGD)中细胞凋亡bcl-2、bax及bim蛋白的调节作用。方法 用生后7 d的SD乳大鼠制备大脑皮质运动区器官型脑片,将培养2 w的脑片随机分为对照组(C组)、模型组(M组)、溶剂对照组(Sc组)和实验组(T组),T组在OGD干预30 min后给予NBP 10μM。将脑片制备OGD模型30 min,部分脑片在NBP干预前后不同时间点(0 h、1 h、24 h、72 h)进行PI染色;部分脑片在NBP干预后6 h用戊二醛固定,做石蜡切片,行HE染色及bcl-2、bax、bim免疫组化染色。结果 PI染色可见C组在不同时间点荧光强度无明显变化,M组、Sc组和T组荧光强度均随时间有不同程度增强,M组和Sc组各时间点荧光强度无明显差异,T组荧光强度较前两者降低,随时间延长,降低幅度增大,尤其是72 h时间点。HE染色C组可见皮质运动区特有的大锥体细胞,结构清晰,M组和T组可见细胞肿胀,细胞核溶解,M组相对明显。免疫组化染色可见在3种染色中M组和T组阳性细胞数均较C组增多,其中bcl-2染色中T组阳性细胞增多更明显,bax和bim染色中M组阳性细胞增多更明显,3种染色中C、M、T各组之间差异均有统计学意义。结论 NBP对OGD后的细胞损伤具有保护作用,可能是通过对bcl-2、bax以及bim蛋白的调节减少细胞凋亡。
器官型脑片; OGD; 丁苯酞; 细胞凋亡; bcl-2; bax; bim
研究表明缺血半暗带中的许多细胞在卒中后的几小时至几天中可能会经历细胞凋亡。相比于细胞坏死,细胞凋亡是能量依赖的程序性的细胞死亡[1]。Bcl-2蛋白家族在细胞凋亡中起重要的作用,包括以bcl-2蛋白为代表的抗凋亡蛋白,以bax、bak为代表的促凋亡蛋白和以bim、bik为代表的促凋亡蛋白。Bcl-2、bax、bim在细胞凋亡中均发挥重要作用,如果可以在细胞凋亡早期对这些蛋白表达进行干预,则可抑制细胞凋亡,挽救细胞。
丁苯酞(dl-3n-butylphthalide,NBP)是我国拥有自主知识产权的国家一类新药,它能够从多个环节改善脑缺血性损伤,对缺血性卒中具有较佳的治疗作用。多项研究发现NBP对缺血损伤后线粒体具有保护作用[2,3]。而线粒体在细胞凋亡的发生中发挥着关键性的作用。
本实验通过器官型脑片培养氧糖剥夺模型(oxygen and glucose deprivation,OGD)复糖复氧后NBP的干预,观察NBP对细胞凋亡的抑制作用,并观察其对bcl-2、bax、bim蛋白的影响,探讨NBP的抗凋亡作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选用出生后5~7 d的SD乳鼠(河北医科大学动物中心提供),雌雄不限。
1.1.2 实验仪器 Mcilwain活组织切片机、CO2培养箱(Sanyo,MCO-18AIC)、插入式培养皿Millicell-CM insert(Millipore),厌氧罐,空气真空泵(天津奥特塞恩斯仪器有限公司,AP-01D),倒置荧光显微镜(Olympus)等。
1.1.3 实验试剂 正常培养液(50%MEM+25%马血清+25%Hank’s平衡液+葡萄糖(均购自Gibco公司),无糖培养液(成分同上,但不加葡萄糖),Geys平衡盐溶液,丁苯酞原料药(NBP,石药集团恩必普药业有限公司免费提供),DMSO,Propidium iodide(Sigma),bcl-2,bax,bim蛋白抗体(Bioworld Technology),免疫组化染色试剂盒(武汉博士德生物工程有限公司)等。
1.2 大脑皮质器官型脑片的制备 根据参考文献[4,5],选用7 d龄SD大鼠的乳鼠,消毒后迅速断头、冰上快速剥离出完整脑组织,取顶叶皮质修整成约0.5 mm×0.8 mm×0.4 mm组织块,剥除软脑膜后用Mcllwain组织切片机连续切成约350 μm冠状切片,放于6孔板内insert半透膜上,每孔3片,于CO2培养箱进行孵育,箱内持续通入5%CO2和95%空气的混合气体,温度维持在37 ℃。
1.3 脑片缺血缺氧模型(OGD)的建立及NBP的干预 取培养2 w的脑片随机分为对照组(C组)、模型组(M组)、溶剂对照组(Sc组,溶剂为甲基亚砜(DMSO)和实验组(T组),每组9片,M组、Sc组以及T组更换无糖培养液(含PI 1μg/ml),置于厌氧培养罐中,用空气真空泵抽出罐内的空气,充入5%CO2+95%氮气的混合气体,于培养箱内孵育30 min后,M组更换正常培养液(含PI 1 μg/ml),Sc组更换等量DMSO但不含NBP的正常培养液(含PI 1 μg/ml),T组更换添加NBP(10 μM)的正常培养液(含PI 1 μg/ml),正常条件孵育。C组同时更换2次正常培养液(含PI 1 μg/ml),正常条件孵育。NBP需事先以DMSO溶解稀释。
1.4 脑片PI染色 用培养液把PI染料稀释成1 μg/ml的终浓度,加入C组、M组、Sc组和T组,于培养箱孵育20 min,倒置荧光显微镜下观察,在0 h(OGD前)及OGD复氧复糖1 h、24 h、72 h拍照,使用Image-Pro Plus5.1软件处理,计算每张照片的荧光强度的强度值。由于脑片厚度的不同可能会导致背景荧光的差异,需要对测得的荧光值进行矫正。设定测得的荧光值为Gm,那么最终的值G=Gm/G0*G0 cont/G cont,其中G0是实验脑片OGD之前所测值,G0 cont是对照组在OGD之前所测得的平均值,G cont是对照组在处理的各个时间点所测得的平均值。
1.5 石蜡切片的制备及染色 在培养2 w时,将脑片做OGD干预后,制备成5 μm石蜡切片,每个脑片取3张切片进行HE染色。取4 μm石蜡切片进行免疫组织化学染色。一抗为兔抗大鼠bcl-2、bax、bim多克隆抗体稀释液(1∶100),二抗为生物素化羊抗兔IgG,三抗为辣根过氧化物酶标记链霉卵白素工作液(S-A/HRP),按照SP法进行免疫组化染色。PBS为空白对照,结果为阴性。棕褐色为阳性染色,胞浆内出现棕褐色颗粒者为阳性细胞。

2 结 果
2.1 器官型脑片大体观察 脑片种植于insert之后约10 min开始贴壁,3 d后即可在insert半透膜上牢固附着,可进行更换培养液等操作。脑片在体外培养存活良好,肉眼观可见脑片呈哑光白色,组织边缘整齐,清晰,无明显的坏死区域。
2.2 脑片石蜡切片的HE染色 培养2 w后所制备的切片可见C组清晰的细胞核及细胞膜结构,并且可见皮质运动区特有的大锥体细胞;OGD后可见M组和T组细胞数量减少,尤其M组明显,部分细胞肿胀,细胞核溶解,但多数细胞在光学显微镜中未见明显坏死表现(见图1)。
2.3 脑片的OGD模型及药物干预的PI染色 见表1。
2.3.1 器官型脑片M组、SC组和T组OGD30 min后,恢复正常氧糖含量并按照实验计划分别予以不同处理。C组各个时间点荧光强度的总体均数相等(P>0.05)。M组随时间点荧光强度明显增强(P<0.05),说明OGD后存在急性期细胞死亡,并且随着时间的延长细胞死亡逐渐增多(见图2);M组和SC组两组之间的荧光强度无差别,说明DMSO对OGD复氧复糖后细胞损伤并无加重或减轻作用。
2.3.2 T组随时间点荧光强度呈轻度增强 各T组间荧光强度有差异(P<0.05),说明随时间延长仍存在细胞死亡;与M组比较,T组各时间点荧光均有降低(P<0.05),说明NBP干预后早期即出现抑制细胞死亡的保护作用,并随时间延长有持续抑制作用,其中72 h时间点T组荧光强度降低幅度最大,说明持续应用NBP能达到更佳疗效。结果表明NBP干预后随时间延长具有减少OGD后细胞损伤的作用,进一步阻断细胞死亡的进展。
2.4 免疫组化染色及分析结果 见表2。免疫组化染色中,OGD复氧复糖6 h后M组和T组抗凋亡蛋白bcl-2和促凋亡蛋白bax、bim阳性细胞均表达增多,与C组比较差异显著(P<0.05);应用NBP干预的T组与M组比较,bcl-2表达明显增多,bax、bim表达均降低(P<0.05),说明培养液中加入NBP后脑片细胞抗凋亡能力增强,凋亡细胞减少(见图3~5)。
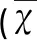
表1 4组不同时期荧光强度比较 ±s)
与 C组比较*P<0.05;与OGD 1 h组比较#P<0.05;与OGD 24 h组比较△P<0.05;与M组及Sc组比较□P<0.05
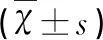
表2 3组bcl-2,bax,bim的表达
与C组比较*P<0.05;与M组比较#P<0.05
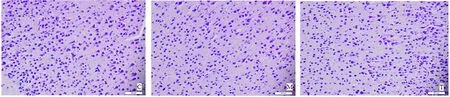
图1 HE染色,对照组C可见细胞结构正常,模型组M和实验组T可见部分细胞肿胀、数量减少

图2 模型组荧光强度随时间延长亮度增加(A:对照组;B:OGD 1 h;C:OGD 24 h;D:OGD 72 h)

图3 OGD 6 h bcl-2阳性细胞在C、M、T组中表达依次增加

图4 OGD 6 h bax阳性细胞在M组中表达最高,T组有降低,但均高于C组
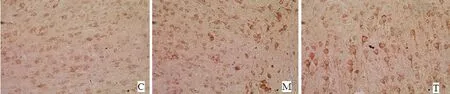
图5 OGD 6 h bim阳性细胞在M组中表达最高,T组有降低,但均高于C组
3 讨 论
器官型脑片是近年来发展起来的一种器官型培养方法,与传统的细胞培养相比,保留了细胞的组织结构和细胞与细胞之间的联系,可以模拟体内的生理环境,有效监控特定细胞周围的微环境,施加实验因素,因此是探讨大脑结构特点、生理功能和病理改变等问题比较理想的方法,近年来成为神经学领域的一个研究热点。本实验选择了出生后7 d SD乳鼠大脑运动皮质制备器官型脑片,选用厌氧培养罐作为密闭容器,并用95%N2+5%CO2的预混气体,成功建立了OGD模型。经过PI荧光染色统计分析说明了模型的可靠性[6]。
PI是一种非常稳定的荧光染料,可溶于水,不能透过完整的细胞膜,但能够透过凋亡中晚期的细胞和坏死细胞的细胞膜,与DNA结合激发出红色荧光。研究表明,PI的荧光强度与细胞死亡的个数成正比[7]。本实验用PI染色,M组在OGD 1 h后PI荧光强度增强,之后在72 h内荧光强度呈现逐渐增高趋势,说明在OGD早期细胞发生了急性坏死,并且在复氧复糖后的培养过程中出现了迟发型细胞凋亡。NBP干预组中24 h、72 h的荧光强度较对照组下降,并且有统计学意义,说明NBP对凋亡具有抑制作用,与既往的研究结果相同[8,9]。
细胞凋亡是能量依赖的程序性的细胞死亡[1],线粒体外膜通透性转换在细胞凋亡中起到很重要的作用,可以引起细胞色素C的释放,进而引起其下游一系列凋亡蛋白酶的激活,从而引起细胞凋亡的发生[10]。正常情况下线粒体外膜通透性转换孔道被bcl-2蛋白家族中的抗凋亡蛋白成员所阻断。Bcl-2蛋白家族包括一个抗凋亡亚族和两个促凋亡亚族,其中bcl-2为抗凋亡蛋白,bax和bim为促凋亡蛋白。因bcl-2蛋白家族对线粒体通透性孔道的重要性及继之细胞的命运-凋亡与否密切相关,因此对于这些蛋白的研究成为细胞凋亡研究中很重要的内容。
bcl-2和bax是细胞凋亡中很重要的调节蛋白。bcl-2主要通过阻止细胞凋亡的早期环节发挥作用[11],阻止或降低细胞皱缩、染色质浓缩和DNA裂解的发生。Bax通过其自身形成的bax同二聚体具有促进细胞凋亡作用,与bcl-2形成bax-bcl-2异二聚体而发挥抑制细胞凋亡发生[12]。正常情况下bcl-2与bax结合从而阻止bax、bax异二聚体的形成。在凋亡刺激因子的作用下bax从bcl-2蛋白分离形成bax同二聚体,并与其他促凋亡蛋白相互作用从而促进线粒体外膜孔道的开放,引起凋亡的发生。如果bcl-2表达水平高于bax,细胞可以存活,反之则死亡。本实验研究了OGD复氧复糖后凋亡相关蛋白的变化及NBP干预后情况,结果表明C组细胞中抗凋亡蛋白bcl-2、促凋亡蛋白bax表达较少;M组OGD复氧复糖后6 h两者表达均明显升高,其中bax升高更加明显,说明细胞发生早期凋亡;T组加入NBP后bcl-2较M组升高、bax较M组降低,但仍明显高于C组,说明在加入NBP后形成更多bcl-2,并且部分抑制bax形成,细胞凋亡减少。故NBP抑制细胞凋亡的作用机制可能与增加bcl-2、降低bax蛋白表达量有关。
此外,bim所在的促凋亡蛋白BH3only家族可以通过在凋亡刺激因素中蛋白量的变化以及磷酸化、去磷酸化而发挥作用[13,14];可与bcl-2等抗凋亡蛋白结合,释放出更多的bax、bak等蛋白[15];或直接与bax、bak等结合并激活之,参与形成线粒体外膜孔道形成,在凋亡中起到重要作用[16]。本实验表明bim在OGD后明显增多,加入NBP后表达下降,说明NBP可通过减少OGD后bim表达减轻细胞凋亡。因此,今后可对bim蛋白磷酸化水平进行研究,探索药物的作用机制。
本实验通过器官型脑片OGD模型中NBP的应用,将药物在体外直接作用于脑组织,证明了其在细胞损伤中的保护作用,并且从对bcl-2蛋白家族中代表性蛋白的变化研究,探索了其对线粒体保护、减少细胞凋亡、减轻细胞损伤的可能机制。
[1]Taylor RC,Cullen SP,Martin SJ. Apoptosis:controlled demolition at the cellular level[J]. Nat Rev Mol Cell Biol,2008,9:231-241.
[2]Wang YG,Li Y,Wang CY,et al. L-3-n-butyl-phthalide protects,rats,cardiomyocytes from ischaemia/reperfusion-induced apoptosis by affeting the mitochondrial apoptosis pathway[J]. Acta Physiol,2014,210(3):524-533.
[3]Li J,Li Y,Ogle M. DL-3-n-Butylphthalide prevents neuronal cell death after focal cerebral ischemia in mice via the JNK pathway[J]. Brainresearch,2010,1359:216 -226.
[4]De Simoni A,Yu LM. Preparation of organotypic hippocampal slice cultures:interface method[J]. Nat Protoc,2006,1(3):1439-1445.
[5]李春岩,肖向建,宋学琴. 大鼠运动区脑片的培养方法[J]. 细胞生物学杂志,2006,28:119-122.
[6]李世平,董 梅,郭彦芳,等. NBP对器官型脑片糖氧剥夺模型中细胞凋亡的影响[J]. 中风与神经疾病杂志,2016,33(1):4-8.
[7]Laake JH,Haug FM,Wieloch T,et al. A simple in vitro model of ischemia based on hippocampal slice cultures and propidium iodide fluorescence[J]. Brain Res Protoc,1999,4(2):173-184.
[8]Li JM,Li Y,Ogle M,et al. DL-3-n-Butylphthalide prevents neuronal cell death after focal cerebral ischemia in mice via the JNK pathway[J]. Brainresearch,2010,1359:216-226.
[9]Li L,Zhang B,Tao YQ,et al. DL-3-n-butylphthalide protects endothelial cells against oxidative/nitrosative stress,mitochondrial damage and subsequent cell death after oxygen glucose deprivation in vitro[J]. Brainresearch,2009,1290:91-101.
[10]Sims HR,Muyderman H. Mitochondria,oxidative metabolism and cell death in stroke[J]. Biochimica et Biophysica Acta,2010,1802:80-91.
[11]Czabotar PE,Lessene G,Strasser A,et al. Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J]. Nat Rev Mol Cell Biol,2014,15(1):49-63.
[12]Basu A,Haldar S. The relationship between Bcl2,Bax and p53:consequences for cell cycle progression and cell death[J]. Molecular Human Reproduction,1998,12:1099-1109.
[13]Yang D,Okamura H,Teramachi J,et al. Histone demethylase Jmjd3 regulates osteoblast apoptosis through targeting anti-apoptotic protein Bcl-2 and pro-apoptotic protein Bim[J]. Biochim Biophys Acta,2016,1863(4):650-659.
[14]Puthalakath H,Villunger A,O’Reilly LA,et al. Bmf:A proapoptotic BH3-only protein regulated by interaction with the myosin V actin motor complex,activated by anoikis[J]. Science,2001,293:1829-1832.
[15]Bajpai R,Matulis SM,Wei C,et al. Targeting glutamine metabolism in multiple myeloma enhances BIM binding to BCL-2 eliciting synthetic lethality to venetoclax[J]. Oncogene,2015,464.
[16]Kumar A,Ghosh S,Chandna S. Evidence for microRNA-31 dependent Bim-Bax interaction preceding mitochondrial Bax translocation during radiation-induced apoptosis[J]. Sci Rep,2015,15923.
The effect of NBP on bcl-2/bax and bim proteins in oxygen-glucose deprivation model of organotypic brain slices
DONGMei,CHENGShubin,GUOYanfang,etal.
(DepartmentofNeurology,KeyLaboratoryofNeurologyofHebeiProvince,TheSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
Objective To establish the oxygen and glucose deprivation (OGD) model of organotypic brain slices of rat cerebral cortex and observe the effects of n-butyl phthalide (NBP) on bcl-2、bax、bim protein in apoptosis. Method We chose the post-natal 7-day rats(SD) to culture the brain slices on the membrane insert and they were divided into four groups after having been cultured for two weeks:control group (group C),model group (group M),the solvent control group (group Sc) and test group (group T). Group T were given NBP 10μM to brain slices after treating with OGD30 min. Some brain slices were observed by PI dyeing before and after being gived NBP 1 h,24 h and 72 h. Other brain slices were fixed by glutaral after 6 h treated with NBP and were dying by HE and assessed the positive cells of bcl-2、bax、bim in brain slices of different groups. Results Brain slices showed no different brightness of red fluorescence in group C and showed increased brightness according to different time in group M,group Sc and group T by PI staining. There were no variety in group M and group Sc. But the brightness was dicreased in group T than that of group M especially in 72 h (P<0.05). There were typital giant pyramidal cells in cortical motor area with normal structures. There were much more swelling cells with karyolysis in group M than that in group T. There were more positive cells in group M and group T than that in group C. Among them there were more positive cells of bcl-2 in group T and more positive cells of bax and bim in group M. There were statistic variance in three groups with each dying of bcl-2,bax and bim. Conclusion NBP had protective effect on damaged brain slice after OGD. NBP could decrease apoptosis by controlling the protein of bcl-2,bax and bim.
Organotypic brain slices; Oxygen and glucose deprivation; N-butyl phthalide; Apoptosis; bcl-2; Bax; Bim.
1003-2754(2017)01-0016-05
2016-09-20;
2016-12 -26
(1.河北医科大学第二医院神经内科,神经病学河北省重点实验室,河北 石家庄 050000;2.河北工程大学附属医院神经内科,河北 邯郸 056002;3.邢台市一院神经内科,河北 邢台 059001;4.河北医科大学第三医院神经外科,河北 石家庄 050051)
李春岩,E-mail:lichuny@126.com
R965
A
