线粒体脑肌病伴乳酸血症和卒中样发作的磁共振波谱分析1例报告
2017-02-20袁俊亮王双坤郭晓娟丁玲玲胡文立
袁俊亮, 王双坤, 郭晓娟, 顾 华, 丁玲玲, 胡文立
线粒体脑肌病伴乳酸血症和卒中样发作的磁共振波谱分析1例报告
袁俊亮1, 王双坤2, 郭晓娟2, 顾 华2, 丁玲玲1, 胡文立1
线粒体脑肌病(mitochondrial encephalomyopathy,ME)是一组因遗传基因异常引起线粒体酶功能障碍而导致的以脑及骨骼肌症候为主的多系统受累疾病。其中,线粒体脑肌病伴乳酸血症和卒中样发作(mitochondrial encephalopathy lactic acidosis stroke-like episodes,MELAS)为最常见类型之一,其典型特征为突发的类脑卒中样发作,偏瘫、偏盲,并有抽搐或阵发性头痛、呕吐,智力低下及高乳酸血症等。近期我科收治了的1例典型MELAS,现报道如下。
1 临床资料
患者,男,21岁,因“突发头晕、头痛、视物模糊1 w”2014年7月19日入院。既往癫痫病史8 y,反复发作,现口服拉莫三嗪及左乙拉西坦治疗;15 y前患肝炎。近4 y有运动后易疲劳现象。生于河南,学习成绩欠佳,初中肄业。其母亲及舅舅3 y前均被诊断为线粒体脑肌病。查体:体温36.9 ℃,血压130/80 mmHg,神清,语利,双眼左侧视野缺损。双侧瞳孔等大等圆,直径3 mm,对光反射迟钝,双眼左视存在轻微水平眼震。双侧鼻唇沟对称,伸舌居中。四肢肌力Ⅴ级,肌张力不高,双侧腱反射减低,双侧病理征阴性。感觉对称,指鼻、跟-膝-胫试验稳准。颈无抵抗。化验检查:血常规、血生化、凝血功能、HIV抗原/抗体、梅毒螺旋体抗体、甲状腺功能、肝炎相关检查、肿瘤标记物、自身免疫、体液免疫、风湿类风湿、髓过氧化物酶、蛋白酶、抗核抗体、抗ds-DNA、脑脊液大致正常。乳酸最小运动量试验阳性:运动前乳酸1.7 mmol/L,运动15 min后4.6 mmol/L,休息10 min后3.7 mmol/L。血液基因检测结果提示线粒体DNA发生A3243G突变,与线粒体脑肌病、MELAS等疾病相关。头部MRI:右侧枕叶新发脑梗死(见图1)。磁共振脑波谱分析:右侧枕叶(病灶区)N-乙酰天门冬氨酸(N-acetylaspartate,NAA)/肌酸(creatine,Cr)=0.405,胆碱复合物(choline,Cho)/Cr=0.81(见图2);左侧枕叶(正常脑区)NAA/Cr=1.7,Cho/Cr=0.86(见图3),提示右侧枕叶皮质NAA/Cr较对侧正常脑区明显降低。脑电图:异常脑电图,双侧半球同步、非同步出现大量多棘慢波、棘慢波放电,闪光刺激诱发肌阵挛发作。
2 讨 论
线粒体病是一组由线粒体基因或细胞核基因发生缺失或点突变导致的线粒体结构和功能异常,引起细胞呼吸链及能量代谢障碍,主要累及脑及骨骼肌为主的多系统遗传代谢性疾病,其共同特征为轻度活动后即感到极度疲乏无力,休息后好转,如病变以侵犯骨骼肌为主则称为线粒体肌病(mitochondrial myopathy);如病变同时累及到中枢神经系统则称为ME。其中,MELAS是ME最常见的类型,1984年由Pavlakis 首次报道[1],为母系遗传疾病,MELAS主要临床表现为发病多小于40岁,青少年期脑卒中样发作,偏瘫、偏盲、癫痫或阵发性头痛、呕吐、智力低下、运动不耐受及高乳酸血症等;典型头部MRI表现为大脑皮质和皮质下呈脑回样层状异常长T1长T2信号,可表现为细胞毒性水肿,多见于大脑半球后部(多位于顶、枕、颞叶皮质)[2,3],并不符合脑血管供血区分布[4],常伴基底节钙化、脑萎缩、脑室扩大等;脑病理检查可在大脑皮质发现灶性板层样坏死伴随毛细血管增生;肌肉病理检查可发现不整红边纤维(ragged red fiber,RRF)、大量破碎样棕褐色肌纤维(ragged brown fiber,RBF)和琥珀酸脱氢酶深染血管;A3243G点突变是最常见的基因突变类型。MELAS诊断的金标准是在病理、基因和生化检查中发现线粒体有结构、分子和功能异常。近年来,有氧前臂运动试验运用血氧分析和乳酸测定的方法,是一种行之有效的线粒体肌病及脑肌病筛查试验,其敏感性及特异性较高[5]。鉴别诊断方面,主要与单纯疱疹病毒性脑炎、多发性肌炎、脂质沉积性肌病、中枢神经系统血管炎、可逆性后部脑病等进行鉴别。治疗上,尚无有效方法,可给予辅酶Q10、三磷酸腺苷二钠、维生素C、维生素E、及维生素B等药物,以补充能量、提供辅酶和抗自由基等治疗[6]。
目前,多种神经影像学技术应用到MELAS研究中,MR平扫、弥散加权成像(diffusion weighted imaging,DWI)、弥散张量成像(diffusion tensor imaging,DTI)[7]以及磁共振波谱分析(MR spectroscopy,MRS)等。MRS作为一种无创伤性检测活体组织器官内生化物质代谢的技术[8],氢质子磁共振波谱分析(Proton MRS,1H-MRS)应用最为广泛[9]。目前认为,NAA主要在神经元线粒体内合成,NAA是神经元的标志物;
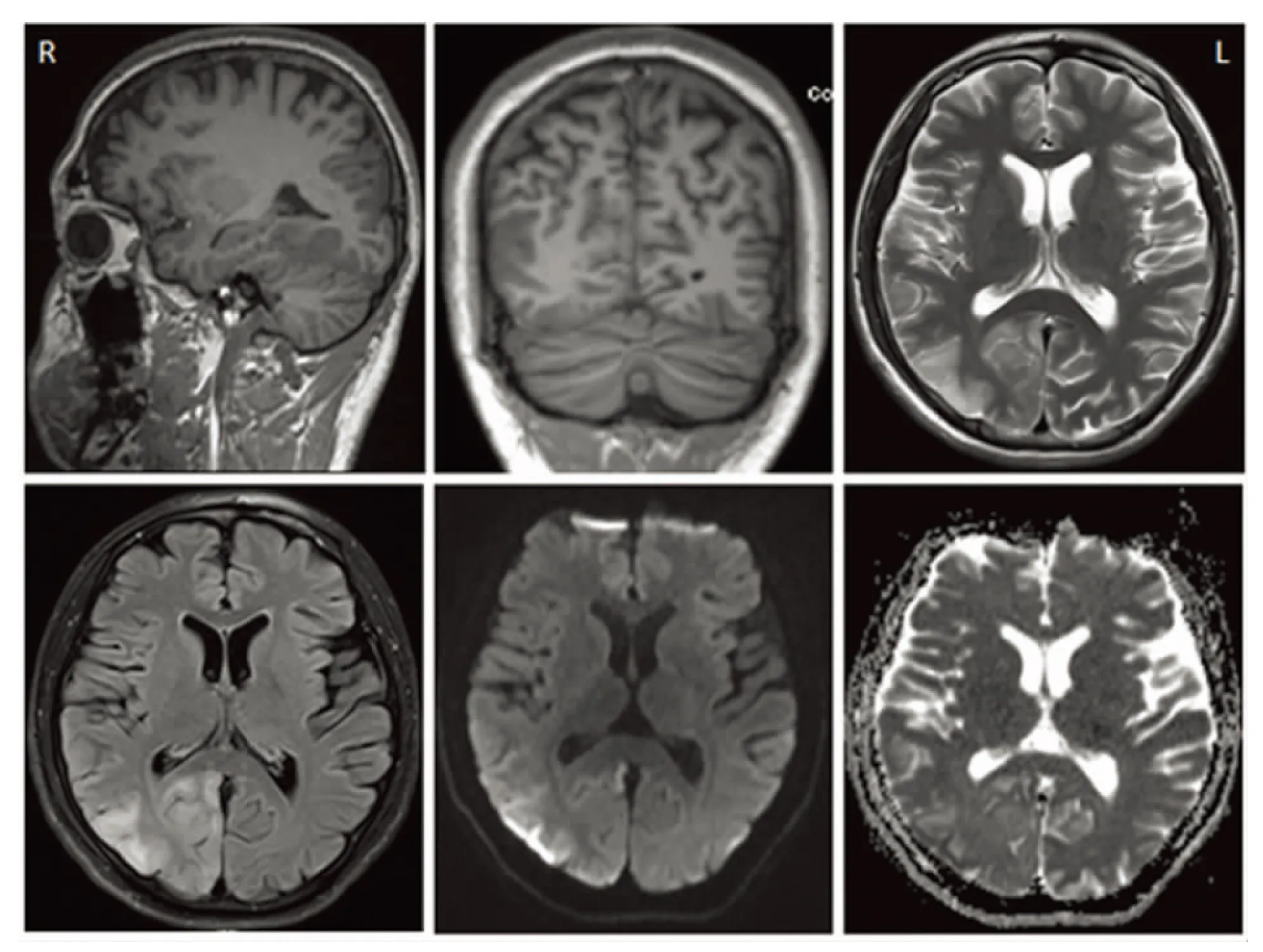
图1 头部MRI示右侧枕叶新发脑梗死
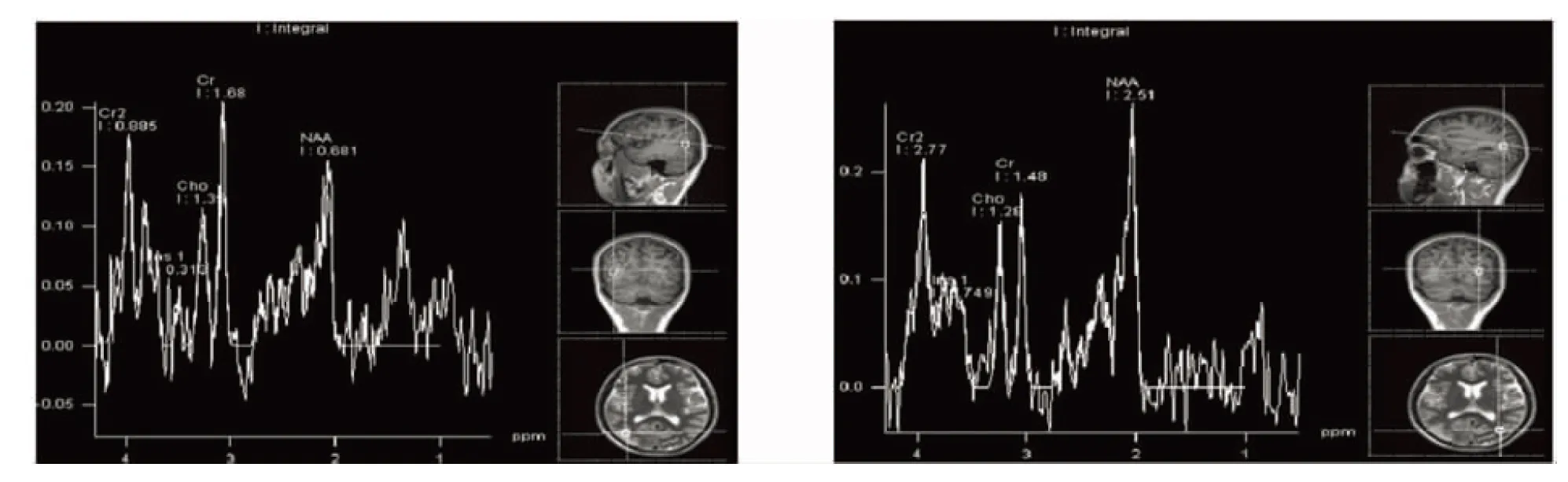
图2 MRS示右枕叶NAA/Cr=0.405,Cho/Cr=0.81 图3 MRS示左枕叶NAA/Cr=1.7,Cho/Cr=0.86
Cho包括甘油磷酸胆碱、磷酸胆碱和磷脂酰胆碱,前者是影响认知、记忆和精神状态的重要神经递质,后者参与细胞膜构成;Cr主要来自细胞内肌酸和磷酸肌酸,一般把Cr当作内参照来衡量其他代谢物的含量;乳酸(lactate)是反映无氧能量代谢的指标。
既往对MELAS患者1H-MRS的研究发现并不多见,发现病灶区存在NAA水平降低,NAA/Cho及NAA/Cr比值降低[2],在看似正常的灰质脑区也可出现类似征象[8,10];有明显的乳酸峰[2,11,12],且乳酸峰随MELAS病程进展不断增加,乳酸盐水平越高,与更为严重的神经系统损害及死亡率密切相关[13,14];且MRS可以用来评价MELAS药物治疗的疗效[8]。Feng等对7例MELAS患者进行了研究,6例患者发现乳酸双峰,其中3例患者在脑脊液中发现乳酸峰,提示无创性的MRS可替代侵入性的脑脊液相关检查[3]。此外,国内学者Liu等采用DWI和MRS联合技术,对10例MELAS患者和15例对照进行了研究,发现MELAS患者的ADC值无论是在损伤区(ADCs of the lesions)还是未受损伤区的(ADCs of the nonaffected areas)均高于对照组的前额叶区,提示MELAS为累及全脑的线粒体相关的神经元病,DWI和MRS联合技术可以发现常规MRI不能发现的有价值的影像学信息[15]。但也有学者发现MRS还可以比DWI更早期发现线粒体的脑生化代谢的改变[16]。近来,前瞻性队列研究对135 例A3243G 突变携带者(45例已经诊断MELAS)和30名健康对照组采用1H-MRS技术进行了研究,经随访发现突变携带者有11例进展为MELAS(converters),79例未进展为MELAS(nonconverters),发现MELAS患者存在较高的乳酸峰,NAA水平下降;出乎意料的是,与对照组相比,converters除了存在较高的乳酸峰外,还存在较高水平的NAA、总Cho和总Cr;与nonconverters相比,converters具有较高的总Cho水平;因此,乳酸和总Cho这两个指标是预测A3243G基因携带者进展为MELAS的非常有价值的生物学标记物[17]。除了1H-MRS分析以外,南京学者Liu等还采用了磷31为递质的MRS分析(31P-MRS ),发现MELAS患者由于存在较高的细胞色素氧化酶表达导致了严重的骨骼肌能量衰竭[18]。上述研究提示了发作期病灶因呼吸链缺陷致神经元破坏,同时无氧代谢增强造成了局部乳酸的堆积,出现了NAA降低,乳酸峰增加的较为特异的MRS表现。
综上所述,临床医师应加强对线粒体疾病尤其是MELAS的认识,尤其要提高对具有以下特点患者的重视:青少年期脑卒中样发作,发病多小于40岁,运动不耐受,出现癫痫和(或)痴呆,血乳酸酸中毒,以及其他局灶性神经系统缺损症状;肌肉活检骨骼肌出现RRF、RBF、琥珀酸脱氢酶深染血管;基因检查发现mtDNA A3243G点突变;头部MRI出现不对称性枕叶损害、基底节钙化且不符合脑血管供血区分布时更加支持MELAS的诊断。因此,MELAS临床诊断主要依靠临床表现、肌肉病理及基因检查,而影像学检查具有简便、无创、可操作性强等优点,尤其是MRS,作为无创伤性检测活体组织器官内生化物质代谢的技术,具有较好的临床应用前景。
[1]Pavlakis SG,Phillips PC,DiMauro S,et al. Mitochondrial myopathy,encephalopathy,lactic acidosis,and strokelike episodes:a distinctive clinical syndrome[J]. Ann Neurol,1984,16(4):481-488.
[2]Casimiro C,Martins J,Nunes C,et al. Conventional and diffusion-weighted magnetic resonance imaging and proton spectroscopy in MELAS[J]. Acta Med Port,2012,25(Suppl 1):59-64.
[3]Feng F,You H,Gao J,et al. Evaluation of mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes with magnetic resonance imaging and proton magnetic resonance spectroscopy[J]. Chin Med Sci J,2006,21(4):234-238.
[4]Iizuka T,Sakai F,Ide T,et al. Regional cerebral blood flow and cerebrovascular reactivity during chronic stage of stroke-like episodes in MELAS -- implication of neurovascular cellular mechanism[J]. J Neurol Sci,2007,257(1/2):126-138.
[5]陈健华,崔丽英,陈 琳. 有氧前臂运动试验在线粒体肌病及脑肌病筛选中的应用[J]. 中华神经科杂志,2007,40(12):800-803.
[6]袁 云. 线粒体脑肌病伴高乳酸血症和卒中样发作的临床研究进展[J]. 中华神经科杂志,2007,40(11):775-776.
[7]Majoie CB,Akkerman EM,Blank C,et al. Mitochondrial encephalomyopathy:comparison of conventional MR imaging with diffusion-weighted and diffusion tensor imaging:case report[J]. AJNR Am J Neuroradiol,2002,23(5):813-816.
[8]Moller HE,Kurlemann G,Putzler M,et al. Magnetic resonance spectroscopy in patients with MELAS[J]. J Neurol Sci,2005,229-230:131-139.
[9]Minati L,Grisoli M,Bruzzone MG. MR spectroscopy,functional MRI,and diffusion-tensor imaging in the aging brain:a conceptual review[J]. J Geriatr Psychiatry Neurol,2007,20(1):3-21.
[10]Bianchi MC,Tosetti M,Battini R,et al. Proton MR spectroscopy of mitochondrial diseases:analysis of brain metabolic abnormalities and their possible diagnostic relevance[J]. AJNR Am J Neuroradiol,2003,24(10):1958-1966.
[11]Bi WL,Baehring JM,Lesser RL. Evolution of brain imaging abnormalities in mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes[J]. J Neuroophthalmol,2006,26(4):251-256.
[12]Ducreux D,Nasser G,Lacroix C,et al. MR diffusion tensor imaging,fiber tracking,and single-voxel spectroscopy findings in an unusual MELAS case[J]. AJNR Am J Neuroradiol,2005,26(7):1840-1844.
[13]Kaufmann P,Shungu DC,Sano MC,et al. Cerebral lactic acidosis correlates with neurological impairment in MELAS[J]. Neurology,2004,62(8):1297-1302.
[14]Kaufmann P,Engelstad K,Wei Y,et al. Natural history of MELAS associated with mitochondrial DNA m. 3243A>G genotype[J]. Neurology,2011,77(22):1965-1971.
[15]Liu Z,Zheng D,Wang X,et al. Apparent diffusion coefficients of metabolites in patients with MELAS using diffusion-weighted MR spectroscopy[J]. AJNR Am J Neuroradiol,2011,32(5):898-902.
[16]Abe K,Yoshimura H,Tanaka H,et al. Comparison of conventional and diffusion-weighted MRI and proton MR spectroscopy in patients with mitochondrial encephalomyopathy,lactic acidosis,and stroke-like events[J]. Neuroradiology,2004,46(2):113-117.
[17]Weiduschat N,Kaufmann P,Mao X,et al. Cerebral metabolic abnormalities in A3243G mitochondrial DNA mutation carriers[J]. Neurology,2014,82(9):798-805.
[18]Liu AH,Niu FN,Chang LL,et al. High cytochrome c oxidase expression links to severe skeletal energy failure by (31)P-MRS spectroscopy in mitochondrial encephalomyopathy,lactic acidosis,and stroke-like episodes[J]. CNS Neurosci Ther,2014,20(6):509-514.
1003-2754(2017)01-0073-03
R746.9
2016-09-10;
2016-12-18
国家自然科学基金(No. 81301016,No. 81271309);北京市青苗计划基金(No. QML20150303)
(1.首都医科大学附属北京朝阳医院神经内科,北京 100020;2.首都医科大学附属北京朝阳医院放射科,北京 100020)
胡文立,E-mail:huwenli@sina.com
短篇与个案报告
