生物样本库中血液RNA提取方法的介绍
2017-02-16章佳英嵇承栋万悦竹付强强朱琳懿
章佳英,嵇承栋,万悦竹,付强强,朱琳懿
生物样本库中血液RNA提取方法的介绍
章佳英,嵇承栋,万悦竹,付强强,朱琳懿
RNA 在人类的多种生理和病理过程中发挥着举足轻重的作用[1-2]。随着第二代测序技术的发展[3],针对人类不同疾病的 RNA 样本测序研究广泛开展,并得到了大量有价值的发现。高质量的 RNA 可以满足 RT-PCR、qRT-PCR、Northern blot、基因表达谱、转录组测序、核酸酶保护实验和阵列分析等生物学下游实验的研究需求[4-5]。
在脊椎动物中,外周血一直被认为是侵害性较小、较有价值的 RNA 来源[6-7]。在许多生物样本库中,由于血液样本的常规收集、处理及保存方法简便、成本低且富含可利用成分(如血清、血浆、白细胞和红细胞等)和生物分子(DNA、RNA、蛋白质和代谢产物),因此是进行多个项目分析的理想实验材料。然而,RNA 极易降解,许多因素如内源性和外源性的 RNA 酶、预处理、保存和提取过程,可能会不同程度地影响 RNA 实验结果。因此,必须注意样本收集、处理和储存过程中的各个环节,从根本上确保获得高质量的RNA[8]。
以前的研究比较了不同采样技术或提取方法对 RNA的影响[9-10],但是尚无关于血液样本 RNA 抽提的系统报道。因此,本文评估各种不同采样技术结合提取方法,比较不同方法对血液 RNA 产量和质量的影响。本研究目的是找到最合适的血液 RNA 提取方案,以便在生物样本库中作批量应用。
1 RNA 提取方法
常见的 RNA 提取方法有苯酚法、阴离子去污剂法、热硼酸法或改良热硼酸法、LiCl-尿素法、改良的 Gomez 法、异硫氰酸胍法、TRIzol 试剂快速提取法、CTAB(十六烷基三甲基溴化铵)法。
随着生物技术的不断发展,很多生物技术公司着手RNA 提取试剂盒的研究并取得丰硕成果,将科研人员从繁琐的提取、纯化工作中解放出来。目前,RNA 提取中常用的试剂盒主要分为 3 种:TRIzol 试剂一步法、TRIzol LS 试剂一步法和 PAXgene 试剂盒法,前两者均使用苯酚和异硫氰酸胍的单相溶液,而 PAXgene 法需根据试剂生产商说明书操作。
近年来,RNA 提取方法有了很大改进[11],本文选取12 种具有代表性的提取方法进行系统比较(表 1),其中Liu 等[12]系统地比较了其中 6 种方法(A ~ F),提取过程见图 1;而 Häntzsch 等[13]比较了另外 6 种方法(G ~ L)(图 2),其中,手工法 4 种和半自动法 2 种。

表 1 分离方法汇总
全血基因的表达谱通常用 PAXgene 或 Tempus 血液采集管研究[14-15],Häntzsch 等[13]比较了不同提取系统(filter-based vs magnetic beads;手工 vs 自动)结合PAXgene 和 Tempus 血液 RNA 采集管的 RNA 数量和质量,计算不同提取方法所耗费的时间,以及每个样本的处理时间,评估 mRNA 和 miRNA 的表达与 RNA 提取方法、RT-PCR 和 qRT-PCR 试剂之间的关系。
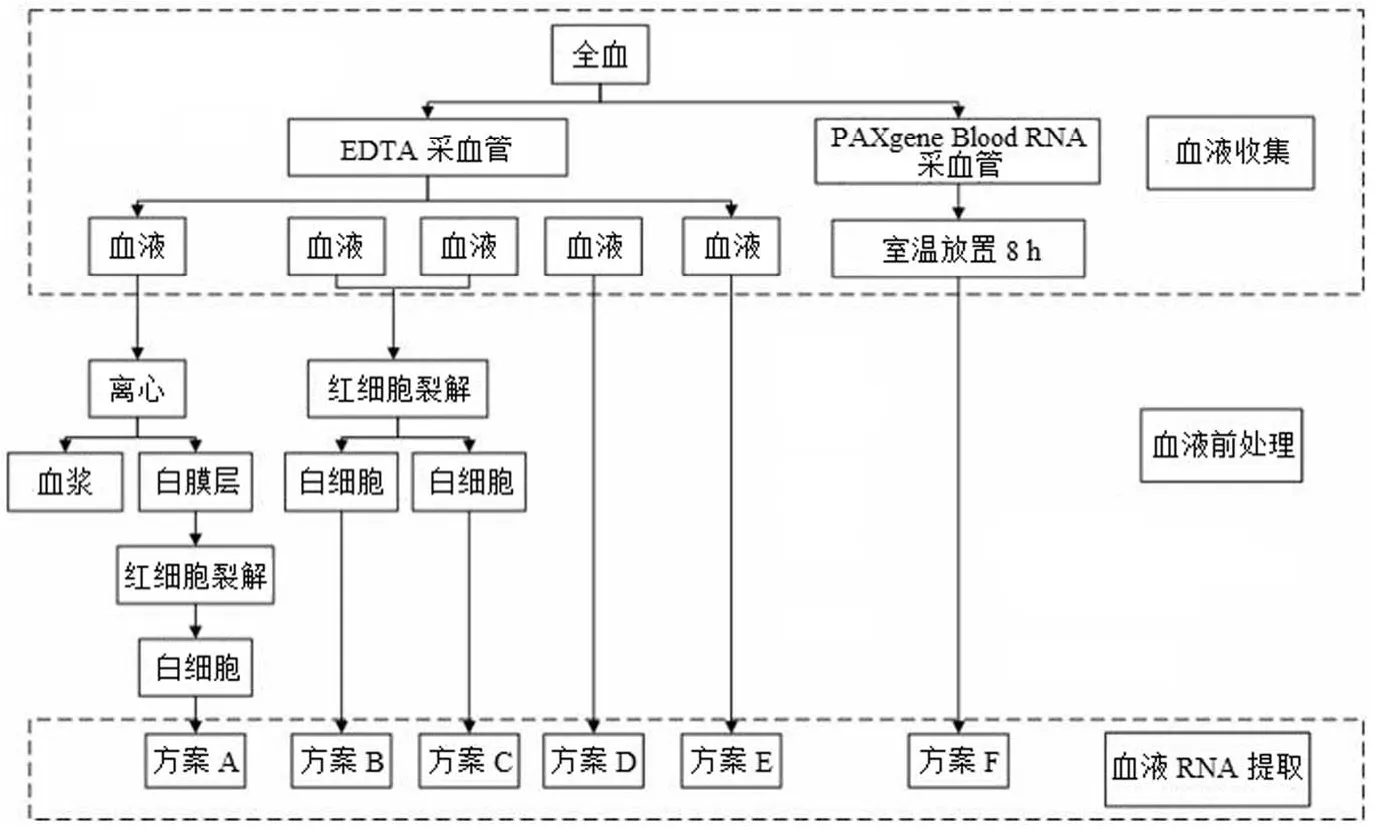
图 1 RNA 的前处理及分离过程
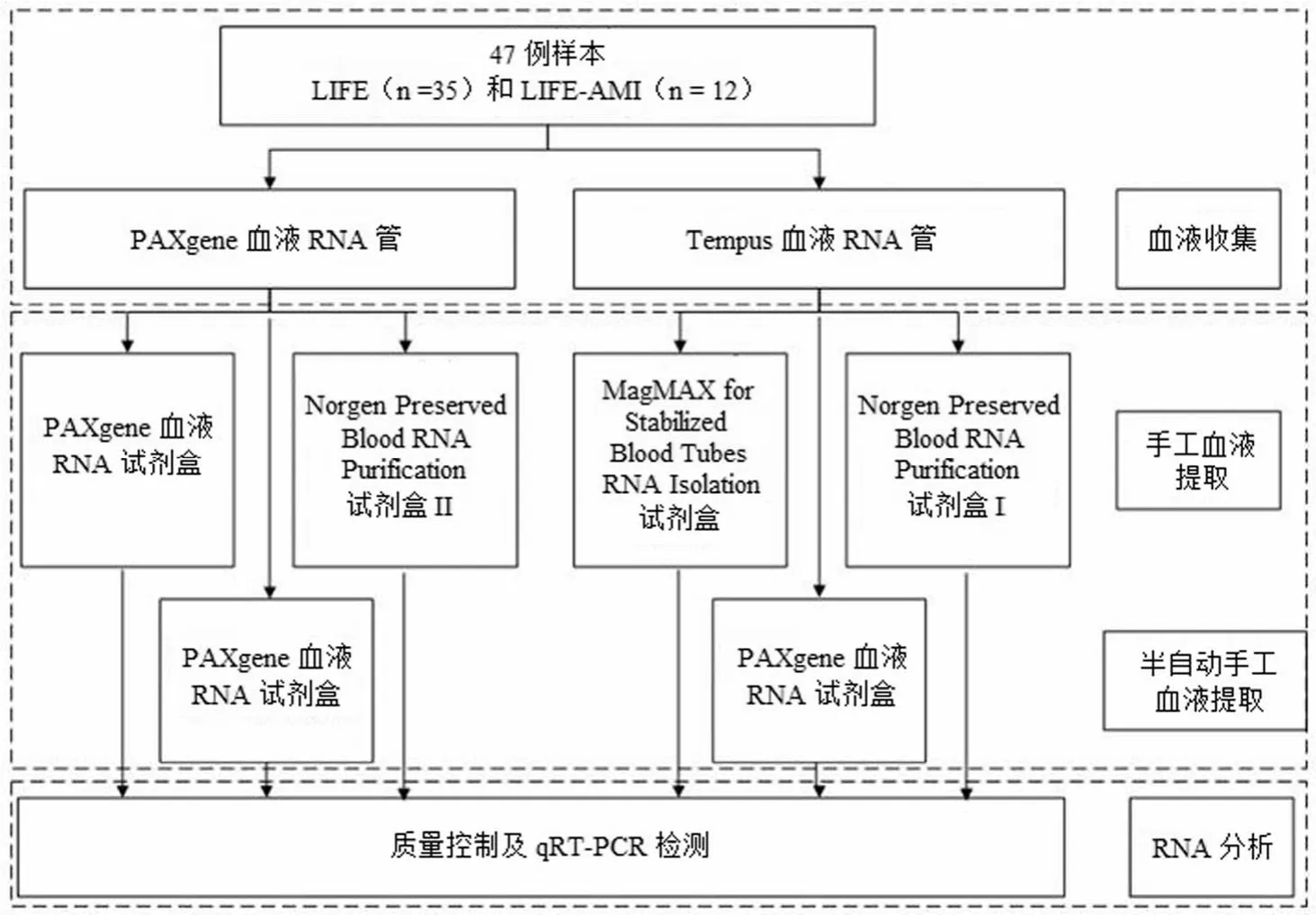
图 2 Häntzsch 等[13]的研究设计
随着大数据时代的到来,保存和使用高质量的样本,以及充足的样本量供下游应用至关重要。如何实现充分利用样本的目标,对研究人员来说仍然是一个非常大的挑战。在医学研究中,人类血液样本经常被用来提取 RNA,包括来自白膜层的总 RNA 和游离的 RNA。Liu 等[12]研究比较冰冻前 RNA 提取的五种不同血液处理方法,并评估从这些方法得到的 RNA 质量和数量。如方案 A,为充分利用血液样本,首先从全血中分离白膜层提取 RNA,其他组分如血浆和红细胞可以直接使用或者留存备用。方案 B(TRIzol)和方案 D(TRIzol LS)用全血分离 RNA,TRIzol 和 TRIzol LS 都是苯酚和异硫氰酸胍的单相溶液,一步法分离 RNA,其也能用于样本的保存。RNAlater(方案 C)是一种水溶性的、无毒的组织保存剂,非冰冻情况下,稳定或保护细胞的原位 RNA,它也能用于处理和保存白细胞,包括短期储存或室温运输和 –80 ℃ 长期保存。PAXgene Blood RNA tube(方案 F)是一种血液采集管,自采血伊始就稳定细胞内的 RNA。一些研究人员选择在血液样本中不加任何添加剂(如稳定剂)而 –80 ℃ 直接保存,其目的是为了排除在长期保存中添加剂可能产生毒性,以及对未来的实验可能产生的干扰。
在 Häntzsch 等[13]进行的研究中,研究对象是 Leipzig in the LIFE Heart substudy 的队列研究,招募的是心肌梗死(AMI)患者。用 3 个 PAXgene和 3 个 Tempus 血液RNA 采集管,收集 LIFE study 中心的 12 个 AMI 患者和35 个正常人,用 4 种手工法和 2 种半自动法提取 RNA,然后再测定 RNA 的数量和质量。
2 RNA 提取方法的结果汇总
在 Liu 等[12]的研究中,RNA 纯度用 NanoDrop (Thermo Scientific,ND-8000)测定,RNA 浓度和完整性用 Agilent 2100 bioanalyzer(Agilent Technologies,G2939A)及相关软件计算,评估分离的 RNA 产量、纯度和完整性(表 2),用于比较和验证 6 种不同 RNA 处理方法的效能[12]。
表 2 RNA 质量控制结果(±s )

表 2 RNA 质量控制结果(±s )
R N A 纯度 R N A 完整性方案 预处理方法 R N A 提取方法 R N A 产量(μ g / m l ) A260/280 A260/230 R I N 值 2 8 S / 1 8 S A B u f f y c o a t -T R I z o l 方法 T R I z o l 试剂一步法 3 . 5 0 ± 0 . 3 2 1 . 9 9 ± 0 . 0 1 1 . 3 5 ± 0 . 1 6 8 . 2 0 ± 0 . 1 6 1 . 4 4 ± 0 . 0 7 B 全血-T R I z o l 方法 3 . 2 9 ± 0 . 3 0 1 . 9 9 ± 0 . 0 1 1 . 4 0 ± 0 . 1 2 8 . 0 1 ± 0 . 1 6 1 . 5 5 ± 0 . 0 7 C 全血-R N A l a t e r 方法 2 . 3 3 ± 0 . 3 3 1 . 9 5 ± 0 . 0 2 1 . 1 0 ± 0 . 1 6 8 . 0 1 ± 0 . 1 4 1 . 1 4 ± 0 . 0 5 D 全血-T R I z o l L S 方法 T R I z o l L S 试剂一步法 9 . 6 8 ± 0 . 7 9 1 . 9 5 ± 0 . 0 1 1 . 3 0 ± 0 . 0 6 7 . 7 5 ± 0 . 1 1 1 . 3 1 ± 0 . 1 9 E 冷冻法 1 4 . 2 9 ± 1 . 5 4 1 . 9 3 ± 0 . 0 1 1 . 2 6 ± 0 . 0 8 5 . 2 9 ± 0 . 4 4 0 . 7 5 ± 0 . 1 4 F P A X g e n e 全血 R N A t u b e P A X g e n e 全血 R N A 试剂盒 5 . 1 0 ± 0 . 7 0 2 . 0 5 ± 0 . 0 1 1 . 3 0 ± 0 . 1 6 7 . 7 6 ± 0 . 1 0 1 . 4 1 ± 0 . 1 0
在 Liu 等[12]进行的研究中,用 6 种不同的处理方法分别提取 11 个样品的 RNA,然后测定平均产量,结果见表 2。TRIzol LS 法、PAXgene 和冷冻法(–80 ℃)直接保存,这 3 种方法得到的 RNA 产量最高。A260/A280比值和A260/A230比值反映 RNA 的纯度。一般来说,A260/A280比值1.8 ~ 2.0 和 A260/A230比值 ≥ 2 被认为是高纯度的样本。6 种方法的 A260/A280比值之间无显著差别,均能得到最适A260/A280比值。然而,所有方法的 A260/A230比值均低于1.5,这可能是由 TRIzol/TRIzol LS 试剂中高浓度的盐/苯酚引起的。最后,用核糖体 28S/18S 比值和 RIN 值评估RNA 的完整性。最适 28S/18S 比值 1.0 ~ 2.0,如果比值大于 2.0 或小于 1.0,表明存在基因组 DNA 或 RNA 降解。在本文中,除了直接 –80 ℃ 保存的样本 28S/18S 比值 < 1.0,其余的 5 种方法均在范围内。除了 –80 ℃ 冷冻直接保存的样本,其余方法得到的 RIN 值均大于 7.0。
在 Liu 等[12]的研究中,方案 A 从白膜层中分离 RNA可以获得最高质量的 RNA(高完整性和高纯度),还能充分利用血液样本;TRIzol LS pretreatment specimens(方案D)获得最高产量 RNA(除了方案 E),质量也较满意,此方法简化了样本的前处理过程,但是全血样本只能用于RNA 提取;用 TRIzol(方案 B)从全血中分离 RNA,得到的 RNA 质量较高,成本也低于 TRIzol LS,但是 RNA数量较低;PAXgene Blood RNA 试剂盒(方案 F)是在无法及时处理血液样本时的良好选择,此方法适用于室温条件下短时间运输,但是仅用作 RNA 提取,成本较高;添加RNAlater 的全血样本可以得到高质量的 RNA,该法的潜在优点尚待研究。
有资料显示,RNA 可用于高要求的基因芯片分析(RIN > 7.0),也能用于定量 PCR 和基因表达谱研究(RIN 4 ~ 7)。因此,上述研究中分离到的 RNA 符合大多数实验的要求。方案 A 中,首先分离血浆和白膜层,其得到的 RNA 的RIN 值最高(7.30 ~ 9.00),血浆还能用于后续的实验。方案 B、C、D、F 均得到高度完整的 RNA,只是方案 C 在处理过程中加了 RNAlater 用于稳定 RNA,需要额外的步骤除去溶液中的 RNAlater,这些步骤可能会导致 RNA 流失,使得 RNA 的产量偏低(1.43 ~ 4.38)。在方案 D(TRIzol LS)和 E(–80 ℃ 直接保存)中,从全血中直接分离 RNA,可能包括游离的 RNA,因此其产量较高,后者得到的 RNA完整性较差(RIN 5.29)。
在 Häntzsch 等[13]进行的研究中,Norgen Kit I with Tempus Tubes 得到的 RNA 收益率最高,Norgen Kit II with PAXgene 最低。疾病状态是 RNA 收益率的次要决定因素(LIFE-AMI 11.2 vs. LIFE 6.7 mg,P < 0.001),首要决定因素是血液采集管。血液采集管和 RNA 分离试剂盒并不影响mRNA 表达,而是 RT/qPCR 试剂导致 mRNA 损耗,但是Norgen Kit II 除外。对于 miRNAs,某些基因的表达差异与采集管有关(miR30b),RNA 分离(Norgen Kit II)和 RT/qRT试剂(miR133a)有关。在 RNA 收益率方面,各种提取试剂盒显著不同,它们影响 miRNA 的表达谱,但是不影响mRNA 的质量。
3 讨论与结语
RNA 提取以溶剂法为基础,从各种样本中快速、有效地提取 RNA。简单而言,用亚硫氢胍及巯基乙醇制备组织匀浆,使内源的 RNA 酶失活,N-月桂肌氨酸将核蛋白复合物变性,再用酸平衡的苯酚:氯仿:异戊醇抽提,使 RNA脱离 DNA 及蛋白质,从混合液中层析到水相,最后用异丙醇沉淀浓缩 RNA。收益率受多个因素的影响,包括组织来源及细胞数量,可通过光吸收测定(A260)来定量 RNA 的浓度。
TRIzol 既是 RNA 的释放剂,又是 RNA 的保护剂。在 TRIzol 中,RNA 是隔离在 RNA 酶污染之外的,对样本的后续操作要求用无 RNA 酶的玻璃器皿。提取 RNA时须注意污染情况,以及尽量少用移液枪抽吸,以免破坏RNA 结构。实验过程要在生物安全柜内进行,避免 RNA酶的污染,操作速度要快,因为提取过程中 RNA 会降解。实验全程佩戴一次性手套和口罩,手套需勤换。
RNA 可以从各种组织中提取出来[16],不过各种组织的RNA 预期产量有差别。材料用量的上限不得超过 1 g,从少量样本中提取 RNA 时可加入少许糖原以促进 RNA 沉淀,糖原浓度不得过高(< 4 mg/ml),否则影响第一链的合成和 PCR 反应。TRIzol 匀浆后加氯仿之前样本可以在 –60 ~ –70 ℃ 保存至少 1 个月,RNA 沉淀在 75% 酒精中 2 ~ 8 ℃ 保存一星期以上或 –20 ℃ 一年以上[17]。提取的 RNA 立即用于逆转录,或保存于 –70 ℃ 超低温冰箱中备用。
RNA 提取系统中各种试剂的作用:①变性剂如 N-月桂肌氨酸、巯基乙醇和亚硫氢胍,可变性细胞内及核蛋白复合物,释放 RNA,这些试剂还能有效抑制核酸酶。②苯酚/氯仿/异戊醇:酸平衡的苯酚/氯仿/异戊醇可抽提去除杂物,使 DNA 及蛋白质沉淀到有机相,而 RNA 留在水相,用酸性的有机溶剂抽提可免去用氯化锂选择沉淀 RNA 的过程。③乙酸钠:具有维持变性的细胞裂解液 pH 值以及沉淀 RNA 的作用。④异丙醇:沉淀浓缩水相中的 RNA。异硫氰酸胍被认为是最有效的 RNA 酶抑制剂,它在裂解组织细胞的同时也使 RNA 酶失活,它既可破坏组织细胞结构使核酸从核蛋白中解离出来,又对 RNA 酶有强烈的变性作用。就变性剂的选择来说,CTAB(CTAB 法)比异硫氰酸胍(TRIzol 试剂法)和 SDS(改良热硼酸法)更有效;就CTAB 法来说,由于以 CTAB 为变性剂,同时加入 PVP 和β-巯基乙醇共同作用变性蛋白、抑制 RNase 的活性,使用无水乙醇或异丙醇沉淀杂蛋白和总核酸等,然后再选择性地分离 RNA。所以 CTAB 法不失为一种很好的 RNA 提取方法。
本文系统地阐述了各种 RNA 的提取方法,供批量RNA 提取时参考。同时,RNA 的质量评估通常只关注产量、RIN 值、18S/28S、A260/280比值、A260/230比值等常规项目,由于生物样本库的样本大多数是用于新项目研究,上述指标合格也不能保证适用于所有的新项目分析,因此有些研究人员反对用生物标志物来评估样本的质量[18-20]。
[1] Meredith AJ. Biomarkers of progression, recovery, and remodeling in acute heart failure. Vancouver: University of British Columbia, 2014.
[2] Moldovan L, Batte KE, Trgovcich J, et al. Methodological challenges in utilizing miRNAs as circulating biomarkers. J Cell Mol Med, 2014, 18(3):371-390.
[3] Malentacchi F, Pazzagli M, Simi L, et al. SPIDIA-RNA: second external quality assessment for the pre-analytical phase of blood samples used for RNA based analyses. PLoS One, 2014, 9(11): e112293.
[4] Remáková M, Škoda M, Faustová M, et al. Validation of RNA extraction procedures focused on micro RNA expression analysis. Folia Biol (Praha), 2013, 59(1):47-50.
[5] Mewis JL, Sun X, Zuidhof MJ, et al. Research note: methodology for high-quality RNA extraction from poultry whole blood for further gene expression analysis. Br Poult Sci, 2014, 55(2):194-196.
[6] Meltzer EB, Barry WT, Yang IV, et al. Familial and sporadic idiopathic pulmonary fibrosis: making the diagnosis from peripheral blood. BMC Genomics, 2014, 15:902.
[7] Letzkus M, Luesink E, Starck-Schwertz S, et al. Gene expression profiling of immunomagnetically separated cells directly from stabilized whole blood for multicenter clinical trials. Clin Transl Med, 2014, 3:36.
[8] Neumann RM, Garvey C, Kaufman S. Biospecimen collection, processing, and analysis: new challenges for oncology nurses. Semin Oncol Nurs, 2014, 30(2):117-123.
[9] Kim JH, Jin HO, Park JA, et al. Comparison of three different kits for extraction of high-quality RNA from frozen blood. Springerplus, 2014, 3:76.
[10] Bayatti N, Cooper-Knock J, Bury JJ, et al. Comparison of blood RNA extraction methods used for gene expression profiling in amyotrophic lateral sclerosis. PLoS One, 2014, 9(1):e87508.
[11] Langelaan M, Dylus J, Bock E, et al. Improved pre-analytical process for RNA isolation from whole blood samples. Ned Tijdschr Klin Chem Labgeneesk, 2014, 39(3):164-165.
[12] Liu X, Li Q, Wang X, et al. Comparison of six different pretreatment methods for blood RNA extraction. Biopreserv Biobank, 2015, 13(1): 56-60.
[13] Häntzsch M, Tolios A, Beutner F, et al. Comparison of whole blood RNA preservation tubes and novel generation RNA extraction kits for analysis of mRNA and MiRNA profiles. PLoS One, 2014, 9(12): e113298.
[14] Kelly VR, Jones SP, Sammartino HL, et al. Donor verification using Short Tandem Repeat (STR) analysis directly from blood collected in PAXgene RNA tubes. Biopreserv Biobank, 2014, 12(3):217-219.
[15] Duale N, Lipkin WI, Briese T, et al. Long-term storage of blood RNA collected in RNA stabilizing Tempus tubes in a large biobank--evaluation of RNA quality and stability. BMC Res Notes, 2014, 7:633.
[16] Wehmeier UF, Hilberg T. Capillary earlobe blood may be used for RNA isolation, gene expression assays and microRNA quantification. Mol Med Rep, 2014, 9(1):211-216.
[17] Salehi Z, Najafi M. RNA preservation and stabilization. Biochem Physiol Open Access, 2014, 3:126.
[18] Le-Niculescu H, Levey DF, Ayalew M, et al. Discovery and validation of blood biomarkers for suicidality. Mol Psychiatry, 2013, 18(12): 1249-1264.
[19] Niculescu AB. Blood biomarkers for suicidality: US, 201414194024:A. 2014-08-28.
[20] Mullins N, Hodgson K, Tansey KE, et al. Investigation of blood mRNA biomarkers for suicidality in an independent sample. Transl Psychiatry, 2014, 4:e474.
10.3969/cmba.j.issn.1673-713X.2017.01.017
200090 上海,同济大学附属杨浦医院(上海市杨浦区中心医院)科研管理部(章佳英、嵇承栋、万悦竹、付强强);200090 上海市五角场镇社区卫生服务中心(朱琳懿)
嵇承栋,Email:15800397667@163.com
2016-08-16
