具创新分子结构的更优长效性重组人血清白蛋白/促红素融合蛋白的表达、制备和特性研究
2017-02-16富岩杨小楠魏开华富俞淞云文琦郑博崴刘丹于在林
富岩,杨小楠,魏开华,富俞淞,云文琦,郑博崴,刘丹,于在林
具创新分子结构的更优长效性重组人血清白蛋白/促红素融合蛋白的表达、制备和特性研究
富岩,杨小楠,魏开华,富俞淞,云文琦,郑博崴,刘丹,于在林
目的研究作为药物级别重组人血清白蛋白/促红素融合蛋白的生产制备工艺;开展详尽的融合蛋白理化特性研究;提出作为长效创新药物的质量基础和技术指标。
方法利用基因工程技术构建 1 个能稳定表达全新分子结构和更优长效性的重组人血清白蛋白/促红素融合蛋白(rHSA/EPO)的基因工程 CHO 细胞株;研究建立悬浮、无血清培养基,批次化、可线性放大的规模化生产工艺,并就分离纯化的融合蛋白进行详尽的理化特性分析。
结果获得的 rHSA/EPO 蛋白质单体纯度达到 97% 以上;经不同作用位点蛋白酶水解的 rHSA/EPO 产物通过MALDI-TOF/TOF 质谱肽质量指纹谱和 Nano LC-MS/MS液质联用串联质谱检测得到总序列覆盖率 100%;N-端氨基酸序列前 15 个氨基酸与理论序列相符;rHSA/EPO 为糖基化蛋白,定位了糖基化位点;原液中融合蛋白的质谱分子量测定值为 93 kD;酶深度脱糖后的质谱分子量测定结果为84205 D,与理论分子量 84849.52 D 值相近;融合蛋白含有 1 个自由巯基,表明仅有 1 个游离半胱氨酸存在;经圆二色光谱分析比对表明,HSA 和 EPO 各自的空间二级构象未变;毛细管电泳测定有多个电荷异构体范围在 pI 5.1 ~5.8,等电聚焦获得的等电点值(pI)约为 pI 4.9;紫外光谱呈现典型蛋白质光谱特征;原料药中的细菌内毒素、宿主蛋白质、外源性 DNA 的残留量均符合药物原料药的要求。免疫学鉴别为阳性;小鼠体内生物比活性测定结果值为 0.9 × 105IU/mg;体外 UT7 细胞法与小鼠体内生物活性测定较大差异,但体内与体外生物活性测定方法可用于不同试验目的,且相互间也具有一定的相关系数。
结论理化特性研究获得较为全面的药学数据,其结果可作为指导“注射用重组人血清白蛋白/促红素融合蛋白(CHO细胞)”原料药的质量标准和制造检定规程的基础,并显示出原创的 rHSA/EPO(之间无连接肽)具有创新性,符合作为药物的更优分子结构要求。
白蛋白类; 红细胞生成素; CHO 细胞;重组融合蛋白质类
慢性肾病患者(肾衰、尿毒症尤其是进行透析的晚期患者)因其肾脏无法生成足量红细胞生成素,常常会罹患贫血症;接受化疗的癌症患者亦可能罹患贫血症而迫使他们终止化疗。重组促红素药物可预防或改善由手术引起的失血性贫血症,从而提升慢性肾科及肿瘤科患者的生活质量,减少手术患者输血的需求,在临床上具有极大价值[1]。促红素(erythropoietin,EPO)是第一个被发现并应用于临床的造血生长因子。促红素属含唾液酸的酸性糖蛋白,它可与红细胞前体细胞表面的 EPO 受体结合,促进其血红蛋白的合成,使之增殖分化成红细胞,从而调节体内红细胞和血红蛋白的生理平衡[2]。EPO 是一个非种属特异性的强有力造血生长因子,体外分析显示,在 0.05 ~ 1 U/ml 的浓度时即具有剂量依赖效应。根据 EPO 的 cDNA 核苷酸序列推断,其基因产物为一个含 193 个氨基酸的前体肽,其中前 27 个高度疏水性的氨基酸构成分泌信号肽,成熟的 EPO 由 166 个氨基酸组成,分子内有 2 个二硫键,3 个 N-糖基化位点和 1 个O-糖基化位点,其中 2 个二硫键在变性 EPO 复性并折叠成有生物活性构型时是必不可少的。从再生障碍性贫血患者的尿中提纯的天然 EPO 的相对分子量为 34 000,而由 CHO 细胞表达的重组人EPO 的相对分子量为 30 400,其成分约 60% 为蛋白质,40% 为碳水化合物[3-5]。去唾液酸或去糖基化不影响 EPO 的体外生物活性,但却缩短了其体内的半衰期,并使其在体内迅速丧失活性。因此,糖基化对保持 EPO 的生物活性十分重要,只有在真核细胞中得到表达的 EPO 在体内才能维持较好的生物学活性。美国的 Amgen 公司先后开展了重组人促红素在 CHO 细胞中的表达制备和药物研究[6-8]。
人促红素蛋白质药物的长效化也受到广泛的关注。于在林首次公开了构建在人血清白蛋白和促红素蛋白质之间不设有连接肽的 rHSA/EPO 分子结构后[9-10],又有 2 个文献公开报道构建重组人血清白蛋白-促红素融合蛋白的研究结果,但都是在人血清白蛋白与促红素蛋白质之间设有一个氨基酸长度不等的连接肽,构成白蛋白-促红素融合蛋白[11-13]。本文将报道利用 CHO 细胞表达和制备“不设有连接肽”的重组人血清白蛋白/促红素融合蛋白,并就其理化特性来确定 rHSA/EPO 原料药(原液)的质量指标,作为创新药长效“注射用重组人血清白蛋白/促红素融合蛋白”的制造和检定规程的依据。关于 rHSA/EPO 已经完成的在不同动物模型开展的药效学研究、药理学研究、毒理学研究、药代、毒代、生殖毒性研究等药效学和安全性评价结果等成药性研究将另文报道[14]。
1 材料和方法
1.1 材料
1.1.1 试剂 本研究中使用的化学试剂均为分析级或药用级;限制性内切酶、DNA 连接酶、聚合酶、胰蛋白酶、琼脂糖凝胶、聚丙烯酰胺凝胶、DNA和蛋白质分子量标准品等均购自美国 Promaga 公司;CHO-K1 细胞来自美国 ATCC;pcDNA3.1 载体质粒 DNA、G418 抗生素、Lipofectin 脂质体和CHO 细胞无血清培养基购自美国 Invitrogen 公司;规模化生物反应器生产用无血清培养基购自北京清大天一生物技术有限公司;各种分离纯化介质填料均来自美国 GE Healthcare 公司;两性电解质购自美国 Ampholyte 公司;等电点标准品购自美国 Bio-Rad 公司;人血清白蛋白特异鼠单克隆抗体购自美国 Sigma 公司;特异识别人促红素的兔抗体购自 R&D 公司和武汉博士德公司;重组人促红素生物学活性测定标准品、CHO 细胞宿主 DNA国家标准品、蛋白质含量标准品均购自中国食品药品检定研究院;CHO 细胞宿主蛋白检测试剂盒为美国 Cygnus 公司产品;Dig-DNA 标记试剂盒为美国 Roche 公司产品;细菌内毒素检测鲎试剂为中国湛江安度斯生物有限公司产品;改进型 Lowry蛋白含量检测试剂盒为美国 Pierce 公司产品;糖蛋白染色试剂盒为美国 Thermo 公司产品。
1.1.2 仪器 高效液相色谱仪 LC-10Avp Plus 为日本岛津公司产品;烷基硅烷键合硅胶填充柱购自美国 Agilent 公司(C-18、C-4);色谱柱 TSK-GEL G2000SWXL(7.8 mm × 300 mm)购自日本 Tosoh公司;CEInfinite C01 型毛细管电泳仪、WCID-FC毛细管柱(100 μm × 5 cm,有效长度 5 cm)和 HR AESlyte 3-10 为美国 AES 公司;microTOF-Q II质谱仪购自德国布鲁克公司;UltiMate3000 纳升液相色谱购自美国 Dionex 公司;ABI-4700 MALDI-TOF/TOF 和 AB4800 MALDI TOF/TOF购自美国 AB 公司;全自动控制 120 L 不锈钢生物反应器系统为 MERCK-Millipore 中国公司制造;连续流离心机为日本日立公司产品。预过滤器(ViresolveA1HC 滤器)和纳米级膜过滤器(ViresolvePro 滤器,纳米滤膜 3.1 cm2)为Merck-Millpore 公司产品。
1.2 方法
1.2.1 高效表达 rHSA/EPO 的 CHO 细胞基因工程株的构建 采用常规的基因克隆和 PCR 技术,人血清白蛋白基因和人促红素成熟肽基因片段分别克隆自人胎肝或者人胎肾全 RNA 转录的cDNA 文库。PCR 扩增的 EPO 成熟肽 DNA 片段插入到带有分泌肽的人血清白蛋白基因全 DNA序列的脊椎动物细胞转移质粒 pcDNA3.1-HSA 的Bsu36 I 和 Xho I 限制性内切酶位点之间。人促红素成熟肽的 N 端与人血清白蛋白成熟肽的 C 端之间直接基因融合,获得 pcDNA3.1-HSA/EPO 转移载体质粒。含有全融合蛋白基因序列的转移质粒,通过脂质体转染与 CHO 细胞株发生基因组重组,将转移质粒中的基因表达组盒重组在 CHO 细胞染色体上,在含有不同浓度的 G418 抗生素培养基中,挑选出最具有抗生素抗性的集落细胞群分别扩增后,经过免疫法确认能够高效表达分泌rHSA/EPO 的 CHO 细胞工程株。具体的 DNA 克隆程序和所用的合成 HSA 和 hEPO 的 DNA 引物序列参见文献[9]。在 CHO 细胞生长扩增时,CMV 启动子也就同时启动了 rHSA/EPO 基因的表达和融合蛋白的生产。rHSA/EPO 被直接分泌到CHO 细胞的人工合成无血清培养基的上清液中,呈现为可溶、蛋白质空间构造折叠正确、糖基化的大分子蛋白质。
1.2.2 rHSA/EPO 规模化无血清悬浮培养批次生产方法 高效表达和分泌 rHSA/EPO 的 CHO 细胞工程株是贴壁细胞形态,经过实验室驯化成为可悬浮生长的细胞形态。随着 CHO 细胞工程株培养单位密度的增加,rHSA/EPO 的表达量呈线性增加,由此制备 rHSA/EPO 的原始细胞库。原始细胞库经多代次传代并确认表达量仍然稳定后,用于主细胞库和工作细胞库的制备。rHSA/EPO 研究和生产用各种细胞库制备和生长所用无血清培养液中均不添加和不含有任何抗生素、动物源蛋白质、人源或者动物源血清组分。rHSA/EPO 的规模化生产采用全自动控制 120 L 不锈钢生物反应器系统。1 支工作细胞库细胞经不超过 5 个代次的扩增后,接种于含有 40 L 起始无血清培养基的 120 L生物细胞反应器中。CHO 细胞工程株的生长和扩增采用市售的无血清培养基或改进优化的人工配制无血清培养基进行。扩增生长的后期,需流加富集培养液以提高细胞单位密度。待细胞密度达(0.5 ~ 1.5)× 107个/ml、在罐培养 11 ~ 13 d 时收获细胞悬浮培养液。经连续流离心机分离细胞和上清液。
1.2.3 rHSA/EPO 的分离纯化 含 rHSA/EPO的细胞上清液经酸调至 pH 3.4 ~ 3.5,维持 30 min后,用碱调至 pH 5 左右,经 0.22 μm 滤器过滤后,按文献[15]描述的方法经 Capto-MMC 介质填料柱层析富集 rHSA/EPO 目的蛋白质,纯度达到90%,然后通过 Phenyl-S FF、Chelating Sepharose Fast Flow 等介质填料柱层析进一步富集和纯化至95% 以上。精纯的 rHSA/EPO 成为原液(原料药)前的最后一步是通过预过滤器和纳米级膜过滤器串联过滤。过滤时间为 1 h,工艺安全系数为 3.3,压力为 28 ~ 30 psi(约为 2 Pa)。根据需要也可再用超滤方法达到制剂所要求的原液蛋白质浓度。
1.2.4 对 rHSA/EPO 原液中杂质残留量的分析
1.2.4.1 宿主蛋白残留量分析 使用 CHO 细胞进行 rHSA/EPO 的生产和制备过程中的宿主蛋白质残留量测定方法参照厂家提供的说明书进行。
1.2.4.2 外源 DNA 残留量分析 采用来自中检院的国家标准品 CHO 细胞总 DNA,利用 Dig-DNA 标记试剂盒来制备总 DNA 探针。rHSA/EPO 原液中残留的外源性 DNA 经变性为单链 DNA 吸附于固相膜上,在一定温度下与相匹配的单链 DNA 探针标记复性而杂交结合为双链DNA,使用相应的显示系统显示杂交结果,并与已知含量的阳性 DNA 对照比对后,给出待测原液中的宿主 DNA 残留量数值。
1.2.4.3 内毒素残留量测定 原液中的细菌内毒素残留量的检查采用试剂盒凝胶法,鲎试剂标定的灵敏度为 0.125 EU/ml。
1.2.5 rHSA/EPO 物理特性分析
1.2.5.1 含量测定 采用改进型 Lowry 法以中检院的蛋白质含量国家标准品为参比,测定所制备的 rHSA/EPO 原液和成品蛋白质溶液中的蛋白质含量。
1.2.5.2 纯度测定
1.2.5.2.1 SDS-PAGE 法 采用常规的 10% 的SDS-聚丙烯酰胺凝胶电泳法,分离胶浓度为 4%,上样量 10 μg,经考马斯亮蓝 R250 染色,电泳结果用扫描仪成像,应用分析软件分析各条带的百分比,计算目的蛋白含量。
1.2.5.2.2 SEC-HPLC 和 RP-HPLC 法 采用凝胶分子排阻-高效液相法(SEC-HPLC)和反相-高效液相法分别对 rHSA/EPO 纯度进行检测。在高效液相色谱仪上样品经色谱柱 TSK-GEL G2000SWXL (7.8 mm × 300 mm)以 50 mmol/L PB、0.1 mol/L NaCl 缓冲液(pH 7.0)为流动相(SEC-HPLC)进行分离;或样品经烷基硅烷键合硅胶填充柱(C-18、C-4)以 A 相(三氟乙酸-水溶液:取 1.0 ml 三氟乙酸加水至 1000 ml,充分混匀)、B 相(三氟乙酸-乙腈溶液:取 1.0 ml 三氟乙酸加乙腈至 1000 ml,充分混匀)为流动相进行分离,在室温条件下进行洗脱。上样体积为 20 μl,上样量不低于 10 μg,检测波长为 280 nm 和 214 nm 双波长。以 rHSA/EPO色谱峰计算理论塔板数应不低于 1000。按面积归一化法计算,rHSA/ EPO 峰面积要求不低于总面积的 95.0%。
1.2.5.3 分子量测定
1.2.5.3.1 SDS-PAGE 分子量测定 采用还原型SDS-PAGE 测定 rHSA/EPO 分子量,分离胶浓度为 10%,上样量为 1 μg。经考马斯亮蓝 R250 染色,用扫描仪对电泳结果成像,应用分析软件计算已知分子量标准品各条带的相对迁移距离制作直线回归,根据目的蛋白迁移距离带入直线回归方程计算出 rHSA/EPO 分子量。
1.2.5.3.2 质谱分子量测定 由北京蛋白质组研究中心承担。检测条件:N2激光源,波长 337 nm;检测方式:正离子,线性方式(飞行管长 1.5 m,加速电压 20 kV),基质:SA。rHSA/EPO 经脱糖以及未经处理的样品分别检测。结果则与 rHSA/EPO氨基酸序列的理论分子量进行比对分析。
1.2.6 rHSA/EPO 化学特性分析
1.2.6.1 N 端氨基酸序列分析 rHSA/EPO 的N 端前 15 个氨基酸序列测定由北京大学生命科学学院按 Edman 降解法进行测定。适量 rHSA/EPO原液样品对纯水充分透析,转移至经预处理的PVDF 膜上,干燥后直接在蛋白质 N 端氨基酸测序仪按标准测定方法,测定 rHSA/EPO 的前 15 个氨基酸的序列。
1.2.6.2 紫外光谱测定 以 10 mmol/L 磷酸盐缓冲液(pH 5.5)为空白对照液,在常规紫外可见分光光度计上对 rHSA/EPO 原液稀释样品(用空白对照液稀释至 0.1 mg/ml)进行 450 ~ 260 nm 波长的连续扫描,测定其最大吸收峰波长。
1.2.6.3 等电点分析 采用常规的等电聚焦垂直板电泳法测定。根据标准品的等电点(pI)对其相应的迁移距离作直线回归,将 rHSA/EPO 的迁移距离代入直线回归方程,求出待测样品的等电点。
1.2.6.4 自由巯基测定 自由巯基测定采用质谱分子量测定方法,由北京蛋白质组研究中心进行测定。将经烷基化处理封闭自由巯基和未经处理的同一来源 rHSA/EPO 原液按 1.2.5.3.2 中描述的质谱分子量测定方法进行比较,每一个烷基的分子量为 57 D。
1.2.6.5 N-糖基化位点定位分析 rHSA/EPO原液样品溶液 200 μl,加入 5 μl 200 mmol/L NH4HCO3调节 pH 至 7.8 左右,按酶:蛋白为1∶40 加入 PNGase F 溶液,涡旋混匀后 37 ℃ 孵育 16 h。取切 N-糖后样本 50 μl,加入 100 mmol/L二硫苏糖醇(DTT)5.5 μl,混匀,56 ℃ 孵育 1 h。加入 250 mmol/L 碘乙酰胺(IAM)6.0 μl,室温避光反应 1 h。取还原烷基化样品 50 μl,按酶与蛋白1∶50 加入胰蛋白酶溶液,充分混匀,37 ℃ 酶解16 h;加入 FA 至终浓度为 0.1%,终止反应。将酶切后样品用 0.1% FA 稀释 10 倍,17 000 × g 离心后,取上清液装入进样瓶中进样,Nano LC-MS/MS鉴定糖位点,以 mgf 数据格式文件进行 mascot蛋白质鉴定检索。糖蛋白定性则是使用商品化的糖蛋白染色试剂盒,按操作手册开展。
1.2.6.6 唾液酸分析 利用酸水解方法将结合在rHSA/EPO 融合蛋白糖链末端上的唾液酸变成游离状态,游离状态的唾液酸可与间苯二酚反应生成有色化合物,再用有机酸萃取有色化合物后,达到测定唾液酸含量的目的。方法按中国药典三部2015 版通则 3102 开展分析。
1.2.6.7 圆二色光谱分析 远紫外区圆二色 CD光谱主要反映肽键的圆二色性,辨识蛋白质的二级和三级结构。rHSA/EPO 的圆二色光谱测定工作由中国科学院过程工程研究所生化工程国家重点研究室和北京蛋白质组学研究中心分别承担。
1.2.6.8 肽图分析
1.2.6.8.1 RP-HPLC 法 取 rHSA/EPO 供试品溶液(预稀释至 1 mg/ml 的溶液),用 1% 碳酸氢铵溶液充分透析,以终浓度 0.01 mol/L DTT 在56 ℃ 还原 60 min,以终浓度 0.055 mol/L 碘乙酰胺室温闭光烷基化 30 min,然后按 1∶50(mg/mg)加入胰蛋白酶溶液[取胰蛋白酶(序列分析纯)适量,加 1% 碳酸氢铵溶液溶解,制成 0.1 mg/ml 的溶液]到供试品溶液中,在 37 ℃ 保温 24 h 后,按 1∶10 加入 50% 醋酸溶液,10 000 r/min 离心5 min,精密量取上清液 100 μl,注入液相色谱仪,梯度洗脱流动相按 1.2.5.2.2 中的 RP-HPLC 描述进行,记录色谱图。
1.2.6.8.2 肽质量指纹谱与序列覆盖率分析 由北京蛋白质组研究中心使用基质辅助激光解吸附电离飞行时间串联质谱仪(MALDI-TOF-MS)进行检测。取样本 90 μg,用水稀释至浓度为 1 μg/μl,用 200 mmol/L 碳酸氢铵溶液调节 pH 至 7.5 ~ 8.0,加入 100 mmol/L DTT 使其终浓度为 10 mmol/L,混匀,56 ℃ 孵育 1 h。加入 250 mmol/L IAM 使其终浓度为 25 mmol/L,室温避光反应 1 h。反应结束后将溶液平均分成 3 管,一管加入 1 μg 胰蛋白酶,37 ℃ 反应 12 h;一管加入 1 μg 金黄色葡萄球菌蛋白酶(Glu-C),37 ℃ 反应 12 h;另一管加入 1 μg 糜蛋白酶,37 ℃ 反应 3 h,反应结束后,–20 ℃ 保存。MALDI-TOF-MS 检测肽质量指纹谱(PMF)分析是将酶解后样品与基质(CCA)按 1∶1 混匀后点于靶上,以反射正离子模式下检测。Nano LC-MS/MS 分析是将酶解后样品加入FA,使 FA 浓度为 0.1%,10 000 × g 离心后,取上清进样,自动采集串联质谱数据。所得数据与已知 rHSA/EPO 氨基酸序列的酶切肽段分子量和串联质谱离子进行比对,得到检出覆盖率。
1.2.7 rHSA/EPO 免疫学鉴别 纯化制备的rHSA/EPO 采用免疫印迹法或免疫斑点法进行两种不同抗体的分别鉴别,人血清白蛋白特异鼠单克隆抗体和人促红素兔抗体分别作为第一抗体;第二抗体采用羊抗鼠或羊抗兔的辣根过氧化物酶标记抗体,按生产单位操作说明书执行。
1.2.8 rHSA/EPO 生物活性分析
1.2.8.1 UT7 细胞/MTT 体外生物活性测定法 详细方法见文献[16]。UT7 细胞测活前用PBS 缓冲液清洗细胞 3 遍,在含 10% 胎牛血清(FBS)、2 mmol/L 谷氨酰胺的 IMDM 培养基中培养细胞 24 h,用 50 U/ml 青链霉素清洗细胞并调整为 1 × 105个/ml,待测样品用上述培养基溶液稀释,进行 3 倍系列稀释,每一稀释度做 3 孔,每孔加入 50 μl,取 50 μl 细胞洗悬浮液(5 × 103个细胞)加入各孔中,置 37 ℃、5% CO2培养 45 ~48 h,每孔加入 20 μl MTT 试剂,继续培养 3 ~6 h,离心弃上清;每孔加入 100 μl 裂解液(由盐酸 14 ml、Triton X-100 溶液 50 ml,加异丙醇至500 ml 制成),混匀后,放入酶标仪,以 630 nm 为参比波长,于波长 579 nm 测定吸光度值。
1.2.8.2 小鼠体内生物活性测定法 rHSA/EPO原液或者成品的小鼠体内生物活性测定时应稀释成低、中、高 3 个剂量(建议采用 30、60 和120 ng 或它们的相近值。即如果小鼠的给药体积确定为 0.4 ml 时,则在 0.4 ml 中应该分别含有 30、60 或 120 ng 的 rhHSA/EPO)作为供试品。具体方法按中国药典 2015 版三部小鼠体内生物活性测定法网织红细胞法开展[17]。

图 1 重组人血清白蛋白/促红素融合蛋白(rHSA/EPO)成熟肽氨基酸序列(下划线标示 hEPO 的成熟肽氨基酸序列)Figure 1 The amino acid sequences of mature peptide of recombinant human serum albumin/erythropoietin fusion protein (rHSA/EPO) (The underline shows the amino acid sequence of hEPO mature peptide)
2 结果
2.1 高效表达 rHSA/EPO 的 CHO 细胞基因工程株的构建
构建的 CHO 细胞工程株可表达分泌完整的rHSA/EPO 成熟肽蛋白质。其理论氨基酸序列见图 1,具有 751 个氨基酸。rHSA/EPO 的理论计算分子量为 84849.52 D,等电点(pI)6.137;共有19 个二硫键,分别为 53-62,75-91,90-101,124-169,168-177,200-246,245-253,265-279,278-289,316-361,360-369,392-438,437-448,461-477,476-487,514-559,558-567,592-627 (7 hEPO161),614-618(29 hEPO33)。HSA 的第34 个半胱氨酸(C)为一个游离的自由巯基。N-糖基化位点分别为:609(24 hEPO)、623(38 hEPO)和 668(83 hEPO)。在位点 711(126 hEPO)有1 个氧连接 O-糖链结构存在。
2.2 rHSA/EPO 规模化无血清悬浮培养批次生产方法
对表达 rHSA/EPO 的 CHO 细胞工程株进行主细胞库和工作细胞库的建立和检定使之符合国家对生物制品生产用细胞库的要求。CHO 细胞工程株使用不同规模不同原理的生物反应器系统(Wave 或一次性的生物反应器)进行生产的工艺都不会显著影响 rHSA/EPO 的理化特性。融合蛋白直接分泌到 CHO 细胞培养液中。培养液为无血清组分,无动物源蛋白质和无抗生素添加的合成培养液。取不同时间的上清液 30 μl 进行非还原的SDS-PAGE 分析结果显示,10 ~ 14 d 时细胞上清液中总蛋白(约为 0.5 g/L)中的 80% 是 rHSA/EPO单体目的产物。从不同时间的表达结果(图 2)可以看出,随着时间的延长,细胞分泌的目的蛋白获得积累,增加上清液中的融合蛋白含量。同时,观察表明目的蛋白表达产物(rHSA/EPO)也还是有被降解和形成聚合体的现象存在。融合蛋白的降解物存在,会对目的蛋白的分离纯化有直接影响。因为目的蛋白降解物是和目的蛋白具有相同的肽段,亲和层析介质和疏水介质(HIC)在特异结合目的蛋白时会受到竞争性结合影响。为此,虽然延长生长时间,单位产量会有显著的增加,但是可能会为下游的纯化带来困难,因此限定在罐培养时间是有必要的。经连续流离心机将细胞和上清液分开,上清液可进入融合蛋白的分离纯化阶段。可以确定CHO 细胞工程的 rHSA/EPO 表达水平不低于500 mg/L。规模化生产工艺可线性放大,无血清培养基组分简单、成本低廉,可满足今后产业化的要求。
2.3 rHSA/EPO 的分离纯化
融合蛋白从 CHO 细胞培养上清液,经不同介质填料逐步富集和分离纯化达到精纯的目的。获得的 rHSA/EPO 原液,按改进型 Lowry 法测定,蛋白质含量在 2 mg/ml 左右。制备的 rHSA/EPO 原液符合生物制品要求的纯度,可以作为“注射用重组人血清白蛋白/促红素融合蛋白”的原料药(原液),并用于药学研究、制剂配方筛选以及临床前动物实验的研究起始材料。
2.4 对 rHSA/EPO 原液中杂质残留量的分析
2.4.1 宿主蛋白残留量分析 采用商品试剂盒检测了 rHSA/EPO 原液中的 CHO 细胞宿主蛋白残留量,结果表明原液中的宿主蛋白含量在 0.05%以下,测定的回收率在 70% ~ 130% 之间,符合国家对注射用重组蛋白质药物中宿主蛋白残留量限定的要求。
2.4.2 外源 DNA 残留量分析 采用来自中检院的国家标准品 CHO 细胞总 DNA,利用 Dig-DNA标记试剂盒来制备 CHO 细胞总 DNA 探针。检测结果表明 rHSA/EPO 原液中融合蛋白的 CHO 细胞外源性 DNA 残留量小于 10 pg/mg,符合临床使用剂量小于 10 ng/人次的标准。
2.4.3 内毒素残留量测定 原液中的细菌内毒素残留量的检查采用鲎试剂标定试剂盒凝胶法,结果表明原液中的内毒素残留量不高于 0.125 IU/mg,符合注射用药的要求。
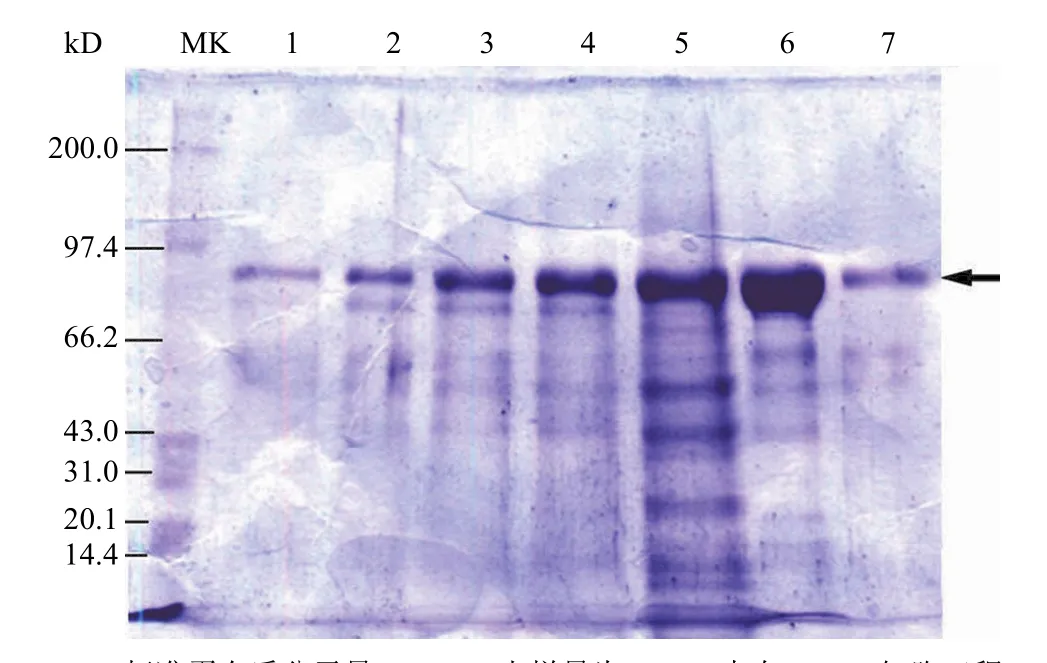
图 2 重组人血清白蛋白/促红素融合蛋白(rHSA/EPO)CHO 细胞工程株在 120 L 生物反应器中以无血清培养基、悬浮和批次生产时在不同时间的 SDS-PAGE 电泳图谱Figure 2 The rHSA/EPO expressed from a genetically engineered CHO cell strain in a 120 L bio-reactor with chemical culture medium, suspension and batched condition in different culture period
2.5 rHSA/EPO 的物理特性分析
2.5.1 含量测定 采用改进型 Lowry 法蛋白质含量测定 rHSA/EPO 原液和成品的蛋白质含量,符合要求,制备的原液的蛋白质含量约在 1.5 mg/ml,可以直接用于配制临床试验用药规格的冻干粉针剂(300 μg/0.5 ml/支)。如果有需要,精纯的rHSA/EPO 还可通过超滤获得高蛋白含量的原液。
2.5.2 纯度测定
2.5.2.1 SDS-PAGE 法 采用常规的 SDS-聚丙烯酰胺凝胶电泳法,分离胶浓度为 10%,上样量10 μg(考马斯亮蓝 R250 染色或者银染上样量5 μg),rHSA/EPO 原液蛋白质在还原和非还原条件下电泳,扫描后经分析软件计算,结果显示分离纯化的 rHSA/EPO 电泳纯度达 99%。
2.5.2.2 SEC-HPLC 和 RP-HPLC 法 采用凝胶分子排阻高效液相法(SEC-HPLC)分析的结果见图 3A;经对图 3A 中的峰 1 和峰 2 组分SDS-PAGE 分析和银染结果见图 3B。反相高效液相法分别对 rHSA/EPO 纯度进行检测,在波长280 nm 和 214 nm 记录结果显示均为单一峰,峰面积不低于总面积的 98%。rHSA/EPO 原液经反相高效液相检测显示,在原液中几乎没有单体 EPO分子和单体 HSA 分子的存在。而以 SEC-HPLC 分析,还是可以看到以聚合体形式存在的 rHSA/EPO,但聚合体含量也确定小于 5%,而且没有融合蛋白的降解片段检出。
2.5.3 分子量
2.5.3.1 SDS-PAGE 分子量 rHSA/EPO 的分子量测定采用 SDS-PAGE 方法,在还原条件下以已知蛋白质分子量为参照物进行直线回归方程计算,分子量测定结果为(100 ± 10)kD。

图3 融合蛋白纯化后的聚合体分析(A:SEC-HPLC 图谱;B:A 中的峰 1 和峰 2 组分 SDS-PAGE 分析和银染结果)Figure 3 The polymer analysis for the purification of rHSA/EPO sample (A: SEC-HPLC fingerprint; B:SDS-PAGE analysis with silver stain of the isolatedcomponts peak 1 and peak 2)
2.5.3.2 质谱分子量 对 rHSA/EPO 理化对照品用基质辅助激光解吸附电离飞行时间质谱仪进行测定,结果为宽峰,是典型的糖蛋白质谱峰,分子量为 93631.2 D 左右。rHSA/EPO 经脱糖后再用质谱测定的分子量为 85205.0 D。经过深度去糖处理后测定的质谱分子量为 84788.4 D,与 rHSA/EPO的理论分子量 84849.52 D 值相近。
2.6 rHSA/EPO 的化学特性分析
2.6.1 N 端氨基酸序列分析 rHSA/EPO 的 N端前 15 个氨基酸序列测定由北京大学生命科学学院按 Edman 降解法进行测定。rHSA/EPO 的N 端氨基酸序列测定的结果为:Asp-Ala-His-Lys-Ser-Glu-Val-Ala-His-Arg-Phe-Lys-Asp-Leu-Gly-(D-A -H-K-S-E-V-A-H-R-F-K-D-L-G-),与 rHSA/EPO 氨基酸理论序列前 15 个氨基酸的序列相符。对不同批次制备的 rHSA/EPO 原液,进行的 N 端氨基酸序列测定都获得相同的结果。
2.6.2 紫外光谱测定 以 10 mmol/L 磷酸盐缓冲液(pH 5.5)为空白对照液,在紫外分光光度计上对 rHSA/EPO 原液稀释样品(用空白对照液稀释至 0.1 mg/ml)进行 450 ~ 260 nm 波长的连续扫描,测定的最大吸收峰波长结果为(277 ± 3)nm,呈典型蛋白质紫外吸收峰。
2.6.3 等电点分析 等电聚焦垂直板电泳法测定结果表明 rHSA/EPO 的等电点值为 pI = 4.9,与理论值(pI 6.137)有一定差异(图 4)。rHSA/EPO 原液中的电荷异构体分析采用毛细管 cIEF-WCID法,获得的图谱见图 5,电荷异构体分布峰面积见表 1。所有 rHSA/EPO 各电荷异构体的等电点处于pI 5.18 ~ 5.83 之间,与理论值 pI 6.137 比较接近。
2.6.4 自由巯基测定 rHSA/EPO 经去 N 糖后,烷基化前和烷基化后,即在封闭和不封闭条件下测试的质谱分子量分别为 85203.0 D 和 85295.5 D,两者之差为 92.5 D,计算 92.5 D/57 D = 1.6,表明rHSA/EPO 中含有约 1.6 个自由巯基。理论氨基酸序列中 rHSA/EPO 含有 1 个自由巯基(半胱氨酸 C)位于第 34 位。因此测定值与理论值一致。在对不同批次生产制备的 rHSA/EPO 原液开展的自由巯基测定工作获得了相近的结果。
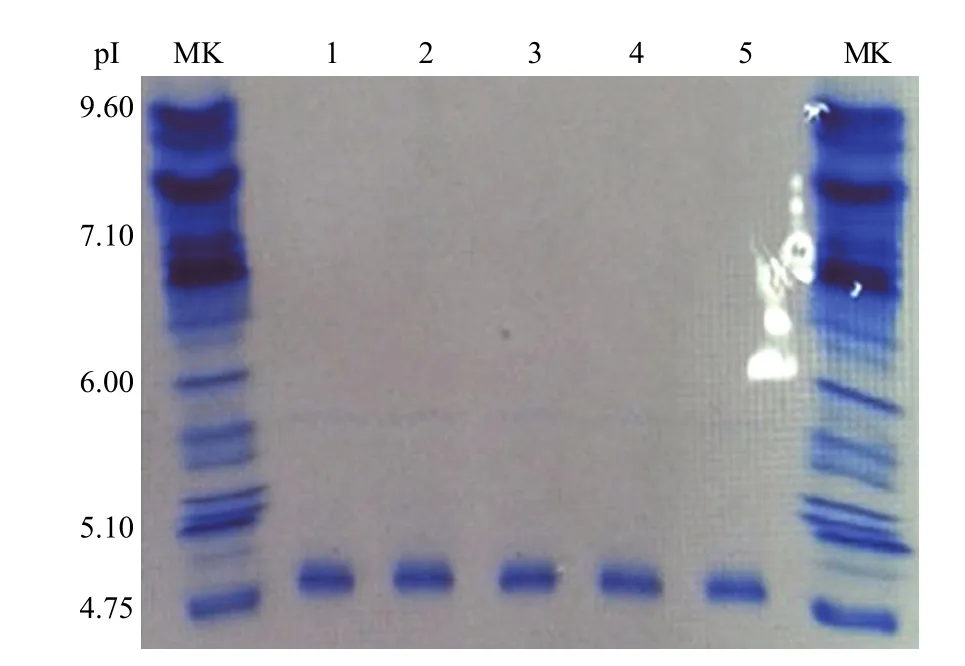
图4 不同批次 rHSA/EPO 原液的等电聚焦电泳结果Figure 4 Isoelectric focusing (IEF) of rHSA/EPO fusion proteins with different lots
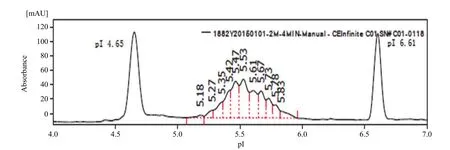
图5 rHSA/EPO 原液(批号:1882Y20150101)等电点(电荷异构体)毛细管电泳分析结果Figure 5 Analysis of the cIEF-WCID (electro-charge isomers) for rHSA/EPO by capillary electrophoresis

表 1 rHSA/EPO 的 cIEF-WCID 等电点检测结果Table 1 Analysis results of the cIEF-WCID (electro-charge isomers) for rHSA/EPO by capillary electrophoresis
2.6.5 糖基化位点分析 通过对 rHSA/EPO 原液样品先还原烷基化后进行适当酶切,所得糖肽采用 PNGase F 切糖,天冬酰胺转变为天冬氨酸,使肽段质量增加 0.984 D 的方法,Nano LC-MS/MS测定切糖后的肽段序列,以 mgf 数据格式文件进行 mascot 蛋白鉴定检索,从而确定了 rHSA/EPO 的 N-糖基化修饰位点分别为 N609、N623、N668,与理论一致。另外使用糖基化蛋白质染色试剂盒检测,也确定 rHSA/EPO 是 1 个糖基化蛋白。
2.6.6 唾液酸分析 酸水解结果表明 rHSA/EPO的唾液酸含量在 9.5 ~ 11 mol。CHO 细胞表达的rhEPO 原液的唾液酸含量一般在 10 ~ 13 mol。考虑到 CHO 细胞修饰糖基化蛋白质时,唾液酸分子仅仅是在糖链修饰完整的情况下,才能在糖链最外端发生修饰,连接上唾液酸;再考虑到融合蛋白的分子量要远大于 rhEPO 分子量,由于空间位阻效应,这也会对唾液酸含量的检测和计算上有一定的影响,因此可以判定处于融合蛋白中的 EPO 蛋白多肽分子的糖基化程度与重组人促红素在 CHO细胞表达状况下是几乎相同,糖链是获得了完全修饰。
2.6.7 圆二色光谱分析应用 利用紫外圆二色光谱仪分别对 rHSA/EPO、rhEPO、pHSA 和 rHSA蛋白质溶液开展了远紫外光谱分析测定,对所获得的光谱曲线分别进行叠加分析比较。图 6 中rHSA/EPO、rHSA、rhEPO 和 pHSA 分子间圆二色光谱叠加结果显示图形相似度非常高,表明在融合蛋白中的人血清白蛋白和人促红素的各自空间结构、蛋白质的二级和三级结构没有发生改变。rHSA/EPO 二级结构中的 α 螺旋、β 折叠、β 转角及随机蜷曲的比例见表 2。中国科学院过程工程研究所和北京蛋白质组研究中心分别开展的rHSA/EPO 的圆二色图谱分析获得的结果是一致的。

表 2 重组人血清白蛋白/促红素融合蛋白二级结构比例表Table 2 Scale table of the second structure of the fusion protein, rHSA/EPO
2.6.8 肽图
2.6.8.1 RP-HPLC 法 rHSA/EPO 蛋白质溶液经变性和烷基化后,胰蛋白酶水解获得清楚可分辨的 RP-HPLC 肽图谱。不同时间制备的 2 个批次rHSA/EPO 原液样品的肽图谱在叠加后显示出绝大部分的肽图峰形相似,可用于 rHSA/EPO 的原液批次质量质检指标之一(图 7)。
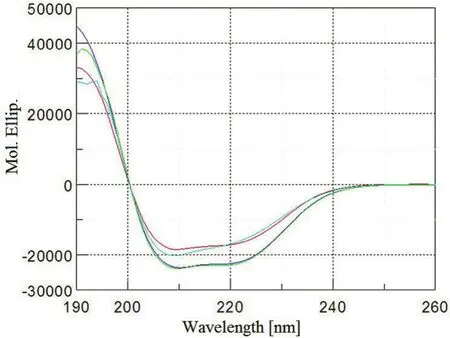
图 6 对 rHSA/EPO 蛋白质紫外圆二色叠加图谱分析[紫色:pHSA(血源人血清白蛋白);绿色:rHSA(酵母菌);红色:rHSA/EPO(CHO 细胞);蓝色:rhEPO(CHO 细胞)]Figure 6 Protein UV-circular dichroism spectra (CD) analysis of rHSA/EPO (Purple: pHSA isolated from human plasma; Green: rHSA expressed from yeast; Red: rHSA/EPO expressed from CHO cells; Blue: rhEPO expressed from CHO cells)
2.6.8.2 肽质量指纹与序列覆盖率 经 MALDI-TOF-MS PMF 方法检测的结果表明,重组人血清白蛋白/促红素融合蛋白(批号:1882Y20150101)经胰蛋白酶单独酶解时,序列覆盖率为 86%;Glu-C 单独酶解序列覆盖率为 83%;糜蛋白酶单独酶解时,序列覆盖率为 70%,合计序列覆盖率为 99.9%。经 Nano LC-MS/MS 的串联质谱数据检索结果则为胰蛋白酶酶解时,检索得分42193,序列覆盖率 51%;Glu-C 酶解时,检索得分 12845,序列覆盖率 43%;糜蛋白酶酶解时,检索得分 11680,序列覆盖率 65%。合计序列覆盖率为 79.4%。经 Nano LC-MS/MS 的一级谱数据检索结果表明,胰蛋白酶酶解时,覆盖率为 78%;Glu-C酶解时,覆盖率为 64%;糜蛋白酶酶解时,氨基酸序列匹配的覆盖率为 96%;合计序列覆盖率:99.9%(图 1 下划线部分)。当 rHSA/EPO 样品经切糖后还原烷基化处理,采用三种酶解(胰蛋白酶、Glu-C、糜蛋白酶)和两种检测方式(MALDI-TOF/TOF 和 Nano LC-MS/MS),检出的氨基酸序列总覆盖率为 100%。
2.7 rHSA/EPO 免疫学鉴别
rHSA/EPO 是由两个蛋白质分子融合组成的,通过免疫印迹试验检测结果显示,特异识别人血清白蛋白的单克隆抗体与 rHSA/EPO 有特异的免疫学反应,也与作为阳性对照品的毕赤酵母菌表达的重组 HSA(rHSA)有免疫反应,但不与阴性对照品人促红素(rhEPO)有免疫反应(图 8A);特异识别人促红素抗体则与 rHSA/EPO 和阳性对照品重组人促红素(rhEPO)有免疫特异反应,但不与阴性对照品 rHSA 有特异反应(图 8B)。免疫斑点法可以获得相同的鉴别结果。
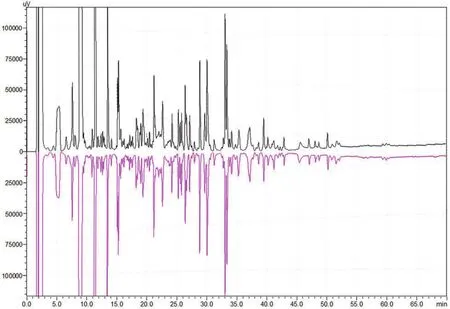
图 7 在还原/烷基化条件下获得的不同批次制备的 rHSA/EPO 融合蛋白的 RP-HPLC 肽图(上:批号为 1882Y20150101;下:批号为 1882Y20150202)Figure 7 The enzymatic peptide maps from different lots of rHSA/EPO preparation under RP-HPLC chromatography (Upper: 1882Y20150101; Down: 1882Y20150202)

图 8 rHSA/EPO 的免疫印迹鉴别试验(A:人促红素兔抗体;B:人血清白蛋白单克隆抗体)Figure 8 The Western blot results are from different first antibodies, rabbit-multi-clonal antibody against human erythropoietin (A) and mouse monoclonal antibody against human serum albumin (B)
2.8 rHSA/EPO 生物活性分析
UT7 细胞/MMT 体外细胞学生物活性测定结果显示,rHSA/EPO 在一定范围内显示了剂量依赖性,但其比活性值要低 4 倍,并不与小鼠体内生物活性(网织红细胞 Ret%)的测定结果相近。结果显示,rHSA/EPO 在 15 ~ 125 ng 剂量范围内的小鼠生物比活性值稳定和可重复,生物比活性值不低于 0.9 × 105IU/mg,生物比活性值的质量标准可规定为 0.7 × 105IU/mg。中国药典中rhEPO 的小鼠体内生物比活性值规定为不低于1.0 × 105IU/mg[17]。rHSA/EPO 和 rhEPO 的分子量比为 100 kD∶34 kD ≈ 3∶1。由此计算可得,在分子等摩尔时(3 mg 融合蛋白中约有 1 mg 的 EPO),两者的生物活性差异不大。
3 讨论
利用基因工程技术构建的 CHO 细胞工程株,由贴壁细胞驯化为可悬浮培养生长的细胞。该细胞株可稳定高效表达和分泌 1 个全新分子结构、可溶性的重组人血清白蛋白/促红素融合蛋白(rHSA/EPO)。重组CHO 细胞工程株制备成原始细胞库,经连续 60 个代次的传代,目的蛋白表达水平稳定,并用于制备主细胞库和工作细胞库。工作细胞库用于生产符合制药要求的 rHSA/EPO 原料药(原液)。经过认真和长时间的仔细研究,建立了可规模化的使用无血清培养液,悬浮批次培养生产工艺和独创的纯化工艺制备 rHSA/EPO 原液。该融合蛋白的理化特性研究也为今后的长效“注射用重组人血清白蛋白/促红素融合蛋”创新药的质量标准、检定技术和方法学验证,为成品的生产都提供了全面的生产制备工艺和质量检控技术指导。获得的 rHSA/EPO 原液满足用于临床目的的注射用冻干粉针剂生产的要求。
rhEPO 在大肠杆菌中可表达为一个非糖基化的蛋白质[18],但是非糖基化 EPO,其体内生物活性则大大降低,作者将人血清白蛋白与 EPO 直接连接后在酵母菌中获得表达,显示出融合蛋白rHSA/EPO(酵母菌)的体内生物活性没有显著下降,半衰期显著延长[9-10]。但是考虑到 rhEPO 作为一个糖基化程度极高的药物已经上市多年,积累了极为详尽的药物代谢,也清楚依赖于其糖基化的特殊结构,才能在临床上具有显著的疗效,而白蛋白长效化的非糖基化 EPO 蛋白质药物是否具有与rhEPO 相似的临床疗效和安全性,是需要大量研究数据探索的。为此,作者也构建了相同的rHSA/EPO 融合蛋白药物分子结构(没有连接肽存在),能够高效表达的 CHO 细胞工程株。同时采用了无血液来源组分、无抗生素、无动物源蛋白质添加的人工合成配制的无血清培养基,采用悬浮、批次、规模化生产工艺制备 rHSA/EPO,并开展了详尽的理化特性分析。研究分析结果表明,在人血清白蛋白和促红素两个大分子蛋白质之间不设有连接肽完全可行,作为药物临床使用为目标的情况下,属于更优蛋白质分子结构。
通过规范的药效学、安全药理、毒理学、药代动力学研究等全面的动物安全评价工作,完成了“注射用重组人血清白蛋白/促红素融合蛋白”新药的临床前研究工作,所提交申报的项目符合国家鼓励和支持的“绿色用药”方向。预计新药的最终临床使用剂量为 150 ~ 600 μg/次,每 2 周使用 1 次。有望将常规 rhEPO 的每 2 周用药频率共 6 针,减为 rHSA/EPO的 1 针。当然,新药 rHSA/EPO的最终临床使用剂量和用药间隔(频率)还需要临床研究来确定。总之,本课题研发的新药,有可能使患者的用药量下降,注射次数下降,特别是在控制给药后患者的红细胞压积和血红蛋白含量指数上,显示出新药可为患者带来更优的升红治疗和预防的疗效,以及更好的治疗依从度。创新药生产成本较现有的同类产品更低,也将会给患者和医疗保险系统带来优惠,具有很好的社会和经济效益。
志谢北京清大天一生物技术有限公司刘华杰;中国科学院过程工程研究所刘瑞娜以及部分曾阶段性参加过本课题研究工作的员工。
[1] krantz SB. Erythropoietin. Blood, 1991, 77(3):419-434.
[2] Fisher JW. Erythropoietin: physiology and pharmacology update. Exp Biol Med (Maywood), 2003, 228(1):1-14.
[3] Lin FK, Suggs S, Lin CH, et al. Cloning and expression of the human erythropoietin gene. Proc Natl Acad Sci U S A, 1985, 82(22):7580-7584.
[4] Lai PH, Everett R, Wang FF, et al. Structural characterization of human erythropoietin. J Biol Chem, 1986, 261(7):3116-3121.
[5] Inouel N, Takeuchil M, Ohashi H, et al. The production ofrecombinant human erythropoietin. Biotechnol Annu Rev, 1995, 1:297-313.
[6] Egrie JC, Strickland TW, Lane J, et al. Characterization and biological effects of recombinant human erythropoietin. Immunobiology, 1986, 172(3-5):213-224.
[7] Browne JK, Cohen AM, Egrie JC, et al. Erythropoietin: gene cloning, protein structure, and biological properties. Cold Spring Harb Symp Quant Biol, 1986, 51 Pt 1: 693-702.
[8] Egrie JC, Dwyer E, Browne JK, et al. Darbepoietin alfa has a longer circulating half-life and greater in vivo potency than recombinant human erythropoietin. Exp Hematol, 2003, 31(4):290-299.
[9] Yu ZL. Human serum albumins recombined merge protein having hyperplasia stimulation function to multiple cells: China, 02142881.6. 2004-01-14. (in Chinese)于在林. 对多种细胞具刺激增生作用的人血清白蛋白重组融合蛋白: 中国, 02142881.6. 2004-01-14.
[10] Yu ZL, Fu Y. Recombinant human serum albumin-Erythropoietin fusion proteins with long-lasting biological effects: US, 7442371. 2008-10-28.
[11] Gou XH, Huang YC, Han L, et al. I nterfusion protein of human serum protein and erythropoietin: China, 200410053319.7. 2009-07-22 (in Chinese)苟兴华, 黄迎春, 韩雷, 等. 人血清蛋白与促红细胞生成素的融合蛋白: 中国, 200410053319.7. 2009-07-22.
[12] Huang YC, Gou XH, Han L, et al. Construction and expression of recombinant human serum albumin-EPO fusion protein. J Sichuan Univ (Med Sci Ed), 2011, 42(3):317-321. (in Chinese)黄迎春, 苟兴华, 韩蕾, 等. 人血清白蛋白与促红细胞生成素融合蛋白的构建及表达. 四川大学学报(医学版), 2011, 42(3):317-321.
[13] Joung CH, Shin JY, Koo JK, et al. Production and characterization of long-acting recombinant human albumin-EPO fusion protein expressed in CHO cell. Protein Expr Purif, 2009, 68(2):137-145.
[14] Fu Y, Ma JL, Li KT, et al. The Pharmacodynamics, pharmacokinetics and safety evaluation studies on a novel bio-better recombinant human serum albumin/erythropoietin fusion protein drug in press. Chin Med Biotechnol, 2017. (in Chinese) [Epub ahead of print]富岩, 马金玲, 李开通, 等. 原创原研创新药重组人血清白蛋白促红素融合蛋白的药效学、药代动力学及安全性评价研究. 中国医药生物技术, 2017. [优先出版]
[15] Yu ZL, Fu Y. Technique for separating and purifying recombination human serum albumin and fusion protein thereof: China, 200810089645.1. 2008-09-10. (in Chinese)于在林, 富岩. 一种重组人血清白蛋白及其融合蛋白的分离纯化工艺: 中国, 200810089645.1. 2008-09-10.
[16] Boissel JP, Lee WR, Presnell SR, et al. Erythropoietin structure-function relationships. Mutant proteins that test a model of tertiary structure. J Biol Chem, 1993, 268(21):15983-15993.
[17] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 3, 2015. Beijing: China Medical Science Press, 2015. (in Chinese)国家药典委员会. 中华人民共和国药典. 2015 年版三部. 北京: 中国医药科技出版社, 2015.
[18] Bill RM, Winter PC, McHale CM, et al. Expression and mutagenesis of recombinant human and murine erythropoietins in Escherichia coli. Biochim Biophys Acta, 1995, 1261(1):35-43.
www.cmbp.net.cn
Chin Med Biotechnol, 2017, 12(1):6-18
·协会之窗·
中国医药生物技术协会当选药品安全合作联盟副理事长单位
2017 年 1 月 19 日,药品安全合作联盟(以下简称“联盟”)第二次全体会议和第二届第一次理事会暨理事长办公会扩大会在京召开。会议审议通过联盟第一届理事会工作报告和财务报告。经选举,中国医药生物技术协会(以下简称“我会”)当选联盟第二届理事会副理事长单位,我会李少丽副理事长当选联盟第二届理事会理事长。我会今后在继续做好本领域工作的同时,多参与联盟的工作,承担联盟的任务。围绕联盟宗旨、结合协会职能,大力开展科普宣传,为药品安全和用药安全多做贡献。
药品安全合作联盟成立于 2012 年 11 月 28 日,由中国非处方药物协会、中国药学会、中国外商投资企业协会等12 家行业协会和单位共同发起成立。经过四年发展,目前联盟已有 25 家成员单位,下设 5 个专业委员会,在湖北、上海、广东、北京建立了 4 个区域工作站,并于 2016 年成立了北京药盾公益基金会。
Expression, preparation and characterization studies of a recombinant human serum albumin/erythropoietin fusion protein with novel molecular structure and long acting bio-better function
FU Yan, YANG Xiao-nan, WEI Kai-hua, FU Yu-song, YUN Wen-qi, ZHENG Bo-wei, LIU Dan, YU Zai-lin
ObjectiveStudies on the compliance of recombinant human serum albumin/erythropoietin fusion protein (rHSA/EPO) manufacture process and on the physicochemical properties and propose as basis and technical indicators of quality as a long acting, bio-better innovative protein drug.MethodsrHSA/EPO with long-acting and bio-better function was stably expressed in CHO cell line which constructed by genetically engineering technology. A manufacture process was established in a batch scale, suspension and growth in a serum-free medium. Then it was analyzed of the preparation process, detailed physicochemical properties and characteristics of technical quality indicators as a novel drug.ResultsThe purity of rHSA/EPO protein reached more than 97%. Products of rHSA/EPO digested by 3 different binding sites of protease separately and was analyzed with peptide mass fingerprint by MALDI-TOF/TOF PMF and Nano LC-MS/MS with the overall amino acid sequence coverage of 100%. N-terminal amino acid sequence of the first 15 amino acids is identical to the theoretical sequence. The glycosylation sites of rHSA/EPO was positioned with its molecular weight (MW) in mass spectrometry as 93 kD, but the MW of the fusion protein without sugars was 84205 D similar with the theoretical MW of 84849.52 D. The fusion protein contained 1 free sulfhydryl groups, which indicated that there existed only 1 free cysteine in the structure. HSA and EPO on their two space conformation unchanged after a round of two color spectrum analysis. A plurality of charge isomers were in the range of pI 5.1 - 5.8 by a capillary electrophoresis with isoelectric focusing obtained (pI) as about pI 4.9. A typical protein spectrum wasobtained by purple spectra. Residues of bacterial endotoxin, host protein, exogenous DNA were in line with the requirements of the regulations as drug raw materials. Immunological identification was positive with rhEPO which also expressed in CHO cells. Biological activity were determination with UT7 cells in vitro and with mice in vivo, but the activity were different. The in vivo and in vitro bioassay method was used for different experimental purposes, and each also had a certain correlation coefficient.ConclusionThe more comprehensive pharmacy data are obtained through studying on the physicochemical properties of the fusion protein. The results can be used as the guidance of the manufacture "Recombinant human serum albumin/erythropoietin fusion protein for injection" (CHO cells) on raw material medicine and preparation and show that the newly created molecular structure of rHSA/EPO (without a linker in between) is comply with the requirements as a bio-better novel protein drug.
Albumins; Erythropoietin; CHO cells; Recombinant fusion proteins
s:YU Zai-lin, Email: yuzailin88@sina.com; WEI Kai-hua, Email: wkh2006@126.com
10.3969/cmba.j.issn.1673-713X.2017.01.003
“重大新药创制”国家科技重大专项(2009ZX09103-706);天津市科学技术委员会科技支撑计划(11ZCKFSY00200)
300457 天津溥瀛生物技术有限公司(富岩、杨小楠、富俞淞、云文琦、郑博崴、于在林);100026 北京,中美福源生物技术(北京)股份有限公司(富岩、杨小楠、富俞淞、于在林);102206 北京,北京蛋白质组研究中心/蛋白质药物国家工程研究中心(魏开华、刘丹)
于在林,Email:yuzailin88@sina.com;魏开华,Email:wkh2006@126.com
2016-12-02
www.cmbp.net.cn 中国医药生物技术, 2017, 12(1):6-18
Author Affiliations:Tianjin SinoBiotech Ltd., Tianjin 300457, China (FU Yan, YANG Xiao-nan, FU Yu-song, YUN Wen-qi, ZHENG Bo-wei, YU Zai-lin); FortuneRock (China) Co., Ltd. Beijing 100026, China (FU Yan, YANG Xiao-nan, FU Yu-song, YU Zai-lin); Beijing Proteome Research Center, National Engineering Research Center for Protein Drugs, Beijing 102206, China (WEI Kai-hua, LIU Dan)
