高效的以腙为配体铜催化的C-N交叉偶联反应
2017-02-15张占金唐旭静李争宁陈会英
张占金,唐旭静,李争宁,陈会英
(1.大连民族大学 生命科学学院,辽宁 大连 116605;2.大连大学环境与化工学院,辽宁 大连 116600)
高效的以腙为配体铜催化的C-N交叉偶联反应
张占金1,唐旭静2,李争宁2,陈会英1
(1.大连民族大学 生命科学学院,辽宁 大连 116605;2.大连大学环境与化工学院,辽宁 大连 116600)
开发了一种温和、高效的以腙为配体的铜催化系统Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/Cs2CO3/DMSO,并在相对温和的条件下,将该系统用于催化胺与芳卤的交叉偶联反应,表现了良好的催化活性。交叉偶联反应的最大收率达到了80 %。实验表明,该类配体是稳定的、价廉的且可从市场上得到的原料,易于通过简单的方法进行制备。
胺;芳卤;腙;C-N交叉偶联
含有N-芳基组成部分的化合物可用于天然产物领域[1]、光学领域[2]及材料学领域[3]中,因此这类化合物的化学合成方法近年来引起了化学工作者的高度关注。钯催化的Ullmann类型的偶联反应是制备这类化合物的传统方法,近年来得到了快速的发展[4-5]。然而从实际的效益看,在温和条件下铜催化的反应显然已成为规模化生产研究的焦点[6]。最近,人们研究了许多在温和条件下用于催化胺化反应的配体,例如1,10-菲咯啉[7]、反式-1, 2-环己二胺[8]、乙二醇[9]、氨基酸[10]、NHC型配体[11]、1, 3-二酮[12]及其他类型含有氮和氧的配体[13-18]。然而,妨碍其应用的两个重要因素是费用和可利用性,特别是一些配体的制备要经过繁琐的多步合成反应。因此,发现更经济、更高效的配体仍然迫在眉睫。鉴于此,我们一直致力于研究开发低成本及易于合成的配体,而且这些配体一般都是从廉价的起始原料,经过简单的反应步骤制备。最近的突破是发展了分别用于脂肪胺及含氮杂环的交叉偶联反应的配体[19]。在应用腙和肟配体于铜催化胺的N-芳基化反应中,结果发现不仅用Cu2O作催化剂前体时腙是高效的配体,而且该类配体是费用低的、容易制备的及在空气中是稳定的。
1 材料与方法
1.1 设备及试剂
熔点的测定由YAZAWA微量熔点仪(未校正,北京泰克仪器有限公司)完成。1H NMR 和13C NMR 谱是以TMS作内标, 用Varian 核磁共振仪(400 MHz,美国瓦里安公司)测定。高分辨质谱(HRMS)的测定通过 Mariner 5303 (USA)高分辨质谱仪(美国应用生物系统公司)完成,乙腈作溶剂。
使用沸点范围为60 ~90 ℃的石油醚。所有溶剂均按照标准方法进行干燥和脱气。通过改变石油醚与乙酸乙酯的比例来实现洗脱液极性梯度的变化,直至将产物分开。
1.2 配体的合成
将H2N-R2(10 mmol)和甲苯(6 mL,R2为a)或三乙胺(6 mL,R2为b、c)加入到装有磁搅拌子干燥的50 mL圆底烧瓶中。搅拌下滴加 R1-CHO(10 mmol)6 mL甲苯溶液。然后,搅拌下加热反应混合物至85 ℃并维持24 h。冷却到室温后,加入4 mL乙醇至得到的混合物中。滤除固体,减压下除去溶剂。用乙醇重结晶粗产物得到目标化合物。
1.3 偶联反应
将Cu2O (14.4 mg,0.1 mmol)、Cs2CO3(977.5 mg,3 mmol)及配体4a (43.2 mg,0.2 mmol)加入到Schlenk瓶中。将Schlenk瓶抽空并置换成氩气氛围(重复5次)。室温下加入DMSO (1 mL)、胺(1.5 mmol)和芳碘(1 mmol)。再次抽空置换Schlenk瓶成氩气氛围(重复5次)。在95 ℃并搅拌下加热反应物36 h。冷却到室温,将4 mL乙酸乙酯和10 mL水加入到反应物中。分出有机层,水层进一步用乙酸乙酯萃取(4×10 mL)。合并后的有机相用饱和食盐水洗涤,无水Na2SO4干燥。真空除去溶剂,以石油醚和乙酸乙酯混合物为洗脱液,剩余物进一步通过硅胶柱纯化得到目标产物。
1.4 芳碘与胺类交叉偶联反应数据
N-丁基苯胺:无色液体(0.1060 g,产率71 %)。1H NMR (400 MHz,CDCl3):δ7.29~7.28 (d,J= 5.9 Hz,2H),6.81~6.80 (d,J= 5.5 Hz,2H),6.71 (s,1H),3.67 (s,1H),3.19 (s,2H),1.69 (s,2H),1.54 (s,2H),1.08~1.07 (d,J= 6.6 Hz,3H)。HRMS (APCI) calcd for C10H16N (M+H+):150.1211,found:150.1284。
N-环己基苯胺:无色液体(0.1262 g,产率72 %)。1H NMR (400 MHz,CDCl3):δ7.23~7.22 (d,J= 4.0 Hz,2H),6.74~6.66 (d,J= 32.0 Hz,3H),3.59 (s,1H),3.32~3.31 (d,J= 3.3 Hz,1H),2.13 (s,2H),1.83~1.72 (d,J= 41.8 Hz 3H),1.52~1.01 (m,5H)。HRMS (APCI) calcd for C12H18N(M+H+):176.1368,found:176.1440。
N-苄基苯胺:白色固体(0.1319 g,产率72 %): m.p. 36~37 ℃。1H NMR (400 MHz,CDCl3):δ7.68~7.39 (m, 4H),7.33~7.28 (t,J= 6.7 Hz,3H),6.90~6.87 (t,J= 6.3 Hz,1H),6.78~6.76 (d,J= 6.8 Hz,2H),4.44 (s,2H),4.16 (s,1H)。HRMS (APCI) calcd for C13H14N(M+H+):184.1055,found:184.1128。
N-异丙基苯胺:无色液体(0.0933 g,产率69 %)。1H NMR (400 MHz,CDCl3):δ6.98~6.97 (d,J= 6.4 Hz,2H),6.59~6.55 (t,J= 7.1 Hz,1H),6.48~6.46 (d,J= 7.5 Hz,2H),3.61~3.42 (m,1H),3.31 (s,1H),1.10~1.09 (d,J= 5.8 Hz,6H)。1HRMS (APCI) calcd for C9H14N (M+H+):136.1047,found:136.1120。
N-叔丁基苯胺:淡黄色液体(0.1015 g,产率68 % )。1H NMR (400 MHz,CDCl3):δ7.36~7.26 (t,J= 7.5 Hz,2H),7.04~6.83 (m,3H),3.80 (s,1H),1.27 (s,9H)。 HRMS(APCI) calcd for C10H16N (M+H+):150.1204,found:150.1277。
N-环己基-4-甲基苯胺:无色液体(0.1268 g,产率67 % )。1H NMR (400 MHz,CDCl3):δ6.90~6.86 (d,J= 7.5 Hz,2H),6.45~6.43 (d,J= 7.4 Hz,2H),3.45 (br,1H),3.14~3.09 (t,J= 9.0 Hz,1H),2.13 (s,3H),1.97~1.94 (d,J= 11.9 Hz,2H),1.67~1.53 (m,3H),1.38~0.92 (m,5H)。HRMS (APCI) calcd for C13H20N (M+H+):190.1500,found:190.1592。
N-苄基-4-氰基苯胺:黄色固体(0.1562 g,产率75 % ):m.p. 72~73 ℃。1H NMR (400 MHz,CDCl3):δ7.51~7.46 (d,J= 8.9 Hz,2H),7.25~7.16 (m,5H),6.50~6.48 (d,J= 8.1 Hz,2H),4.53 (s,1H),4.28 (s,2H)。HRMS (APCI) calcd for C14H13N2(M+H+):209.0994,found:209.1067。
N-环己基-4-甲氧基苯胺:白色固体(0.1314 g,产率64 % )。m.p. 41~42 ℃。1H NMR (400 MHz,CDCl3):δ7.45~7.43 (d,J= 6.8 Hz,2H),6.57~6.56 (d,J= 6.8 Hz,2H),3.65 (s,3H),3.26 (s,1H),3.06 (s,1H),1.94~1.93 (d,J= 11.2 Hz,2H),1.66~1.53 (m,3H),1.36~0.91 (m,5H)。HRMS (APCI) calcd for C13H20NO (M+H+):206.1466,found:206.1538。
N-苯基吡咯烷:无色液体(0.1089 g,产率74 %)。1H NMR (400 MHz,CDCl3):δ7.14~7.11 (m,2H),6.57 (s,1H),6.48~6.47 (d,J= 6.1 Hz,2H),3.17 (s,4H),1.89 (s,4H)。HRMS (APCI) calcd for C10H14N (M+H+):148.1057,found:148.1130。
N-(4-甲氧苯基)吡咯烷:白色固体(0.1152,产率65 % )。m.p. 42~43 ℃。1H NMR (400 MHz,CDCl3):δ6.77~6.75 (d,J= 7.6 Hz,2H),6.48~6.46 (d,J= 7.3 Hz,2H),3.69~3.67 (d,J= 9.2 Hz,3H),3.15 (s,4H),1.90 (s,4H)。HRMS (APCI) calcd for C11H16NO (M+H+):178.1164,found:178.1237。
N-甲基-N-苯基哌嗪:无色液体(0.1234 g,产率70 % )。1H NMR (400 MHz,CDCl3):δ7.28~7.25 (t,J= 5.9 Hz,2H),7.03~6.89 (m,2H),6.88~6.85 (t,J= 6.4 Hz,1H),3.21 (s,4H),2.58 (s,4H),2.35 (s,3H)。HRMS (APCI) calcd for C11H17N2(M+H+):177.1300,found:177.1403。
N-苯基吗啉:白色固体(0.1224 g,产率75 % )。m.p. 51~52 ℃。1H NMR (400 MHz,CDCl3):δ7.33~7.31 (d,J= 6.7 Hz,2H),6.96~6.94 (d,J= 7.5 Hz,3H),3.89 (s,4H),3.19 (s,4H)。HRMS (APCI) calcd for C10H14NO (M+H+):164.1001,found:164.1073。
N-苯基-3, 5-二甲基吗啉:无色液体(0.1377 g,产率72 % )。1H NMR (400 MHz,CDCl3):δ7.33~7.30 (t,J= 6.6 Hz,2H),7.13~6.68 (m,3H),4.20~4.19 (d,J= 2.7 Hz,1H),3.86~3.85 (d,J= 1.9 Hz,1H),3.50~3.48 (d,J= 11.7 Hz,1H),3.25~3.22 (d,J= 11.6 Hz,1H),2.93~2.91 (m,1H),2.48~2.42 (t,J= 10.8 Hz,1H),1.37~1.30 (m,6H)。HRMS (APCI) calcd for C12H18NO (M+H+):192.1324,found:192.1397。
N-(4-氰苯基)吗啉:白色固体(0.1506 g,产率80 %)。m.p. 75~76 ℃。1H NMR (400 MHz,CDCl3):δ7.52~7.50 (d,J= 8.2 Hz,2H),6.89~6.87 (d,J= 8.2 Hz,2H),3.86 (s,4H),3.28 (s,4H)。HRMS (APCI) calcd for C11H13N2O (M+H+):189.0900,found:189.1013。
N-(4-甲苯基)吗啉:白色固体(0.1223 g,产率69 % )。m.p. 40~42 ℃。1H NMR (400 MHz,CDCl3):δ7.03~7.02 (d,J= 5.4 Hz,2H),6.79 (s,2H),3.80 (s,4H),3.05 (s,4H),2.21 (s,3H)。HRMS (APCI) calcd for C11H16NO (M+H+):178.1200,found:178.1233。
N-(4-甲氧苯基)吗啉:白色固体(0.1275 g,产率66 %)。m.p. 66~67 ℃。1H NMR (400 MHz,CDCl3):δ7.04~6.72 (m,4H),3.88 (s,4H),3.77 (s,3H),3.07 (s,4H)。HRMS (APCI) calcd for C11H16NO2(M+H+):194.1106,found:194.1179。
N-苯基吲哚:无色液体(0.1236 g,产率64 %)。1H NMR (400 MHz,CDCl3):δ7.83 (s,1H),7.57~7.55 (d,J= 7.4 Hz,2H),7.21~7.20 (d,J= 7.7 Hz,2H),7.12~6.86 (m,4H),6.44 (s,2H)。HRMS (APCI) calcd for C14H12N (M+H+):194.0900,found:194.0937。
1.5 含氮杂芳环与胺类交叉偶联反应数据
5-(环己胺-N-基)嘧啶:白色固体(0.1205 g,产率68 %)。m.p. 106~107 ℃。1H NMR (400 MHz,CDCl3):δ8.48 (s,1H),8.04 (s,2H),3.60 (s,1H),3.21 (s,1H),2.00 (s,2H),1.70~1.60 (d,J= 29.3 Hz,3H),1.38~0.95 (m,5H)。 HRMS (APCI) calcd for C10H16N3(M+H+):178.1272,found:178.1345。
5-(苄胺-N-基)嘧啶:白色固体(0.1278 g,产率69 %)。m.p. 98~99 ℃。1H NMR (400 MHz,CDCl3):δ8.49 (s,1H),8.02 (s,2H),7.34~7.18 (m,5H),4.38 (s,1H),4.25 (s,2H)。HRMS (APCI) calcd for C11H12N3(M+H+):186.1000,found:186.1022。
5-(吡咯烷-1-基)嘧啶:无色液体(0.1000 g,67 % )。1H NMR (400 MHz,CDCl3):δ8.54 (s,1H),8.05 (s,2H),3.30 (s,4H),2.04 (s,4H)。HRMS (APCI) calcd for C8H12N3(M+H+):150.0957,found:150.1029。
5-(吗啉-1-基)嘧啶:无色液体(0.1173 g,产率71 % )。1H NMR (400 MHz,CDCl3):δ8.55 (s,1H),7.99 (s,2H),4.77 (s,4H),3.62 (s,4H)。HRMS (APCI) calcd for C8H12N3O (M+H+):166.0893,found:166.0966。
2-(吡咯烷-N-基)吡啶:无色液体(0.0934 g,产率63 % )。1H NMR (400 MHz,CDCl3):δ8.13 (s,1H),7.40~7.38 (d,J= 7.0 Hz,1H),6.47 (s,1H),6.32~6.30 (d,J= 7.9 Hz,1H),3.41 (s,4H),1.97~1.96 (d,J= 1.9 Hz,4H)。HRMS (APCI) calcd for C9H13N2(M+H+):149.1013,found:149.1086。
2-(吗啉-N-基)吡啶:无色液体 (0.1084 g,产率66 % )。1H NMR (400 MHz,CDCl3):δ8.16~8.15 (d,J= 1.9 Hz,1H),7.48~7.44 (m,1H),6.61~6.58 (t,J= 7.2 Hz,2H),3.77 (s,4H),3.45 (s,4H)。HRMS (APCI) calcd for C9H13N2O (M+H+):165.0959,found:165.1031。
2-(环己胺-N-基)吡啶:白色固体(0.1146 g,产率65 %)。m.p. 100~101 ℃。1H NMR (400 MHz,CDCl3):δ8.37 (s,1H),8.03 (s,1H),6.51 (s,1H),6.37~6.35 (d,J= 8.2 Hz,1H),4.59 (s,1H),3.51~3.50 (d,J= 4.5 Hz,1H),2.04~2.01 (d,J= 11.8 Hz,2H),1.76~1.61 (m,3H),1.43~1.34 (m,2H),1.28~1.06 (m,3H)。HRMS (APCI) calcd for C11H17N2(M+H+):177.1323,found:177.1396。
2-(苄胺-N-基)吡啶:白色固体(0.1271 g,产率69 % )。m.p. 82~83 ℃。1H NMR (400 MHz,CDCl3):δ8.16~8.15 (d,J= 6.7 Hz,1H),7.65~7.49 (m,5H),6.72~6.69 (t,J= 6.5 Hz,1H),6.55~6.46 (m,1H),5.30 (s,1H),4.74 (s,2H)。HRMS (APCI) calcd for C12H13N2(M+H+):185.1001,found:185.1074。
2 结果与讨论
腙及肟配体的合成如图1。腙和肟配体1b、2a、3b、4a、4b、4c、5a、5b及5c可以通过简单的一步反应,由廉价、易得的苯肼(取代苯肼)、羟胺及相应的芳甲醛(杂环芳甲醛)以优良的分离收率合成。利用萃取和重结晶而不是使用复杂的分离过程得到配体,并且该类配体数周内在空气中可稳定存在。
在初步的配体筛选实验中,K3PO4作为碱,在95 ℃及CuBr存在下,使用碘苯与吗啉在DMSO中的偶联反应作为模板反应。合成的腙和肟分别用于碘苯和吗啉的偶联反应中,所得交叉偶联反应的结果如图2。
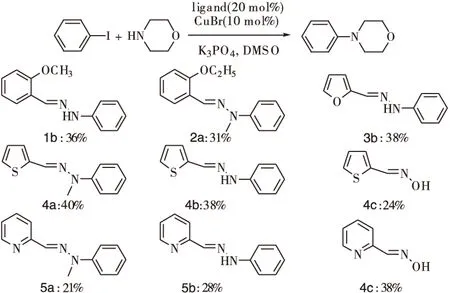
图2 铜催化吗啉的N-芳基化反应:配体的筛选
反应条件:CuBr (0.1 mmol),配体 (0.2 mmol),PhI (1.0 mmol),吗啉 (1.5 mmol),K3PO4(3 mmol),DMSO (1 mL),95 ℃,36 h
2-呋喃甲醛苯腙和2-噻吩甲醛苯腙配体上的氧和硫对配体活性的影响几乎没有差别。而使用2-吡啶苯腙配体,偶联反应的产率较低。对于2-噻吩甲醛苯腙配体,观察到了较高的分离收率。使用4a配体得到40 %最好产率,这可能与配体氮原子所连的甲基有关。因此,为了进一步筛选配体,又测定了4c,5a和5c的活性。不幸的是使用4c作为配体,得到了更低的结果。
为了达到有效偶联反应的目的,通常选择合适的碱、溶剂及铜源是非常重要的。因此,使用上述已筛选出的配体,对碱、溶剂及铜源进行了优化,所得结果见表1。
表1 用于吗啉N-芳基化反应的碱、溶剂及铜源的筛选a
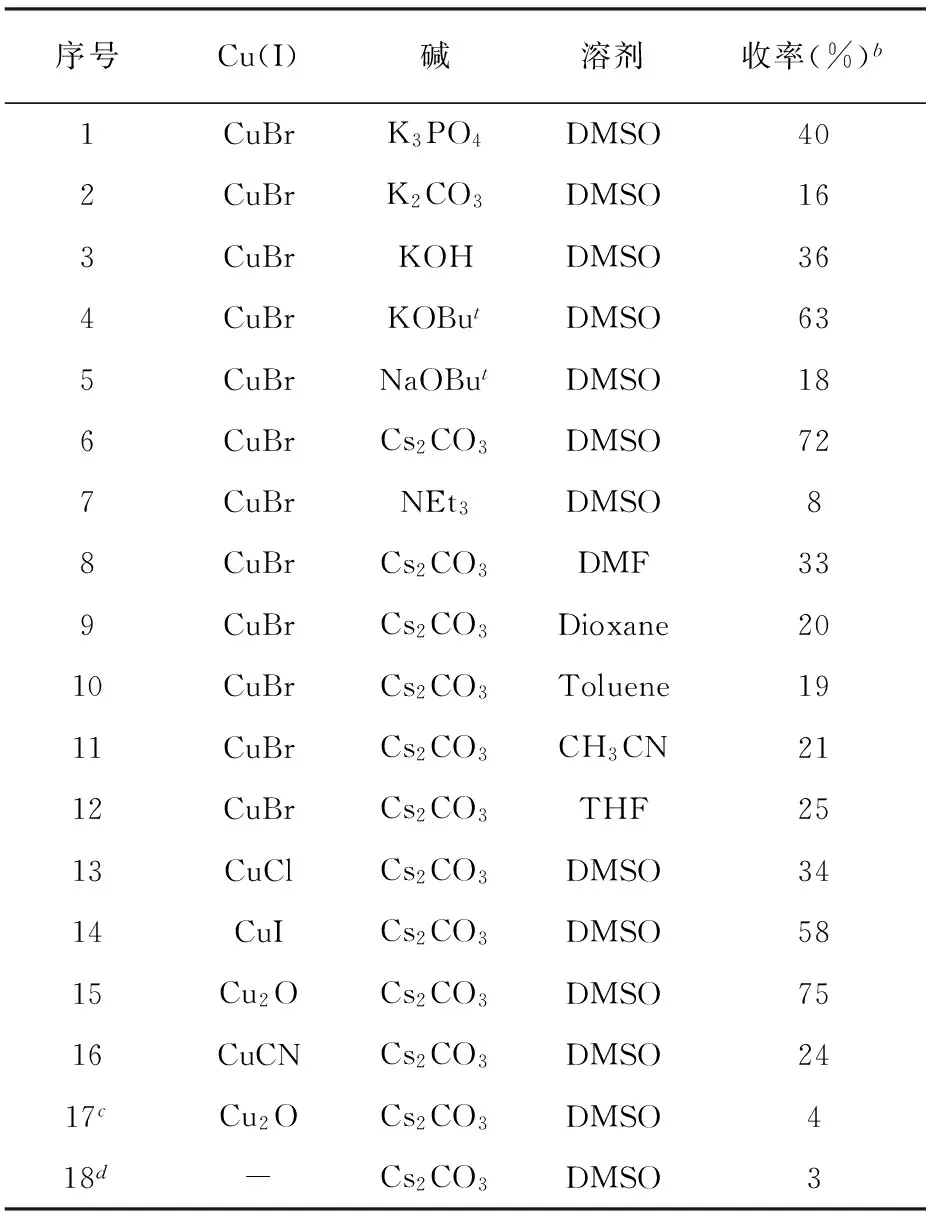
序号Cu(I)碱溶剂收率(%)b1CuBrK3PO4DMSO402CuBrK2CO3DMSO163CuBrKOHDMSO364CuBrKOButDMSO635CuBrNaOButDMSO186CuBrCs2CO3DMSO727CuBrNEt3DMSO88CuBrCs2CO3DMF339CuBrCs2CO3Dioxane2010CuBrCs2CO3Toluene1911CuBrCs2CO3CH3CN2112CuBrCs2CO3THF2513CuClCs2CO3DMSO3414CuICs2CO3DMSO5815Cu2OCs2CO3DMSO7516CuCNCs2CO3DMSO2417cCu2OCs2CO3DMSO418d-Cs2CO3DMSO3
注:a为反应条件:Cu(I) (0.1 mmol),4a (0.2 mmol),PhI (1.0 mmol),吗啉 (1.5 mmol),碱 (3 mmol),溶剂 (1 mL),95 ℃,36 h;b为分离收率;c为没有使用配体;d为没有使用铜源。
从表1可以看出,通常使用的碱,如K3PO4、K2CO3、KOH、KOBut、NaOBut、Cs2CO3及 NEt3对偶联反应有不同的影响(序号1-7),其中Cs2CO3最好(序号6)。其次,KOBut也可供选择(序号4)。当使用有机碱 NEt3时,仅仅得到了8 %的分离收率(序号7)。使用 Cs2CO3作为碱,测定溶剂影响的研究表明:模板反应在溶剂DMSO中能高效进行(序号6),而在其他所选用的溶剂中,反应效率较低(序号8-12)。因此,选择DMSO作为接下来实验的溶剂。在铜源检测中,发现空气中稳定的、廉价的 Cu2O是更有效的铜源(序号15)。而在没有配体只有铜源或只有铜源没有配体的情况下,仅仅观察到了很低的产率(序号17-18)。通过筛选实验得到的最佳催化系统为:Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/Cs2CO3/DMSO。
为了进一步考查铜催化的芳碘与胺的交叉偶联反应,扩展催化系统Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/Cs2CO3/DMSO至其他的伯胺、仲胺与芳碘类化合物的交叉偶联反应(见表2)、5-溴嘧啶及2-溴吡啶的交叉偶联反应(见表3)。
表2 铜催化的芳碘与胺的偶联反应a

注:a为反应条件:Cu2O(0.1 mmol),4a (0.2 mmol),芳卤(1.0 mmol), 胺(1.5 mmol),Cs2CO3(3 mmol),在DMSO (1 mL)中,95 ℃,36 h;b为分离收率。
由表2可看出,筛选出的Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/DMSO/Cs2CO3可作为脂肪伯胺、仲胺与芳碘偶联反应的最佳催化系统。首先,采用伯胺作为试剂,观察到了优良的分离收率(表3 序号 1-8)。反应能够忍耐像氰基、甲氧基等官能团(序号 5-8)。对于取代芳碘,观察到了电子效应的明显影响。对含有吸电子基的芳碘,得到了相对较高的收率(序号 2,5,序号 3,6)。对含有供电子基的芳碘,得到了相对较低的分离收率(序号 2,7)。其次,选用仲胺作试剂,得到了可观的分离收率(序号 9-17)。同样,反应也能够容忍像氰基及甲氧基等活性基团(序号 10,14~16)。吸电子及供电子基(序号 12,14,序号 12,16)对芳碘偶联反应产率的影响与伯胺的芳基化相似。
表3 铜催化的含氮杂芳环与胺的偶联反应a

注:a为反应条件:Cu2O(0.2 mmol),4a (0.4 mmol),芳卤(1.0 mmol),胺(1.5 mmol),和Cs2CO3(3 mmol),在DMSO (1 mL)中,95 ℃,48 h;b为分离收率。
接下来,将Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/DMSO/Cs2CO3作为催化系统用于脂肪胺与N-杂环芳烃的偶联反应。如表3所示,当Cu2O和配体的量加倍后,8种N-杂环化合物能有效地转化为所要求的产物。5-溴嘧啶与4种胺的偶联反应能够平稳进行(序号 1-4)。得到了良好的分离收率,但所得结果稍有差别。2-溴吡啶也能成功地与某些胺类进行偶联反应(序号 5-8)。
3 结 论
如上所述,发展了一种温和的、高效的胺与芳卤的N-芳基化反应的铜催化系统Cu2O/2-噻吩甲醛-N-甲基苯腙(4a)/DMSO/Cs2CO3。腙配体通过简单、有效的方法,使用廉价易得的起始原料合成,使其具有价廉、稳定的特点。尽管该催化系统仅限于高活性芳卤的C-N偶联反应,但这也不妨碍它们在某些情况下具有一定的、潜在的应用价值,同时也代表了简单、价廉催化系统的实际发展趋势。进一步的研究正在进行中。
[1] BUCKINGHAM J B. Dictionary of Natural Products[M]. Vol. 1, CRC Press(USA), 1994.
[2] LOUTFY R O, HOR A M, KAZMAIER P M, et al. Organic photoconductive (OPC)devices incorporating bisarylimidazole perinone pigments[J]. Dyes and Pigments, 1991, 15(2): 139-156.
[3] APRANO G D, LECLERC M, ZOTTI G, et al. Electrochemistry of phenyl-N-capped aniline oligomers. Evaluation of optical and electrochemical properties of ideal polyaniline[J]. Synthetic Metals, 1996, 82(1): 59-61.
[4] YANG B H, BUCHWALD S L. Palladium-catalyzed amination of aryl halides and sulfonates[J]. J Organomet. Chem, 1999, 576(1-2): 125-146.
[5] HARTWIG J F. Synthesis, structure and reactivity of a palladium hydrazonato complex: a new type of reductive elimination reaction to form C-N bonds and catalytic arylation of benzophenone hydrazone[J]. Angew Chem Int Ed Engl, 1998, 37: 2090-2093.
[6] HASSAN J, SéVIFNON M, GOZZI C, et al. Aryl bond formation one century after the discovery of the Ullmann reaction[J]. Chem Rev, 2002, 102(5):1359-1470.
[7] JONES K L, PORZELLE A, HALL A, et al. Copper-catalyzed coupling of hydroxylamines with aryl iodides[J]. Org Lett, 2008, 10(5): 797-800.
[8] LEE H W, CHAN A S C, KWONG F Y. Iron complex-catalyzedN-arylation of pyrazoles under aqueous medium[J]. Tetrahedron Lett, 2009, 50(42): 5868-5871.
[9] KHATRI P K, JAIN S L. Glycerol ingrained copper: an efficient recyclable catalyst for theN-arylation of amines with aryl halides[J]. Tetrahedron Lett, 2013, 54(21): 2740-2743.
[10] CHOW W, CHAN T. Microwave-assisted solvent-freeN-arylation of imidazole and pyrazole[J]. Tetrahedron Lett, 2009, 50(12): 1286-1289.
[11] LIU J, ZHANG R, WANG S, et al. A general and efficient copper catalyst for the double carbonylation reaction[J]. Org. Lett, 2009, 11(6): 1321-1324.
[12] MALIGRES P E, KRSKA S W, DORMER P G. A soluble copper(I) source and stable salts of volatile ligands for copper-catalyzed C-X couplings[J]. J Org Chem, 2012, 77(17): 7646-7651.
[13] CHEN D, YANG K, XIANG H, et al. CuCl-catalyzed formation of C-N bond with a soluble base[J]. Tetrahedron Lett, 2012, 53(52): 7121-7124.
[14] TSURITANI T, STROTMAN N A, YAMAMOTO Y, et al.N-Cyclopropylation of indoles and cyclic amides with copper(II) reagent[J]. Org. Lett, 2008, 10(8): 1653-1655.
[15] LAM M S, LEE H W, CHAN A S C, et al. Copper(I)-picolinic acid catalyzedN-arylation of hydrazides[J]. Tetrahedron Lett, 2008, 49(43): 6192-6194.
[16] WANG X, GURAM A, RONK M, et al. Copper-catalyzedN-arylation of sulfonamides with aryl bromides under mild conditions[J]. Tetrahedron Lett, 2012, 53(1): 7-10.
[17] KHATRI P K, JAIN S L. Copper-catalyzedN-arylation of sulfonamides with aryl bromides under mild conditions[J]. Tetrahedron Lett, 2013, 54(21): 2740-2743.
[18] YANG B, MAO Z, ZHU X, et al. Functionalised chitosan as a green, recyclable, supported catalyst for the copper-catalysed Ullmann C-N coupling reaction in water[J]. Catalysis Communications, 2015, 60: 92-95.
[19] ZHANG Z, MAO J, ZHU D, et al. Highly efficient and practical phosphoramidite-copper catalysts for amination of aryl iodides and heteroaryl bromides with alkylamines and N(H)-heterocycles[J]. Tetrahedron, 2006, 62(18): 4435-4443.
(责任编辑 邹永红)
Highly Efficient Copper-Catalyzed C-N Cross Coupling Reaction Using Hydrazone as Ligand
ZHANG Zhan-jin1, TANG Xu-jing2, LI Zheng-ning2, CHEN Hui-ying1
(1.School of Life Science, Dalian Minzu University, Dalian Liaoning 116605, China; 2.College of Environmental and Chemical Engineering, Dalian University, Dalian Liaoning 116600, China)
A mild and highly efficient copper-catalyzed system, i.e, Cu2O/2-thiophenolaldehyde-N-methyl phenyl hydrazone (4a)/Cs2CO3/DMSO for cross coupling reaction of amines with aryl halides using hydrazone as ligand was developed and good catalytic activity was revealed. The reactions were carried out under relatively mild condition. The optimal yield reached to 80% for cross coupling reactions. It was showed that hydrazone ligands were stable, low-cost and easily prepared from inexpensive, commercially available starting materials using a simple, efficient method.
amine; arylhalide; hydrazone; C-N cross coupling
2016-09-28;最后
2016-11-21
张占金(1959-),男,辽宁朝阳人,教授,博士,主要从事有机合成,均相催化研究。
2096-1383(2017)01-0014-07
O625.41
A
