FRK通过调节EGFR-Y1173磷酸化促进脑胶质瘤细胞凋亡作用的研究
2017-02-14张道为石琼金戈王军宋旭蔡畅方震周秀萍郭克勤于如同
张道为,石琼,金戈,王军,宋旭,蔡畅,方震,周秀萍,郭克勤,于如同
·论著·
FRK通过调节EGFR-Y1173磷酸化促进脑胶质瘤细胞凋亡作用的研究
张道为,石琼,金戈,王军,宋旭,蔡畅,方震,周秀萍,郭克勤,于如同
目的 研究FRK是否通过调节表皮生长因子受体(EGFR)-Y1173磷酸化促进胶质瘤细胞的凋亡。 方法 应用PolyJetTM将FRK质粒转染入脑胶质瘤U251细胞中,western blot(WB)检测质粒转染效果及EGFR蛋白水平和EGFR-Y1173磷酸化水平的变化,流式细胞术检测脑胶质瘤细胞凋亡的变化;转染EGFR(WT)、EGFR(Y1173F)质粒,或共转FRK和EGFR(WT)、EGFR(Y1173F)质粒,流式细胞术检测脑胶质瘤U251细胞凋亡的变化。结果 成功将FRK质粒转染入脑胶质瘤U251细胞,过表达FRK促进脑胶质瘤U251细胞的凋亡。过表达FRK增加EGFR-Y1173磷酸化水平,而对EGFR蛋白水平无影响。过表达EGFR(WT)、EGFR(Y1173F)质粒,细胞凋亡均减少,分别减少了25%和75%。WB结果显示,共转FRK和EGFR(WT)、EGFR(Y1173F)质粒成功;流式细胞术结果显示,与对照组相比,过表达FRK促进了细胞凋亡,EGFR抑制了细胞凋亡,且转染EGFR(Y1173F)质粒组的作用比转染EGFR(WT)的效果更明显。此外,转染EGFR(Y1173F)质粒可逆转过表达FRK对胶质瘤细胞的促凋亡作用。结论 FRK可以通过促进EGFR-Y1173磷酸化从而调节胶质瘤细胞的凋亡。
胶质瘤;FRK;EGFR;凋亡
脑胶质瘤是颅内最常见的原发性脑肿瘤[1],发病率高,预后很不理想,究其原因主要是胶质瘤细胞的凋亡能力下降所致。因此,探明胶质瘤细胞的凋亡分子机制并采取有效的防治措施,有着极其重要的医学价值。现有的研究发现,在宫颈癌HeLa细胞系、乳腺癌MCF-7和BT474细胞系中,过表达FRK均可促进细胞凋亡[2]。本实验室研究发现过表达FRK能够抑制胶质瘤细胞的增殖,促进其凋亡[3],那么FRK是通过何种机制发挥这种作用的呢?2013年Jin和Craven首次报道了在肺癌细胞中FRK与表皮生长因子受体(EGFR)直接结合,促进Tyr1173残基磷酸化[4]。磷酸化的Tyr1173降低EGFR活性且抑制下游信号通路,调节细胞凋亡[5]。本研究采用Western blot、流式细胞术等实验方法,研究FRK是否通过调节EGFR-1173磷酸化来影响脑胶质瘤细胞的凋亡,为脑胶质瘤的治疗提供理论依据与治疗靶点。
1 材料与方法
1.1 主要材料和试剂 U251细胞系(中国科学院上海细胞库),pcDNA3.0-FRK质粒(Flag-tag)、pcDNA3.0-EGFR(WT)、pcDNA3.0-EGFR(Y1173F)(美国德州大学医学部安德森肿瘤研究中心馈赠),FRK、EGFR、EGFR(phospho Y1173)抗体(Abcam公司),GAPDH抗体(杭州贤至公司)。
1.2 方法
1.2.1 细胞培养 脑胶质瘤U251细胞依照其培养说明书,在超净工作台上操作。弃去原培养基,0.01%PBS洗细胞两遍,加入0.25%胰酶消化,待细胞收缩变圆后加入适量含有10%FBS的DMEM/F12完全培养基终止消化,后轻轻吹打细胞至形成单细胞悬液,分瓶培养。培养条件:37℃,5%CO2,饱和湿度。每3~4 d,细胞处于对数生长期,铺满培养瓶底约70%时传代一次;按1∶3或1∶4的细胞比例传代。
1.2.2 细胞转染 单转组PolyJetTM与 DNA比例为3.0 μl∶1 μg,共转组PolyJetTM与siRNA、DNA 比例为5 μl∶4 μl∶1 μg,检测时间点为转染后48 h。转染前24 h将 U251细胞接种于6孔塑料培养板,每孔细胞约 5×105个。培养基为含10%胎牛血清的DMEM培养基,不含抗生素,细胞在24 h后达到85%~90%的融合即可转染。每孔用量为质粒DNA 1.0 μg,PolyJetTM3.0 μl,各用高糖培养基50 μl 稀释,室温静置5 min,将两者混匀室温静置孵育15 min,然后直接将混合物加到6孔板中。轻轻摇晃混匀,培养箱内培养12 h 后换为含10%胎牛血清的DMEM培养基继续培养,48 h后提取细胞蛋白进行检测。
1.2.3 Western blot检测 将待测蛋白用4×上样缓冲液配成40 μl体积,然后在垂直电泳槽通过聚丙烯酰胺凝胶电泳分离,以100 V电压电泳约2 h。电泳结束后,根据上样情况和蛋白质分子量切取适当大小的长方形分离胶,至电转液中浸泡。 剪适当大小的PVDF膜,PVDF膜用甲醇浸泡数分钟后,置入电转液中,而中性滤纸则直接放入电转液中浸泡数分钟后开始转膜。恒压100 V,时间为100 min左右。转膜完毕,把膜放入封闭液中2 h。将膜从封闭液中取出,根据标记分别放入相应的一抗,4℃过夜,然后加入辣根过氧化物酶标记的二抗,室温孵育2 h。暗室中进行显影,定影。
1.2.4 流式细胞术 收集细胞(1~5)×106个,800 r/min离心5 min,弃去培养液;3 ml PBS洗1次;离心去PBS,加入冰预冷的70%的乙醇固定,4℃,过夜;离心弃去固定液,3 ml PBS重悬5 min;800 r/min离心5 min,弃去PBS;用1 ml PI染液,4℃避光30 min;然后加Annexin V-FITC(5 μl),流式细胞仪检测。
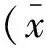
2 结 果
2.1 过表达FRK对脑胶质瘤U251细胞凋亡的影响 在胶质瘤U251细胞中转染FRK质粒后48h,提取细胞总蛋白,分别用Flag抗体(图1A左)和FRK抗体(图1A右)进行检测。结果显示,脑胶质瘤U251 细胞中,FRK过表达组中FRK的蛋白水平明显升高,提示转染成功(图 1A)。应用流式细胞术检测细胞凋亡情况,结果显示:与对照组相比,过表达FRK促进了脑胶质瘤U251细胞的凋亡,增加约300%(图1B、1C)。
A:转染Flag和Flag-FRK质粒48 h后,Western blot检测转染效率;B、C:过表达FRK对胶质瘤细胞凋亡的影响及统计图(*P<0.05)图1 FRK对胶质瘤细胞凋亡的影响
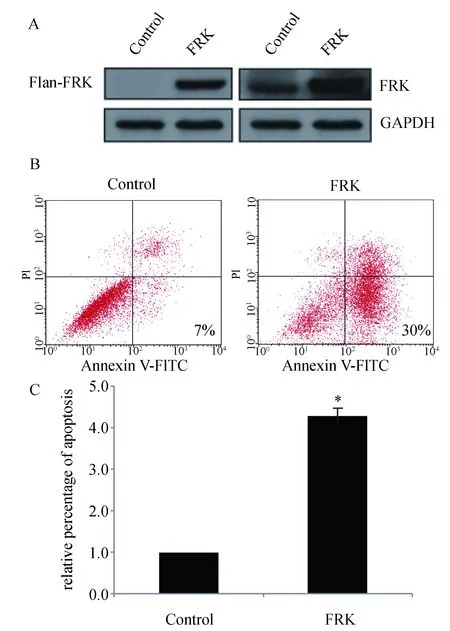
2.2 过表达FRK对EGFR蛋白水平的影响 在胶质瘤U251中转染FRK质粒后48 h,Western blot检测EGFR和EGFR-pY1173水平。与对照组相比,转染FRK质粒组EGFR-pY1173蛋白水平明显上升,上升约200%,而EGFR蛋白水平无明显变化。结果表明FRK可以促进EGFR-Y1173磷酸化,但不影响EGFR总蛋白水平(图2)。
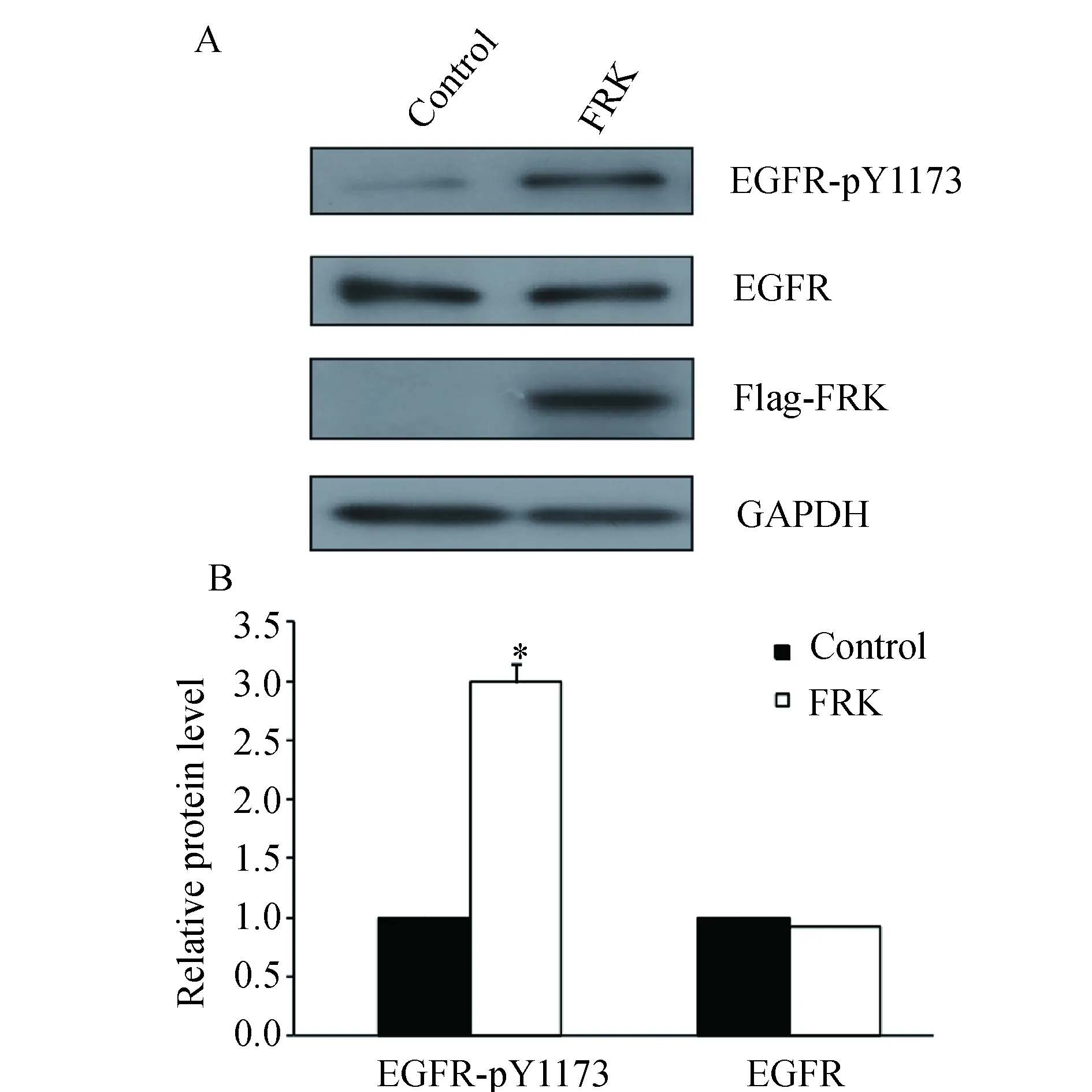
2.3 过表达EGFR(WT)、EGFR(Y1173F)对细胞凋亡的影响 在胶质瘤U251细胞中转染EGFR(WT)和EGFR(Y1173F)质粒后,Western blot检测EGFR蛋白水平。结果显示,与对照组相比,转染EGFR(WT)和EGFR(Y1173F)质粒组EGFR蛋白水平均明显上升,提示转染成功(图3A)。应用流式细胞术检测细胞凋亡(图3B),与转染空质粒对照组相比,转染EGFR(WT)和EGFR(Y1173F)质粒组细胞凋亡数减少,分别减少了25%和75%(图3C,P<0.05);且转染EGFR(Y1173F)质粒组与转染EGFR(WT)质粒组相比细胞凋亡数明显减少,差异有统计学意义(图3C,P<0.01)。
A:Western blot检测EGFR蛋白水平;B:统计图(* P<0.05)图2 FRK对EGFR蛋白水平的影响
A:质粒转染验证图;B、C:转染质粒后流式细胞术检测细胞凋亡及统计图(*P<0.05,**P<0.01)图3 过表达EGFR(WT)、EGFR(Y1173F)对细胞凋亡的影响
2.4 共转FRK和EGFR(WT)、EGFR(Y1173F)质粒对细胞凋亡的影响 为研究FRK是否可以通过磷酸化EGFR的Tyr1173残基促进脑胶质瘤细胞的凋亡,设计了6个共转组:NC+Control,NC+FRK,Control+EGFR(WT),Control+EGFR(Y1173F),FRK+ EGFR(WT)和RK+ EGFR(Y1173F)。WB检测显示,共转成功(图4A);采用流式细胞术检测细胞凋亡(图4B),与对照组相比,过表达FRK促进了细胞凋亡,EGFR抑制了细胞凋亡,且转染EGFR(Y1173F)质粒组的作用比转染EGFR(WT)的效果更明显;此外,转染EGFR(Y1173F)质粒逆转了过表达FRK对胶质瘤细胞促凋亡的作用(图4C,P<0.05)。表明通过对EGFR Tyr1173位点突变,可以逆转FRK促进细胞凋亡的作用,FRK可以通过磷酸化EGFR Tyr1173残基,促进胶质瘤细胞凋亡。
3 讨 论
脑胶质瘤是中枢神经系统最常见、病死率最高的原发性脑肿瘤,是威胁人类生命最主要的疾病之一,约占全部原发性神经系统肿瘤的50%~60%[1],虽然经过近几十年的手术、放疗、化疗等综合治疗研究发展,其总体生存率仍不高。因此,探明胶质瘤细胞的分子机制及针对靶基因的基因治疗,成为一种新的治疗方法。
Src是最早发现的原癌基因,后来发现的一些基因在结构、功能上与其有着共同的特点,被统称为Src激酶家族[6]。众多研究表明,Src家族在众多信号传导通路中起着关键作用,影响着细胞的增殖、分化、迁移和存活,与肿瘤的发生发展、转移及预后密切相关[7]。其家族成员之一FRK是一个分子量为54 kD的蛋白酪氨酸激酶,属于Src非受体酪氨酸蛋白激酶家族,与Src激酶家族的大部分成员不同的是,越来越多的证据表明FRK在人类肿瘤组织中是一个抑癌基因[2-4,8-11]。在宫颈癌HeLa细胞系、乳腺癌MCF-7和BT474细胞系中,过表达FRK均可促进细胞凋亡[11]。本实验研究发现过表达FRK可以促进脑胶质瘤细胞的凋亡,与我们以往的报道相符[3]。
EGFR的分子量约为170 kD,由胞外配体结合域、跨膜疏水结构域和胞内酪氨酸结构域组成[12]。EGFR基因是肿瘤中主要的突变基因之一,EGFR激活后,触发Ras/Raf、 MAPK、 PKC、 PI3K/PKB、JAK/STAT等很多信号通路,最终调节肿瘤的生长、增殖、分化、迁移等相关基因的表达[13-14]。 EGFR介导的PI3K/PDK1/Akt 信号通路在肿瘤细胞的增殖和凋亡方面扮演重要角色。磷酸化的EGFR-Y920 可以与PI3K结合,将PIP2转变为PIP3,同时使Akt磷酸化,抑制Bad和 caspase-9引起的凋亡信号通路[5]。EGFR是影响多形性胶质母细胞瘤病理和预后主要致癌基因之一[15]。EGFR基因的扩增、过表达和突变已经被证明与癌症有广泛的联系,并且在影响肿瘤发生多个方面扮演重要角色。本研究发现,转染EGFR(WT)和EGFR(Y1173F)质粒组细胞凋亡数减少,分别减少了25%和75%(图3C);且转染EGFR(Y1173F)质粒组与转染EGFR(WT)质粒组相比,细胞凋亡数明显减少,差异有统计学意义(P<0.05)。这可能与EGFR-Y1173F突变体对肿瘤的致癌性有关。
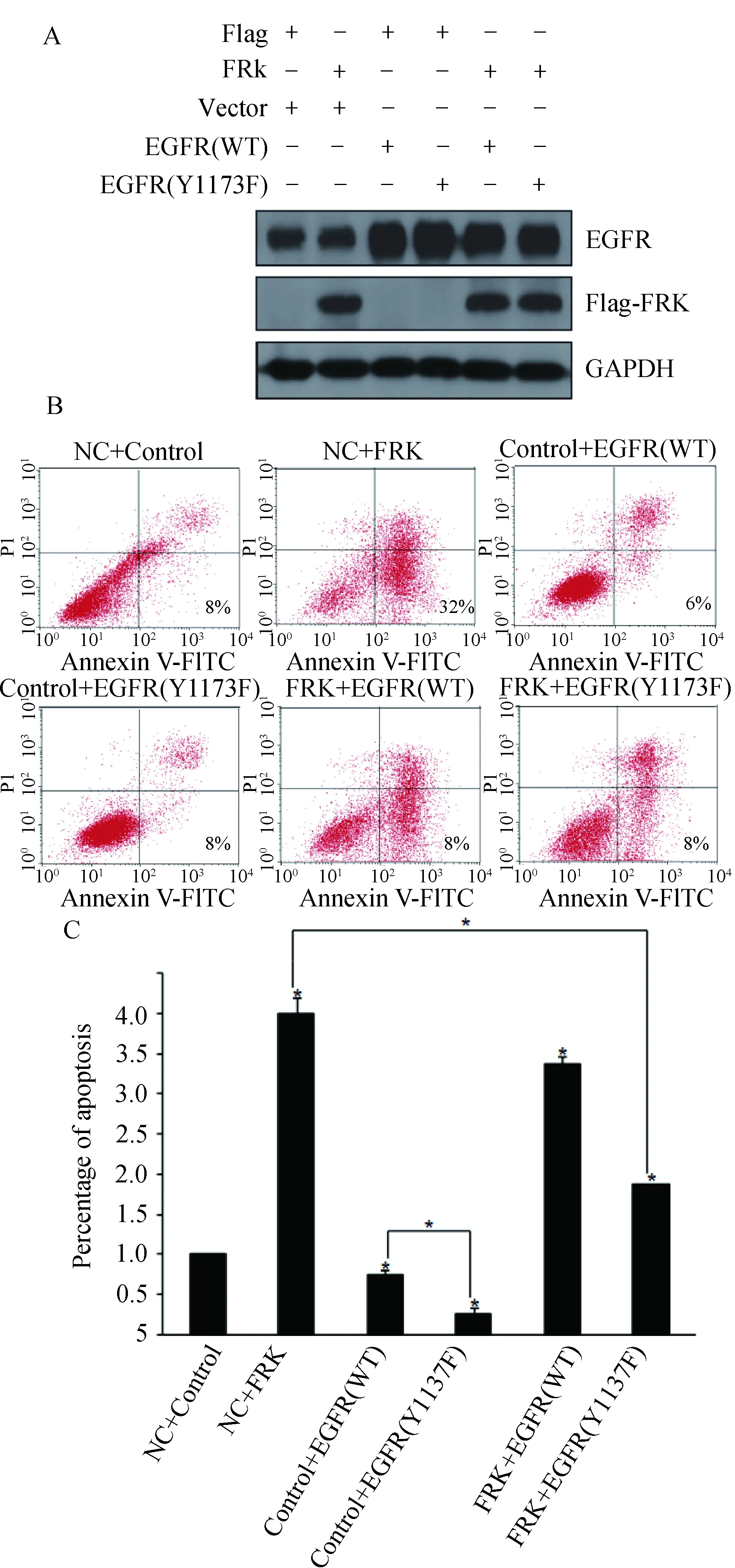
A:共转质粒验证图;B、C:流式细胞术检测6组细胞凋亡及统计图(*P<0.05)图4 共转FRK和EGFR(WT)、EGFR(Y1173F)质粒对细胞凋亡的影响
2013年Jin和Craven首次报道了在肺癌细胞中FRK对EGFR的作用。FRK与EGFR直接结合,磷酸化Tyr1173残基,而不改变EGFR整体水平[4]。而磷酸化的Tyr1173与EGFR的活性有关[5]。Hsu等制作了EGFR-Y1173F突变体(1173位的酪氨酸突变为苯丙氨酸),发现含有突变体的细胞相比野生型细胞生长更快并且表现出更高的肿瘤形成能力。进一步证明了磷酸化的Tyr1173对EGFR信号通路的抑制作用[5]。本研究发现,与对照组相比,转染FRK质粒后,EGFR-pY1173蛋白水平明显上升,而EGFR蛋白水平无明显变化(图2B),表明在胶质瘤细胞中FRK可以促进Tyr1173残基磷酸化。流式细胞术结果显示,与对照组相比,过表达FRK促进了细胞凋亡,EGFR抑制了细胞凋亡,且转染EGFR(Y1173F)质粒组的作用比转染EGFR(WT)的效果更明显,此外,转染EGFR(Y1173F)质粒逆转了过表达FRK对胶质瘤细胞促凋亡的作用(图4B)。以上结果表明通过对EGFR Tyr1173位点突变,可以逆转FRK促进细胞凋亡的作用,提示FRK可以通过磷酸化EGFR Tyr1173残基,促进胶质瘤细胞凋亡。
综上所述,本研究结果显示FRK通过磷酸化EGFR的Tyr1173残基促进胶质瘤细胞凋亡。这一结果提示EGFR的Tyr1173残基可能作为脑胶质瘤治疗的重要靶点,但其具体机制还需要进一步研究。
[1] Kleihues P,Louis DN,Scheithauer BW,etal.The WHO classification of tumors of the nervous system[J].Neuropathol Exp Neurol,2002,61:215.
[2] Yim EK,Peng G,Dai H,etal.Rak functions as a tumor suppressor by regulating PTEN protein stability and function[J].Cancer Cell,2009,15:304.
[3] Hua L,Zhu M,Song X,etal.FRK suppresses the proliferation of human glioma cells by inhibiting cyclin D1 nuclear accumulation[J].Neurooncol,2014,119:49.
[4] Jin L,Craven RJ.The Rak/Frk tyrosine kinase associates with and internalizes the epidermal growth factor receptor[J].Oncogene,2013,33:326.
[5] Hsu JM,Chen CT,Chou CK,etal.Crosstalk between Arg 1175 methylation and Tyr 1173 phosphorylation negatively modulates EGFR-mediated ERK activation[J].Nat Cell Biol,2011,13:174.
[6] Margaret CF.Src in cancer:deregulation and consequences for cell behaviour[J].Biochim Biophys Acta,2007,1602:114.
[7] Parsons SJ,Parsons JT.Src family kinases,key regulators of signal transduction[J].Oncogene,2004,23:7906.
[8] Shi Q,Song X,Wang J,etal.FRK inhibits migration and invasion of human glioma cells by promoting N-cadherin/β-catenin complex formation[J].Mol Neurosci,2015,55:32.
[9] Aneren C,Lindholm CK,Kriz V,etal.The FRK/RAK SHB signaling cascade:a versatile signal-transduction pathway that regulates cell survival,differentiation and proliferation[J].Curr Mol Med,2003,3:313.
[10] Eun KY,Stefan S,Shiaw YL.Exploring FRK tyrosine kinase function in breast cancer[J].Cell Cycle,2009,8:2360.
[11] Yim EK,Siwko S,Lin SY.Exploring Rak tyrosine kinase function in breast cancer[J].Cell Cycle,2009,15,2360.
[12] Sobani ZA,Sawant A,Jafri M,etal.Oncogenic fingerprint of epidermal growth factor receptor pathway and emerging epidermal growth factor receptor blockade resistance in colorectal cancer[J].World J Clin Oncol,2016,5:340.
[13] Lopez-Chavez A,Carter CA,Giaccone G,etal.The role of KRAS mutations in resistance to EGFR inhibition in the treatment of cancer[J].Curr Opin Investig Drugs,2009,12,1305.
[14] Khanna P,Chua PJ,Bay BH,etal.The JAK/STAT signaling cascade in gastric carcinoma (Review)[J].Int J Oncol,2015,47:1617.
[15] Senders JT,Muskens IS,Schnoor R,etal.Agents for fluorescence-guided glioma surgery:a systematic review of preclinical and clinical results[J].Acta Neurochir (Wien),2016,Nov 22.[Epub ahead of print]
(收稿2015-10-23 修回2016-02-01)
FRK promotes the apoptosis of glioma cells by regulating phosphorylation of EGFR-Y1173
ZHANGDao-Wei,SHIQiong,JINGe,etal.
TheGraduateSchool,XuzhouMedicalCollege,Xuzhou221002,China
Correspondingauthor:GUOKe-qin
Objective To study whether FRK can promote the apoptosis of glioma cells by regulating phosphorylation of EGFR-Y1173.Methods The FRK plasmid was transfected into glioma U251 cells,transfection efficiency,the protein level and Y1173 phosphorylation of EGFR was exmined by western blot.The flow cytometry was used to examine the apoptosis of glioma cells.The EGFR(WT) and EGFR(Y1173F) plasmids were transfected to glioma U251 cells respectively,also the FRK,EGFR(WT) and EGFR(Y1173F) were co-transfected to glioma U251 cells,the apoptosis of glioma cells was tested by flow cytometry.Results The FRK plasmid was transfected into glioma U251 cells successfully,FRK over-expression promoted the apoptosis of glioma U251 cells.And FRK over-expression increased the EGFR-Y1173 phosphorylation,but had no effect on the protein level of EGFR.Also,the ability of glioma cells apoptosis was all decreased in EGFR(WT) and EGFR(Y1173F) over-expression group,and decreased by 25% and 75%,respectively.WB results showed,the FRK,EGFR(WT) and EGFR(Y1173F) plasmid were co-transfected into glioma U251 cells successfully.The flow cytometry results showed,the ability of glioma cells apoptosis was increased after FRK over-expression,but decreased in EGFR overexpression group,and the effect of EGFR(Y1173F) on glioma cells apoptosis showed stronger than EGFR(WT)’s. In addition,the promoting effect of FRK on glioma cells apoptosis was abolished after EGFR(Y1173F) plasmid transfection.Conclusion FRK can regulate the glioma cells apoptosis by promoting phosphorylation of EGFR-Y1173.
glioma;FRK;EGFR;apoptosis
10.3969/j.issn.1672-7770.2017.01.006
国家自然科学基金(81372699,81472345,81402046);江苏省普通高校研究生科研创新计划项目(CXZZ13_0990)
221000 徐州,徐州医学院研究生院(张道为,金戈,王军,蔡畅,方震);徐州医学院神经系统疾病研究所(石琼,周秀萍,于如同);徐州医学院附属医院脑科医院神经外科(石琼,郭克勤,于如同)
郭克勤
R739.41
A
1672-7770(2017)01-0021-05
