持续泵入托拉塞米与异山梨酯治疗心肾综合征的临床研究
2017-02-11唐进
唐 进
持续泵入托拉塞米与异山梨酯治疗心肾综合征的临床研究
唐 进
目的 探讨持续泵入托拉塞米与异山梨酯(异舒吉)对心肾综合征的治疗效果。方法 将61例利尿剂抵抗病人分为常规治疗组(n=35)与联合治疗组(n=26)。常规治疗组接受心衰的规范化治疗,根据基础病因的不同酌情调整治疗方案。联合治疗组在常规治疗组基础上给予0.9%氯化钠溶液100 mL+托拉塞米100 mg持续静脉泵入(10 mL/h)。同时0.1%异舒吉持续泵入(2 mg/h~10 mg/h),根据病人血流动力学参数进行调整,最长使用时间为3 d。此后改为间断用药,每天至少停用8 h后可再次泵入。7 d为1个疗程。记录两组病人的生命体征、电解质、每日尿量,观察心肾功能的改善情况;心脏彩色多普勒测定左心室舒张末期内径(LVEDD)、左心室后壁厚度(LVPW)及左室射血分数(LVEF);测定两组血清血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)、去甲肾上腺素(NE)、血清N末端脑钠肽原(NT-proBNP)水平。结果 常规治疗组总有效率为42.8%,联合治疗组总有效率为69.2%,两组比较差异有统计学意义(P<0.05)。随着治疗时间的延长,两组病人尿量逐渐增加,但联合治疗组的利尿效果更佳(P<0.01)。与常规治疗组比较,联合治疗组心率降低,LVEF提高(P<0.01),AngⅡ、ALD、NT-proBNP等神经内分泌因子水平降低(P<0.05)。结论 联合治疗可迅速改善心肾功能,减少钠水潴留,纠正电解质紊乱,其作用机制可能与其利尿、扩管及拮抗神经内分泌因子相关。
心肾综合征;托拉塞米;异山梨酯;神经内分泌因子
心肾综合征(cardiorenal syndrome,CRS)是指心力衰竭与肾功能衰竭同时存在的状态[1]。这既包含继发于心衰的肾功能不全,也包括肾功能受损后对心功能的不良影响,二者相互影响,互为因果[2]。目前研究证实:慢性肾功能不全是慢性心衰病人预后的独立预测指标,存在CRS及利尿药抵抗病人死亡、泵衰竭和猝死的比率均升高[3]。而临床上发生CRS时,通常使用呋塞米进行治疗,但往往治疗效果差,且容易出现利尿剂抵抗、电解质紊乱、交感激活等不良反应,增加死亡风险[4]。作为新一代高效髓袢利尿剂,托拉塞米因其利尿效果强,作用时间持久,对电解质影响小等优点已广泛用于充血性心力衰竭的治疗[5]。而异山梨酯(异舒吉)因其可扩张外周动静脉,也广泛用于心绞痛和充血性心力衰竭的治疗,且同样没有交感神经激活作用[6]。两者配合使用,理论上不但不增加交感神经激活,还有协同利尿作用,且对电解质影响小,适合CRS的治疗。本研究旨在研究持续泵入托拉塞米与异舒吉治疗CRS的疗效及安全性。
1 资料与方法
1.1 病例来源 选取2014年10月—2015年6月于成都大学附属医院重症医学科住院的病人61例,分为常规治疗组(35例)及联合治疗组(26例)。两组性别、年龄、病因等基线资料比较差异无统计学意义(P>0.05)。
1.2 病例选择标准
1.2.1 纳入标准 年龄>18岁;符合慢性心力衰竭的诊断标准[7],纽约心脏病学会(NYHA)心功能分级为Ⅲ级以上,原发病包括:冠心病、扩张型心肌病、高血压心脏病、肺源性心脏病等;入院时肌酐水平133 μmol/L~442 μmol/L。
1.2.2 排除标准 血流动力学不稳定;安装辅助循环装置;甲亢性心脏病、心肌炎、心肌淀粉样变性,重度主动脉瓣狭窄,重度肺动脉高压;高死亡风险因素:如恶性心律失常、心源性休克等;有消化道出血、严重脱水、休克等血容量严重不足者,入院时伴有其他外伤或进行大外科严重肝肾功能不全者;明显感染;恶性肿瘤者。
1.2.3 终止标准 出现严重药物不良反应、严重并发症需特殊处理、特殊生理反应等。
1.3 治疗方法 常规治疗组遵循2013美国慢性心力衰竭诊断治疗指南[7]接受心衰的规范化治疗:包括休息、限盐、利尿剂、洋地黄类制剂、扩血管药、血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体阻滞剂(ARB)、β受体阻滞剂、螺内酯等。根据基础病因的不同酌情调整治疗方案。联合治疗组:在常规治疗组基础上给予0.9%氯化钠溶液100 mL+托拉塞米100 mg持续静脉泵入(10 mL/h)。同时0.1%异舒吉持续泵入(2 mg/h~10 mg/h),根据病人血流动力学参数进行调整,最长使用时间为3 d。此后改为间断用药,每天至少停用8 h后可再次泵入。7 d为1个疗程。
1.4 检测指标
1.4.1 常规指标检测 包括三大常规(血、尿、大便),肝肾功能、电解质、胸片等。全自动生化分析仪检测血清肌酐(SCR)、尿素氮(BUN)、尿酸(UA)、胱抑素C(CYSC),并计算表皮生长因子受体(eGFR)。观察并记录药物不良反应。
1.4.2 心脏彩超及神经内分泌因子的检测 治疗前后所有病人均接受心脏彩色多普勒及神经内分泌因子测定。心脏彩色多普勒为Philip公司生产的LOGIQ E9,采用改良Simpson法测定左心室舒张末期内径(LVEDD)、左心室后壁厚度(LVPW),并经体表面积校正后,计算相应的左室射血分数(LVEF);放免法测定肾血管紧张素Ⅱ(AngⅡ)、醛固酮(ALD)、去甲肾上腺素(NE)。ELISA法检测血清N末端脑钠肽原(NT-proBNP)水平,试剂由罗氏公司提供。
1.5 疗效判定标准 按NYHA分级方法,根据病人临床症状变化情况评定心功能疗效。显效:心衰基本控制或心功能提高2级以上;有效:心功能提高1级尚不足2级;无效:心功能提高不足1级;恶化:心功能恶化1级或1级以上。

2 结 果
2.1 两组治疗前后心功能改善的比较 常规治疗组总有效率为42.8%,联合治疗组总有效率为69.2%,两组比较差异有统计学意义(Pearsonχ2=4.1787,P<0.05)。两组显效率比较差异性无统计学意义(Pearsonχ2=3.486 6,P=0.06)。联合治疗恶化率低于常规治疗组,差异有统计学意义(Pearsonχ2=4.115 5,P<0.05)。详见表1。
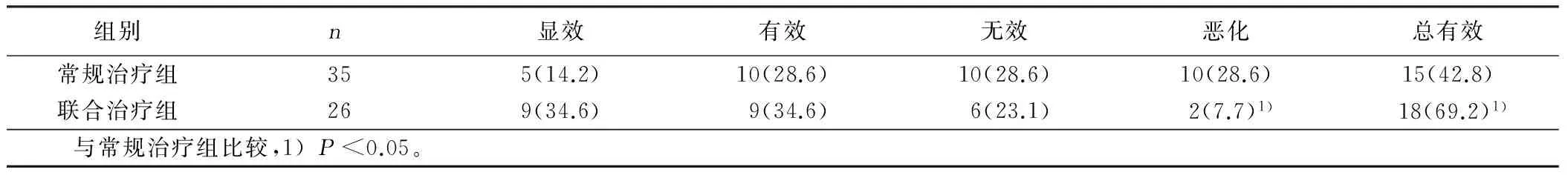
表1 两组治疗后心功能改善的比较 例(%)
2.2 两组病人利尿效果比较 随着治疗时间的延长,两组病人尿量逐渐增加。但联合治疗组的利尿效果更佳(P<0.01)。从治疗当天开始,联合治疗组病人尿量增多,但与常规治疗组比较差异无统计学意义(P>0.05)。至第2天结束后,联合治疗组尿量明显增多(P<0.05),随着时间的推延,利尿效果继续增加,在第6天~第7天时逐渐达到稳定状态,仍保持较好的利尿效果(P<0.01)。相反,常规治疗组收益有限。详见图1。
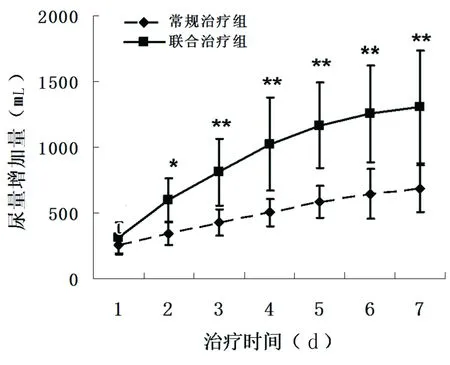
注:与常规疗组相比,※P<0.05,※※P<0.01。
2.3 两组治疗前后超声相关指标的比较 治疗后两组心率、LVEF均较前明显改善(P<0.05或P<0.01),且联合治疗组与常规治疗组治疗后比较差异有统计学意义(P<0.05或P<0.01)。而两组治疗前后LVEDD及LVPW比较差异无统计学意义(P>0.05)。详见表2。
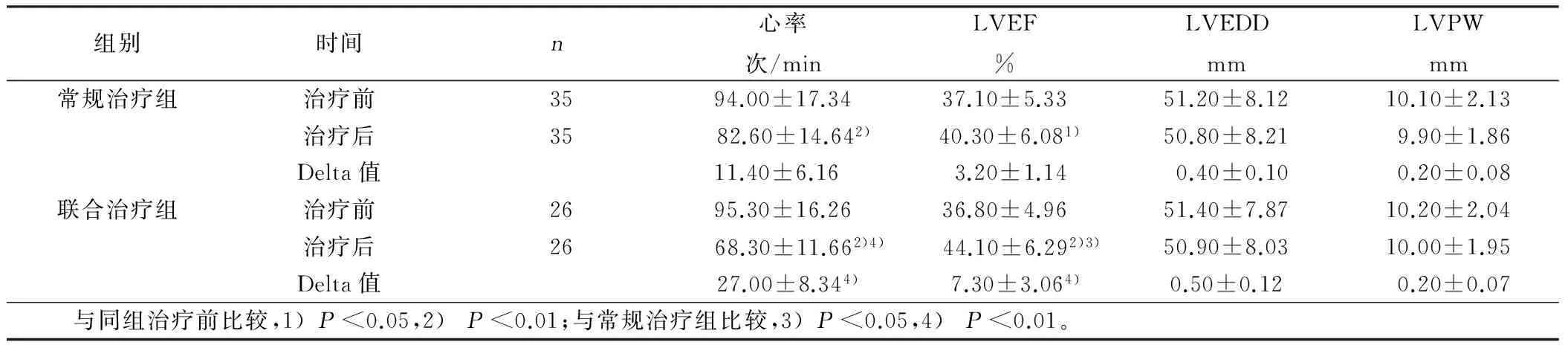
组别时间n心率次/minLVEF%LVEDDmmLVPWmm常规治疗组治疗前3594.00±17.3437.10±5.3351.20±8.1210.10±2.13治疗后3582.60±14.642)40.30±6.081)50.80±8.219.90±1.86Delta值11.40±6.16 3.20±1.140.40±0.100.20±0.08联合治疗组治疗前2695.30±16.2636.80±4.9651.40±7.8710.20±2.04治疗后26 68.30±11.662)4) 44.10±6.292)3)50.90±8.0310.00±1.95Delta值27.00±8.344)7.30±3.064)0.50±0.120.20±0.07 与同组治疗前比较,1)P<0.05,2)P<0.01;与常规治疗组比较,3)P<0.05,4)P<0.01。
2.4 两组治疗前后肾功能及电解质的比较 治疗后两组BUN、SCR、CYSC显著下降(P<0.01),eGFR显著升高(P<0.01),但联合治疗组更为明显(P<0.05);两组治疗后UA及血清钾浓度显著降低,血清钠浓度升高,差异有统计学意义(P<0.01),但治疗后两组UA及血清钾浓度比较差异无统计学意义(P>0.05)。详见表3。
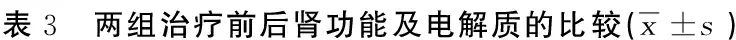
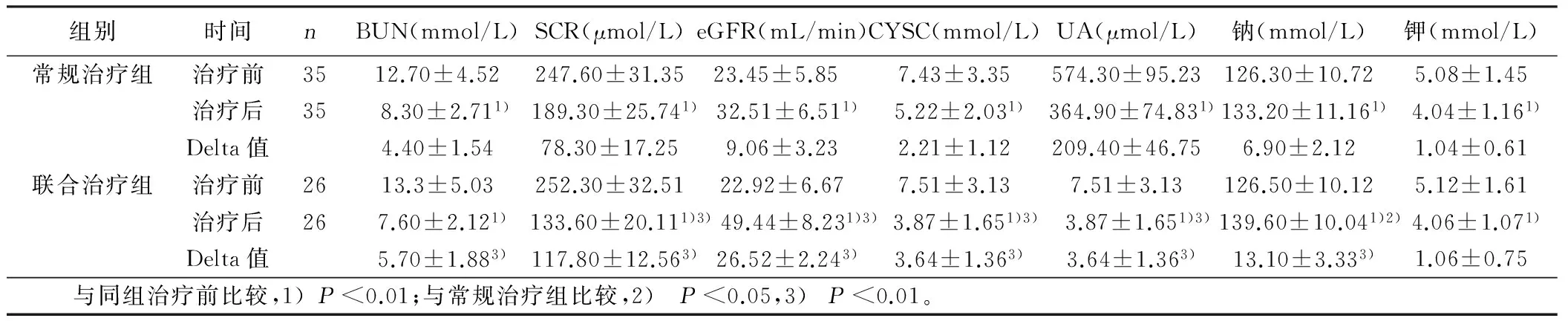
组别时间nBUN(mmol/L)SCR(μmol/L)eGFR(mL/min)CYSC(mmol/L)UA(μmol/L)钠(mmol/L)钾(mmol/L)常规治疗组治疗前3512.70±4.52247.60±31.3523.45±5.85 7.43±3.35574.30±95.23126.30±10.725.08±1.45治疗后358.30±2.711)189.30±25.741)32.51±6.511)5.22±2.031)364.90±74.831)133.20±11.161)4.04±1.161)Delta值4.40±1.5478.30±17.259.06±3.232.21±1.12209.40±46.756.90±2.121.04±0.61联合治疗组治疗前2613.3±5.03252.30±32.5122.92±6.677.51±3.137.51±3.13126.50±10.125.12±1.61治疗后267.60±2.121) 133.60±20.111)3) 49.44±8.231)3) 3.87±1.651)3) 3.87±1.651)3) 139.60±10.041)2)4.06±1.071)Delta值5.70±1.883)117.80±12.563)26.52±2.243)3.64±1.363)3.64±1.363)13.10±3.333)1.06±0.75 与同组治疗前比较,1)P<0.01;与常规治疗组比较,2)P<0.05,3)P<0.01。
2.5 两组治疗前后神经内分泌因子的变化 治疗后两组病人血清神经内分泌因子均有不同程度的下降,其中AngⅡ、ALD及NT-proBNP与治疗前比较差异有统计学意义(P<0.05),而血清NE水平与治疗前比较差异无统计学意义(P>0.05)。与常规治疗组比较,联合治疗组治疗后血清AngⅡ、ALD及NT-proBNP水平降低(P<0.05)。这说明联合治疗对神经内分泌因子有一定的拮抗作用,能够降低血管紧张素Ⅱ-醛固酮轴分泌。详见表4。

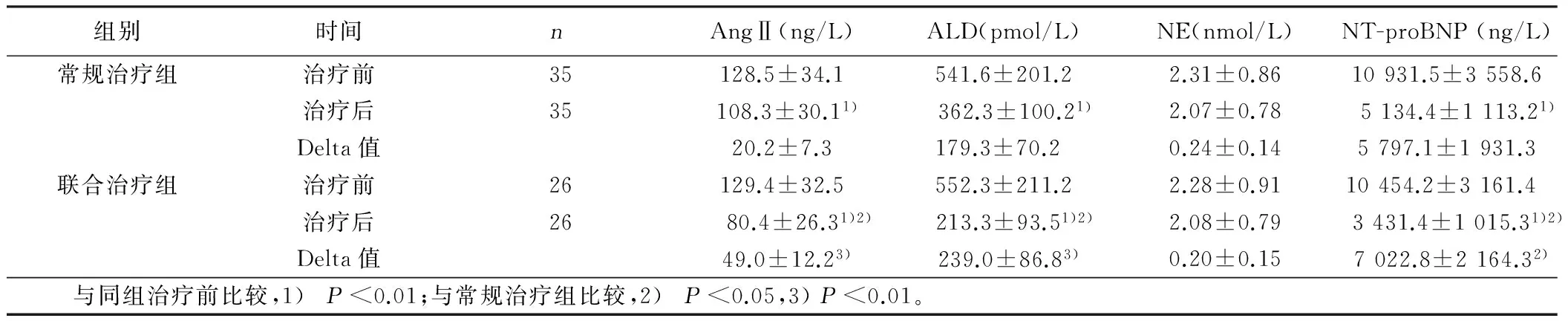
组别时间nAngⅡ(ng/L)ALD(pmol/L)NE(nmol/L)NT-proBNP(ng/L)常规治疗组治疗前35128.5±34.1541.6±201.22.31±0.8610931.5±3558.6治疗后35108.3±30.11)362.3±100.21)2.07±0.785134.4±1113.21)Delta值20.2±7.3179.3±70.2 0.24±0.145797.1±1931.3联合治疗组治疗前26129.4±32.5552.3±211.22.28±0.9110454.2±3161.4 治疗后26 80.4±26.31)2) 213.3±93.51)2)2.08±0.79 3431.4±1015.31)2)Delta值49.0±12.23)239.0±86.83)0.20±0.157022.8±2164.32) 与同组治疗前比较,1)P<0.01;与常规治疗组比较,2)P<0.05,3)P<0.01。
3 讨 论
心肾综合征是心脏或肾脏急性或慢性功能障碍而导致另一器官急性或慢性功能受损的临床综合征。这一概念强调了心功能不全与肾功能不全之间复杂、双向的病理生理本质[8]。尽管临床上对其机制及分类进行了较系统研究,但不管是CRS的哪个类型,治疗的难点在于同时兼顾心脏和肾脏。控制心力衰竭时需充分利尿,而体液减少低灌注易引起肾功能恶化,如何维持二者之间的平衡是治疗的关键[9]。为此,本研究采用持续泵入托拉塞米与异舒吉来改善心肾功能。
托拉塞米是新一代高效髓袢利尿剂,作用于髓袢升支粗段,干扰管腔细胞膜的Na+、K+、Cl-同向转运体系,抑制Cl-和Na+的重吸收,有利尿、排Na+和排Cl-作用。相比传统利尿剂呋塞米,其具有以下优点:不显著改变肾小球滤过率、肾血浆流量和酸碱平衡;对电解质影响小;肝肾双通道代谢,安全性好;有一定的醛固酮拮抗作用,交感兴奋作用低等[10]。而异舒吉能松弛血管平滑肌,降低前后负荷,减少心肌耗氧,增加肾灌注。相比传统的硝酸甘油,异舒吉的耐药性更少,且易于调整剂量。因此两组的联合应用有理论基础。
本研究中,短期持续泵入托拉塞米与异舒吉显著改善了临床症状,提高了心肾功能,增加了每日尿量,且显示出一定的神经拮抗作用。这说明联合治疗较常规治疗能阻止心肾综合征的恶性循环,这首先归因于联合治疗对心衰有快速减轻钠水潴留的作用。尿量的增加有利于体内肌酐、尿素氮等产物的排出,进而病人肾功能得到较好改善。由于心脏的前负荷明显减少,联合治疗组心率明显下降且射血分数提高,但对LVEDD及LVPW影响不明显,说明其短期使用对心脏结构形态的影响不大。更重要的是慢性重度心衰病人往往伴发低钠、低氯血症,这是心衰死亡率增加的危险因素。联合治疗很好地解决了这一问题,由于托拉塞米独特的对电解质影响小的特点,其更适合稀释性低钠血症病人的治疗。本研究也再次印证了这一结果,说明托拉塞米与异舒吉的持续泵入既增加肾灌注保护了肾功能又减少了电解质紊乱,是治疗心肾综合征的有效药物。
心衰的发生发展伴有神经内分泌因子的激活,抑制其激活有助于心衰的长期防治。因此本研究评价托拉塞米与异舒吉联合治疗对RAAS系统及NT-proBNP的影响,结果显示,治疗后两组血清AngⅡ、ALD及NT-proBNP明显下降,其中联合治疗组尤为明显。结合托拉塞米药理特点,考虑与其本身有一定的醛固酮拮抗效应有关[11]。因此,认为相比传统利尿剂,异舒吉及托拉塞米的联合使用有更强的抗心衰效果,不仅是因为异舒吉的扩管作用及托拉塞米的利尿效果,更可能是因为托拉塞米的神经内分泌激素的拮抗作用[12]。两者的联合适用于心肾综合征的治疗,且对儿茶酚胺分泌调控轴的影响不大。
综上所述,在常规治疗的基础上持续泵入托拉塞米与异舒吉能够迅速减轻钠水潴留,改善心衰症状及肾功能,纠正低钠血症。这些抗心衰作用可能与异舒吉的扩张血管作用及托拉塞米的利尿及神经体液因子拮抗作用密切相关。
[1] Verbrugge FH,Grieten L,Mullens W.Management of the cardiorenal syndrome in decompensated heart failure[J].Cardiorenal Med,2014,4(3-4):176-188.
[2] Onuigbo MA.RAAS inhibition and cardiorenal syndrome[J].Curr Hypertens Rev,2014,10(2):107-111.
[3] Tsuruya K,Eriguchi M.Cardiorenal syndrome in chronic kidney disease[J].Curr Opin Nephrol Hypertens,2015,24(2):154-162.
[4] De Vecchis R,Ciccarelli A,Pucciarelli A.Unloading therapy by intravenous diuretic in chronic heart failure: a double-edged weapon?[J].J Cardiovasc Med (Hagerstown),2010,11(8):571-574.
[5] Roush GC,Kaur R,Ernst ME.Diuretics:a review and update[J].J Cardiovasc Pharmacol Ther,2014,19(1):5-13.
[6] Ferdinand KC,Elkayam U,Mancini D,et al.Use of isosorbide dinitrate and hydralazine in African-Americans with heart failure 9 years after the African-American Heart Failure Trial[J].Am J Cardiol,2014,114(1):151-159.
[7] Writing Committee Members,Yancy CW,Jessup M,et al.2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines[J].Circulation,2013,128(16):e240-327.
[8] Poelzl G,Auer J.Cardiohepatic syndrome[J].Curr Heart Fail Rep,2015,12(1):68-78.
[9] Fu Q,Cao L,Li H,et al.Cardiorenal syndrome:pathophysiological mechanism,preclinical models,novel contributors and potential therapies[J].Chin Med J(Engl),2014,127(16):3011-3018.
[10] Ishido H,Senzaki H.Torasemide for the treatment of heart failure[J].Cardiovasc Hematol Disord Drug Targets,2008,8(2):127-132.
[11] Adam O,Zimmer C,Hanke N,et al.Inhibition of aldosterone synthase (CYP11B2) by torasemide prevents atrial fibrosis and atrial fibrillation in mice[J].J Mol Cell Cardiol,2015,85:140-150.
[12] Valente MA,Voors AA,Damman K.Diuretic response in acute heart failure: clinical characteristics and prognostic significance[J].Eur Heart J,2014,35(19):1284-1293.
(本文编辑郭怀印)
Clinical Study on Continuous Pumping of Torasemide and Isosorbide in the Treatment of Cardiorenal Syndrome
Tang Jin
The Affiliated Hospital/Clinical Medical College,Chengdu University,Chengdu 610081,Sichuan,China
Objective To explore the effect of continuous pumping of torasemide and isoket (CPTAI) on cardiorenal syndrome (CRS).Methods Sixty-one patients with CRS were enrolled in this study.They were individed into the conventional treatment group(n=35)and the combined treatment group(n=26) according to whether using CPTAI or not.The vital signs,serum electrolyte,daily urine output and cardiorenal function were recorded.The left ventricular end-diastolic diameter (LVEDD),left ventricular posterior wall thickness (LVPW) and left ventricular ejection fraction (LVEF) were measured by color doppler echocardiography.The levels of serum angiotensin Ⅱ (Ang Ⅱ),aldosterone (ALD),norepinephrine (NE) and N-terminal pro brain natriuretic peptide (NT-proBNP) were measured.The readmission rate was followed up for one month.Results The total clinical effective rate was 69.2% in the combined treatment group,which was significantly higher than that in the conventional treatment group(42.8%,Pearson χ2=4.178 7,P<0.05).After treatment,the urine output was increased significantly in two groups.The diuretic effect was better in the combined treatment group.Compared with the conventional treatment group,the heart rate and the levels of serum AngⅡ,ALD,NT-proBNP were decreased while LVEF was increased in the combined treatment group(P<0.01).Conclusion CPTAI can quickly improve cardiorenal function,attenuate water and sodium retention and electrolyte disorder,which may be related to the diuresis,vasodilation effect and neuroendocrine factors inhibition.
cardiorenal syndrome;torasemide;isosorbide;neuroendocrine factor
成都大学附属医院(成都 610081),E-mail: 364750669@qq.com
引用信息:唐进.持续泵入托拉塞米与异山梨酯治疗心肾综合征的临床研究[J].中西医结合心脑血管病杂志,2017,15(1):82-85.
R541 R256.2
B
10.3969/j.issn.1672-1349.2017.01.024
1672-1349(2017)01-0082-04
2016-04-18)
