促红细胞生成素对神经胶质细胞增殖、凋亡、迁移能力的影响
2017-02-11呼格吉乐石芸萍薛东力兰海霞
呼格吉乐,石芸萍,薛东力,兰海霞
促红细胞生成素对神经胶质细胞增殖、凋亡、迁移能力的影响
呼格吉乐1,石芸萍2,薛东力2,兰海霞3
目的 探讨促红细胞生成素(EPO)对神经胶质细胞增殖、凋亡、迁移能力的影响,为EPO神经保护作用机制的研究提供依据。方法 体外培养用不同浓度EPO混合培养基培养U251细胞,用噻唑蓝(MTT)法筛选EPO的最佳浓度,以EPO最佳浓度的细胞为实验组,未加EPO细胞为阴性对照组,通过细胞克隆实验检测细胞增殖水平变化、通过划痕实验检测细胞迁移能力变化、通过transwell实验检测细胞侵袭能力变化、通过细胞流式术观察EPO对神经胶质细胞凋亡能力的变化。结果 通过MTT实验检测EPO最佳浓度为300 IU/L;克隆实验检测发现细胞增殖水平增加;划痕实验检测发现细胞迁移能力增加;Transwell实验检测发现细胞侵袭能力增加;细胞流式术发现细胞的凋亡能力降低。结论 本实验得出EPO可促进U251细胞的增殖、迁移、侵袭,并抑制其凋亡,因此证实EPO对神经细胞具有保护作用,在临床上为新生儿脑损伤的早期干预治疗提供一条新途径和理论根据。
促红细胞生成素;神经保护;增殖;凋亡;迁移
促红细胞生成素(EPO)是一种含唾液酸的特异性糖蛋白激素,胎儿肝脏和成人肾脏是合成、分泌EPO的主要器官,EPO主要通过与红细胞膜上特异性促红细胞生成素受体(erythropoietin receptor,EPOR)结合促进血液循环中红细胞增殖、分化、成熟及释放,恢复红系祖细胞造血能力,可促进红细胞生成、骨髓红系祖细胞生长及血管生成,抑制红系祖细胞凋亡,参与胎盘血管发生等过程[1]。近几十年来,国内外学者研究发现EPO除促进造血外还具有神经保护和修复作用,并可改善远期神经预后[2]。有研究证实[3-4]:EPO对各种脑损伤有治疗作用,特别是新生儿脑损伤,EPO的早期应用能减轻脑损伤甚至避免脑损伤。近年来,EPO认为是防治新生儿脑损伤最有前途的药物之一[5]。然而EPO治疗和防治新生儿脑损伤的作用机制目前还不明确,有待进一步研究。本研究观察EPO对神经胶质U251细胞增殖、侵袭、迁移、凋亡的影响,为研究EPO神经保护作用机制奠定实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞 神经胶质U251细胞株,购自中科院上海细胞库。
1.1.2 实验药品 EPO。
1.1.3 主要实验试剂及仪器 MEM培养基、胎牛血清、0.25%胰酶、双抗、磷酸缓冲盐溶液(PBS)、二甲基亚砜(DMSO)、噻唑蓝(MTT)试剂、试剂、Annexin V-FITC/PI双染试剂盒、transwell小室、电热恒温培养箱、离心机、生物安全柜、水浴锅、倒置显微镜、酶联免疫检测仪、流式细胞仪等。
1.2 实验方法
1.2.1 细胞培养 将U251细胞置于MEM完全培养基中,在5%CO2、37 ℃条件下培养,3 d~4 d更换1次培养液;使用0.25%胰蛋白酶常规消化、传代,并取对数生长期的细胞进行实验。
1.2.2 实验分组 采用MTT实验筛选EPO最佳浓度,以EPO最佳浓度的细胞为实验组,未加EPO细胞为阴性对照组。
1.2.3 MTT实验 收集对数生长期细胞,消化并计数,按2×103个/孔接种到96孔培养板,培养24 h后弃原培养液,分别加入0 IU/mL、150 IU/mL、300 IU/mL、450 IU/mL EPO继续培养,分别于24 h、48 h、72 h加入MTT(浓度为5 g/L)溶液20 μL,继续培养4 h后弃上清液,加150 μL DMSO,在摇床上低速振荡10 min后利用酶标仪在490 nm处测定吸光度值。筛选EPO最佳浓度。
1.2.4 细胞克隆实验 取对数生长期细胞用胰酶消化并垂打成单个细胞,按100个/孔接种于细胞培养皿中,实验组加含EPO培养液,对照组加不含EPO的培养液,在5%CO2、37 ℃条件下培养,3 d后显微镜下计数。
1.2.5 划痕实验 将对数生长期细胞按1.0×106/mL密度接种于6孔板,待细胞覆盖板底80%以上时,用20 μL加样枪头在每孔中划一直线,使用无菌PBS(pH 7.4)漂洗3次去除悬浮细胞,实验组加入含EPO培养液,对照组加不含EPO的培养液,分别取0 h、24 h观察细胞在同一划痕处迁移情况并照相。
1.2.6 侵袭实验(transwell) 取实验组及对照组的细胞用胰酶消化并计数,以每孔5 000个细胞接种于transwell小室中,室上加100 μL MEM基础培养基,室下加600 μL含20%FBS的MEM培养基,继续培养8 h~12 h;弃原培养液,用沾PBS棉签擦去膜上未侵袭细胞,4%多聚甲醛固定10 min;常规HE染色10 min;蒸馏水冲洗浮色后晾干,显微镜下观察计数。
1.2.7 流式细胞仪检测细胞凋亡 将对数生长期细胞消化制成细胞悬液,按1.0×106/mL密度接种于6孔板中继续培养。培养24 h后胰酶消化制成细胞悬液,调整细胞密度为5×105/mL,每组各取2 mL细胞悬液离心后加4 ℃预冷的PBS(pH7.4)漂洗3次,离心1 000 r/min,5 min,将细胞重悬于100 μL结合缓冲液,依次加入5 μL膜联蛋白V-异硫氰酸荧光素(PI)和5 μL碘化丙啶(FITC),轻轻震荡混匀,室温下避光放置15 min后加入400 μL结合缓冲液,立即上机检测,以CellQuest分析软件计算细胞凋亡率。
2 结 果
2.1 MTT实验 从24 h开始,在同一时间各浓度间比较,150IU/mL组与0IU/mL组间差异无统计学意义(P>0.05);300 IU/mL组与0 IU/mL组间差异有统计学意义(P<0.05);450 IU/mL组与0 IU/mL组间差异无统计学意义(P>0.05)。上述实验结果说明,MTT实验筛选出EPO最佳浓度为300 IU/mL。详见表1、图1。

组别24h48h72h0IU/mL组 0.221±0.0470.346±0.0610.491±0.062150IU/mL组0.223±0.0310.372±0.0370.506±0.015300IU/mL组0.324±0.0151)0.463±0.0501)0.638±0.0661)450IU/mL组0.254±0.0340.376±0.0500.501±0.084 与0IU/mL组比较,1)P<0.05。

图1 各组U251细胞OD值比较
2.2 细胞克隆形成数比较 克隆实验通过计数细胞克隆形成数来测定单个细胞的增殖能力。细胞克隆实验结果显示,300 IU/mL组显著高于0 IU/mL组,差异有统计学意义(P<0.05)。由此可得出:EPO可促进U251细胞增殖。详见表2。
表2 细胞克隆形成数比较(±s) 个
2.3 细胞划痕实验比较 通过细胞划痕修复实验观察EPO300 IU/mL组与0 IU/mL组细胞迁移能力的影响,实验结果如图所示:24 h U251细胞的迁移距离,300 IU/mL组明显大于0 IU/mL组,差异有统计学意义(P<0.05)。因此得出结论,EPO可以增加U251细胞的迁移能力。详见图2和表3。
300 IU/mL 0 IU/mL

图2 U251细胞划痕实验图片

cm
2.4 transwell比较 transwell侵袭实验结果显示,300 IU/mL组穿过transwell小室的细胞数明显多于0 IU/mL组,差异有统计学意义(P<0.05)。transwell侵袭实验结果说明,EPO可增加U251细胞的侵袭能力。详见图3、表4。
300 IU/mL 0 IU/mL

图3 U251细胞侵袭力的变化(×200)
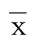
(±s) 个
2.5 细胞凋亡率比较 通过使用Annexin VFITC/PI双标法检测细胞凋亡情况,流式细胞分析仪结果显示,EPO作用于U251细胞24 h后均出现凋亡,300 IU/mL组细胞凋亡率明显低于0 IU/mL组,差异有统计学意义(P<0.05)。详见图4、表5。
0 IU/mL

300 IU/mL

图4 U251细胞流式图
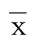
表5 细胞凋亡率比较(±s) %
3 讨 论
新生儿中枢神经系统、神经生物学和解剖生理结构发育不成熟,其代偿能力较差,且易受缺血、缺氧和感染因素影响而造成损伤。随着新生儿医学及新生儿重症监护技术不断提高,早产儿成活率增加,随之早产儿脑损伤及其后遗症也日益突出,脑损伤发生率与出生体重及出生胎龄具相关性,体重越低、胎龄越小越容易发生脑损伤[6]。脑室周围-脑室内出血(PIVH)及脑室周围白质软化(PLV)是早产儿脑损伤的主要类型[7],也是导致新生儿神经行为发育障碍及死亡的主要原因。早产儿生命健康和生存质量受脑损伤后遗症的严重影响,目前国内外对早产儿脑损伤的预防与治疗措施尚未取得满意效果,处于探索阶段。
EPO作为一种新型的神经保护剂得到国内外许多研究者认可。近年来EPO成为国内外防治新生儿脑损伤的研究热点,但关于EPO防治早产儿脑损伤研究国内外均较少,随着早产儿脑损伤模型建立,越来越多动物模型发现EPO对早产儿脑损伤具有神经保护作用,但其机制尚未明确。Wei等[8]通过早产大鼠PVL造模实验探讨EPO的神经保护作用,实验结果得出EPO可降低小胶质细胞的活化并可减少少突胶质细胞(OL)损伤,促进髓鞘形成,但正常OL成熟及髓鞘化不受影响。除此之外,还发现早产大鼠脑损伤后其运动功能经EPO治疗后明显好于未治疗组。动物实验发现EPO对PWMD的少突胶质细胞具有保护作用,且可促进损伤后髓鞘形成[9]。刘后存等[10]通过临床观察EPO治疗早产儿脑损伤得出,EPO可改善早产儿脑损伤预后,加速神经系统损伤修复。早期应用EPO不仅可改善早产儿脑损伤的预后,而且还可减少其后遗症发生。迄今为止,动物实验在EPO预防早产儿脑损伤的研究中占主要地位。文献报道EPO可引起血压升高并可导致抗EPO抗体形成和红细胞发育不良,减少细胞表面EPOR表达,EPO使用量越大其不良反应也随之越多[11-15]。故EPO用于早产儿PWMD治疗仍需临床试验证实。
本实验结果表明,外源性EPO可促进神经胶质U251细胞增殖、侵袭、迁移,抑制其凋亡,发挥神经保护作用。证实EPO对神经细胞具有保护作用,在临床上为新生儿脑损伤的早期干预治疗提供一条新的途径和理论根据。此外,患有肿瘤且贫血病人:不建议使用EPO来进行贫血的治疗。该实验不足之处在于只通过体外细胞实验探讨EPO的神经保护作用,对EPO的体内实验还需进一步探讨。
[1] 熊涛,屈艺,母得志.促红细胞生成素与新生儿脑损伤[J].中华儿科杂志,2011,49(10);756-760.
[2] Alexander ML,Hill CA,Rosenkrantz TS,et al.Evaluation of the therapeutic benefit of delayed administration of erythropoietin following early hypoxic-ischemic injury in rodents[J].Dev Neurosic,2012,6(34):515-524.
[3] Mc Pherson RJ,Juul SE.Recent trends in erythropoietin-mediated neuroprotection[J].Int J Dev Neurosci,2008,26(1);103-111.
[4] 何金水,黄仲玲,杨鸿,等.早期应用rhu-EPO对早产儿神经行为发育的影响[J].中国当代儿科杂志,2008,5(10):586-588.
[5] Kumral A,Tuzun F,Oner MG,et al.Erythropoietin in neonatal brain protection: the past,the present and the future[J].Brain Dev,2011,33(8):632-643.
[6] 王杨.促红细胞生成素治疗早产儿脑损伤疗效分析[J].安徽卫生职业技术学院学报,2012,5(11):20-21.
[7] 金越,陆继红,鲍鱼鱼,等,尿S-100B蛋白动态变化对早产儿脑损伤的诊断价值[J].临床儿科杂志,2015,33(1):44-47.
[8] Wei L,Yan S,Plane JM,et al.Neuroprotective potential of erythropoietin and its derivative carbamylated erythropoietin in periventricular leukomalacia[J].Experimental Neurology,2011,230(230):227-239.
[9] 胡燕,蒋犁,张敏,等.促红细胞生成素对脑室周围白质软化新生大鼠髓鞘磷脂蛋白和神经生长相关蛋白的影响[J].中华实用儿科临床杂志,2010,25(14):1046-1048.
[10] 刘后存,闰平.促红细胞生成素对改善早产儿脑损伤的效果研究[J].中国医药导报,2014,11(12):60-63.
[11] 张连国,徐海涛,张庆广,等.促红细胞生成素及其受体在肺癌组织中的表达[J].滨州学院学报,2013,36(3):169-171.
[12] 俞婷婷,单莉,韩志刚.非小细胞肺癌组织中促红细胞生成素及其受体mRNA的表达及意义[J].临床肿瘤学杂志,2013,18(3):203-206.
[13] 任潇毅,柯其广,牛跃平.促红细胞生成素及其受体在直肠癌中表达及临床意义[J].中华实用诊断与治疗杂志,2011,25(1):48-51.
[14] 武东辉,李劲松,李海刚,等.舌鳞癌红细胞生成素及其受体的表达和临床意义[J].中华口腔医学研究杂志(电子版),2010,4(1):56-62.
[15] 陈光华,周铁,许传亮,等.促红细胞生成素和受体在前列腺癌组织中共同过表达的研究[J].现代生物医学进展,2012,12(36):7070-7076.
(本文编辑薛妮)
Effects of Erythropoietin on the Activity of Proliferation,Apoptosis and Migration of Glioma U251 Cells
Huge Jile,Shi Yunping,Xue Dongli,Lan Haixia
The Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010051,Inner Mongolia, China
Lan Haixia (The 253 Hospital of the People’s Liberation Army, Hohhot,Inner Mongolia, China)
Objective To investigate the effects of erythropoietin (EPO) on the activity of proliferation,apoptosis and migration of glioma U251 cells. Methods The glioma U251 cells were cultured in vitro and optimal concentration of EPO was screened with MTT.Then glioma U251 cells were divided into negative control group and the experimental group (EPO optimum concentration for the experimental group). The proliferation,migration,invasion and apoptosis capability of glioma U251 cells were detected by cloning experiments,scratch test,transwell experiment and the cells flow cytometry. Results The result of MTT was that the optimal concentration of EPO was 300 IU/mL.The cloning experiment showed that the level of cell proliferation was increased.The result of the scratch test showed that cell migration was increased.Transwell experiment showed the capacity of cell invasion was increased.The cell flow cytometry showed that the ability of apoptosis was reduced.Conclusion The experimentally derived EPO could promote the proliferation, migration and invasion,and inhibit the apoptosis of glioma U251 cells. It could be seen the EPO had a protective effect on nerve cells. It provided a new way and theoretical basis for the intervention in the early of neonatal brain injury in clinical.
erythropoietin; neuroprotection; proliferation;apoptosis;migration
1.内蒙古医科大学附属医院(呼和浩特 010051);2.内蒙古医科大学;3.解放军第253医院
兰海霞,E-mail:hugejilesj@163.com
R331.3 R741
A
10.3969/j.issn.1672-1349.2017.02.013
1672-1349(2017)02-0170-04
2016-09-25)
引用信息:呼格吉乐,石芸萍,薛东力,等.非糖尿病与糖尿病主动脉夹层病人发生自主神经病变的对比研究[J].中西医结合心脑血管病杂志,2017,15(2):170-173.
