两种培养基的培养体系对CIK细胞增殖和功能的影响
2017-02-10宋文玲姚惟琦武栋成
宋文玲,韩 蓉,张 曼,张 权,姚惟琦,3,武栋成,4
(1.湖北省武汉市黄陂区人民医院暨江汉大学附属第三医院肿瘤三科 430060;2.武汉汉密顿生物科技股份有限公司研发部,武汉 430075;3.武汉大学第一临床学院肿瘤中心,武汉 430060;4.武汉大学基础医学院,武汉 430072)
两种培养基的培养体系对CIK细胞增殖和功能的影响
宋文玲1,韩 蓉1,张 曼1,张 权2,姚惟琦2,3,武栋成2,4
(1.湖北省武汉市黄陂区人民医院暨江汉大学附属第三医院肿瘤三科 430060;2.武汉汉密顿生物科技股份有限公司研发部,武汉 430075;3.武汉大学第一临床学院肿瘤中心,武汉 430060;4.武汉大学基础医学院,武汉 430072)
目的 观察细胞因子诱导的杀伤细胞(CIK细胞)增殖情况,检测CIK细胞的表面分子表型和体外对白血病细胞K562的杀伤作用。方法 通过用H3培养基培养的分别来源于脐带血和患者自体外周血分离的单个核细胞(PBMC),添加重组人γ干扰素(IFN-γ)与CD3单抗,体外诱导CIK细胞,在培养的第7天分别加入H3培养基和T551培养基继续诱导培养至14 d。计数观察CIK细胞增殖能力,流式检测细胞表面CD3、CD56的表达情况,CCK8法检测两组培养基条件下对白血病细胞K562的杀伤效果。结果 动态计数及表型分析结果表明,H3及H3+T551培养的CIK细胞扩增倍数(包括脐带血CIK总细胞数和自体CIK总细胞数)在第14天均分别达到76.9倍、62.3倍;两种培养条件下脐带血CIK细胞中 CD3+CD56+双阳性细胞含量分别是(16.70±2.72)%和(10.80±2.59)%,自体CIK细胞中 CD3+CD56+双阳性细胞含量分别是(11.23±6.64)%和(10.70±6.42)%;体外杀瘤实验表明,当效靶比为5∶1时,H3培养的脐带血CIK细胞杀伤率达到(33.50±9.99)%,显著高于H3+T551培养脐带血CIK细胞的(20.3±6.76)%,差异有统计学意义(P=0.011),而H3和H3+T551培养的自体CIK细胞杀伤率分别是(59.67±27.59)%和(42.13±19.47)%,差异无统计学意义(P=0.080)。结论 H3培养的脐带血和自体CIK细胞具有较强的体外抗白血病癌细胞活性,可应用于临床上白血病的过继性免疫治疗。
白血病,幼红细胞,急性;CIK细胞;白血病细胞K562;H3培养基;T551培养基;杀伤率
体内回输免疫活性细胞的过继免疫疗法,具有一定的抗肿瘤效果,与其他抗肿瘤药物相比,它能在没有损伤机体免疫系统结构和功能的基础上,直接杀伤肿瘤细胞,并且调节和增强机体的免疫功能,故而成为放化疗、肿瘤手术的重要辅助治疗方法,为预防肿瘤复发、改善晚期患者的生存质量提供了新的途径[1-2]。为了得到更好的抗肿瘤效果,用于过继免疫疗法的免疫活性细胞必须具有较强的细胞毒活性和增殖力,研究结果显示细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK 细胞)可以满足过继免疫治疗中对效应细胞的要求[3-4]。CIK细胞是将人外周血单个核细胞(peripheral blood mononuclear cell,PBMC),在体外用多种细胞因子如白细胞介素(IL)-2、IL-1α、γ-干扰素(IFN-γ)、CD3单克隆抗体(anti-CD3 monoclonal antibody,MabCD3)等共同培养一段时间后获得的一群异质细胞,兼有T淋巴细胞强大的抗瘤活性和自然杀伤(NK)细胞的非主要组织相容性复合体(major histocompatibility complex,MHC)限制性杀瘤优点[5-7],被认为是新一代抗肿瘤过继细胞免疫治疗的首选方案[8]。
急性白血病是一种源于造血干细胞某一单株细胞的恶性克隆性疾病,以儿童及青年居多,临床诊断一般可分为急性淋巴性白血病和急性髓性白血病。目前化疗是急性白血病的常规治疗方法,但是其较大的不良反应限制了化疗疗效的进一步提高。细胞免疫治疗有可能为急性白血病的治疗提供有益帮助[9-10]。由于CIK细胞的增殖能力和杀瘤活性是影响细胞治疗效果的重要因素,因此本研究拟通过观察不同成分培养基制备的CIK细胞的增殖能力和对白血病K562细胞株的杀伤力,为提高CIK细胞疗效提供实验依据。
1 材料与方法
1.1 材料 白血病细胞K562由武汉汉密顿生物科技股份有限公司实验室提供。将K562用含10%胎牛血清RPMI 1640培养,置于37 ℃含5%CO2细胞培养箱中。试剂:IL-2(美国PEPR0 TECH公司),IFN-γ(美国PEPR0 TECH公司),MabCD3(日本TaKaRa公司)。RPMI 1640 和胎牛血清(FBS,Gibco公司),CCK-8(5 mg/mL,碧云天),FITC-抗CD3流式抗体和PECy5-抗CD56流失抗体(美国Biolegend公司)。
1.2 方法
1.2.1 效应细胞CIK细胞的制备 使用密度离心方法常规分离脐带血和白血病患者外周血制备单核细胞悬液,调整细胞浓度为(1~2)×106/mL进行培养,于培养第1天在H3培养体系中加入IFN-γ 2 000 U/mL,培养24 h后加入IL-2 1 000 U/mL,MabCD3 100 ng/mL,刺激CIK 细胞的生长和增殖。在培养的第7天,组1加入H3(含1 000 U/mL 的重组人IL-2)培养基,组2加入T551(含1 000 U/mL 的重组人IL-2)培养基继续诱导培养至14 d,保证细胞生长密度在(1~2)×106/mL。计数培养第0、4、7、10及14天的CIK细胞的数量。
1.2.2 效应细胞的表型分析 取培养第14天的CIK细胞以流式抗体染色,流式细胞仪分析,测定CIK细胞CD3+CD56+双阳性细胞的百分比。
1.2.3 CCK8法杀伤活性鉴定CIK对K562的杀伤作用 以不同效靶比(1∶1、2∶1、5∶1)将CIK效应细胞与K562细胞各50 μL,一起放入96孔培养板中,另设单独靶细胞和单独效应细胞对照孔,以及空白培养基对照孔,每组设3孔,37 ℃、5%CO2孵箱中培养4 h,用CCK-8显色法测定,确定各组吸光度值(A值)按下列公式计算杀瘤率[11-12]:杀伤活性(%)=[1-(实验孔A值-效应细胞A值)/(靶细胞A值-空白孔A值)]×100%
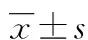
2 结 果
2.1 两种培养基体外诱导CIK细胞的增殖水平 实验结果显示,H3培养基培养的CIK细胞直至第4天后开始大量增殖,细胞数量呈非线形增长。从脐带血分离的细胞继续经H3培养基培养至第7、10、14天时,至培养第7天约增加23.3倍,其后进入快速增长期,至第14天约增加76.9倍;继续经T551培养基培养至第7天约增加23.3倍,其后进入快速增长期,至第14天约增加62.3倍。同时,从外周血分离单个核细胞继续经H3培养基培养至第7、10、14天时,培养至第7天约增加20.2倍,其后进入快速增长期,至第14天约增加76.9倍;继续经T551培养基培养至第7天约增加17.5倍,其后进入快速增长期,至第14天约增加62.3倍(图1)。两种培养基体外诱导的CIK细胞第14天的形态学照片如图2所示。
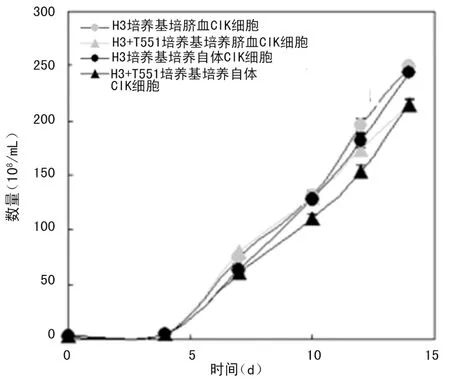
图1 两种培养基诱导不同来源CIK细胞的增殖水平
A:来源脐带血,H3培养基;B:来源脐带血,H3+T551培养基;C:来源自体,H3培养基;D:来源自体,H3+T551培养基。
图2 两种培养基诱导不同来源的CIK细胞形态(×100)
2.2 两种培养基诱导的CIK细胞表型 随着培养时间延长,H3和T551培养基培养的CIK细胞表达CD3+CD56+双阳性细胞的比例逐渐增加,细胞培养至第14天时,流式细胞术进行检测,结果如图3所示。H3培养基诱导的脐带血和自体CIK细胞中CD3+CD56+细胞百分比分别为(16.70±2.72)%和(11.23±6.64)%,T551培养基诱导的脐带血和自体CIK细胞中CD3+CD56+细胞百分比分别为(10.80±2.59)%和(10.70±6.42)%,两种培养基诱导第14天获得的自体、脐带血CIK细胞表型见表1、2。
2.3CIK细胞对K562的杀伤作用 当效靶比为1∶1时,H3培养基培养14d的脐带血和自体CIK细胞杀瘤率分别是(12.33±12.49)%和(19.43±12.65)%,T551培养基培养14d的脐带血和自体CIK细胞杀瘤率分别是(6.20±8.59)%和(16.23±8.63)%;当效靶比为2∶1时,H3培养基培养的脐带血和自体CIK细胞杀瘤率分别是(19.97±16.68)%和(33.37±15.62)%,T551培养基培养14d的脐带血和自体CIK细胞杀瘤率分别是(10.93±8.24)%和(25.38±10.99)%;当效靶比为5∶1时,H3培养基培养的脐带血和自体CIK细胞杀瘤率分别是(33.50±9.99)%和(59.67±27.59)%,差异有统计学意义(P=0.011),H3+T551培养基培养14d的脐带血和自体CIK细胞杀瘤率分别是(20.30±6.76)%和(42.13±19.47)%,差异无统计学意义(P=0.080)。CIK细胞对白血病K562细胞的杀伤作用与浓度有关。相同浓度下作用24h,H3培养基培养的CIK细胞的杀伤效率优于T551培养基培养的CIK细胞,见表3。

图3 两种培养基诱导第14天T细胞表面CD3+和CD56+的表达

脐血CIK活细胞数(109)CD3+CD56+CD3-CD56+效应细胞数(109)N121.4019.80.94.43N218.7413.70.62.68H120.0314.73.43.63H217.3910.03.52.35M120.2515.60.33.22M219.988.70.31.80
N1、H1、M1和N2、H2、M2分别表示H3和T551培养基培养诱导第14天获得的脐带血CIK细胞,实验重复3次。

表2 两种培养基诱导第14天获得的自体CIK细胞表型
5a、6a、7a和5b、6b、7b分别表示H3和T551培养基培养诱导第14天获得的自体CIK细胞,实验重复3次。

表3 CIK对K562的杀伤效率,%,n=3)
a:P<0.05,与H3+T551培养基培养。
3 讨 论
免疫细胞过继疗法已成为放化疗后肿瘤患者辅助治疗的重要手段之一。CIK细胞是由人体血液中酶单个核细胞在体外条件下经过多种细胞因子共同刺激诱导而成的[13-14],是一类非主要组织相容性复合物和非T细胞受体限制性的免疫活性细胞,其主要效应细胞为CD3+CD56+双阳性细胞[15]。
本研究显示随着培养时间的延长,H3和H3+T551培养基培养的CIK细胞的数量及CD3+CD56+双阳性细胞的比例均升高。H3培养基体外培养14 d的脐带血和自体CIK细胞其细胞数量增加76.9倍,同时表达CD3+CD56+双阳性细胞的比例也达到较高水平,分别约为(16.70±2.72)%和(11.23±6.64)%;同时,H3+T551培养基体外培养14 d的CIK细胞其细胞数量增加62.3倍,同时表达CD3+CD56+双阳性细胞的比例也达到较高水平。
本研究对比了相同效靶比及相同培养方式下同种来源两的CIK细胞对K562的杀伤效率。相同效靶比的来源于脐带血或自体CIK细胞,H3培养条件下对K562的杀伤效率高于H3+T551培养条件下对K562的杀伤效率,显示CIK细胞能有效地杀伤K562细胞。尤其,当效靶比为5∶1时,H3培养基培养的脐带血和自体CIK细胞杀瘤率分别是(33.50±9.99)%和(59.67±27.59)%,T551培养基培养14 d的脐带血和自体CIK细胞杀瘤率分别是(20.30±6.76)%和(42.13±19.47)%,但个体差异较大。来源脐带血CIK细胞对K562具有较稳定的杀伤作用,但来源自体的CIK细胞对K562具有较高的杀瘤率。结合图2流式细胞分析可推测,H3和T551培养条件下,自体CIK在杀伤K562时伴随NK细胞的杀伤作用,推测可能是H3和T551培养条件产生CIK细胞的同时,伴随NK细胞产生,从而产生较高的杀瘤率。因此,临床输入CIK细胞治疗肿瘤应达到一定的数量并维持一定时间,根据患者个体差异,若瘤体内CIK细胞数量与肿瘤细胞数量之比能维持在5∶1水平以上,有望达到较好的治疗效果。故而H3培养的脐带血和自体CIK细胞具有较强的体外抗白血病癌细胞活性,可应用于临床上白血病的过继性免疫治疗,并为临床治疗恶性肿瘤提供理论依据。
[1]Pan K,Guan XX,Li YQ,et al.Clinical activity of adjuvant cytokine-induced killer cell immunotherapy in patients with post-mastectomy triple-negative breast cancer[J].Clin Cancer Res,2014,20(11):3003-3011.
[2]June CH,Riddell SR,Schumacher TN,et al.Adoptive cellular therapy:a race to the finish line[J].Sci Transl Med,2015,25(7):280.
[3]Li DR,Yang YH,Gao L,et al.The possible molecular regulation mechanism of CIK cells inhibiting the proliferation of Human Lung Adenocarcinoma NCL-H157 Cells[J].Open Med,2016,11(1):1-6.
[4]Jäkel CE,Schmidt-Wolf IG.An update on new adoptive immunotherapy strategies for solid tumors with cytokine-induced killer cells[J].Expert Opin Biol Ther,2014,14(7):905-916.
[5]Kim JS,Park YS,Kim JY,et al.Inhibition of human pancreatic tumor growth by cytokine-induced killer cells in nude mouse xenograft model[J].Immune Netw,2012,12(6):247-252.
[6]Pan QZ,Pan K,Wang QJ.et al.Annexin A3 as a potential target for immunotherapy of liver cancer stem-like cells[J].Stem Cells,2015,33(2):354-366.
[7]Jiang J,Wu C,Lu B.Cytokine-induced killer cells promote antitumor immunity[J].J Transl Med,2013(11):83.
[8]殷雪,徐鑫,赵瑶,等.抗体介导的高效CIK(AMHE-CIK)细胞体外诱导的数种优化方案的比较研究[J].中国实验血液学杂志,2016,24(1):46-48.
[9]Amadori S,Del Principe MI,Venditti A.Advances in the treatment of elderly and frail patients with acute myeloid leukemia[J].Curr Opin Oncol,2014,26(6):663-669.
[10]Loh ML,Mullighan CG.Advances in the genetics of high-risk childhood B-progenitor acute lymphoblastic leukemia and juvenile myelomonocytic leukemia:implications for therapy[J].Clin Cancer Res,2012,18(10):2754-2767.
[11]黄谋珍,白俊,李峰松,等.PHA诱导的CIK细胞的生物学特性及其对K562细胞杀伤活性影响的研究[J].中国实验血液学杂志,2014,22(1):64-68.
[12]张小锋.CIK细胞杀瘤实验前后细胞表型与细胞毒性相关性研究[J].中国医药导刊,2013(5):870-871.
[13]陈娟,卢光琇.CIK细胞的生物特性和应用研究新进展[J].肿瘤药学,2014,4(3):166-171.
[14]Lu X,Zhu A,Cai X,et al.Role of NKG2D in cytokine-induced killer cells against multiple myeloma cells[J].Cancer Biol Ther,2012,13(8):623-629.
[15]Wang W,Li R,Meng M,et al.microRNA profiling of CD3+CD56+cytokine-induced killer cells[J].Sci Rep,2015(5):9571.
Effects of two different cell culture medium on proliferative and functional activities of cytokine-induced killer cells
SongWenling1,HanRong1,ZhangMan1,ZhangQuan2,YaoWeiqi2,3,WuDongcheng2,4
(1.ThirdDepartmentofOncology,HuangpiDistrictPeople′sHospital/ThirdAffiliatedHospital,JianghanUniversity,Wuhan,Hubei430060,China;2.DepartmentofResearchandDevelopment,WuhanHamiltonBiotechnologyCo.,Ltd,Wuhan,Hubei430075,China;3.TumoprCenter,FirstClinicalCollegeofWuhanUniversity,WuhanUniversity,Wuhan,Hubei430060,China;4.SchoolofBasicMedicineSciences,WuhanUniversity,Wuhan,Hubei430072,China)
Objective To observe the proliferation ability of cytokine-induced killer(CIK) cells and to detect surface molecule phenotype of CIK cells and in vitro killing effect to leukemia K562 cells.Methods The cord blood lymphocytes and peripheral blood mononuclear cells(PBMCs) from patients were cultured by the H3 medium and added with human recombinant interferon(IFN)-γ and CD3 monoclonal antibodies(mAb) for inducing CIK cells in vitro.The H3 medium and T551 medium were respectively added on 7 d of culture.The induction and culture were continued until 14 d.The CIK cells proliferation ability was observed by cell count and the expressions of CD3 and CD56 were detected by flow cytometry.The killing effect of CIK cells on leukemia cells was tested by CCK8 assays.Results The dynamic counting and phenotype analysis results revealed that the CIK cells amplification times(including cord blood CIK total cells and autologous CIK total cells) cultured by H3 and H3+T551 reached 76.9 times and 62.3 times on 14 d respectively;the CD3+CD56+double positive cells contents of cord blood CIK cells under the two kinds of culture condition were(16.7±2.7)% and(10.8±2.6)% respectively,while which of autologous CIK cells were(11.2±6.6)% and(10.7±6.4)% respectively;the in vitro killing-tumor test revealed that when the effector to-target ratio was 5:1,the cell cytotoxic activity of cord blood CIK cells cultured by H3 reached(33.50±9.99)%,which was significantly higher than(20.3±6.76)% of cord CIK cells cultured by H3+T551(P=0.011),while which of autologous CIK cells cultured by H3+T551 were(59.67±27.59)% and(42.13±19.47)% respectively,but the difference was not significant(P=0.080).Conclusion Cord blood and autologous CIK cells incubated by H3 have stronger in vitro anti-leukemia cells activity and can be used in the adoptive immunotherapy of leukemia in clinic.
leukemia,erythroblastic,acute;cytokine-induced killer cells;K562;H3 medium;T551 medium;inhibitory rates
宋文玲(1972)-,主治医师,本科,主要从事恶性肿瘤的诊断与治疗方面研究。
�术与方法·
10.3969/j.issn.1671-8348.2017.02.021
R733.7
A
1671-8348(2017)02-0215-03
2016-07-24
2016-09-29)
