长链非编码RNA-UBC1 对膀胱癌细胞生物学功能的影响
2017-02-10朱晨曦李文洲郭永连余家俊李国灏
朱晨曦,李文洲,郭永连,余家俊,舒 博,陈 琳,李国灏,卫 丹
(湖北省武汉市中心医院泌尿外科 430014)
长链非编码RNA-UBC1 对膀胱癌细胞生物学功能的影响
朱晨曦,李文洲,郭永连,余家俊,舒 博,陈 琳,李国灏,卫 丹
(湖北省武汉市中心医院泌尿外科 430014)
目的 探讨长链非编码RNA(lncRNA)-尿路上皮癌相关基因1(UBC1)对膀胱癌细胞增殖、凋亡和侵袭转移的作用及其可能的机制。方法 采用siRNA干扰技术沉默膀胱癌细胞系T24细胞的lncRNA-UBC1,设置阴性对照组,CCK-8检测细胞增殖,流式细胞仪检测细胞凋亡,Transwell检测细胞侵袭能力,Westernblot印迹法检测与转移相关的基质金属蛋白2(MMP-2)与zeste基因增强子同源2(EZH2)。结果lncRNA-UBC1在T24细胞株中表达明显高于人胚胎膀胱组织来源细胞;与阴性对照组和空白对照组相比,沉默UBC1后,UBC1沉默组膀胱癌细胞增殖速率慢于对照组,UBC1沉默组膀胱癌细胞凋亡细胞比例高于阴性对照组[(18.72±7.79)% vs. (13.09±5.66)%,P<0.05],UBC1沉默组细胞侵袭能力受到抑制,T24细胞MMP-2与EZH2表达降低。结论 沉默lncRNA-UBC1可抑制T24细胞增殖、凋亡及侵袭能力,其机制可能是通过MMP-2与EZH2途径。
RNA;膀胱肿瘤;长链非编码RNA-UBC1;肿瘤浸润;细胞增殖;基质金属蛋白酶2;zeste基因增强子同源物2
膀胱癌是最为常见的泌尿系统恶性肿瘤之一,其特点是复发率高和恶性程度高,尤其是浸润性膀胱癌,恶性程度极高,预后不佳,5年生存率不超过50%[1]。近年来,众多研究正深入探索膀胱癌发生、发展的分子机制,寻找可信度高的生物标志物和有效的治疗靶点成为膀胱癌诊治的突破点之一。长链非编码RNA(long non-coding RNA,lncRNA)已成为当前全球基因领域研究的热点内容之一[2],lncRNA可通过表观遗传学相关的修饰在肿瘤的发生、发展中发挥重要作用,部分lncRNA具有重要的潜在临床应用价值,有望成为人类癌症新的诊断标志物及分子治疗靶点[3]。 有研究从临床组织学水平检测并筛查发现长链非编码RNA(lncRNA)-尿路上皮癌相关基因1(UBC1)表达与膀胱癌患者淋巴转移及预后密切相关,而且,术前检测UBC1表达水平可为膀胱癌淋巴结清扫范围提供有力参考依据[4-5]。UBC1可能通过调控下游基因表达来发挥作用,但其具体机制尚在研究当中。本研究拟从细胞水平探讨UBC1与膀胱癌细胞增殖、凋亡和侵袭转移的关系及其可能的机制,现报道如下。
1 材料与方法
1.1 材料 膀胱癌细胞系T24细胞株和人胚胎膀胱组织来源细胞(CCC-HB-2)购自美国典型培养物保藏中心(ATCC);DMEM和RPMI-1640均购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;UBC1 siRNA和negative siRNA由广州市锐博生物科技有限公司合成;磷酸盐缓冲液(PBS)、0.25%胰蛋白酶和RIPA组织细胞快速裂解液等购自武汉华联科生物技术有限公司;SYBR Green染料购自天根生化科技有限公司;CCK-8试剂盒购自株式会社日本同仁; AnnexinV-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒、Matrigel基质胶均购自BD公司;各种孔板、Transell小室及其他细胞培养所需耗材为Corning公司产品。LipofectamineTM2000、TRIzol试剂和DNase Ⅰ酶等购自Invertogen公司;引物合成委托广州市锐博生物科技有限公司;CO2恒温培养箱(Thermo)、酶标仪(芬兰雷勃)、移液枪(吉尔森)、流式细胞仪(BD公司)均由本院科研中心提供使用。蛋白质标记物(Promega)、脱脂奶粉(BD公司)、十二烷基硫酸钠(SDS)(Sigma)和硝酸纤维素膜(millipore)均购自武汉谷歌生物公司。
1.2 方法
1.2.1 细胞培养及转染 人胚胎膀胱组织来源细胞CCC-HB-2用DMEM+10%胎牛血清+双抗培养。T24人膀胱癌细胞用DMEM+10%胎牛血清培养,常规细胞培养方法培养细胞,操作过程严格遵循无菌操作原则,细胞培养条件为37 ℃、5% CO2。取对数生长期生长状态最佳的细胞,接种于6孔板中,每孔2 mL细胞悬液,待细胞长满70%~80%时,参照LipofectamineTM2000转染试剂操作说明书进行siRNA瞬时转染操作,转染终浓度为100 nmol/L,在转染进行48 h后收集细胞进行下一步实验。实验分为空白对照组,阴性对照组(转染negative siRNA)和UBC1沉默组(转染UBC1-siRNA)。
1.2.2 逆转录PCR(RT-PCT)检测RNA表达水平 转染48 h后,采用Trizol法提取总RNA,用逆转录试剂盒对总RNA进行逆转录得到总cDNA,然后按选定引物采用TaqPCR MasterMix(Toyobo)进行下一步荧光定量PCR操作。随后进行目的基因片段的扩增,以U6基因为内参。lncRNA UBC1基因引物序列:上游引物 5′-CCU GUC UAC AGA CUG AAU ATT-3′,下游引物 5′-CCG GAA CAA AUG GCU UCA UTT-3′),阴性对照siRNA序列 5′-UUC UCC GAA CGU GUC ACG UTT-3′,各组设置3个复孔进行重复试验。采用RT-PCR法检测CCC-HB-2-人胚胎膀胱组织来源细胞株(CH2组)和T24膀胱癌细胞株(T24组)中的UBC1表达水平,方法同前。
1.2.3 CCK-8检测细胞增殖试验 取处于对数生长期的对照组和实验组的细胞,用胰蛋白酶消化后重悬,调整细胞浓度为(1~5)×104/mL,取96孔培养板,每组设置6个复孔,每孔加入100 μL细胞悬浮液,种植细胞浓度为(1~5)×103/孔,并设置空白对照。37 ℃培养过夜,按照每孔100 μL CCK-8,37 ℃,5% CO2孵育1~4 h; 用分光光度计测定450 nm波长光密度值(OD值)。记录每块板的数值,以培养处理的时间为横轴,以平均OD值为纵轴,制作处理后T24人膀胱癌细胞生长曲线。
1.2.4 流式细胞仪检测凋亡实验 转染48 h后,移去各组细胞上液,采用PBS洗涤1次,用胰酶消化液消化后重悬细胞,调整细胞浓度1×105/mL。用预冷的PBS洗涤2次,每次加入1 mL预冷的PBS,轻轻震荡操作,使细胞充分悬浮,1 000 g、4 ℃条件离心5 min,弃上清液。将细胞重悬于200 μL,注意调整细胞浓度;加入10 μL Annexin V-FITC和10 μL PI,轻轻混匀,注意不要用力震荡,在4 ℃避光孵育30 min后加入300 μL结合缓冲液(Binging Buffer),随即进行流式细胞仪上机检测。
1.2.5 Transwell侵袭实验 用无血清DMEM培养基进行细胞血清饥饿处理24 h,将24孔板和Transwell小室用1×PBS浸泡5 min;用不含血清的DMEM培养液洗涤细胞,然后用含有1%FBS的DMEM培养基重悬处理后的细胞,调整细胞浓度至1×105/mL,注意细胞浓度不可太高,接种到Transwell小室上层内,每个小室上层加0.50 mL细胞悬液,下层加入500 μL含10%FBS的DMEM培养液,每组3复孔。培养箱中继续培养48 h后每孔加入1 mL 4%甲醛溶液,室温下固定10 min后吸去固定液,用1×PBS洗涤1次,用0.5%结晶紫溶液进行染色,处理至少30 min后用1×PBS洗3次,晾干后观察。观察前用棉签小心擦去Transwell小室内没有迁移的细胞,注意不要擦掉小室牵引过去的细胞,不要残留棉花碎屑,然后将小室置于200倍的显微镜下观察,计数每个视野中的细胞数。
1.2.6 Western blot 细胞传代培养至70%~80%融合时进行转染,48 h后,胰酶消化并重悬细胞,采用RIPA试剂裂解法提取总蛋白,并用二喹啉甲酸(BCA)蛋白试剂盒检测蛋白浓度,达标蛋白浓度方可进行下一步实验。水浴法变性蛋白后,加入5×SDS-聚丙烯酰胺凝胶(PAGE)蛋白上样缓冲液,取含相同量蛋白的蛋白裂解液,采用10%的SDS-PAGE 胶进行电泳分离,注意调整电泳电压和时间,用电转印到尼龙膜上,用脱脂牛奶室温封闭1 h,免疫印迹的一抗用按1∶1 000稀释的抗人基质金属蛋白酶2(MMP-2)、zeste基因增强子同源物2(EZH2)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体过夜孵育,在室温下用PBS-Tween洗膜3次,每次10 min;印迹膜用按1∶3 000的抗鼠或抗兔IgG耦联的辣根过氧化物酶作为二抗,室温孵育 1 h,用PBS-Tween 洗膜3次,室温下每次10 min。用增强型化学发光液检测试剂盒化学发光显色。
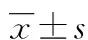
2 结 果
2.1RT-PCR检测细胞系UBC1基因表达T24组细胞UBC1表达水平高于CH2组近3倍,差异有统计学意义(P<0.05);T24膀胱癌细胞UBC1沉默组与阴性对照组及空白对照组相比,UBC1相对表达明显较低(P<0.05),见图1。

A:T24膀胱癌细胞UBC1基因表达水平;B:T24细胞UBC1表达水平。
图1RT-PCR检测细胞系UBC1基因表达水平
2.2 沉默UBC1对膀胱癌细胞增殖影响结果 与阴性对照组及空白对照组相比,24、48和72h时UBC1沉默组细胞OD值均降低,T24膀胱癌细胞增殖受到抑制,且差异有统计学意义(P<0.05),见图2。

图2 CCK-8检测T24膀胱癌细胞增殖情况
2.3 沉默UBC1对膀胱癌细胞凋亡影响 人T24膀胱癌细胞转染UBC1-siRNA24h后,流式细胞术检测膀胱癌细胞凋亡情况,结果显示,UBC1沉默组膀胱癌细胞凋亡细胞比例高于阴性对照组[(18.72±7.79)%vs.(13.09±5.66)%,P<0.05],见图3。

图3 流式细胞仪术检测T24膀胱癌细胞增殖情况
2.4 沉默UBC1对膀胱癌细胞侵袭转移影响Transwell小室实验检测膀胱癌细胞侵袭转移情况,结果显示,穿膜细胞数目分别为:空白对照组(333.0±22.3)、阴性对照组(310.0±30.5)和UBC1沉默组(172.0±20.9),与阴性对照组比较,UBC1沉默组细胞侵袭能力受到抑制(P<0.05),见图4。
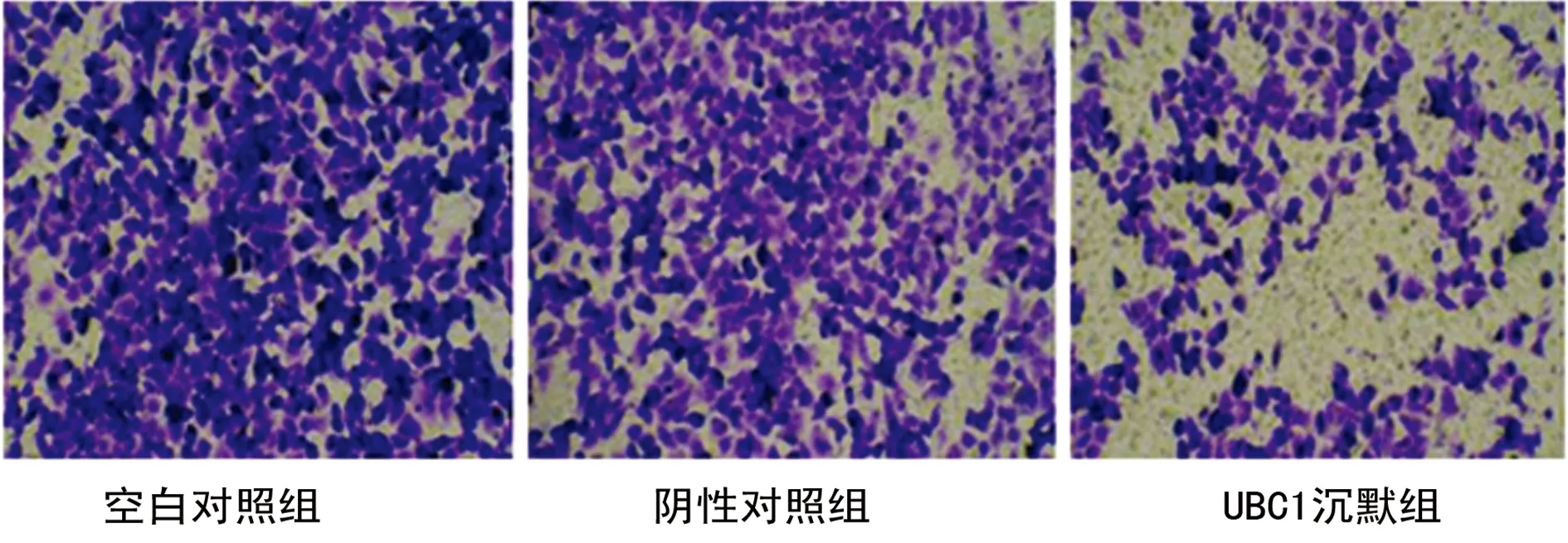
图4 Transwell检测T24膀胱癌细胞侵袭情况(×100)
2.5Westernblot检测MMP-2和EZH2蛋白的表达水平 转染24h后,Westernblot结果显示,与阴性对照组和空白对照组相比,UBC1沉默组细胞MMP-2和EZH2蛋白水平降低,见图5。

图5 Western blot检测T24肿瘤细胞MMP-2和EZH2蛋白的表达水平
3 讨 论
lncRNA是一类转录本长度大于200nt单位的RNA,普遍存在于细胞中,它们起初被认为是基因组转录的“转录垃圾”,不具有生物学功能[6-7]。然而,近年来研究表明,lncRNA参与了基因组印记、染色质修饰、转录干扰及转录激活等多种重要的调控过程[7]。lncRNA在膀胱癌中的研究既可以丰富非编码RNA的研究内容,到目前为止,已发现的与膀胱癌疾病密切相关的lncRNA有H19[8]、UCA1[9]、ncRAN[10]、MALAT-1[11]和MEG3[12]等。它们与膀胱癌疾病的发病机制、复发转移、诊断治疗及预后都有着一定的相关性[13]。
UBC1是新近发现的与膀胱癌疾病相关的又一lncRNA,He等[5]采用qRT-PCR检测102名膀胱癌患者的癌组织和癌旁组织UBC1的表达,发现UBC1在膀胱癌组织中呈现高表达,而且这种高表达与预后密切相关,其表达越高,患者预后越差,是可能的致癌基因或基因干预治疗的靶点。本实验在此基础上进行细胞实验,结果表明,在膀胱癌细胞系中UBC1表达明显高于人胚胎膀胱组织源性细胞中,这与He等[5]研究一致。当下调UBC1后,膀胱癌细胞的增殖、凋亡和侵袭能力均受到抑制。而在关于UBC1与胃肠道癌症关系的一项研究中,Hu等[4]也证实,在胃肠道癌组织中UBC1呈现高表达,下调UBC1后,胃肠道癌症细胞株BGC-823,SGC-7901的增殖、侵袭和转移均受到抑制。因此,结合以往研究不难得出,UBC1可能在膀胱癌的发生、发展中有致癌作用,若干扰UBC1的表达,可能对膀胱癌具有一定的治疗意义。
本实验研究结果还表明,下调UBC1后,膀胱癌细胞MMP-2和EZH2基因相关蛋白表达也随之下降。lncRNA并不直接参与调控蛋白的翻译合成,但其在mRNA前体的剪辑的调节和活性丝氨酸/精氨酸剪接因子水平的调控起着至关重要的作用,从而进一步影响蛋白的表达。虽然本项目研究的是UBC1,但是有关lncRNA调控MMPs基因的研究并不陌生,Dong等[11]下调肝癌细胞中的lncRNA-MALAT1后发现,MMP-9基因相关蛋白被明显下调[10]。Ji等[13]研究发现,MALAT1调控c-Myc和MMP-7基因的表达抑制结肠癌细胞的转移。已知MMPs蛋白家族参与多种癌症细胞的转移过程[14-15]。因此,UBC1可能通过MMP-2途径调控膀胱癌细胞的侵袭转移。此外,本研究还发现UBC1干扰组的膀胱癌细胞EZH2蛋白水平的降低。以往研究发现lncRNA-MALAT1可以通过调控EZH2而调控前列腺癌细胞的生物学功能[16],EZH2在膀胱癌增殖和侵袭转移过程中起到重要作用,EZH2在膀胱癌中呈现高表达,其表达水平的高低与预后成反比,但可能作为治疗的干预靶点[17-18]。因此,参与UBC1调控膀胱癌细胞的侵袭转移等生物学功能的蛋白途径除了MMP-2之外,还可能有EZH2途径。
总之,lncRNA-UBC1是膀胱癌发生、发展,增殖浸润和转移复发的重要调控分子,lncRNA与表观遗传学的调控是相互关联、相互影响的,并非独立存在于人体,随着研究的深入,lncRNA-UBC1在膀胱癌中的作用机制将越来越明确,甚至可能作为膀胱癌诊断的特异性标志物和药物作用基因靶点,为膀胱癌诊断和治疗提供新策略。
[1]张志凌,周芳坚.膀胱癌的诊断和治疗进展[J].临床外科杂志,2015,23(2):91-92.
[2]Martens-UzunovaES,BöttcherR,CroceCM,etal.LongnoncodingRNAinprostate,bladder,andkidneycancer[J].EurUrol,2014,65(6):1140-1151.
[3]ZhangQ,SuM,LuG,etal.Thecomplexityofbladdercancer:longnoncodingRNAsareonthestage[J].MolCancer,2013,12(1):101.
[4]HuY,PanJ,WangY,etal.LongnoncodingRNAlinc-UBC1isnegativeprognosticfactorandexhibitstumorpro-oncogenicactivityingastriccancer[J].IntJClinExpPathol,2015,8(1):594-600.
[5]HeW,CaiQ,SunF,etal.linc-UBC1physicallyassociateswithpolycombrepressivecomplex2(PRC2)and acts as a negative prognostic factor for lymph node metastasis and survival in bladder cancer[J].Biochim Biophys Acta,2013,1832(10):1528-1537.
[6]郑文雯,张淑芳.长链非编码 RNA 在膀胱癌中的研究进展[J].现代肿瘤医学,2015,23(24):3685-3690.
[7]Zhu YP,Bian XJ,Ye DW,et al.Long noncoding RNA expression signatures of bladdercancer revealed by microarray[J].Oncol Lett,2014,7(4):1197-1202.
[8]Luo M,Li Z,Wang W,et al.Long non-coding RNA H19 increases bladdercancer metastasis by associating with EZH2 and inhibiting E-cadherin expression[J].Cancer Lett,2013,333(2):213-221.
[9]Li Z,Li X,Wu S,et al.Long non-coding RNA UCA1 promotes glycolysis by upregulating hexokinase 2 through the mTOR-STAT3/microRNA143 pathway[J].Cancer Sci,2014,105(8):951-955.
[10]Zhu Y,Yu M,Li Z,et al.ncRAN,a newly identified long noncoding RNA,enhances human bladder tumor growth,invasion,and survival[J].Urology,2011,77(2):510.
[11]Dong Y,Liang G,Yuan B,et al.MALAT1 promotes the proliferation and metastasis of osteosarcoma cells by activating the PI3K/Akt pathway[J].Tumour Biol,2015,36(3):1477-1486.
[12]Ying L,Huang Y,Chen H,et al.Downregulated MEG3 activates autophagy and increases cell proliferation in bladdercancer[J].Mol Biosyst,2013,9(3):407-411.
[13]Ji Q,Liu X,Fu X,et al.Resveratrol inhibits invasion and metastasis of colorectal cancer cells via MALAT1 mediated Wnt/β-catenin signal pathway[J].PLoS One,2013,8(11):e78700.
[14]Coccia A,Bastianelli D,Mosca L,et al.Extra virgin olive oil phenols suppress migration and invasion of T24 human bladder cancer cells through modulation of matrix metalloproteinase-2[J].Nutr Cancer,2014,66(6):946-954.
[15]Yan Y,Liang H,Li T,et al.The MMP-1,MMP-2,and MMP-9 gene polymorphisms and susceptibility to bladder cancer:a meta-analysis[J].Tumour Biol,2014,35(4):3047-3052.
[16]Wang D,Ding L,Wang L,et al.LncRNA MALAT1 enhances oncogenic activities of EZH2 in castration-resistant prostate cancer[J].Oncotarget,2015,6(38):41045-41055.
[17]Martínez-Fernández M,Rubio C,Segovia C,et al.EZH2 in bladder cancer,a promising therapeutic target[J].Int J Mol Sci,2015,16(11):27107-27132.
[18]Wang HF,Yang H,Hu LB,et al.Effect of siRNA targeting EZH2 on cell viability and apoptosis of bladder cancer T24 cells[J].Genet Mol Res,2014,13(4):9939-9950.
Effect of long-chain non-coding RNA UBC1 on biological function of bladder cancer cells
ZhuChenxi,LiWenzhou,GuoYonglian,YuJiajun,ShuBo,ChenLin,LiGuohao,WeiDan
(DepartmentofUrology,WuhanMunicipalCentralHospital,Wuhan,Hubei430014,China)
Objective To investigate the effect of long-chain non-coding RNA-UBC1(lncRNA-UBCI) on proliferation,apoptosis,invasion and metastasis of bladder cancer cells and its possible mechanism.Methods The siRNA was used to silence lncRNA-UBC1 in bladder cancer cell line T24 cells.The negative control group was set.CCK-8 was used to detect cell proliferation,flow cytometry was used to detect cell apoptosis,Transwell assay was used to detect the invasion ability and the expression of EZH2 and MMP-2 was detected by Western blot.Results The lncRNA-UBC1 expression in T24 cell lines was significantly higher than that in human embryonic bladder tissue derived cells.Compared with the negative control group and blank control group,T24 bladder cancer cell proliferation rate in the UBC1 silence group was slower than that of the control groups.T24 bladder cancer cell apoptosis cell percentage in the UBC1 silence group was higher than that in the negative control group[(18.72±7.79)%vs. (13.09±5.66)%,P<0.05].The T24 bladder cancer cell invasion ability in the UBC1 silence group was inhibited.Expression of MMP-2 and EZH2 of T24 cell in UBC1 silence group was decreased.Conclusion Silencing lncRNA-UBC1 can inhibit the proliferation,apoptosis and invasion ability of T24 cells and its mechanism may be through MMP-2 and EZH2 pathway.
RNA;urinary bladder neoplasms;long-chain non-coding RNA UBC1;neoplasm invasiveness;cell proliferation;matrix metalloproteinase 2;enhancer of zeste homolog 2
朱晨曦(1979-),主治医师,博士,主要从事泌尿系肿瘤及结石方面研究。
��·基础研究
10.3969/j.issn.1671-8348.2017.02.007
R
A
1671-8348(2017)02-0169-03
2016-07-03
2016-08-26)
