体素内不相干运动扩散加权成像评估淋巴结转移对头颈部鳞癌治疗应答率的预测价值
2017-02-10邓承健何卫红
邓承健,何卫红
(南华大学附属第二医院医学影像科,湖南衡阳,421001)
体素内不相干运动扩散加权成像评估淋巴结转移对头颈部鳞癌治疗应答率的预测价值
邓承健,何卫红
(南华大学附属第二医院医学影像科,湖南衡阳,421001)
目的体素内不相干运动扩散加权成像(IVIM-DWI)评估头颈部鳞状细胞癌(HNSCC)淋巴结转移弥散和微灌注情况。采用IVIM参数进行淋巴结分期,并根据随访获得的治疗应答率数据分析IVIM参数的预测价值。方法15例经病理确诊的局部晚期头颈部鳞癌淋巴结转移患者在施行非手术保留器官治疗前进行弥散加权成像(DWI)检查。使用8种不同的b值(0~800 s/mm2)进行3 T DWI成像。IVIM双指数拟合计算灌注指数f和扩散系数D。所有患者随访期均为13.5个月。对所有患者进行感兴趣区(ROI)分析。结果13.5个月随访期间,15例患者中3例局部复发(LRF)。LRF患者初始f值高于局部区域控制(LRC)患者(14.5±0.6)%vs(7.7±2.6)%(P=0.001)。两组间初始扩散系数D差异无统计学意义(0.97±0.15)×10-3mm2/s vs(0.88±0.13)× 10-3mm2/s(P=0.301)。结论淋巴结中初始灌注指数f具有预测HNSCC患者局部复发率和治疗应答率价值。
体素内不相干运动;扩散加权成像;灌注分数;淋巴结转移;头颈部鳞状细胞癌;治疗应答率
Keywords:intravoxel incoherent motion;diffusion-weighted imaging;perfusion fraction;lymph node metastsis; head and neck squamous cell carcinoma;treatment response
弥散加权成像(diffusion weighted imaging,DWI)联合表观弥散系数(apparent diffusion coefficient,ADC)是评价淋巴结转移的有效方法[1]。与形态学评价相比,DWI和ADC联合使用评价能够更好区分头颈部鳞状细胞癌(head and neck squamous cell carcinomas,HNSCC)患者良性淋巴结和淋巴结转移。转移性淋巴结中ADC值明显偏低[2]。以往研究使用CT、MRI对比增强灌注成像亦发现,与良性淋巴结相比,HNSCC颈淋巴结转移过度灌注和过度血管化[3]。
体素内不相干运动扩散加权成像(intravoxel incoherent motion-diffusion weighted imaging,IVIMDWI)是一种先进成像技术,可同时测量血管腔隙(灌注分数f)和扩散限制(扩散系数D)信号,无需使用造影剂。IVIM-DWI是基于b值不断增加的扩散加权成像,b值较低时灌注良好组织会出现明显信号衰减[4]。有研究采用反转恢复DWI序列证实,血管腔隙b值较低时非单指数信号衰减是由于血容量、血流量和T2信号引起[5]。扩散加权数据采用双指数拟合,可以区分灌注分数f和灌注自由扩散系数D。采用IVIM-DWI检测头颈肿瘤原发部位,可以提高不同部位头部和颈部肿瘤的分辨率。此外,IVIMDWI在肿瘤表征和HNSCC治疗应答率预测中潜力巨大。本研究旨在通过获取HNSCC淋巴结转移患者治疗前灌注分数f和扩散系数D,评估其在预测治疗应答率中的价值。
1 资料与方法
1.1 研究对象
连续招募22例经病理确诊的局部晚期HNSCC患者。其中15例DWI成像基线检查显示疑似淋巴结转移,回顾性分析疑似淋巴结转移情况,短轴>15 mm的可疑淋巴结被认为是淋巴结转移。多淋巴结转移患者中,选取DWI序列覆盖最大的淋巴结进行分析。15例患者中,女性6例,男性9例;年龄43~69岁,平均(54.5±7.6)岁;9例口咽癌,3例下咽癌,3例喉癌。
非手术器官保留治疗前扫基线MRI。每例患者进行化疗和/或免疫治疗结合放疗,化疗方案可变。患者接受卡铂/顺铂和单用氟尿嘧啶(n=10)或联合使用多西他赛(n=4)。接受免疫治疗患者(n=12)增加西妥昔单抗。所有患者临床和影像学随访期为治疗结束后13.5个月或出现局部复发为止。影像显示局部复发均经组织学活检证实。
1.2 磁共振成像检测
基线磁共振成像检查和后续检查(治疗完成后1.5、4.5、7.5和13.5个月)采用相同扫描方案。采用3T扫描仪(Magnetom Trio,西门子,埃朗根,德国),4通道颈线圈对患者进行检查。DWI单次回波平面成像(SE-EPI)轴向脉冲序列参数如下:TR/TE:1 300/50 ms,13层,层面厚度:3 mm,平面分辨率:3×3 mm2,视野(FOV):240×240 mm2,10中等水平,带宽:3 472 Hz/像素,K空间并行成像技术GRAPPA因子2,总成像时间:4 min 51 s。0~800 s/mm2取8个不同b值(b=0、50、100、150、200、250、700和800 s/mm2)。使用3个扩散方向。对获取图像计算出跟踪加权图像,并进一步分析。除了DWI,还获取了形态学图像包括T1和T2加权TSE序列以及T2TIRM(快速反转恢复序列)。应用对比剂(0.1 mmol/kg体重钆布醇)后,得到脂肪饱和T1 TSE图像。
1.3 检测后处理和数据分析
为计算灌注分数f和扩散系数D,根据IVIM模型利用MITK(医学影像互动工具包)软件对扩散加权数据进行后处理:
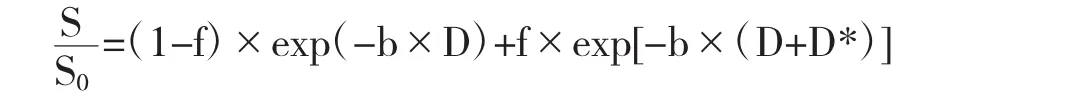
该公式中,S0为无扩散加权信号,S为扩散加权信号。参数估计是根据假设扩散测定主要受2种效应的影响,即毛细管网分子运动引入的灌注相关作用(假扩散系数,D*)和被动扩散的血管外作用(D)。由于D,D*同时非线性拟合,加权系数f不固定,第一步根据推荐方法以>170 s/mm2的b值时的测量值用于估计f和D。第二步,通过穷举搜索计算D*。
对这些定量分析进行感兴趣区(region of interest,ROI)分析。由一位经验丰富的放射科医师通过与形态图像比较这些数据首先确定出弥散加权图像的对应区域。在整个淋巴结转移区域的扩散加权成像中画出ROI(在少数情况下,增大的淋巴结几乎全部被DWI覆盖),同时排除大片坏死及邻近颈部血管。因肉眼可见的完全坏死性淋巴结转移,分析数据将1例患者排除。每个ROI的信号强度首先取平均值,然后计算IVIM参数f和D。在治疗结束后13.5个月内,将这些基线值与临床疗效进行比较。根据随访结果将患者分为两组,局部控制(locoregional control,LRC)组和局部复发(locoregional failure,LRF)组,局部复发是指复发肿瘤位于原发肿瘤部位,局部控制是指影像学上肿瘤未增大。
1.4 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,非正态分布资料用中位数(四分位数间距)表示。LRC组和LRF组间符合正态分布的基线值进行独立样本t检验,P<0.05为差异有统计学意义。
2 结果
HNSCC患者接受非手术器官保护治疗前,采用IVIM评估15例患者淋巴结转移情况。治疗结束后13.5个月随访期内,4例患者局部复发(LRF),11例患者局部控制(LRC)。LRF组和LRC组基线检查的f和D值见图1。LRF组平均初始f值为(14.5±0.6)%(14.1%~15.3%),LRC组平均初始f值为(7.7± 2.6)%(3.1%~12.3%)。因此,LRF患者初始f值高于LRC患者(t=3.183,P=0.001)。LRF组基线D值为(0.97±0.15)×10-3mm2/s,LRC组基线D值为(0.88± 0.13)×10-3mm2/s,两组比较差异无统计学意义(t= 0.481,P=0.301)(见图2)。
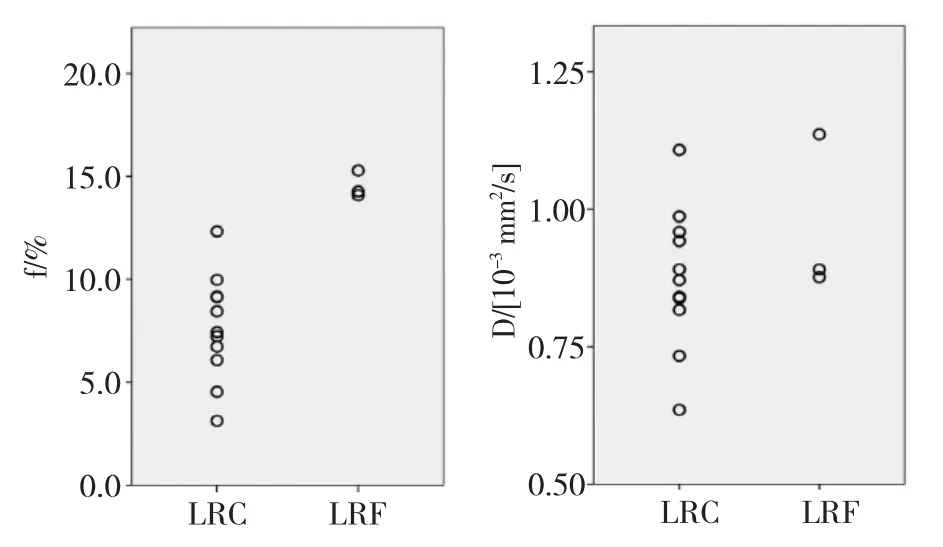
图1 两组患者基线f值和D值分布情况
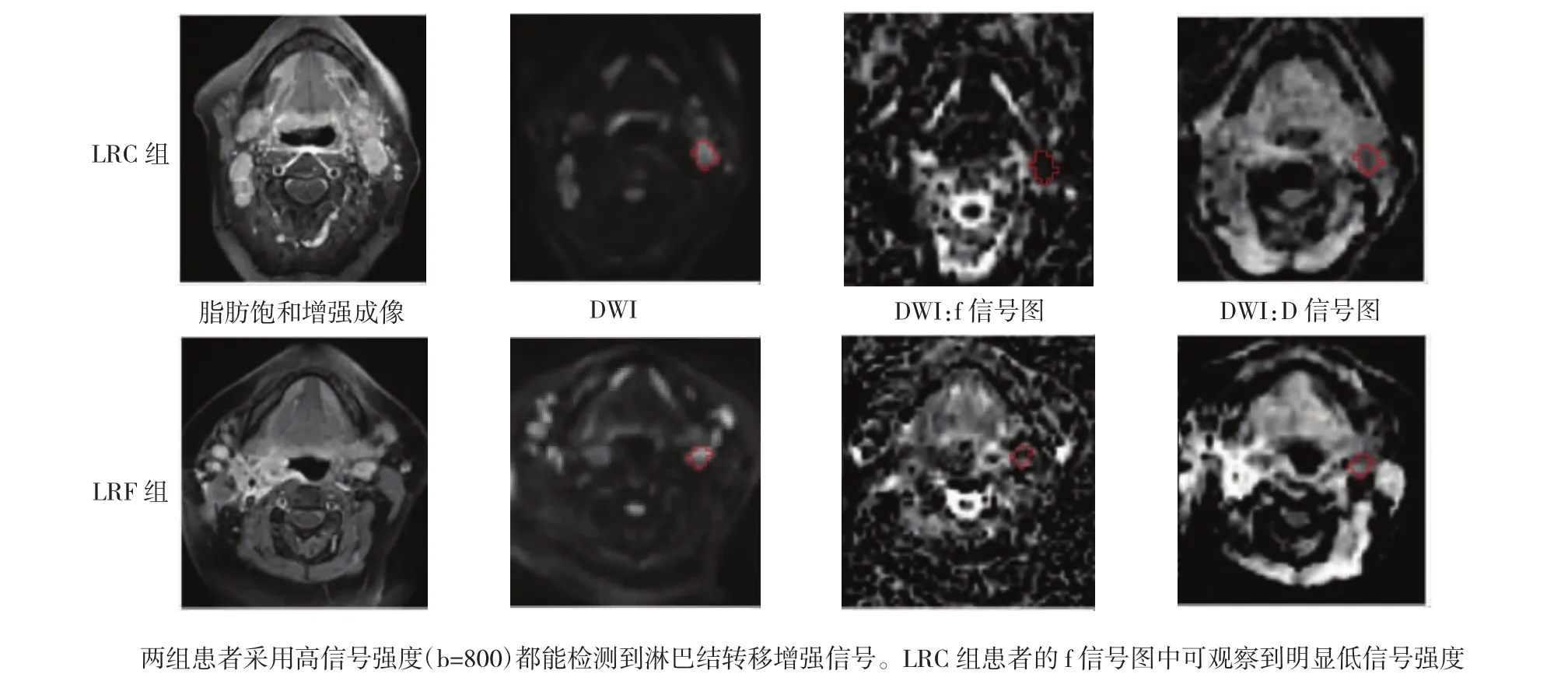
图2 两组患者治疗完成后1.5个月时MRI检查的典型影像
3 讨论
本研究发现,HNSCC患者接受非手术保留器官治疗前,LRF组患者基线f值高于LRC患者。由于f值为血管腔隙的替代指标,最有可能反映肿瘤T2-加权血管体积分数,动态对比增强磁共振成像(DCE-MRI)中主要与局部血流量有关。然而,f受多种因素影响,包括局部血容量、血流量和T2信号[6],故不能与DCE-MRI测量区域血流量进行比较。
以往有研究分析,HNSCC患者接受非手术器官保留治疗前的区域血流量(DCE-MRI测量)对治疗应答率的影响[7]。CAO等[8]研究发现,LRF患者基线血容量和血流高于LRC患者。与此相反,CHAWLA等[9]分析指出,LRF患者基线血浆体积分数低于LRC患者。但是这两项研究结果并没有统计学意义。
根据HNSCC原发肿瘤组织病理学分析,微血管密度越高,HNSCC侵袭性更高,从而导致淋巴结转移和远端转移发生风险更高。组织病理学检测结果显示,局部控制率越低原发肿瘤微血管密度越高,以往有研究采用彩色超声多普勒检测患者放化疗前淋巴结转移情况也得到类似结果,该研究发现,基线检查超声显示淋巴结血管化程度越高,生存率下降,远端转移较早发生,从而预后越差[10]。这些结果也与本研究结果一致,HNSCC LRF患者淋巴结转移血管腔隙(f)更大。以往对HNSCC原发肿瘤部位的IVIM分析表明,预后不良(LRF、远处转移和死亡)患者肿瘤原发部位基线f值更高,因此,基线f值更高往往提示肿瘤高侵袭性。
尽管HAUSER等[11]研究发现,预后好与预后差HNSCC患者原发肿瘤部位ADC水平差异有统计学意义,但预后较好患者基线D值仅呈较低趋势,这一研究结果与本课题在淋巴结转移中观察到的结果一致,LRC患者基线D值略低。此外,本研究结果与CHAWLA等[9]研究结果类似,CHAWLA等发现,完全应答HNSCC患者淋巴结中ADC值仅略低于部分应答患者,差异有统计学意义。一般来说,肿瘤细胞外空间较大如硬癌或坏死肿瘤通常预后不良,而高度增殖实体肿瘤细胞密度高通常预后良好,这些差异可能与缺氧和微坏死肿瘤组织酸中毒有关,从而导致放化疗抵抗[12-14]。然而,本组患者淋巴结转移LRF和LRC患者D值差异无统计学意义。本研究和以往其他研究仅发现f和ADC分析具有预后价值,而D值则不具有预后价值。这些结果提示,HNSCC患者预后良好和较差患者ADC水平差异可能与不同血管分型有关。原发肿瘤部位的类似结果[11]也验证该假设。本研究的主要局限性是样本量小,随访中仅有15例HNSCC淋巴结转移患者可供评估和分析。然而,这一初步结果具有一定临床应用价值,本课题组未来将在更大样本量患者和更长随访期进一步深入研究,以验证本研究的结果。
总之,局部晚期HNSCC患者淋巴结转移IVIM分析表明,基线检查中高f值可以预测治疗后局部复发,而LRC和LRF患者D值差异无统计学意义。因此,HNSCC扩散加权成像结果提示LRC和LRF患者不同血管分型具有预测临床结果的潜力。
[1]DE-BONDT R,HOEBERIGS M P,DESERNO W,et al.Diagnostic accuracy and additional value of diffusion-weighted imaging for discrimination of malignant cervical lymph nodes in head and neck squamous cell carcinoma[J].Neuroradiology,2009,51(3): 183-192.
[2]刘轶群,于骞,马周鹏,等.磁共振扩散加权成像在评估鼻咽癌颈部淋巴结转移放化疗中的应用[J].中国乡村医药,2015(10):69-70.
[3]HEUSCH P,SPROLL C,BUCHBENDER C,et al.Diagnostic accuracy of ultrasound,18F-FDG-PET/CT,and fused 18F-FDGPET-MR images with DWI for the detection of cervical lymph node metastases of HNSCC[J].Clinical oral investigations,2014, 18(3):969-978.
[4]YOON J H,LEE J M,BAEK J H,et al.Evaluation of hepatic fibrosis using intravoxel incoherent motion in diffusion-weighted liver MRI[J].Journal of computer assisted tomography,2014,38(1): 110-116.
[5]LEMKE A,LAUN F B,SIMON D,et al.An in vivo verification of the intravoxel incoherent motion effect in diffusion‐weighted imaging oftheabdomen[J].Magneticresonanceinmedicine, 2010,64(6):1580-1585.
[6]上官建伟,梁俊芳,张新明,等.CT及MRI在头颈癌淋巴结转移早期诊断中的应用[J].中国实用医刊,2015,42(23):1-2.
[7]PATEL J,SIGMUND E E,RUSINEK H,et al.Diagnosis of cirrhosiswith intravoxel incoherent motion diffusion MRI and dynamic contrast-enhanced MRI alone and in combination:preliminary experience[J].J Magn ResonImaging,2010,31(3):589-600.
[8]CAO Y,POPOVTZER A,LI D,et al.Early prediction of outcome in advanced head-and-neck cancer based on tumor blood volume alterations during therapy:aprospective study[J].Int J Radiat Oncol Biol Phys,2008,72(5):1287-1290.
[9]CHAWLA S,KIM S,DOUGHERTY L,et al.Pretreatment diffusion-weighted anddynamic contrast-enhanced MRI for prediction of local treatment responsein squamous cell carcinomas of the head and neck[J].AJR Am J Roentgenol,2013,200(1):35-43.
[10]SUMI M,NAKAMURA T.Head and neck tumors:assessment of perfusion-relatedparameters and diffusion coefficients based on the intravoxel incoherentmotion model[J].AJNR Am J Neuroradiol,2013,34(2):410-416.
[11]HAUSER T,ESSIG M,JENSEN A,et al.Characterization and therapy monitoring of head and neck carcinomas using diffu sion-imaging-basedintravoxelincoherentmotionparameterspreliminary results[J].Neuroradiology,2013,55(5):527-536.
[12]VANDECAVEYE V,DE KEYZER F,DIRIX P,et al.Applications of diffusion-weighted magnetic resonance imaging inhead and neck squamous cell carcinoma[J].Neuroradiology 2010,52(9): 773-784.
[13]BRIZEL D M,DODGE R K,CLOUGH R W,et al.Oxygenation of head andneck cancer:changes during radiotherapy and impact on treatment outcome[J].Radiother Oncol,1999,53(2):113-117.
[14]TATUM J L,KELLOFF G J,GILLIES R J,et al.Hypoxia:importance in tumor biology,noninvasive measurement by imaging, and value of its measurement in themanagement of cancer therapy[J].Int J Radiat Biol,2006,82(10):699-757.
(张蕾 编辑)
Predictive value of IVIM-DWI in evaluation of lymph node metastasis on treatment response in head and neck squamous carcinomas
Cheng-jian Deng,Wei-hong He
(Department of Medical Imaging,the Second Affiliated Hospital,University of South China, Hengyang,Hunan 421001,China)
ObjectiveTo evaluate diffusion and micro-perfusion of lymph node metastases of head and neck squamous cell carcinomas(HNSCC)using intravoxel incoherent motion(IVIM)diffusion-weighted imaging(DWI), use the obtained IVIM parameters to characterize lymph nodes staging and to evaluate the potential predictive value of these parameters using therapy response rate during follow-up.MethodsFifteen patients with lymph node metastases of histologically-confirmed locally advanced HNSCC were examined using DWI before a nonsurgical organ preserving therapy.DWI imaging was performed at 3 T using eight different b-values ranging 0-800 s/mm2. The perfusion fraction f and the diffusion coefficient D were extracted using IVIM biexponential fit.A follow-up period of 13.5 months was available for all the patients.A region of interest(ROI)analysis was performed in all the patients.ResultsLocoregional failure(LRF)was present in 3 of the 15 patients within 13.5 months of follow-up.The initial f-value was significantly higher(P=0.001)in the patients with LRF than in the patients with locoregional control[(14.5±0.6)%vs.(7.7±2.6%),P=0.001].The initial diffusion coefficient D did not differ significantly between the two groups[(0.97±0.15)×10-3mm2/s vs.(0.88±0.13)×10-3mm2/s,P=0.301].ConclusionsOur results indicate that a high initial perfusion fraction f in lymph nodes may predict poor treatment response in patients with HNSCC due to locoregional failure.
R739.91
:B
10.3969/j.issn.1005-8982.2017.02.018
1005-8982(2017)02-0094-04
2016-04-19
