芥子气经腹腔和气管致大鼠急性肺损伤纤维化指标变化*
2017-02-10韩玮朱双双贝媛媛赵建钟玉绪刘菲赵玉玲祝筱姬
韩玮,朱双双,贝媛媛,赵建,钟玉绪,刘菲,赵玉玲,祝筱姬
(1.济南军区总医院医务部,山东济南250001;2.潍坊医学院研究生处,山东潍坊261042;3.军事医学科学院毒物药物研究所,北京100850;4.解放军第89医院呼吸科,山东潍坊261021)
论著
芥子气经腹腔和气管致大鼠急性肺损伤纤维化指标变化*
韩玮1,朱双双2,贝媛媛2,赵建3,钟玉绪3,刘菲4,赵玉玲4,祝筱姬4
(1.济南军区总医院医务部,山东济南250001;2.潍坊医学院研究生处,山东潍坊261042;3.军事医学科学院毒物药物研究所,北京100850;4.解放军第89医院呼吸科,山东潍坊261021)
目的经腹腔和气管复制大鼠芥子气(SM)急性肺损伤动物模型,比较2种大鼠急性肺损伤模型肺纤维化指标的差异。方法选取Sprague Dawley大鼠136只,随机分为5组。腹腔SM组腹腔内注入稀释的SM 0.1 ml(0.96 LD50=8 mg/kg),气管SM组气管内注入稀释的SM 0.1 ml(0.98 LD50=2 mg/kg),腹腔和气管丙二醇组分别腹腔和气管内注入丙二醇0.1 ml,正常对照组不做任何处理。采用Masson染色和免疫组织化学,判断肺纤维化指标变化。结果①光镜下见72 h肺泡间隔被染成绿色的胶原纤维增多;②腹腔SM组大鼠肺泡间隔各时间段基质金属蛋白酶MMP-2、MMP-9、基质金属蛋白酶组织抑制剂TIMP-1、TIMP-2蛋白阳性表达率分别与气管SM组比较升高(P<0.05);③腹腔SM组大鼠肺泡间隔各时间段肺泡间隔Ⅰ型胶原、Ⅲ型胶原蛋白阳性表达率分别与气管SM组比较升高(P<0.05);④腹腔SM组大鼠肺泡间隔各时间段肺泡间隔转化生长因子(TGF-β1)、母亲DPP同源物7(Smad7)蛋白阳性表达率分别与气管SM组比较升高(P<0.05)。结论大鼠在经腹腔和气管SM LD50浓度相似的情况下,经腹腔途径肺纤维化指标与经气管比较升高,提示SM经腹腔途径更容易诱导肺纤维化。
芥子气;肺损伤;肺纤维化;大鼠
芥子气(sulfur mustard,SM)是一种强有力的以细胞毒为主的双功能烷化剂,具有诱变和癌变特性[1]。SM损伤最常见的器官是皮肤、呼吸道和眼睛,其中肺损伤所导致急性呼吸窘迫综合征和肺纤维化是致死的重要原因[2]。SM的毒性主要归属于对蛋白的烷化和其亲脂性,它能快速穿透靶组织,结合细胞中的脂类和核酸导致DNA损伤和细胞毒性[3]。前期笔者在复制经腹腔和气管SM急性肺损伤动物模型的基础上,对SM肺损伤的炎症反应、氧化应激和细胞凋亡机制进行了研究[4-6]。本文通过对肺组织特殊染色和免疫组织化学,分析比较经腹腔和气管SM急性肺损伤的纤维化指标变化,并探讨其分子机制,为抗纤维化靶向治疗提供靶标。
1 材料与方法
1.1 试剂与仪器
1,2-丙二醇溶液由天津致远化学有限公司提供,Masson染色液由北京博奥森生物技术有限公司提供,基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、基质金属蛋白酶组织抑制剂1(tissueinhibitorofmatrixmetalloproteinases-1,TIMP-1)、基质金属蛋白酶组织抑制剂2(tissue inhibitor of matrix metalloproteinases-2,TIMP-2)、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、转化生长因子(transforming growth factor-beta 1,TGF-β1)及母亲DPP同源物7(mothers against decapentaplegic homolog 7,Smad7)蛋白免疫组织化学试剂盒由北京博奥森生物技术有限公司提供。冷光源(AXEL-300型,图特林根,德国),光学显微镜(BX51型,奥林巴斯公司,日本)。
1.2 实验动物与分组
健康雄性Sprague Dawley大鼠136只(SPF级,中国人民解放军军事医学科学院实验动物中心,合格证号:0015902),体重280~300 g,年龄15周。
将大鼠分为腹腔SM组(32只)、腹腔丙二醇组(32只)、气管SM组(32只)、气管丙二醇组(32只)、正常对照组(8只)。SM液(纯度>90%)临用前用丙二醇稀释至所需浓度。①气管途径染毒动物模型复制:实验前气管SM组和气管丙二醇组皮下注射阿托品(0.05 mg/kg),30 min后腹腔内注射盐酸氯胺酮(100 mg/kg)实施麻醉,气管内注入稀释的SM 0.1 ml(0.98LD50=2mg/kg),气管丙二醇组注入丙二醇0.1 ml。②腹腔途径染毒动物模型复制:同上方法实施麻醉。腹腔SM组大鼠腹腔内注入稀释的SM 0.1 ml(0.96 LD50=8 mg/kg),腹腔丙二醇组注入丙二醇0.1 ml。正常对照组不做任何处理。
1.3 观察指标
收集大鼠肺组织标本共136份,用10%中性福尔马林溶液固定标本24 h,常规脱水、石蜡包埋、切片、HE染色,每一个标本切取15份,每5份一组进行Masson和免疫组织化学染色。
1.3.1 Masson染色石蜡切片脱蜡至水,铬化处理,依次自来水和蒸馏水洗,用Regaud苏木精染色液染核5~10 min,水洗和蒸馏水洗,用Masson丽春红酸性复红液5~10 min,以2%冰醋酸水溶液浸洗片刻,1%磷钼酸水溶液分化3~5 min,不经水洗,直接用苯胺蓝液染5 min,以0.2%冰醋酸水溶液浸洗片刻,95%酒精、无水酒精、二甲苯透明、中性树胶封固。
1.3.2 免疫组织化学免疫组织化学(SP)法检测MMP-2、MMP-9、TIMP-1、TIMP-2、Ⅰ型胶原蛋白、Ⅲ胶原蛋白、TGF-β1、Smad7蛋白的表达。石蜡切片,常规二甲苯脱蜡,抗原修复,滴加兔抗大鼠MMP-2、MMP-9、TIMP-1、TIMP-2、Ⅰ型胶原、Ⅲ胶原、TGF-β1、Smad7单克隆抗体20μl/片,再滴加二抗,DABC显色,苏木精衬染,常规树脂封片。PBS代替一抗作阴性对照,用已知阳性切片作阳性对照。
1.3.3 显微图像分析采用Image-Pro Plus 6.0病理细胞图像分析系统,将各组MMP-2、MMP-9、TIMP-1、TIMP-2、Ⅰ型胶原、Ⅲ型胶原、TGF-β1、Smad7免疫组织化学染色切片行图像分析,选取测量参数,测定阳性率和强阳性率,每间隔一个高倍视野(400倍)选取一个视野进行观察,每张切片至少观察5个高倍视野,计算其肺泡间隔阳性细胞比率(5个高倍视野的阳性细胞数/细胞总数×100%)并计算其平均值。
1.4 统计学方法
采用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较用重复测量的多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺组织Masson染色结果
腹腔和气管SM组6 h肺泡间隔可见微量被染成绿色的胶原纤维,24和48 h肺泡间隔可见少量被染成绿色的胶原纤维,72 h肺泡间隔被染成绿色的胶原纤维增多。气管丙二醇和正常对照组肺泡间隔见微量被染成绿色的胶原纤维分布。见图1。
2.2 大鼠MMP-2、MMP-9、TIMP-1、TIMP-2、Ⅰ型胶原蛋白、Ⅲ胶原蛋白、TGF-β1、Smad7蛋白的表达
2.2.1 MMP-2腹腔和气管SM组6 h肺泡间隔MMP-2蛋白阳性表达呈散在分布,24和48 h肺泡间隔MMP-2蛋白阳性表达聚集成簇分布,72 h肺泡间隔MMP-2蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔MMP-2蛋白阳性表达呈零星分布。见图2。5组不同时间的MMP-2蛋白阳性表达率比较,采用重复测量的方差分析,结果:①腹腔和气管SM组不同时间点的MMP-2蛋白阳性表达率比较,差异有统计学意义(F=524.282,P= 0.000);②腹腔SM组与其他4组的MMP-2蛋白阳性表达率比较,差异有统计学意义(F=2 698.015,P=0.000);③腹腔SM组与气管SM组的MMP-2蛋白阳性表达率变化趋势比较,差异有统计学意义(F=264.515,P=0.000),呈递增趋势。见图3、4。
2.2.2 MMP-9腹腔和气管SM组6 h肺泡间隔MMP-9蛋白阳性表达呈散在分布,24和48h肺泡间隔MMP-9蛋白阳性表达聚集成簇分布,72 h肺泡间隔MMP-9蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔MMP-9蛋白阳性表达呈零星分布。见图5。5组不同时间的MMP-9蛋白阳性表达率比较,采用重复测量的方差分析,结果:①腹腔和气管SM组不同时间点的MMP-9蛋白阳性表达率比较,差异有统计学意义(F=363.009,P= 0.000);②腹腔SM组与其他4组的MMP-9蛋白阳性表达率比较,差异有统计学意义(F=647.823,P= 0.000);③腹腔SM组与气管SM组的MMP-9蛋白阳性表达率变化趋势比较,差异有统计学意义(F=161.152,P=0.000),呈递增趋势。见图6、7。
2.2.3 TIMP-1腹腔和气管SM组6 h肺泡间隔TIMP-1蛋白阳性表达呈散在分布,24和48 h肺泡间隔TIMP-1蛋白阳性表达聚集成簇分布,72 h肺泡间隔TIMP-1蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔TIMP-1阳性蛋白表达呈零星分布。见图8。5组不同时间的TIMP-1蛋白阳性表达率比较,采用重复测量的方差分析,结果:①腹腔和气管SM组不同时间点的TIMP-1阳性蛋白表达率比较,差异有统计学意义(F=607.751,P= 0.000);②腹腔SM组与其他4组的TIMP-1蛋白阳性表达率比较,差异有统计学意义(F=3471.017,P= 0.000);③腹腔SM组与气管SM组的TIMP-1蛋白阳性表达率变化趋势比较,差异有统计学意义(F= 289.162,P=0.000),呈递增趋势。见图9、10。
2.2.4 TIMP-2腹腔和气管SM组6 h肺泡间隔TIMP-2蛋白阳性表达呈散在分布,24和48 h肺泡间隔TIMP-2蛋白阳性表达聚集成簇分布,72 h肺泡间隔TIMP-2蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔TIMP-2蛋白阳性表达呈零星分布。见图11。5组不同时间的TIMP-2蛋白阳性表达率比较,采用重复测量的方差分析,结果:①腹腔和气管SM组不同时间点的TIMP-2阳性蛋白表达率比较,差异有统计学意义(F=341.900,P= 0.000);②腹腔SM组与其他4组的TIMP-2蛋白阳性表达率比较,差异有统计学意义(F=1540.403,P= 0.000);③腹腔SM组与气管SM组的TIMP-2蛋白阳性表达率变化趋势比较,差异有统计学意义(F= 166.807,P=0.000),呈递增趋势。见图12、13。
2.2.5 Ⅰ型胶原腹腔和气管SM组6 h肺泡间隔Ⅰ型胶原蛋白阳性表达呈散在分布,24和48 h肺泡间隔Ⅰ型胶原蛋白阳性表达聚集成簇分布,72 h肺泡间隔Ⅰ型胶原蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔Ⅰ型胶原蛋白阳性表达呈零星分布。见图14。5组不同时间的Ⅰ型胶原蛋白阳性表达率比较,采用重复测量的方差分析,结果:①腹腔和气管SM组不同时间点的Ⅰ型胶原蛋白阳性表达率比较,差异有统计学意义(F=283.700,P=0.000);②腹腔SM组与其他4组的Ⅰ型胶原蛋白阳性表达率比较,差异有统计学意义(F=1677.605,P=0.000);③腹腔SM组与气管SM组的Ⅰ型胶原蛋白阳性表达率变化趋势比较,差异有统计学意义(F=171.012,P=0.000),呈递增趋势。见图15、16。
2.2.6 Ⅲ型胶原腹腔和气管SM组6 h肺泡间隔Ⅲ型胶原蛋白阳性表达呈散在分布,24和48 h肺泡间隔Ⅲ型胶原蛋白阳性表达聚集成簇分布,72 h肺泡间隔Ⅲ型胶原蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔Ⅲ型胶原蛋白阳性表达呈零星分布。见图17。5组不同时间的Ⅲ型胶原蛋白阳性表达率比较,采用重复测量数据的方差分析,结果:①腹腔和气管SM组不同时间点间的Ⅲ型胶原蛋白阳性表达率比较,差异有统计学意义(F= 245.616,P=0.000);②腹腔SM组与其他4组的Ⅲ型胶原蛋白阳性表达率比较,差异有统计学意义(F=1 792.061,P=0.000);③腹腔SM组与气管SM组的Ⅲ型胶原蛋白阳性表达率变化趋势比较,差异有统计学意义(F=136.851,P=0.000),呈递增趋势。见图18、19。
2.2.7 TGF-β1腹腔和气管SM组6 h肺泡间隔TGF-β1蛋白阳性表达呈散在分布,24和48 h肺泡间隔TGF-β1蛋白阳性表达聚集成簇分布,72 h肺泡间隔TGF-β1蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔TGF-β1蛋白阳性表达呈零星分布(见图20)。5组不同时间的TGF-β1蛋白阳性表达率比较,采用重复测量数据的方差分析,结果:①腹腔和气管SM组不同时间点的TGF-β1蛋白阳性表达率比较,差异有统计学意义(F=403.720,P=0.000)。②腹腔SM组与其他4组的TGF-β1蛋白阳性表达率比较,差异有统计学意义(F=2 034.116,P=0.000)。③腹腔SM组与气管SM组的TGF-β1蛋白阳性表达率变化趋势比较,差异有统计学意义(F=189.081,P=0.000),呈递增趋势。见图21、22。

图1 大鼠肺泡间隔纤维分布(Masson染色×400)

图2 大鼠肺泡间隔MMP-2蛋白表达(×400)

图3 大鼠肺泡间隔MMP-2蛋白阳性表达率

图4 5组大鼠肺泡间隔MMP-2蛋白阳性表达率不同时间的变化趋势
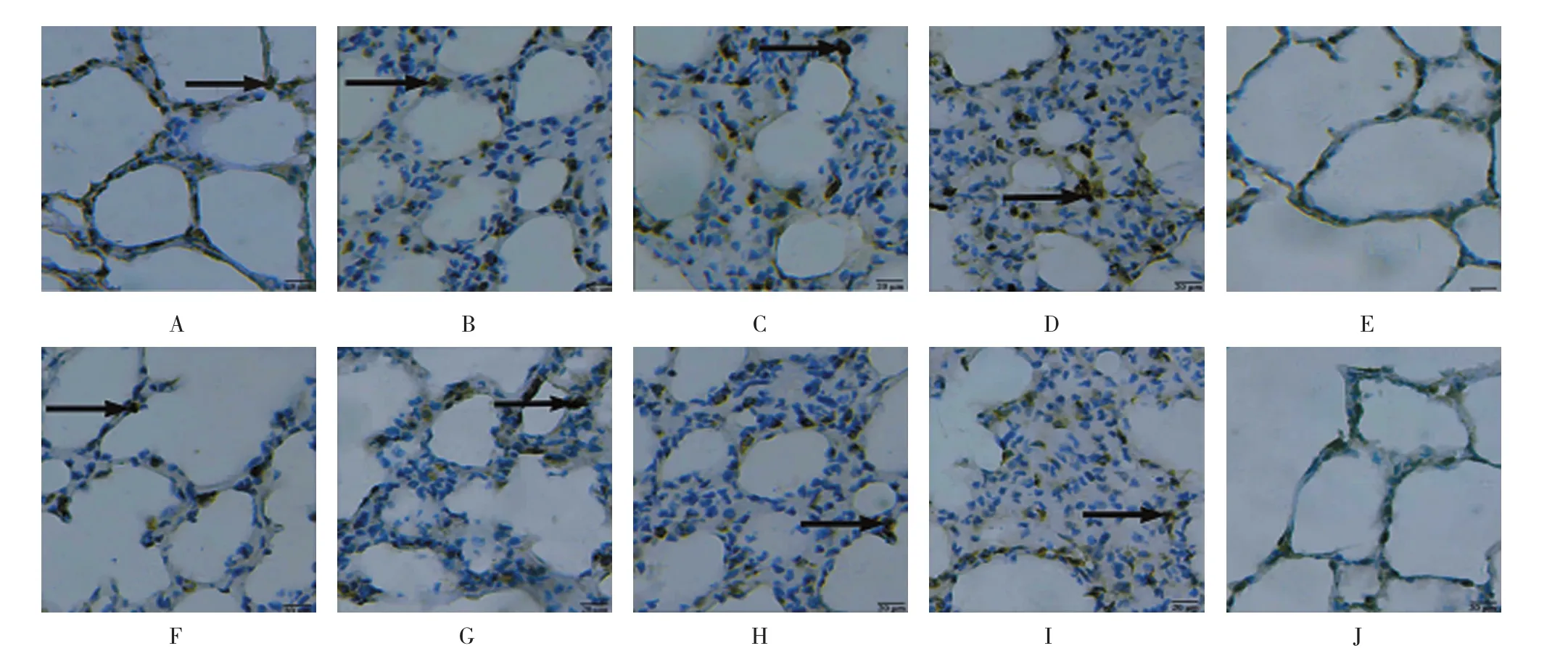
图5 大鼠肺泡间隔MMP-9蛋白表达(×400)

图6 大鼠肺泡间隔MMP-9蛋白阳性表达率

图7 5组大鼠肺泡间隔MMP-9蛋白阳性表达率不同时间的变化趋势
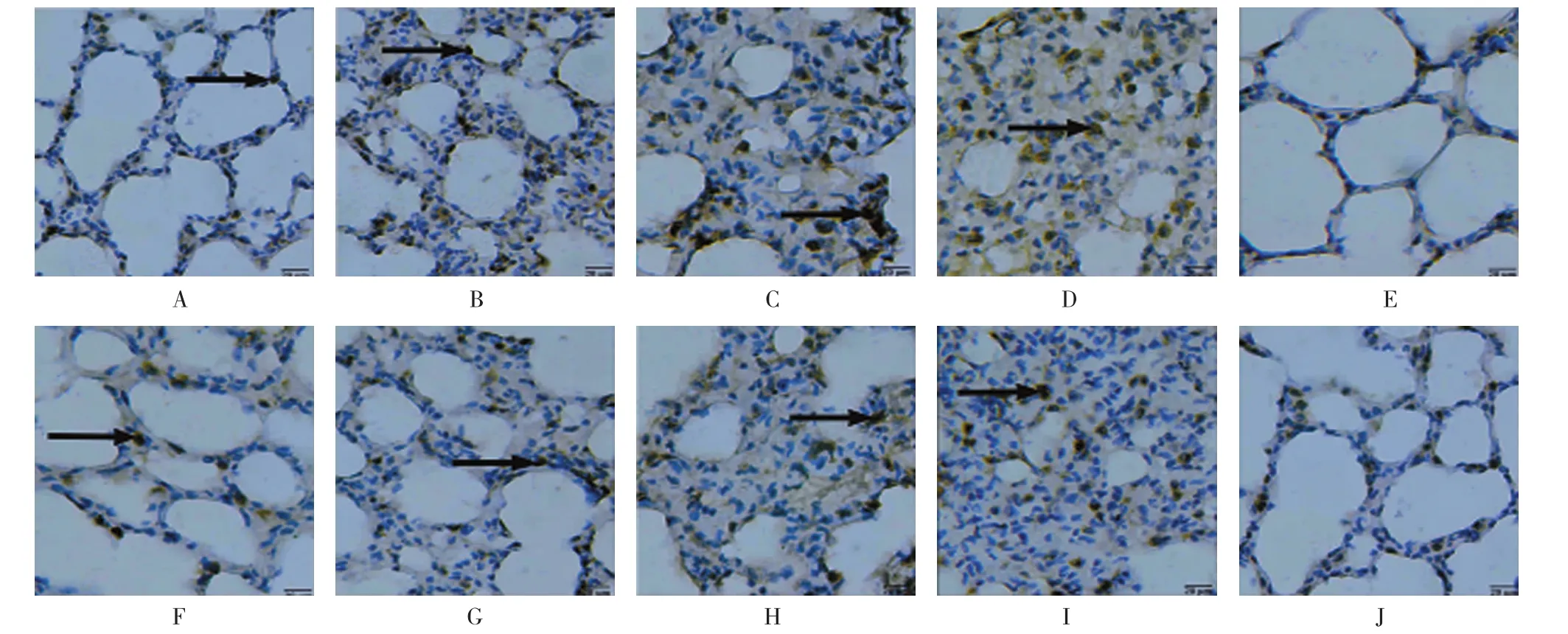
图8 大鼠肺泡间隔TIMP-1蛋白表达(×400)

图9 大鼠肺泡间隔TIMP-1蛋白阳性表达率

图10 5组大鼠肺泡间隔TIMP-1蛋白阳性表达率不同时间的变化趋势

图11 大鼠肺泡间隔TIMP-2蛋白表达(×400)

图12 大鼠肺泡间隔TIMP-2蛋白阳性表达率

图13 5组大鼠肺泡间隔TIMP-2蛋白阳性表达率不同时间的变化趋势

图14 大鼠肺泡间隔Ⅰ型胶原蛋白表达(×400)

图15 大鼠肺泡间隔Ⅰ型胶原蛋白阳性表达率

图16 5组大鼠肺泡间隔Ⅰ型胶原蛋白阳性表达率不同时间的变化趋势

图17 大鼠肺泡间隔Ⅲ胶原蛋白表达(×400)

图18 大鼠肺泡间隔Ⅲ型胶原蛋白阳性表达率

图19 5组大鼠肺泡间隔Ⅲ型胶原蛋白阳性表达率不同时间的变化趋势

图20 大鼠肺泡间隔TGF-β1蛋白表达(×400)

图21 大鼠肺泡间隔TGF-β1蛋白阳性表达率

图22 5组大鼠肺泡间隔TGF-β1蛋白阳性表达率不同时间的变化趋势

图23 大鼠肺泡间隔Smad7蛋白表达(×400)
2.2.8 Smad7腹腔和气管SM组6 h肺泡间隔Smad7蛋白阳性表达呈散在分布,24和48 h肺泡间隔Smad7蛋白阳性表达聚集成簇分布,72 h肺泡间隔Smad7蛋白阳性表达呈密集分布;气管丙二醇和正常对照组肺泡间隔Smad7阳性蛋白表达呈零星分布。见图23。5组不同时间的Smad7阳性蛋白表达率比较,采用重复测量数据的方差分析,结果:①腹腔和气管SM组不同时间点的Smad7蛋白阳性表达率比较,差异有统计学意义(F=1 165.499,P= 0.000);②腹腔SM组与其他4组的Smad7蛋白阳性表达率比较,差异有统计学意义(F=3 487.702,P=0.000);③腹腔SM组与气管SM组的Smad7蛋白阳性表达率变化趋势比较,差异有统计学意义(F=563.158,P=0.000),呈递增趋势。见图24、25。

图24 大鼠肺泡间隔Smad7蛋白阳性表达率

图25 5组大鼠肺泡间隔Smad7蛋白阳性表达率不同时间的变化趋势
3 讨论
肺纤维化的病理特点是肺泡持续性损伤和炎症,细胞外基质的反复破坏、修复、重构和胶原过度沉积[7]。基质金属蛋白酶(MMPs)能够降解细胞外基质,其中MMP-2,MMP-9是降解构成肺泡基膜主要成分Ⅳ型胶原的主要酶类。肺纤维化早期以肺泡炎症为主,肺组织内MMP-2和MMP-9活性增强;后期以纤维化为主,肺组织TIMP-1和TIMP-2表达则明显增加[8]。MMP-9和TIMP-1参与肺纤维化中肺组织的重构。肺间质成纤维细胞是纤维化早期产生MMP-2的主要细胞,MMP-2过度活化可能是肺基膜Ⅳ型胶原蛋白降解的主要原因,成为启动肺纤维化的重要机制。研究表明,Ⅳ型胶原和MMP-9与支气管上皮细胞的移行有关[9]。现已发现肺内Ⅰ型胶原的含量最为丰富,主要分布于支气管树和血管树的周围,Ⅲ型胶原主要见于肺泡间质内,包括肺泡壁、小叶间隔,是构成肺间质胶原的主要成分[10]。TGF-β1是目前认为的最强致纤维化因子之一,它可促进成纤维细胞的增殖和胶原蛋白的合成,是肺纤维化形成和发展的关键性细胞因子[11]。MMP-9可参与TGF-β1的激活,此激活过程需依赖细胞表面上的CD44[12]。另有学者发现,MMP-9对TGF-β1复合物的裂解作用无需CD44,可能与其他的细胞表面分子参与激活有关[13]。TIMP-1也可通过细胞因子网络引发TGF-β1代谢紊乱,促进肺纤维化[14]。Smad蛋白通路是TGF-β1信号转导的主要通路,Smad3、Smad4是该信号转导通路中的主要信号蛋白,Smad7是一种抑制性的信号蛋白,在肺纤维化发生发展过程中发挥重要的负性调控作用[15]。研究发现,SM可诱导肺脏炎症细胞浸润,触发MMPs/TIMPs和TGF-β/Smad的调节失衡,大量胶原蛋白肺内沉积,最终导致肺纤维化[16-18]。因此,复制SM经腹腔和气管致急性肺损伤动物模型,探索高剂量SM致肺纤维化的分子机制,对未来的靶向干预具有潜在的意义。
本研究发现,SM经腹腔和气管染毒大鼠72 h后,肺泡间隔被染成绿色的胶原纤维明显增多。腹腔组不同时间点的MMP-2、MMP-9、TIMP-1、TIMP-2蛋白阳性表达率与气管SM组比较升高。腹腔SM组的MMP-2、MMP-9、TIMP-1、TIMP-2蛋白阳性表达率与其他4组比较升高。腹腔SM组的Ⅰ型胶原、Ⅲ型胶原、TIMP-1、TIMP-2蛋白阳性表达率变化趋势与气管SM组比较,呈递增趋势。腹腔组不同时间点的Ⅰ型胶原、Ⅲ型胶原、TGF-β1、Smad7蛋白阳性表达率与气管SM组比较升高。腹腔SM组的Ⅰ型胶原、Ⅲ型胶原、TGF-β1、Smad7蛋白阳性表达率与其他4组比较升高。腹腔SM组的Ⅰ型胶原、Ⅲ型胶原、TGF-β1、Smad7蛋白阳性表达率变化趋势与气管SM组比较,呈递增趋势。结果提示,在高剂量SM致急性肺损伤的早期,肺纤维化指标可发生异常变化,并随损伤时间的延长而加重,且腹腔SM组更为明显。正常肺组织中仅有少量的MMP-2、MMP-9表达,但在SM诱导的肺炎症反应过程中,成纤维细胞、支气管上皮细胞、Ⅱ型肺泡上皮细胞及一些炎症细胞如巨噬细胞、中性粒细胞都可产生MMP-2和MMP-9,损伤肺泡基膜,启动肺纤维化的发生。TIMP-1和TIMP-2作为MMP-2和MMP-9的生理抑制剂,与MMP-2和MMP-9以共价键的形式结合形成酶原复合物而特异性抑制MMP-2和MMP-9的活性[19]。本研究提示,肺泡间隔MMP-2和MMP-9的蛋白表达增加,说明肺组织损伤以炎症反应为主。TIMP-1和TIMP-2的蛋白表达增加,可暗示为一种一过性生理补偿。本结果还揭示一种可能的“迁移或移行”机制,即MMP-9可促进单核细胞转化为肌成纤维细胞,并有利于肌成纤维细胞从血管向组织损伤处迁移。与此同时,还参与中性粒细胞跨基底膜移行[20-21]。肺血管内皮细胞和肺泡Ⅱ型上皮细胞是肺纤维化的主要靶细胞,间质细胞如巨噬细胞、肥大细胞参与其中,成纤维细胞和肌成纤维细胞为主要的效应细胞,TGF-β1则称为一种分子性“开关”[22]。c-Jun氨基末端激酶(c-Jun NH2-terminal kinases,JNK)信号通路能有效且特异地传递应答胞外的多种刺激信号。成纤维细胞中TGF-β1的激活需要Smad介导的JNK/AP等转录因子的活化来发挥作用,JNK则通过调控转录激活因子1(transcription activator-1,AP-1)来控制肺纤维化进程[23-24]。本研究显示,肺泡间隔TGF-β1和Ⅰ、Ⅲ型胶原蛋白表达增加,提示SM肺损伤早期会出现分子层面的肺纤维化指标变化。Smad7蛋白表达增加,则是触发对TGF-β1的一种负反馈机制[25-26]。TGF-β1的过度表达是一种病态反应(损伤或炎症),Smad7可通过对Ⅰ型受体的竞争性结合,抑制TGF-β1信号的转导和Smad2、3的活性[27-28]。笔者认为,在SM肺损伤的炎症反应阶段,损伤和炎症可触发MMP-2和MMP-9蛋白的高表达,继发TIMP-1和TIMP-2蛋白的代偿性高表达;TGF-β1和Ⅰ、Ⅲ型胶原蛋白的高表达,继发Smad7蛋白的代偿性高表达。这些病理和生理性反应的存在,促进了分子信号通路失调的再平衡。大鼠在经腹腔和气管SM LD50浓度相似的情况下,经腹腔途径肺纤维化指标与经气管比较升高,提示SM经腹腔途径更容易诱导肺纤维化。本动物模型的复制和分子机制的探讨,为SM诱导急性肺损伤的防治-抗纤维化研究提供可借鉴的靶标。
[1]LINDSAY C D,GENTILHOMME E,MATHIEU J D.The use of doxycycline as a protectant against sulphur mustard in HaCaT cells[J].J Appl Toxicol,2008,28(5):665-673.
[2]EMAD A,EMAD Y.Relationship between eosinophilia and levels of chemokines(CCL5 and CCL11)and IL-5 in bronchoalveolar lavage fluid of patients with mustard gas-induced pulmonary fibrosis[J].J Clin Immunol,2007,27(6):605-612.
[3]KHAZDAIR M R,BOSKABADY M H,GHORANI V.Respiratory effects of sulfur mustard exposure,similarities and differences with asthma and COPD[J].Inhal Toxicol,2015,27(14):731-744. [4]贝媛媛,朱双双,祝筱姬,等.芥子气经腹腔和气管致大鼠急性肺损伤炎性反应的比较研究[J].重庆医学,2016,45(26):3608-3610. [5]韩玮,朱双双,赵建,等.芥子气经腹腔和气管致大鼠急性肺损伤氧化应激反应的机制[J].国际呼吸杂志,2016,36(11):840-846.
[6]祝筱姬,朱双双,韩玮,等.芥子气经腹腔和气管致大鼠急性肺损伤细胞凋亡的变化[J].中国现代医学杂志,2016,26(15):11-21.
[7]JI Y,WANG T,WEI Z F,et al.Paeoniflorin,the main active constituent of Paeonia lactiflora roots,attenuates bleomycin-induced pulmonary fibrosis in mice by suppressing the synthesis of type I collagen.J Ethnopharmacol,2013,149(3):825-832.
[8]GUIGNABERT C,TAYSSE L,CALVET J H,et al.Effect of doxycyclineonsulfurmustard-inducedrespiratorylesionsin guinea pigs[J].Am J Physiol Lung Cell Mol Physiol,2005,289 (1):67-74.
[9]LEGRAND C,GILLES C,ZAHM J M,et al.Airway epithelial cell migration dynamics.MMP-9 role in cell-extracellular matrix remodeling[J].J Cell Biol,1999,46(2):517-529.
[10]LIU J Y,BRODY A R.Increased TGF-betal in the lungs of asbestos-exposed rats and mice:reduced expression in TNF-alpha receptorknockoutmice[J].J EnvironPatholToxicolOncol, 2001,20(2):97-108.
[11]WILSON M S,WYNN T A.Pulmonary fibrosis:pathogenesis, etiology and regulation[J].Mucosal Immunol,2009,2(2):103-121.
[12]YU Q,STAMENKOVIC I.Cell surface-localized matrix metalloproteinase-9 proteolytically activates TGF-beta and promotes tumor invasion and angiogenesis[J].Genes Dev,2000,14(2):163-176.
[13]LEE C G,HOMER R J,ZHU Z,et al.Interleukin-13 induces tissue fibrosis by selectively stimulating and activating transforming growth factor beta[J].J Exp Med,2001,194(6):809-821.
[14]KUWANO K,HAGIMOTO N,HARA N.Molecular mechanisms of pulmonary fibrosis and current treatment[J].Curr Mol Med, 2001,1(5):551-573.
[15]PETRIDOU S,MALTSEVA O,SPANAKIS S,et al.TGF-beta receptor expression and smad2 localization are cell density dependent in fibroblasts[J].Invest Ophthalmol Vis Sci,2000,41 (1):89-95.
[16]GHANE ZADEH F,MIRZAMANI M S,HALABIYAN R,et al. The effects of sulfur mustard on expression of TGF-βs variants in lung epithelial cell line[J].J Recept Signal Transduct Res, 2015,35(4):284-288.
[17]KIANI A,MOSTAFAIE A,SHIRAZI F H,et al.Serum profiles ofmatrixmetalloproteinasesandtheirtissueinhibitorsin long-term pulmonary complication induced by sulfur mustard: Sardasht-IranCohortStudy(SICS)[J].IntImmunopharmacol, 2013,17(3):964-967.
[18]ADELIPOUR M,IMANI FOOLADI A A,YAZDANI S,et al. Smad molecules expression pattern in human bronchial airway induced by sulfur mustard[J].Iran J Allergy Asthma Immunol, 2011,10(3):147-154.
[19]SHOHRATI M,HAJI HOSSEINI R,ESFANDIARI M A,et al. Serum matrix metalloproteinase levels in patients exposed to sulfur mustard[J].Iran Red Crescent Med J,2014,16(3):e15129. [20]SATO M,HIRAYAMA S,LARA-GUERRA H,et al.MMP-dependentmigrationofextrapulmonarymyofibroblastprogenitors contributing to posttransplant airway fibrosis in the lung[J].Am J Transplant,2009,9(5):1027-1036.
[21]ATKINSON J J,SENIOR R M.matrix metalloproteinase-9 in the lung[J].Am J Respir Cell Mol Biol,2003,28(1):12-24.
[22]AGHANOURI R,GHANEI M,ASLANI J,et al.Fibrogenic cytokine levels in bronchoalveolar lavage aspirates 15 years after exposure to sul fur mustard[J].Am J Physiol Lung Cell Mol Physiol,2004,287(6):1160-1164.
[23]MAO R,FAN Y,MOU Y,et al.TAK1 lysine 158 is required forTGF-β-inducedTRAF6-mediatedSmad-independent IKK/NF-κB and JNK/AP-1 activation[J].Cell Signal.2011,23 (1):222-227.
[24]EFERL R,HASSELBLATT P,RATH M,et al.Development of pulmonary fibrosis through a pathway involving the transcription factor Fra-2/AP-1[J].Proc Natl Acad Sci U S A,2008,105 (30):10525-10530.
[25]O'BEIRNE S L,WALSH S M,FABRE A,et al.CXCL9 regulates TGF-β1-induced epithelial to mesenchymal transition in human alveolar epithelial cells[J].J Immunol,2015,195(6): 2788-2796.
[26]CHEN Z,TAN W,ZHANG L,et al.Beneficial impact of bFGF antisense therapy in a rat model of fulmonary fibrosis[J].Sarcoidosis Vasc Diffuse Lung Dis,2015,32(1):22-31.
[27]WEN FQ,LIU X,KOBAYASHI T,et al.Interferon-gamma inhibits transforming growth factor-beta production in human airway epithelial cells by targeting Smads[J].Am J Respir Cell Mol Biol,2004,30(6):816-822.
[28]SONG J S,KANG C M,PARK C K,et al.Inhibitory effect of receptor for advanced glycation end products(RAGE)on the TGF-β-induced alveolar epithelial to mesenchymal transition[J]. Exp Mol Med,2011,43(9):517-524.
(张蕾 编辑)
Changes of pulmonary fibrosis indexes due to sulfur mustardinduced acute lung injury in rats via intraperitoneal and tracheal injection*
Wei Han1,Shuang-shuang Zhu2,Yuan-yuan Bei2,Jian Zhao3, Yu-xu Zhong3,Fei Liu4,Yu-ling Zhao4,Xiao-ji Zhu4
(1.Department of Medical Affairs,Jinan Military General Hospital,Jinan,Shandong 250001, China;2.Department of Postgraduate,Weifang Medical College,Weifang,Shandong 261042, China;3.Institute of Pharmacology and Toxicology,Chinese Academy of Military Medical Sciences,Beijing 100850,China;4.Department of Respiratory Medicine,the 89th Hospital of Chinese PLA,Weifang,Shandong 261021,China)
ObjectiveTo establish rat model of sulfur mustard(SM)-induced acute lung injury via intraperitoneal and tracheal injection,in order to compare the differences of pulmonary fibrosis indexes.MethodsA total of 136 male Sprague Dawley rats were randomly divided into the five groups,i.e.the control group with 8 rats and other four groups(intraperitoneal SM group,intraperitoneal propylene glycol group,tracheal SM group and tracheal propylene glycol group)with 32 rats in each group.The rats in the intraperitoneal SM group were intraperitoneally injected with 0.1 ml diluted SM(0.96 LD50=8 mg/kg),the rats in the tracheal SM group were intratracheallyinjected with 0.1 ml diluted SM(0.98 LD50=2 mg/kg),the rats in the intraperitoneal propylene glycol group and the tracheal propylene glycol group were injected with 0.1 ml propylene glycol through peritoneal cavity and trachea respectively;meanwhile the status quo was kept with the normal control group.SM-induced pulmonary fibrosis indexes were observed by Masson and immunohistochemical staining.ResultsLight microscopic observation confirmed that green-stained collagen fibers increased in the alveolar septa at 72nd h.Significantly higher positive expression rates of MMP-2,MMP-9,TIMP-1 and TIMP-2 by immunohistochemical staining in the alveolar septa were detected in the intraperitoneal SM groups compared with those in the tracheal SM groups at each period of time (P<0.05).The positive expression rates of typeⅠcollagen and typeⅢcollagen in the alveolar septa in the intraperitoneal SM groups were significantly increased compared with those in the tracheal SM group at each period of time(P<0.05).Significantly higher positive expression rates of TGF-β1and Smad7 in the alveolar septa were also observed in the intraperitoneal SM group compared with the tracheal SM group at each period of time(P<0.05).ConclusionsWhen LD50concentration of SM through intraperitoneal injection is similar to that through tracheal injection in rat,the indexes of pulmonary fibrosis are significantly increased after intraperitoneal injection compared with those after tracheal injection,suggesting that SM-induced pulmonary fibrosis can be more easily induced through intraperitoneal injection.
sulfur mustard;lung injury;pulmonary fibrosis;rat
R-332;R563.8
:A
10.3969/j.issn.1005-8982.2017.02.001
1005-8982(2017)02-0001-12
2016-05-03
国家“重大新药创制”科技重大专项(No:2013ZX09J13103-01B)
祝筱姬,Email:xiaojizhu@163.com
