线粒体介导产生的活性氧在血管紧张素Ⅱ诱导的肾脏损害中的作用*
2017-02-10冯苗苗刘素晓王小晓崔琳谢世阳沈思朱明军王幼平
冯苗苗,刘素晓,王小晓,崔琳,谢世阳,沈思,朱明军,王幼平
(1.河南中医学院中西医结合临床学科,河南郑州450008;2.河南中医学院第一附属医院,河南郑州450000)
论著
线粒体介导产生的活性氧在血管紧张素Ⅱ诱导的肾脏损害中的作用*
冯苗苗1,刘素晓2,王小晓2,崔琳2,谢世阳2,沈思2,朱明军2,王幼平2
(1.河南中医学院中西医结合临床学科,河南郑州450008;2.河南中医学院第一附属医院,河南郑州450000)
目的利用特异性的线粒体活性氧清除剂mitoTEMPO,探讨线粒体介导产生的活性氧(ROS)在血管紧张素Ⅱ(AngⅡ)诱发的肾脏损害中的作用。方法通过miniosmotic pump对小鼠皮下灌注AngⅡ复制AngⅡ依赖型高血压模型,而对照组小鼠仅皮下灌注生理盐水。AngⅡ依赖型高血压小鼠分为AngⅡ组和AngⅡ+mitoTEMPO组,分别于皮下注射溶媒和mitoTEMPO。实验处理4周后,分别检测小鼠尾动脉收缩压、尿8-异构前列腺素及24 h白蛋白排泄量、肌酐清除率和肾脏中线粒体所产生ROS含量的变化,并同时对肾脏组织病理学的改变进行分析。结果与对照组比较,AngⅡ组小鼠血压升高、尿8-异构前列腺素和白蛋白排泄量增加、肌酐清除率下降,肾脏中肾小球硬化指数、肾小管间质损害程度均增加,并伴有线粒体介导产生ROS水平的升高(P<0.05)。除血压外,mitoTEMPO能抑制上述病理性变化,从而减轻AngⅡ所诱发的肾脏损害(P<0.05)。结论在AngⅡ诱发的高血压过程中,特异性的线粒体活性氧清除剂mitoTEMPO抑制该过程诱发的肾脏损害,并同时伴有肾脏线粒体ROS产生的下降。因此,上述研究结果提示线粒体介导产生的ROS能够促进AngⅡ诱发的肾脏损害。
血管紧张素Ⅱ;高血压;肾脏损害;线粒体;活性氧
高血压是除糖尿病外导致慢性肾脏病(chronic kidney disease)的主要原因之一[1-2]。大量临床观察及动物实验显示,线粒体功能与慢性肾脏病的发生和发展密切相关[3]。线粒体除主要通过氧化磷酸化合成产生ATP外,其功能还涉及细胞增殖和活性氧(reactive oxygen species,ROS)的产生等多种生理及病理过程[3]。因此,当线粒体功能下降时,除ATP合成减少外,通常表现为ROS产生增多,从而造成组织器官的损害。大量研究已发现和证实,NADPH氧化酶介导产生的ROS促进高血压诱发的肾脏损害[4-5]。本研究拟通过血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)诱导的高血压小鼠模型探讨特异性的线粒体ROS清除剂mitoTEMPO对肾脏功能以及形态学发生损伤时的影响,从而阐明线粒体介导产生的ROS对AngⅡ诱发的肾脏功能损害的影响作用。
1 材料与方法
1.1 动物
8~9周龄的SPF级雄性C57BL/6小鼠购自北京维通利华实验动物有限公司。动物许可证号为:SCXK(京)2015-0011。
1.2 试剂
线粒体ROS清除剂mitoTEMPO购自美国EnzoLife Sciences公司,AngⅡ购自美国Sigma公司,ELISA尿蛋白检测试剂盒购自美国Exocell公司,改良的Jaffe肌酐检测试剂盒购自美国BioAssay System公司,尿8-异构前列腺素检测试剂盒购自美国Cayman Chemical公司。
1.3 造模及分组
经1周的适应性饲养以后,对小鼠行皮下注射甲苯噻嗪(4 mg/kg)和氯胺酮(80 mg/kg)混合麻醉剂进行麻醉,于小鼠颈背部皮下包埋miniosmotic pump(Alzetmodel 1004,Durect Corp,Cupertino,CA,美国),分别皮下连续灌注生理盐水或AngⅡ[1μg/(kg·min)],持续4周。本实验小鼠分为以下3组:对照组,经miniosmotic pump皮下灌注生理盐水;AngⅡ组;AngⅡ+mitoTEMPO组。第2和第3组小鼠,则经miniosmotic pump皮下灌注Ang II诱发高血压及肾脏损害。另外,针对第2和第3组小鼠,于皮下包埋含AngⅡ的miniosmotic pump时,包埋另1个miniosmotic pump,经该miniosmotic pump皮下注射mitoTEMPO的溶媒或mitoTEMPO[0.7 mg/(kg·d)]。mitoTEMPO溶于生理盐水。手术后,连续3 d对所有小鼠注射青霉素钠盐。本实验对各组小鼠的观察周期为4周。
1.4 动脉收缩压的测定
本实验依据Tail-cuff体积描记法的原理测定小鼠清醒状态时的尾动脉收缩压。手术前及手术后各周,取各组小鼠,于30℃温箱中加热10 min,用固定器对其固定,等待小鼠安静后,利用血压测定仪(购自美国Visitech System公司,型号为BP-2000)对尾动脉收缩压连续测定5次,取5次的平均值作为小鼠的动脉收缩压值。本实验安排上午10:00~12:00为测定时间。
1.5 尿液及血浆分析
实验处理后第26天,分别取各组小鼠放于代谢笼中,待其稳定后,收集24 h尿液,并称小鼠体重。经皮下注射甲苯噻嗪(4 mg/kg)和氯胺酮(80 mg/kg)麻醉小鼠后,于腹主动脉采集血样,4℃、10 000 r/min条件下离心10 min,然后收集血浆置于-80℃冰箱保存。分别利用ELISA试剂盒检测尿白蛋白,特异性的8-异构前列腺素试剂盒检测尿8-异构前列腺素,改良的Jaffe肌酐检测试剂盒测定尿液以及血浆中的肌酐浓度。
1.6 肾脏组织病理学分析
摘取小鼠右肾,称重后,用4%的多聚甲醛进行固定,石蜡包埋组织切片。采用过碘酸-雪夫反应(PAS)与Masson三色法对4μm厚的组织切片进行染色。为确保实验结果的客观性,由一位不知道实验设计安排的病理学技术人员,根据笔者已经发表的相关方法[6-7],对染色后的切片进行肾小球硬化程度以及肾小管间质损伤程度的分析评估。依据肾小球产生纤维样硬化的范围和肾小管的肥厚、扩张与间质纤维化程度以及炎症细胞的浸润程度等来对结果进行半定量分析。
1.7 免疫组织化学染色
F4/80作为单核/巨噬细胞的标记物,本实验利用卵白素-生物素-酶复合物(ABC)染色法对其进行染色。常规方法处理石蜡包埋的组织切片,然后加入一抗F4/80单克隆抗体(大鼠抗小鼠),于4℃孵育12 h,清洗切片后,加入生物素化二抗即抗大鼠IgG(稀释比例为1∶400),于室温孵育1 h,然后加入ABC复合物,继续于室温下孵育45 min,最后添加二氨基联苯胺(DAB)显色液显色,于显微镜下观察染色结果。采用加入正常大鼠血清或者不加一抗的方法作为本实验的阴性对照。依据相关文献[8],于×400倍镜下对F4/80呈阳性细胞的数量进行统计,每张切片随机观察15个视野,最后取其平均值来表示单核/巨噬细胞的数目。
1.8 肾组织线粒体ROS测定
实验结束后,收取新鲜肾组织,按说明利用试剂盒进行线粒体分离,并通过Bradford法进行蛋白定量。然后,将分离获得的线粒体重新悬浮于HEPES缓冲液(10mmol/L HEPES,140 mmol/L氯化钠NaCl,5 mmol/L氯化钾KCl,1.2 mmol/L磷酸一氢钠Na2HPO4,5 mmol/L碳酸氢钠NaHCO3,6 mmol/L葡萄糖,1 mmol/L氯化镁MgCl2,2 mmol/L氯化钙CaCl2,pH 7.4)中,取10μl样本溶液加入96孔培养板中,同时加入2'-,7'-dichlorfluoresceindiacetate(DCFHDA,最终浓度为10μmol/L),然后在37℃条件下避光孵育30 min,最后,通过多功能酶标仪于激发波长485 nm和吸收波长520 nm的条件下,进行荧光强度的测定。数据以每毫克蛋白所具有的荧光强度表示。
1.9 统计学方法
采用Prism 5.0统计软件进行统计学分析,实验数据以均数±标准差(±s)表示。本实验各组小鼠血压间的比较用两因素方差分析法(Two-way ANOVA,Bonferroni检验)。除血压外,其他指标多组间比较用单因素方差分析(One-way ANOVA,Bonferroni检验)。所有分析均用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血压的变化
如图1所示,手术前各组小鼠间的基础血压差异无统计学意义。手术后各周,对照组小鼠的血压平稳,没有出现明显改变。然而,AngⅡ组和AngⅡ+ mitoTEMPO组小鼠于手术后第1周开始较对照组小鼠血压升高,差异有统计学意义(130±9)mmHg vs(103±6)mmHg,(t=7.136,P=0.011);(137±7)mmHg vs(103±6)mmHg,(t=8.987,P=0.009),且到手术后3、4周时达到高峰,但是,AngⅡ组和AngⅡ+mito TEMPO组小鼠血压之间差异无统计学意义[术后4周:(156±9)mmHg vs(150±11)mmHg,t=1.535,P=0.726]。
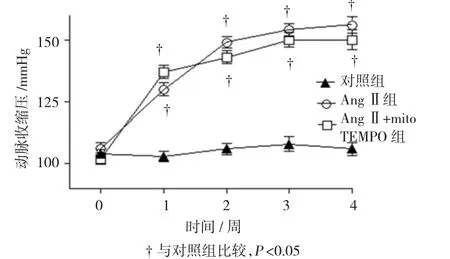
图1 各组小鼠血压比较
2.2 各组小鼠尿白蛋白、8-异构前列腺素排泄量及肌酐清除率的变化
如图2所示,与对照组比较,AngⅡ组小鼠24 h尿白蛋白排泄量[(4.19±2.01)μg/24 h vs(54.63± 8.39)μg/24 h,t=12.970,P=0.006],以及尿8-异构前列腺素的排泄量均增加[(0.3±0.09)ng/24 h vs(2.59±0.31)ng/24 h,t=6.455,P=0.012],但肌酐清除率表现出下降的现象[(352.10±51.21)ml/24 h vs(102.90±26.45)ml/24 h,t=10.900,P=0.007]。特异性的线粒体ROS清除剂mitoTEMPO能够抑制AngⅡ所诱发的上述变化,其差异有统计学意义。尿白蛋白排泄量:[(54.63±8.39)μg/24 h vs(26.06± 9.19)μg/24 h,t=7.347,P=0.011];肌酐清除率:[(102.90±26.45)ml/24 h vs(210.30±46.60)ml/24 h,t=4.697,P=0.017];尿8-异构前列腺素的排泄量:[(2.59±0.31)ng/24h vs(1.17±0.29)ng/24 h,t=4.015,P=0.020]。
2.3 各组小鼠肾脏组织病理学的变化
如图3所示,AngⅡ组小鼠肾脏中肾小球出现纤维样硬化现象,与对照组比较,其纤维样硬化指数增高(0.08±0.06 vs 1.78±0.30,t=5.748,P=0.013),而经过mitoTEMPO处理后,纤维样硬化现象受到抑制,从而减轻AngⅡ诱发的肾小球纤维化(1.78±0.30 vs 0.72±0.20,t=3.584,P=0.022)。另外,如图4所示,与对照组比较,AngⅡ组小鼠出现明显的肾小管间质纤维化、炎症细胞的侵润以及肾小管的肥厚与扩张等现象,肾小管的间质损伤程度增高(0.18± 0.06 vs 3.20±0.37,t=8.169,P=0.009)。而经过mitoTEMPO处理后,上述变化受到抑制,从而减轻AngⅡ诱导的肾小管间质损伤现象(3.20±0.37 vs 1.46±0.25,t=4.707,P=0.021)。
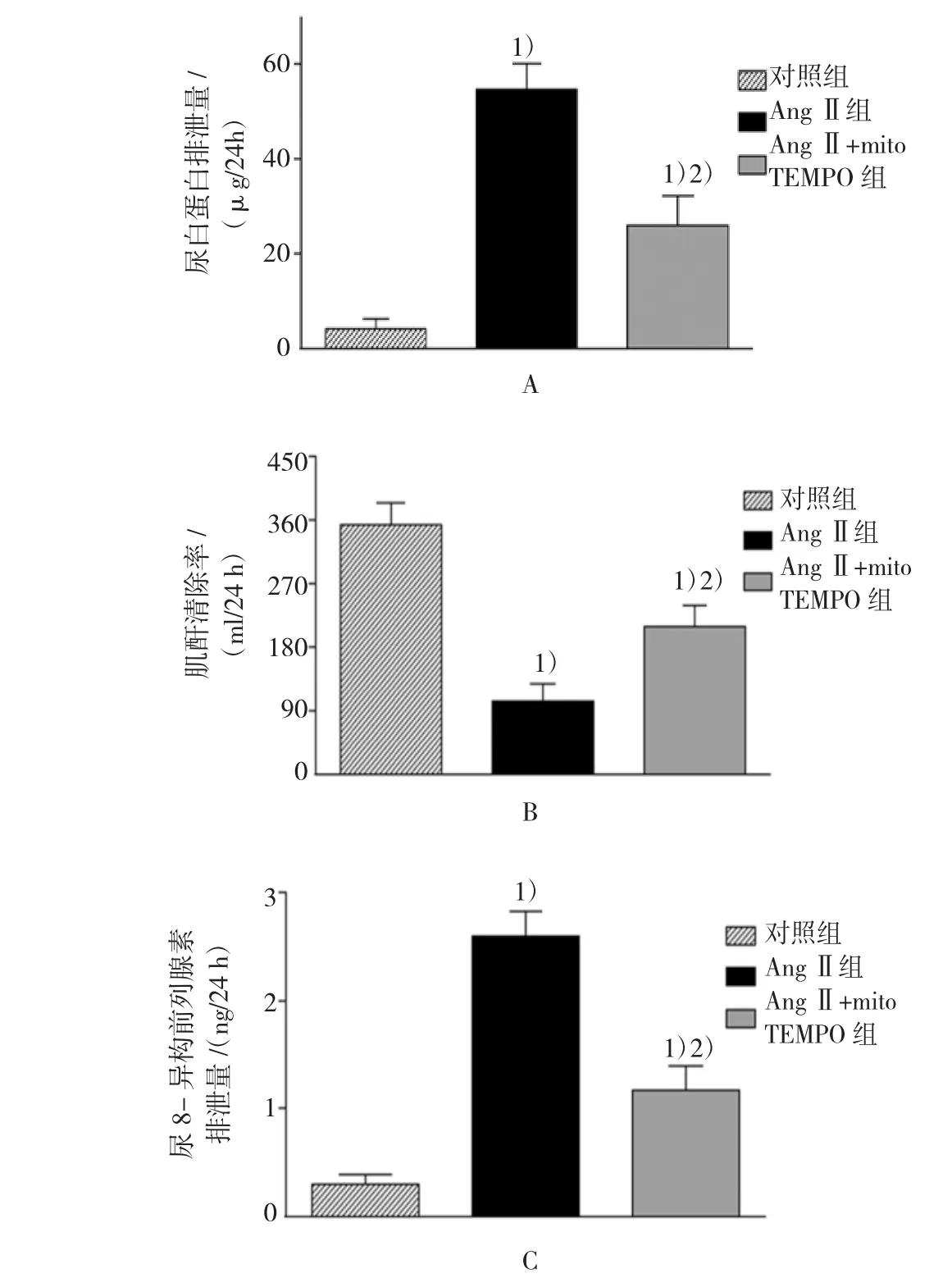
图2 各组小鼠尿白蛋白排泄量(A)、肌酐清除率(B)及尿8-异构前列腺素排泄量(C)的变化
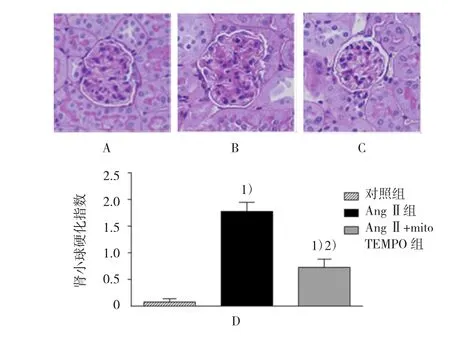
图3 各组小鼠肾脏肾小球硬化程度
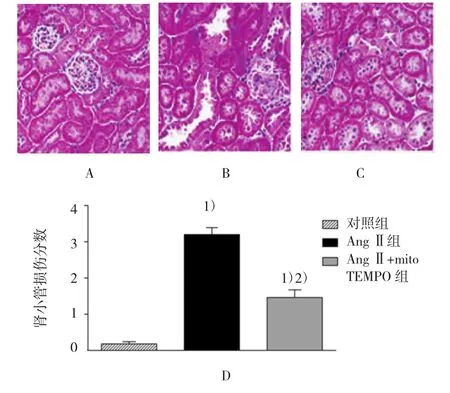
图4 各组小鼠肾脏肾小管间质损害程度
2.4 各组小鼠肾脏免疫组织化学染色的变化
如图5所示,与对照组比较,在AngⅡ组小鼠的肾脏中F4/80呈阳性的单核/巨噬细胞数量增加[(7.80±2.29)个/mm2vs(68.80±10.34)个/mm2,t= 6.391,P=0.012],说明以单核/巨噬细胞的浸润为主要特征的肾脏炎症反应加重,而经过mitoTEMPO处理后,上述病理变化受到抑制,从而减轻和缓解AngⅡ所诱发的肾脏炎症反应[(68.80±10.34)个/mm2vs(29.40±4.95)个/mm2,t=4.128,P=0.023]。
2.5 各组小鼠肾脏线粒体介导所产生ROS的变化
如图6所示,与对照组比较,在AngⅡ组小鼠肾脏,线粒体介导所产生的ROS增加[(20.67±4.76)灰度/mg蛋白vs(55.83±9.45)灰度/mg蛋白,t= 8.350,P=0.009],mitoTEMPO处理抑制该病理变化,从而阻止在AngⅡ刺激下线粒体介导产生ROS [(55.83±9.45)灰度/mg蛋白vs(26.00±6.89)灰度/mg蛋白,t=7.084,P=0.011]。
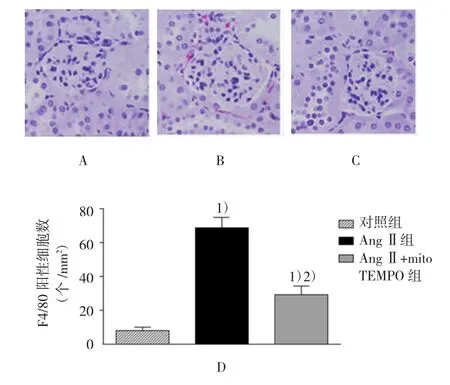
图5 各组小鼠肾脏F4/80呈阳性的单核/巨噬细胞的数量比较
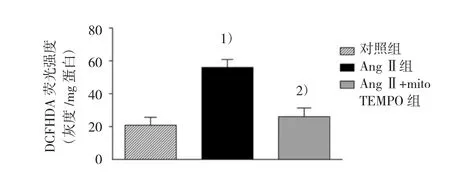
图6 各组小鼠肾脏线粒体介导所产生活性氧的变化
3 讨论
本实验研究结果表明,通过皮下注射AngⅡ诱发的高血压能够造成肾脏功能及病理学损伤,而该损伤主要表现在8-异构前列腺素与尿白蛋白排泄量的增加、肌酐清除率的下降、肾组织线粒体ROS产生的增多,以及包括肾小管肥厚、扩张在内的肾小管间质损伤与肾小球硬化等方面。而由AngⅡ诱发的上述所有肾脏损害均被特异性的线粒体ROS清除剂mitoTEMPO抑制,该研究结果表明线粒体介导产生的ROS能够促进AngⅡ所诱发的肾脏损害。
造成肾脏功能损伤的机制之一是由于高血压发生及发展过程中的血压升高[9]。通过对小鼠尾动脉收缩压的测定分析结果说明在小鼠中通过皮下注射AngⅡ可诱发高血压,而特异性的线粒体ROS清除剂mitoTEMPO可以缓解和抑制高血压诱发的肾脏损害,然而,线粒体ROS清除剂mitoTEMPO并不影响皮下注射AngⅡ诱发的高血压。因此,笔者推测,在由高血压引起的肾脏损伤过程中,特异性的线粒体ROS清除剂mitoTEMPO介导的肾脏保护作用,主要是通过mitoTEMPO对线粒体所产生ROS的清除作用而不是对血压的影响作用。本实验结果表明在皮下注射AngⅡ诱发的高血压过程中,线粒体ROS清除剂mitoTEMPO表现出的肾脏保护作用并不是通过降低血压来实现的。
在正常生理状态下,线粒体的主要功能为通过氧化磷酸化产生能量,从而参与细胞的能量代谢,同时线粒体还参与对氧自由基和钙离子介导的信息传递,以及对细胞衰老的调控作用,其中包括对细胞凋亡的调节作用[3,10]。当线粒体功能下降时,通常表现为ROS增多,从而造成组织器官的损害。因此,在病理状态下,除NADPH氧化酶、黄嘌呤氧化酶和非耦联的一氧化氮合成酶外,线粒体是ROS的重要来源,并且大量研究证实mitoTEMPO是特异性的线粒体产生的ROS清除剂[11-12]。近年来,除线粒体外,其他ROS产生酶即NADPH氧化酶和非耦联的一氧化氮合成酶在促进高血压及其并发症的发生和发展中的作用受到了广泛深入的研究[13]。目前,随着对高血压发病机制研究的进展,有关线粒体功能及其所产生的ROS在该疾病中的作用逐渐受到人们的关注和研究。
目前,人们还没有完全明确由高血压而引起的肾脏功能损伤的具体机制。但是,已有相关报道证实氧化应激反应在该过程中发挥促进作用[4-5]。在病理状态下,大量的ROS可氧化包括细胞膜和DNA在内的多种细胞成分,从而造成机体组织器官的损伤。8-异构前列腺素作为氧化应激产物之一,目前通常被用来作为测定对象来确定氧化应激程度,以测定结果来反映组织器官内ROS的水平。本实验结果表明,通过皮下注射AngⅡ诱发肾脏损害时,尿8-异构前列腺素的排泄量增加,从而间接反映出肾脏内氧自由基水平的增高。另外,笔者进一步发现和证实在AngⅡ诱发的高血压过程中,肾脏组织内线粒体介导产生的ROS增加。然而,经过特异性的线粒体ROS清除剂mitoTEMPO处理后,AngⅡ导致的肾脏损害受到抑制。因此,根据本实验的研究结果,在AngⅡ诱发的高血压过程中,线粒体介导产生的ROS对其诱导的肾脏损害具有促进作用。
本研究证实AngⅡ可以诱发肾脏损害,而在此过程中线粒体介导产生的ROS发挥着非常重要的作用。在AngⅡ所致高血压过程中,特异性的线粒体ROS清除剂mitoTEMPO通过抑制线粒体产生的氧自由基及其所介导的组织器官损害而实现其肾脏保护的作用。因此,在临床中,通过一些药理学方法改善线粒体功能,从而减少线粒体ROS的产生,或许可以作为防治高血压,以及由高血压造成的肾脏损伤的途径之一。
[1]JHA V,GARCIA-GARCIA G,ISEKI K,et al.Chronic kidney disease:global dimension and perspectives[J].Lancet,2013,382 (9888):260-272.
[2]ROSTAND S G,KIRK K A,RUTSKY E A,et al.Racial differences in the incidence of treatment for end stage renal disease[J]. N Engl J Med,1982,306(21):1276-1279.
[3]CHE R,YUAN Y,HUANG S,et al.Mitochondrial dysfunction in the pathophysiology of renal disease[J].Am J Physiol,2014, 306(4):F367-F378.
[4]JENNINGS B L,ANDERSON L J,ESTES A M,et al.Involvement of cytochrome P-450 1B1 in renal dysfunction,injury,and inflammation associated with angiotensin II-induced hypertension in rats[J].Am J Physiol,2012,302(4):F408-F420.
[5]MATTACERASO G,SIMEOLI R,RUSSO R,et al.N-Palmitoylethanolamide protects the kidney from hypertensive injury in spontaneously hypertensive rats via inhibition of oxidative stress[J]. Pharmacol Res,2013,76:67-76.
[6]WANG Y,WANG D H.Aggravated renal inflammatory responses in TRPV1 gene knockout mice subjected to DOAC-salt hypertension[J].Am J Physiol,2009,297(6):F1550-F1559.
[7]WANGY,ZHUM,XUH,etal.Roleofthemonocyte chemoattractantprotein-1/C-Cchemokinereceptor2signaling pathway in transient receptor potential vanilloid type 1 ablation-induced renal injury in salt-sensitive hypertension[J].ExpBiol Med,2015,240(9):1223-1234.
[8]WANG Y,WANG D H.Role of substance P in renal injury during DOCA-salt hypertension[J].Endocrinology,2012,153(12): 5972-5979.
[9]POLICHNOWSKI A J,LU L,COWLEY A W.Renal injury in angiotensinⅡ+L-NAME-induced hypertensive rats is independent of elevated blood pressure[J].Am J Physiol,2011,300(4): F1008-F1016.
[10]WALLACE D C.Mitochondrial diseases in man and mouse[J]. Science,1999,283(5407):1482-1488.
[11]JAFFER O A,CARTER A B,SANDERS P N,et al.Mitochondrial-targeted antioxidant therapy decreases transforming growth factor-β-mediatedcollagenproductioninamurineasthma model[J].Am J Respir Cell Mol Biol,2015,52(1):106-115.
[12]SIMS C R,MACMILLAN-CROW L A,MAYEUX P R.Targeting mitochondrialoxidants may facilitate recovery of renal function during infant sepsis[J].Clin Pharmacol Ther,2014,96(6):662-664.
[13]WESELER A R,BAST A.Oxidative stress and vascular function:implications for pharmacologic treatments[J].CurrHypertens Rep,2010,12(3):154-161.
(张蕾 编辑)
Role of mitochondrial reactive oxygen species in angiotensinⅡ-induced renal injury*
Miao-miao Feng1,Su-xiao Liu2,Xiao-xiao Wang2,Lin Cui2,Shi-yang Xie2, Si Shen2,Ming-jun Zhu2,You-ping Wang2
(1.Clinical Department of Integrated Traditional Chinese and Western Medicine,Henan University of Traditional Chinese Medicine,Zhengzhou,Henan 450008,China;2.The First Affiliated Hospital, Henan University of Traditional Chinese Medicine,Zhengzhou,Henan 450000,China)
ObjectiveTo clarify the role of mitochondrial reactive oxygen species(ROS)in angiotensinⅡ(AngⅡ)-induced renal injury by use of a specific scavenger of mitochondrial ROS,mitoTEMPO.MethodsThe mouse model of AngⅡ-dependent hypertension was induced with infusion of AngⅡvia subcutaneous miniosmotic pump, and the sham mice were given with normal saline.The AngⅡ-dependent hypertensive mice were divided into control(AngⅡ)group and experimental(AngⅡ+mitoTEMPO)group,which were subcutaneously administered with solvent and mitoTEMPO,respectively.Tail-cuff systolic blood pressure,and urinary excretion of 8-isoprostane and albumin,creatinine clearance,and the levels of mitochondrial ROS in the kidneys were assayed,and pathological changes of renal tissues were analyzed after 4 weeks of treatment.ResultsCompared with the shammice,AngⅡinfusion led to increased systolic blood pressure and urinary excretion of 8-isoprostane and albumin, decreased creatinine clearance,and enhanced glomerulosclerosis index and renal tubulointerstitial injury(P<0.05). The results were accompanied by the enhanced mitochondrial ROS production in the kidneys(P<0.05).However,the treatment with mitoTEMPO alleviated all the above changes except for blood pressure,leading to renal protection(P<0.05).ConclusionsTreatment with a specific scavenger of mitochondrial ROS,mitoTEMPO,can inhibit renal injury during AngⅡ-dependent hypertension,which is associated with the decreased mitochondrial ROS production in the kidneys.Thus,the results suggest that mitochondrial ROS can promote AngⅡ-induced renal injury.
angiotensin II;hypertension;renal injury;mitochondria;reactive oxygen species
R544.1
:A
10.3969/j.issn.1005-8982.2017.02.002
1005-8982(2017)02-0013-06
2016-06-08
国家自然科学基金(No:81170243);河南省科技创新杰出人才项目(No:124200510007);河南省科技攻关计划项目(No:162102410048)
王幼平,Tel:0371-66248345;E-mail:wangyp8@163.com
