牛奶蛋白过敏致婴儿嗜酸细胞性胃肠炎24例临床分析
2017-02-10万盛华李香莲张双红杨文萍万宏罗丽娟刘岚刘云
万盛华,李香莲,张双红,杨文萍,万宏,罗丽娟,刘岚,刘云
(江西省儿童医院 消化科,江西 南昌 330006)
牛奶蛋白过敏致婴儿嗜酸细胞性胃肠炎24例临床分析
万盛华,李香莲,张双红,杨文萍,万宏,罗丽娟,刘岚,刘云
(江西省儿童医院 消化科,江西 南昌 330006)
目的研究牛奶蛋白过敏(CMPA)致婴儿嗜酸细胞性胃肠炎(EG)的临床特征、治疗及预后,以提高CMPA致婴儿EG的诊断及治疗水平。方法以该院2010年6月-2014年1月住院诊治的24例CMPA引起的婴儿EG患儿为研究对象,回顾分析CMPA致婴儿EG的临床表现、内镜下特点、组织病理学改变、治疗及预后。结果呕吐24例(100.00%),阵发性哭吵24例(100.00%),腹胀24例(100.00%),呕血23例(95.83%),便血1例(4.17%),伴湿疹17例(70.83%),轻度-中度贫血21例(87.50%),重度贫血1例(4.17%),其中外周血嗜酸性粒细胞(Eos)升高19例(79.17%),血清免疫球蛋白E(IgE)升高8例(33.33%),血清幽门螺杆菌抗体检测阳性4例(16.67%);食物过敏原特异性IgE抗体检测对CMPA 3例(12.50%),镜下表现胃、十二指肠黏膜充血、水肿、糜烂和溃疡,其中胃炎24例(100.00%),十二指肠球炎5例(20.83%),十二指肠球部溃疡1例(4.17%),24例组织病理提示胃和/或十二指肠球部有Eos浸润[>20个/HPF(每高倍视野)],均伴有肥大细胞浸润;所有患儿经制酸、保护胃肠黏膜和牛奶蛋白回避等治疗取得满意疗效,24例患儿经口服普通配方牛奶激发试验证实CMPA,其中3例患者8~12周后复查胃镜示胃、十二指肠黏膜光滑,Eos均<5个/HPF,肥大细胞均<8个/HPF。结论CMPA致婴儿EG的临床表现和内镜下表现均无特异性,胃肠黏膜组织中Eos异常浸润且同时均伴有肥大细胞浸润;黏膜型不需要使用糖皮质激素,牛奶蛋白回避等治疗可取得满意疗效,但明确诊断需依靠活组织病理检查及Eos计数,并结合牛奶蛋白回避和牛奶蛋白激发试验进一步确诊,但激发试验应至少观察患儿10 d,并仔细记录症状,以免漏诊迟发型CMPA。
婴儿;牛奶蛋白过敏;嗜酸细胞性胃肠炎;内镜;组织病理学
嗜酸细胞性胃肠炎(eosinophilic gastroenteritis,EG)是以胃肠道组织中嗜酸细胞性异常浸润为特征的罕见胃肠道疾病,病变可累及从食管到直肠的全胃肠道壁各层,临床表现多样,但无特异性,国内病例较少,且报道的病例特点不一,易误诊误治[1]。为了提高对牛奶蛋白过敏(cow’s milk protein allergy,CMPA)致婴儿EG的认识,早期诊治,缩短病程,减少并发症,回顾分析我院2010年6月-2014年1月诊治的24例CMPA致婴儿EG。现报道如下:
1 资料与方法
1.1 一般资料
共24例婴儿EG。其中,男16例,女8例,男∶女为2∶1,年龄1.3~7.0个月,平均(3.1±1.2)个月,≤6个月20例,6~7个月4例,病程20 d~6个月。主要表现为反复呕吐、阵发性哭吵、呕血和便血等,其中呕吐24例(100.00%),阵发性哭吵24例(100.00%),腹胀24例(100.00%),呕血23例(95.83%),便血1例(4.17%),伴湿疹17例(70.83%),牛奶喂养24例(100.00%),入院时手指采血处无出血不止,父母有荨麻疹、过敏性鼻炎和哮喘等过敏性疾病史7例(29.17%)。
1.2 诊断标准
①有胃肠道症状;②食管至结肠消化道活组织检查有1个或者1个以上的部位嗜酸性粒细胞(eosinophils, Eos)浸润,或者特征性的影像学发现,并有外周Eos升高;③无消化道外其他组织的Eos浸润,且无寄生虫感染[2],本研究中24例EG患儿均符合以上诊断标准。
1.3 治疗方法及随访
24例患儿经制酸,保护胃黏膜,同时回避普通配方奶,予深度水解蛋白奶或氨基酸配方奶喂养,有幽门螺杆菌感染者抗幽门螺杆菌治疗。出院后继续服用深度水解蛋白奶或氨基酸配方奶,所有患儿开始坚持每1或2周门诊随访1次,10例患儿6~8周后经口服牛奶开放式激发试验[3]。激发试验时开始将1滴牛奶滴在患儿嘴唇;激发量逐渐增加为0.5、1.0、3.0、10.0、30.0、50.0、100.0和200.0 ml。每次增量间隔时间应根据病史或怀疑的过敏类型来确定,一般为20~30 min。激发过程中监测并记录相关症状,当激发试验诱发出症状,即可确诊牛奶过敏。若未能诱发出症状,指导家长离院后继续观察患儿表现至少2周,并仔细记录症状,以免漏诊迟发型CMPA。
2 结果
2.1 实验室检查结果
轻度-中度贫血21例(87.50%),重度贫血1例(4.17%),血小板计数均正常,Eos升高19例(79.17%),其中Eos比例为3.50%~10.80%,血清免疫球蛋白E(immunoglobulin E,IgE)升高8例(33.33%);血清免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(immunoglobulinA,IgA)、免疫球蛋白M(immunoglobulin M,IgM)及血凝血酶原时间(prothrombin time,PT),白陶土部分凝血活酶时间(kaolin partial thromboplastin time,KPTT)均正常,血清幽门螺杆菌抗体检测阳性4例(16.67%);吸入性及食物性过敏原特异性IgE抗体检测CMPA 3例(12.50%),腹部彩超均示腹部胀气24例(100.00%),大便虫卵检查均阴性24例(100.00%),10例行胸片检查未见异常,3例行骨髓检查示增生性骨髓像。
2.2 胃镜下表现
24例患儿均行胃镜检查,示胃、十二指肠黏膜充血、水肿,有的伴点、片状糜烂,溃疡,其中胃炎(图1)24例(100.00%),十二指肠球炎(图2A)5例(20.83%),十二指肠球部溃疡(图2B)1例(4.17%)。
2.3 组织病理学变化
24例胃黏膜(图3A)、3例十二指肠球部黏膜均示Eos浸润,24例苏木素-姬姆萨-伊红染色(HGE染色)Eos计数,21~25个/HPF(每高倍视野)13例,26~50个/HPF 10例,>50个/HPF 1例;24例同时Csaba阿尔辛蓝沙红染色法肥大细胞计数(图3B),10~20个/HPF 10例,20~50个/HPF 14例;24例幽门螺杆菌双重染色液(生物电荷法),幽门螺杆菌阳性4例,快速尿素酶试验均阴性。
2.4 疗效及随访
24例患儿经制酸,保护胃黏膜,24~48 h后消化道出血停止,同时回避普通配方奶,予深度水解蛋白奶或氨基酸配方奶喂养,4例幽门螺杆菌感染者抗幽门螺杆菌治疗,5~7 d后病情稳定带药出院。出院后继续服用深度水解蛋白奶或氨基酸配方奶,所有患儿开始坚持每1或2周门诊随访1次,10例患儿6~8周后经口服牛奶开放式激发试验[3]证实CMPA,24 h之内出现症状2例,72 h之内出现症状3例,3~7 d之内出现症状3例,7~10 d之内出现症状2例,14例患儿出院4周后未坚持随访,换用普通配方奶后入院时症状再现,再予深度水解蛋白奶或氨基酸配方奶喂养和制酸,保护胃黏膜治疗后症状消失,进一步确诊为CMPA。其中3例患儿8~12周后复查胃镜胃、十二指肠黏膜光滑,Eos均<5个/HPF,肥大细胞均<8个/HPF。
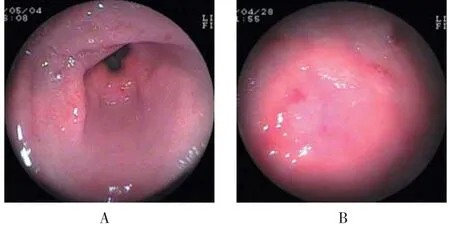
图1 胃镜下胃炎的表现Fig.1 Manifestations of gastritis under gastroscopy
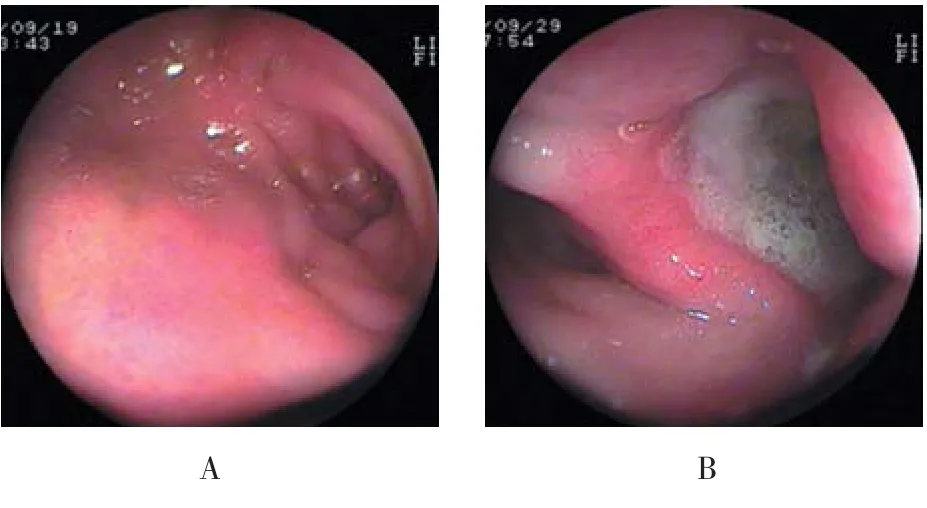
图2 胃镜下十二指肠病变的表现Fig.2 Manifestations of duodenal lesions under gastroscopy
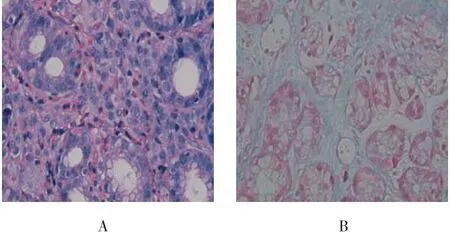
图3 胃黏膜病理学变化Fig.3 Pathological changes of gastric mucosa
3 讨论
EG是一种罕见的因Eos浸润到胃肠组织引起的一系列胃肠症状的疾病。这种浸润可以是弥散性或是局限性的,从食管到结肠的一个或多个部位受累,临床表现具有多样性、非特异性的特点。确诊需组织学活检证实有Eos浸润胃肠道或腹水中Eos计数较高,且排除寄生虫感染和其他可引起Eos增多的疾病[4]。目前关于EG的诊断国际上还没有统一标准[5],应用较广的是TALLEY标准[2]:国内学者提出内镜下黏膜活检证实胃肠道黏膜组织有Eos浸润(> 20 Eos/HPF)是诊断EG的关键,但胃肠道Eos浸润常呈局灶性分布,内镜下黏膜活检可能为阴性表现,内镜下多点活检(6点以上)可有效提高诊断率[1]。本组患儿胃肠黏膜均有Eos浸润(>20个/HPF),均为1或2点活检,关键是特殊染色,并进行Eos计数才有助诊断[6],本组患儿组织病理学检查,除苏木精-伊红染色外,还行姬姆萨色法,这样更有利于镜下Eos计数;其中3例行骨髓检查排除了嗜酸细胞性白血病,其余患儿家属拒绝检查,且所有患儿大便虫卵检查均阴性,排除了寄生虫感染。同时在考虑婴儿呕血、便血原因时,本组所有患儿入院时手指采血处无出血不止,查PT,KPTT正常,已排除晚发性VitK缺乏症引起的出血,胃镜检查排除咽下综合征、急性胃黏膜病变及先天性胃血管畸形[7]。
EG的病因和发病机制目前仍不明确,多数学者认为可能与内在或外在的过敏原引起的变态反应有关[8];研究发现,EG患者多伴有过敏体质或过敏性疾病,且绝大多数伴有血清IgE水平升高;本组24例患儿湿疹17例(70.83%),父母有荨麻疹、过敏性鼻炎和哮喘等过敏性疾病史7例(29.17%),过敏原特异性IgE抗体检测CMPA 3例(12.50%),血清IgE升高8例(33.33%);也有人认为可能与Ⅰ型变态反应有关[9];认为由于某种因素破坏了消化道黏膜的完整性,抗原进入组织使肥大细胞致敏,并释放Eos趋化因子,导致Eos浸润,组织损伤。本组24例患儿胃肠黏膜除Eos异常浸润外,同时均伴有肥大细胞浸润。KLEIN等[9]将EG分为3型:①黏膜病变型,最常见,主要为胃肠黏膜充血水肿、糜烂、Eos浸润,以消化吸收不良症状为主要表现,可有腹泻;②肌层病变型,较少见,胃肠壁增厚、僵硬、呈结节状,可致幽门梗阻及肠梗阻,胃肠蠕动减弱或消失,深层肌活检能发现Eos浸润;③浆膜病变型,罕见。以上3型可单独或混合出现。本组24例患儿均为黏膜型。
食物过敏作为临床最早表现出来的过敏反应,在儿童中的发病率较成人高,尤其婴儿期是食物过敏的易感年龄[10]。食物过敏是由免疫机制介导的某种食物或食品添加剂等引起肠道内或全身的变态反应。其中CMPA多见于婴幼儿,为牛奶蛋白引起的异常或过强的免疫反应,可由IgE介导、非IgE介导和两者混合介导[11]。而食物蛋白过敏性胃肠病多为非IgE介导的免疫反应,临床诊断困难,CMPA症状无特异性,常可累及多器官系统,如皮肤、胃肠道及呼吸系统等,甚至可发生严重过敏反应。因此,CMPA早期诊断及正确治疗有利于减轻疾病对生长发育的影响。
CMPA的诊断:根据病史或临床资料提示CMPA可能时,需进一步检查皮肤点刺试验和血清牛奶特异性IgE抗体测定,饮食回避是诊断年幼儿牛奶过敏最常用的方法,但确诊仍需口服牛奶激发试验。但牛奶蛋白诱导的食管炎、胃肠炎、结肠炎等多属非IgE介导和IgE、非IgE两者混合介导,故难于用皮肤点刺试验和血清特异性IgE抗体检测结果判断,若病史提示症状与牛奶摄入密切相关时,可行消化道内镜检查,内镜检查可查病理黏膜标本,若黏膜下Eos每高倍视野大于15~20个,即可诊断为Eos浸润[3],本组患儿虽然只有3例血清牛奶特异性IgE抗体测定阳性,但胃、十二指肠黏膜均示Eos浸润(>20个/HPF),且经食物回避普通配方牛奶治疗症状明显改善;其中10例行口服牛奶激发试验证实CMPA,但是本组10例患儿观察72 h只有5例证实CMPA,观察到10 d时均证实CMPA,若根据中国婴幼儿CMPA诊治循证建议[3]激发试验只观察72 h,只有5例证实CMPA,其余5例易漏诊。因此,婴儿胃肠道疾病疑诊CMPA引起,口服牛奶激发试验时,若在医院未诱发症状时,医生应指导家长离院后继续观察患儿表现,至少10 d,并仔细记录症状,以免漏诊迟发型CMPA。另外14例患儿病情好转后自行换用普通配方奶粉,又出现呕吐,呕血,再进行食物回避后症状消失,进一步确诊为CMPA。
EG的治疗原则是去除诱因、避免接触过敏原,抑制变态反应和稳定肥大细胞,从而达到缓解病情的目的。具体治疗方法包括[12-14]:①饮食治疗:虽然EG的病因目前尚未明确,但普遍认为与过敏原引起的变态反应有关。有报道EG患者停用致敏药物或食物后症状明显缓解,尤其是黏膜病变型患者和儿童患者。因此,对于确定EG诊断的患者,可首先停用确定或可疑的过敏食物或药物,如果对多种食物过敏,可采取要素饮食方案;②药物治疗:糖皮质激素是治疗EG的主要药物,其疗效良好确切。本组24例婴儿EG为黏膜型,考虑CMPA所致,经饮食回避普通配方奶,予深度水解蛋白奶或氨基酸配方奶喂养,取得满意疗效,且均未使用糖皮质激素;其中3例患儿复查胃镜胃、十二指肠黏膜光滑,Eos和肥大细胞均明显减少,进一步证实CMPA所致婴儿EG(黏膜型),不需要使用糖皮质激素,通过饮食回避过敏原可取得满意疗效。
综上所述,CMPA致婴儿EG(黏膜型)的临床表现和内镜下表现均无特异性,胃肠黏膜组织中Eos异常浸润且同时均伴有肥大细胞浸润;不需要使用糖皮质激素,牛奶蛋白回避等治疗可取得满意疗效,但明确诊断需根据病史、活组织病理检查及Eos计数,并结合牛奶蛋白回避和牛奶蛋白激发试验进一步确诊,但激发试验应至少观察患儿10 d,并仔细记录症状,以免漏诊迟发型CMPA。
[1] 张安忠, 杨崇美, 崔屹, 等. 嗜酸细胞性胃肠炎的临床和内镜特点[J]. 中国内镜杂志, 2007, 13(6): 602-604.
[1] ZHANG A Z, YANG C M, CUI Y, et al. Clinical manifestations and endoscopic charactristics of eoinopnlliC gastroenteritis[J]. China Journal of Endoscopy, 2007, 13(6): 602-604. Chinese
[2] TALLEY N J, SHORTER R G, PHILLIPS S F, et al. Eosinophilic gastroenteritisa clinicopathological study of patients with disease of the mucosa,muscle layer and subserosal tissues[J]. Gut, 1990, 31(1): 54-58.
[3] 胡燕黎, 海芪. 中国婴幼儿牛奶蛋白过敏诊治循证建议[J]. 中华儿科杂志, 2013, 51(3): 183-185.
[3] HU Y L, HAI Q. Evidence based recommendations for diagnosis and treatment of milk allergy in infants and young children in China[J]. Chinese Journal of Pediatrics, 2013, 51(3): 183-185. Chinese
[4] 刘梅, 黄永坤. 嗜酸性粒细胞性胃肠病的诊断与治疗[J]. 实用儿科临床杂志, 2011, 26(7): 550-552.
[4] LIU M, HUANG Y K. Diagnosis and treatment of eosinophilic digestive disease[J]. Journal of Applied Clinical Pediatrics, 2011, 26(7): 550-552. Chinese
[5] 李丽, 王孟春. 8例嗜酸细胞性胃肠炎的临床分析[J]. 胃肠病学和肝病学杂志, 2010, 19(10): 928-930.
[5] LI L, WANG M C. CIinical analysis of 8 cases of eosinophic gastroenteritis[J]. Chinese Journal of Gastroenterology and Hepatology, 2010, 19(10): 928-930. Chinese
[6] 万盛华, 李香莲, 张双红, 等. 儿童嗜酸细胞性胃肠炎的临床、内镜及病理学特点[J]. 南昌大学学报(医学版), 2014, 54(12): 42-45.
[6] WAN S H, LI X L, ZHANG S H, et al. Clinal endoscopicand pathological Features of eosinophilic gastroenteritisin children[J]. Journal of Nanchang University (Medical Sciences), 2014, 54(12): 42-45. Chinese
[7] 万盛华, 李香莲, 张双红, 等. 婴儿食物过敏致上消化道出血35例分析[J]. 中国实用儿科杂志, 2012, 27(2): 134-136.
[7] WAN S H, LI X L, ZHANG S H, et al. The clinical endoscopic and pathologic characteristic of food allergy inducing upper gastrointestinal tract hemorrphage in infant[J]. Chinese Journal of Practical Pediatrics, 2012, 27(2): 134-136. Chinese
[8] BLACKSHAW A J, LEVISON D A. Eosinophilic infi ltrates of the gastrointestinal tract[J]. J Clin Pathol, 1986, 39(1): 1-7.
[9] KLEIN N C, HARGROVE R L, SLEISENGER M H, et al. Eosinophilic gastroenteritis[J]. Medicine (Baltimore), 1970, 49(4): 299-319.
[10] 赵巧玲. 儿童食物过敏的诊疗进展[J]. 医学综述, 2008, 14(22): 3445-3447.
[10] ZHAO Q L. Progress in diagnosis and treatment of child food allergy[J]. Medical Recapitulate, 2008, 14(22): 3445-3447. Chinese
[11] FIOCCHI A, BROZEK J, SCHÜNEMANN H, et al. World Allergy Organinzation (WAO) diagnosis and rationale for action againist cow’s milk allergy (dracma) guidelines[J]. World Allergy Organ J, 2010, 3(4): 57-161.
[12] 张劼为, 胡志红. 儿童嗜酸细胞性胃肠炎研究进展[J]. 实用儿科临床杂志, 2011, 26(19): 1533-1536.
[12] ZHANG J W, HU Z H. Research progress of eosinophilic gastroenteritis in children[J]. Journal of Applied Clinical Pediatrics, 2011, 26(19): 1533-1536. Chinese
[13] MORI A, ENWELUZO C, GRIER D, et al. Eosinophilic gas-troenteritis: review of a rare and treatable disease of thegastrointestinal tract[J]. Case Rep Gastroenterol, 2013, 7(2): 293-298.
[14] GARRETT J K, JAMESON S C, THOMSON B, et al. Antiinterleu-kin-5 (mepolizumab) therapy for hypereosinophilic syndromes[J]. J Allergy Clin Immunol, 2004, 113(1): 115-119.
(吴静 编辑)
The clinical, endoscopic and pathologic characteristics of eosinophilic gastroenteritis of 24 cases infants resulted from milk protein allergy
Sheng-hua Wan, Xiang-lian Li, Shuang-hong Zhang, Wen-ping Yang, Hong Wan, Li-juan Luo, Lan Liu, Yun Liu
(Department of Gastroenterology, Jiangxi Chlildren’s Hospital, Nanchang, Jinagxi 330006, China)
ObjectiveBy studying clinical features, treatment and prognosis of eosinophilic gastroenteritis of infants resulted from milk protein allergy an, to improve the diagnosis and treatment level of eosinophilic gastroenteritis.Methods 24 cases of infants which diagnosed eosinophilic gastroenteritis were chosen from June of 2010 to January of 2014 in children’s Hospital of XX province and By retrospective analysis clinical manifestations, endoscopic features, histopathology, treatment and prognosis of the 24 cases.ResultsThe 24 cases who were vomiting, paroxysmal crying, abdominal distension (100.00%), which accompanied by haematemesis 23 cases (95.83%), 1case (4.17%) hematochezia, 17cases (70.83%) eczema, 21 cases (87.50%) mild to moderate anemia, 1 cases (4.17%) severe anemia, 19 cases (79.17%) the increasing of peripheral blood eosinophil cells, 8 cases (33.33%)the increasing of IgE of the serum and 4 cases (16.67%) the test of antibody of the Helicobacter pylori in Serum was positive; 3 cases (12.50%) were milk protein allergy by the detecting of food allergenspecifi c IgE antibodies, the endoscopic characteristics were hyperemia, edema, erosion, ulcer of gastric and duodenal mucosa. Among them, 24 cases (100.00%) were gastritis, 5 cases (20.83%) duodenitis and 1 cases (4.17%) duodenal ulcer. The histopathology of the 24 cases revealed that there were gastric or duodenal eosinophils infiltration (> 20/HPF) and were all associated with mast cell infiltration; By antisecretory, protection of the gastrointestinal mucosa and the obviating of milk protein had a satisfactory treatment effect, 24 cases of children with oral general formula milk test confi rmed that the milk protein allergy, The 3 cases of the patients were reviewed by 8~12 weeks after gastroscope, and the mucosa of the duodenum was smooth, Eosinophils were /HPF < 8, mast cells were /HPF < 5.ConclusionThere are no specifi c clinical and endoscopic manifestations in eosinophilic gastroenteritis of infants resulted from milk protein allergy, gastrointestinal mucosa eosinophil infi ltration and simultaneously are accompanied by abnormal mast cell infi ltration; Mucosal type without the use of corticosteroids, through milk protein avoidance treatment can achieve satisfactory results, But definite diagnosis must rely on biopsy and eosinophils, combined with avoidance stimulation test of milk protein can further confirmed, But the excitation test should be at least 10 days of observation of children, and carefully recorded symptoms, so as not to delay the missed diagnosis of CMPA.
infants; milk protein allergy; eosinophilic gastroenteritis; endoscopic; histopathology
R725.7
10.3969/j.issn.1007-1989.2017.01.020
1007-1989(2017)01-0095-05
2016-07-11
