斑点叉尾NK-lysin成熟肽在毕赤酵母中的表达
2017-02-09吴慧,陶妍
吴 慧,陶 妍
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)

吴 慧,陶 妍
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)


NK-lysin是自然杀伤细胞(NK)和毒性T细胞(CTLs)中产生的具有抗菌作用的阳离子多肽,与颗粒溶素在结构和功能上有很大的相似性[1,2],是细胞免疫系统的效应分子,在动物抵御病毒、细菌等感染过程中起着非常重要的作用[3]。Andersson等首次从猪的小肠中提取到NK-lysin,并鉴定了其结构和功能[4];张殿卿等通过荧光定量RT-PCR法检测了在不同浓度脂多糖(lipopolysaccharide,LPS)、不同时间刺激下,绵羊NK-lysin基因在巨噬细胞中的表达量及在不同免疫器官中的表达情况[5]。鱼类中也发现具有类似作用的NK-lysin,它是鱼类在抵御病毒、细菌和寄生虫等感染过程中的先天性免疫成分[6-10]。迄今为止,关于NK-lysin的研究报道主要聚焦于基因克隆及其在不同组织器官中的表达[11],但很少有涉及重组DNA表达方面的。

1 材料与方法
1.1 材料
pET-32a(+)-mNK-lysin来自于本研究室,用于质粒复制的大肠杆菌DH5α购自天根生物科技公司(北京);限制性内切酶(EcoRI、XbaI、SacI)、T4DNA连接酶、克隆质粒pMD-19T simple vector购自TaKaRa公司(日本);胰蛋白胨、酵母粉为OXOID公司(英国)产品;DNA割胶回收试剂盒、质粒提取试剂盒、酵母DNA提取试剂盒、DNA分子量标准、蛋白质分子量标准和PCR反应试剂购自天根生物科技有限公司;博来霉素ZeocinTM、真核表达载体pPICZαA及野生型毕赤酵母X-33购自美国Invitrogen公司。其他试剂为国产或进口分析纯。
1.2 方法
1.2.1 基于PCR的mNK-lysin成熟肽基因酶切位点和His标签的添加
以本研究室已有的原核重组表达载体pET-32a(+)-mNK-lysin为模板,以5’端添加EcoRI酶切位点和3’端添加4×His标签为目的,设计引物F1、R1(表1)用于第一次PCR,PCR反应体系(20 μL):上下游引物(10 μmol/L)各0.8 μL、10×PCR Buffer 2.0 μL、dNTPs (2.5 mmol/L) 1.6 μL、TaqDNA聚合酶(2.5 U/μL) 0.2 μL、DNA模板0.5 μL、无菌水14.1 μL;反应条件:94 ℃预变性3 min、94 ℃变性30 s、53 ℃退火30 s、72 ℃延伸1 min,共30个循环,72 ℃延伸5 min。以第一次PCR产物为模板,以3’端依次添加2×His标签、终止密码子和XbaI酶切位点为目的,设计引物F2、R2(表1)进行第二次PCR,反应体系和条件同上,除退火温度改为56 ℃。割胶回收第二次PCR产物后,与pMD-19T质粒连接,转化大肠杆菌DH5α感受态细胞,37 ℃培养过夜;挑选阳性克隆用于DNA测序。
表1 引物序列
Tab.1 Sequences of the primers
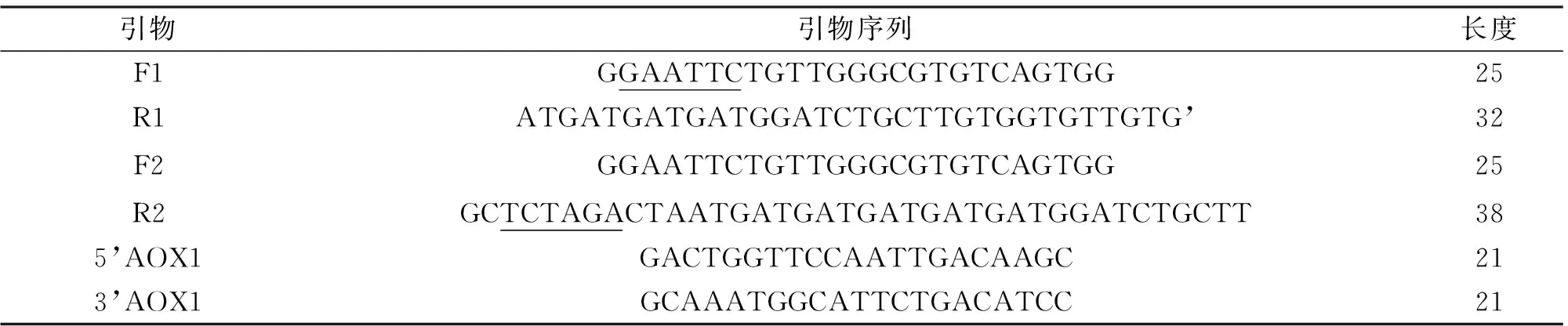
引物引物序列长度F1GGAATTCTGTTGGGCGTGTCAGTGG25R1ATGATGATGATGGATCTGCTTGTGGTGTTGTG’32F2GGAATTCTGTTGGGCGTGTCAGTGG25R2GCTCTAGACTAATGATGATGATGATGATGGATCTGCTT385’AOX1GACTGGTTCCAATTGACAAGC213’AOX1GCAAATGGCATTCTGACATCC21
注:下划线标记的序列分别为EcoRI和XbaI的酶切位点。
1.2.2 真核重组表达载体pPICZαA-mNK-lysin的构建及电转至毕赤酵母X-33
经DNA 测序确证的阳性菌落经培养后抽提质粒,采用EcoRI和XbaI对其双酶切后获得目的片段“mNK-lysin”;将此片段与经相同限制性酶处理过的pPICZαA 连接(图1),在T4DNA连接酶作用下,16 ℃反应过夜;转化至DH5α感受态细胞,37 ℃培养过夜。通过菌落PCR、双酶切和DNA测序鉴定重组表达载体pPICZαA-mNK-lysin;采用SacI对其进行酶切,酶切产物经回收后与毕赤酵母X-33感受态细胞以1∶8(V/V)混合,转入预冷的0.2 cm电转杯中,冰浴5 min,1.5 kV、25 μF、200电击5 ms,立即加入1 mL预冷的1 mol/L山梨醇,离心后菌体涂布于含100 μg/mL博来霉素的YPDS平板(酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、山梨醇182.2 g/L、琼脂20 g/L),30 ℃孵育至单菌落产生。

图1 重组表达载体pPICZαA-mNK-lysin的构建
1.2.3 甲醇利用快速型高拷贝酵母转化子的筛选和鉴定
挑取6个长势良好的菌落分别接种至含100 μg/mL博来霉素的YPD平板(酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L),筛选高拷贝酵母转化子。将筛选到的转化子分别接种到MM平板(YNB13.4 g/L、生物素0.4 mg/L、甲醇5 mL/L,琼脂15 g/L)和MD平板(无氨基酸酵母氮源(yeast nitrogen base without amino acids,YNB)13.4 g/L、生物素0.4 mg/L、葡萄糖20 g/L、琼脂15 g/L),筛选甲醇利用快速型转化子。对筛选到的转化子提取酵母基因组DNA,以此为模板,采用pPICZαA的通用引物5’AOX1和3’AOX1(表1)进行PCR鉴定。
1.2.4 mNK-lysin的诱导表达及Tricine-SDS-PAGE
挑取上述优良转化子(高拷贝、甲醇利用快速型、经PCR鉴定合格)在50 mL BMG培养基(YNB13.4 g/L、生物素0.4 mg /L、甘油10 mL/L、磷酸钾缓冲液100 mmol/L,pH6.0)中,29 ℃、250 rpm培养至 OD600为3.0~6.0,8 000 rpm离心5 min收集菌体,重悬于500 mL BMM培养基(配方同BMG培养基,除了甲醇取代甘油)中,调OD600至1.0;29 ℃、250 rpm培养120 h,每隔24 h补加占总体积0.5%的甲醇。收集不同发酵时间的培养液用作Tricine-SDS-PAGE分析(浓缩胶浓度4%、夹层胶浓度10%、分离胶浓度15.5%),超低分子量蛋白Marker由中科瑞泰(北京)生物科技有限公司提供。
1.2.5 重组体mNK-lysin的分离纯化和Western blot鉴定
重组体mNK-lysin的C端带有6×His标签,因此可用镍亲和层析的方法纯化目的蛋白。1.2 L表达72 h的培养液经离心得上清,用去离子水透析后上Profinia蛋白质纯化仪,通过Tricine-SDS-PAGE分析其纯度。电泳后的凝胶用于Western blot分析,阴性对照为含pPICZαA空载体的酵母表达上清;转膜条件为100 V恒压1 h,PVDF膜依次用抗His标签鼠单克隆抗体和HRP标记山羊抗鼠IgG孵育,最后用HRP-DAB显色试剂盒显色。
2 结果
2.1 添加酶切位点和6×His标签的mNK-lysin基因的扩增
第一次PCR产物的电泳结果显示,在292 bp处有清晰条带(图2A),该片段在mNK-lysin成熟肽基因的5’端加上了EcoRI酶切位点,3’端添加了4×His的密码子;以第一次PCR产物为模板,第二次PCR获得了1个309 bp的片段(图2B),该片段在3’端依次添加了2×His的密码子、终止密码子和XbaI酶切位点。DNA测序证明2个酶切位点和6×His标签的密码子被正确添加。除去2个酶切位点和终止密码子,其余291 bp编码了97个氨基酸残基,内含6个保守的半胱氨酸残基(图3),它们可以在空间上形成3对二硫键以稳定mNK-lysin的结构。

图2 对目的片段添加酶切位点和His标签的PCR扩增
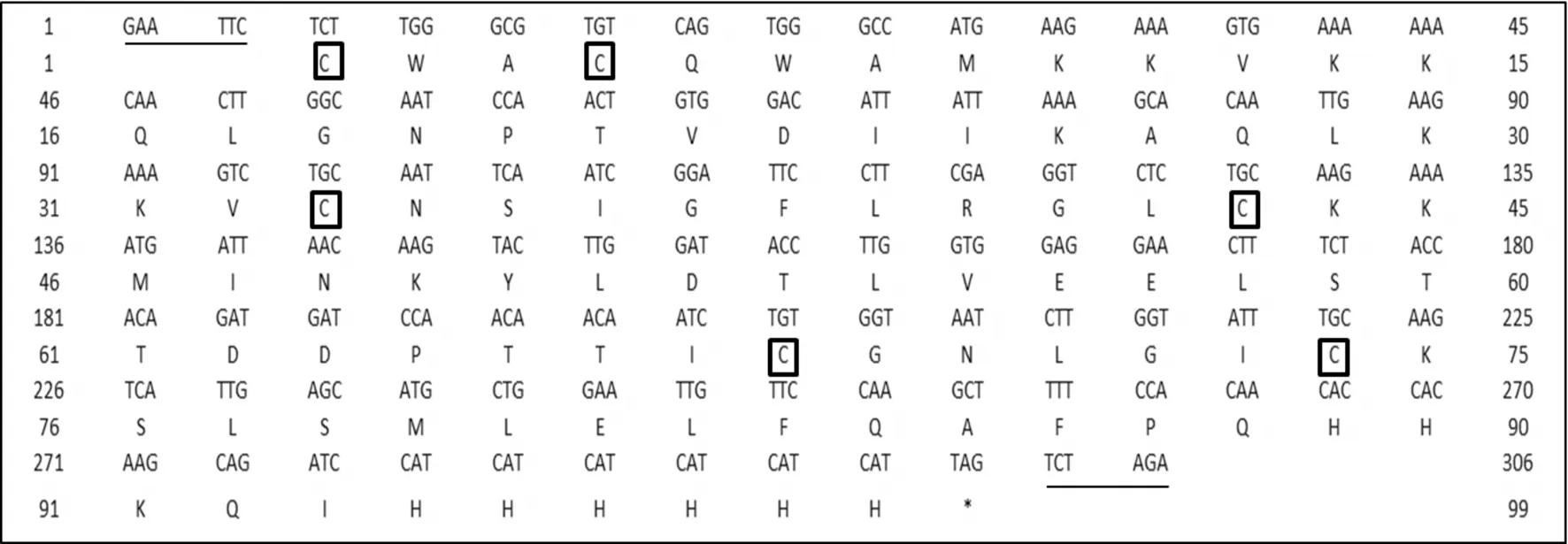
图3 mNK-lysin的核苷酸及其推断的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of the mNK-lysin gene 下划线标记的是EcoRⅠ和XbaⅠ的酶切位点,方框内是保守的半胱氨酸残基,星号是终止密码子
2.2 重组表达载体pPICZαA-mNK-lysin的构建及其鉴定
将上述片段与pPICZαA连接,构建重组表达载体pPICZαA-mNK-lysin后转化感受态细胞DH5α,经培养后挑取阳性菌落为模板,使用载体通用引物5’AOX1和3’AOX1进行PCR,得到一个832 bp的片段(图4A);另一方面,对重组表达载体pPICZαA-mNK-lysin纯化后,使用EcoRI和XbaI对其进行双酶切,获得303 bp的mNK-lysin片段(图4B)。DNA测序显示序列正确(结果未显示)。据此可以证明重组表达载体pPICZαA-mNK-lysin已成功构建。
2.3 经筛选和鉴定的甲醇利用快速型高拷贝酵母转化子
将线性化的重组表达载体pPICZαA-mNK-lysin电转进毕赤酵母细胞后,通过博来霉素筛选、甲醇利用速度筛选,获得6个长势良好的酵母转化子,选取1个长势最好的转化子提取其基因组DNA作为模板,以载体的通用引物5’AOX1和3’AOX1进行PCR扩增,电泳结果显示,在2 200 bp和832 bp处有明显条带(图5),前者为毕赤酵母X-33中因存在醇氧化酶基因AOX1自身的引物结合位点而扩增的条带,后者为含目的基因的扩增条带,与理论值相符。
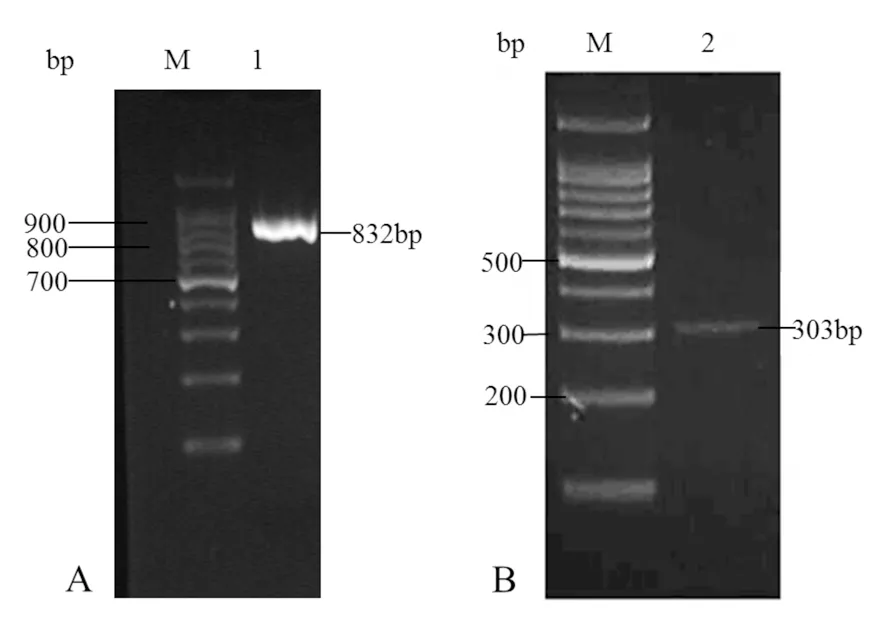
图4 重组表达载体pPICZαA-mNK-lysin的菌落PCR(A)和双酶切鉴定(B)
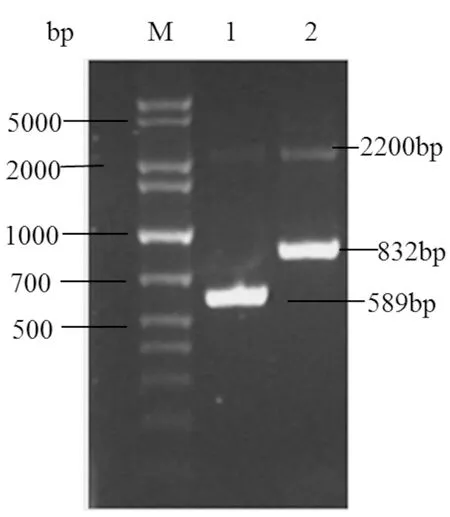
图5 高拷贝酵母转化子的PCR鉴定
2.4 发酵上清的Tricine-SDS-PAGE分析
图6是在29 ℃,250 rpm,0.5%甲醇诱导条件下,发酵培养不同时间的发酵液上清的Tricine-SDS-PAGE分析结果。可以发现,表达不同时间的样品均在约11.5 kD处有条带,但空白对照(泳道1)在此位置未显示条带。经蛋白质浓度测定,表达时间为72 h的样品蛋白质浓度最高,据此,将表达时间确定为72 h。

图6 发酵上清的Tricine-SDS-PAGE分析
2.5 经亲和层析获得纯化的重组体mNK-lysin
将扩大体积培养72 h的发酵上清经过Vivaflow200超滤膜包浓缩脱盐后,采用固化金属离子亲和层析(IMAC)对其纯化。Tricine-SDS-PAGE分析显示,纯化产物在11.5 kD处有单一条带(图7),证明获得较高纯度的重组体mNK-lysin。进一步将凝胶上的条带电转至PVDF膜,与抗His标签的鼠单克隆抗体(一抗)和辣根过氧化物酶标记山羊抗小鼠IgG(二抗)反应,进行Western blot鉴定,经DAB显色,在11.5 kD处有明显条带(图8),因Western blot分析的灵敏度高于Tricine-SDS-PAGE分析,故该条带较图7中的条带明显,此结果进一步证明重组体mNK-lysin在毕赤酵母X-33中得到成功表达。
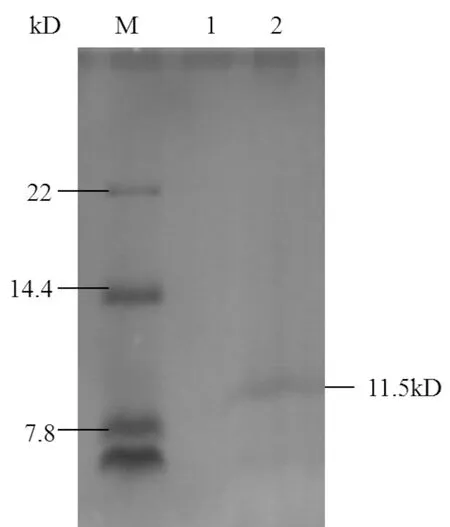
图7 纯化产物的Tricine-SDS-PAGE分析
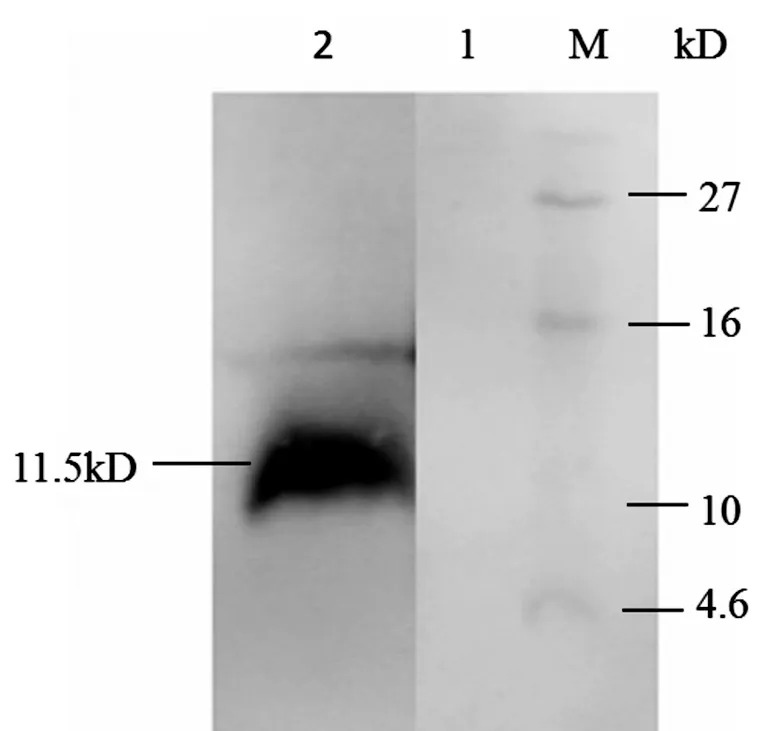
图8 纯化产物的Western blot分析
3 讨论

[1]陈 菲,许 伟.Granulysin结构和功能的研究进展[J].国外医学免疫学分册,2005,(02):96-100.
[2]Kandasamy S,Mitra A.Characterization and expression profile of complete functional domain of granulysin/NK-lysin homologue (buffalo-lysin) gene of water buffalo (Bubalusbubalis) [J].Vet Immunol & Immunopathol,2009,128(4):413-417.
[3]吴 南,张永安.鱼类自然杀伤样细胞的研究进展[J].水生生物学报,2012,36(6):1176-1183.
[4]Andersson M,Curstedt T,Jörnvall H,et al.An amphipathic helical motif common to tumourolytic polypeptide NK-lysin and pulmonary surfactant polypeptide SP-B.[J].Febs Letters,1995,362(3):328-32.
[5]张殿卿,李 蕊,陈鹏博,等.不同浓度脂多糖诱导绵羊免疫器官中NK-Lysin基因表达的研究[J].中国畜牧兽医,2014,(07):44-49.
[6]单 红,周国勤,朱银安,等.鱼类抗菌肽的研究进展[J].水产养殖,2012,33(1):20-25.
[7]张书剑.几种鱼类抗菌肽的研究进展[J].饲料研究,2007,(12):58-61.
[8]Pereiro P,Varela M,Diaz-Rosales P,et al.ZebrafishNk-lysins:First insights about their cellular and functional diversification [J].Develop & Compara Immunol,2015,51:148-159.
[9]Zhang M,Hao L,Li S.A NK-lysin from Cynoglossus semilaevis enhances antimicrobial defense against bacterial and viral pathogens [J].Develop & Compara Immunol,2013,40(s3-4):258-265.
[10]Wang Q,Wang Y,Xu P,Liu Z.NK-lysin of channel catfish:Gene triplication,sequence variation,and expression analysis [J].Molecular Immunology,2006,43(10):1676-1686.
[11]Zhang M.NKLP27:A Teleost NK-Lysin Peptide that Modulates Immune Response,Induces Degradation of Bacterial DNA,and Inhibits Bacterial and Viral Infection [J].Plos One,2014,9(9):e106543-e106543.
[12]谢帝芝,刘 臻,王赏初,等.青鱼生长激素在毕赤酵母中的表达[J].淡水渔业,2011,41(6):19-24.
[13]王树云,李江宇,高志强,等.鲤春病毒血症病毒糖蛋白基因在毕赤酵母中的分泌表达[J].淡水渔业,2015,(4):31-35.
[14]苏 岚,曾令兵,周 勇,等.草鱼呼肠孤病VP6蛋白在毕赤酵母中表达的初步研究[J].淡水渔业,2012,42(6):38-42.

[16]范翠英,冯利兴,樊金玲,等.重组蛋白表达系统的研究进展[J].生物技术,2012,22(2):76-80.
[17]郜赵伟.葡萄糖氧化酶基因密码子优化及其在毕赤酵母中的高效表达[D].西南大学,2010.
[18]刘 朔.纳豆激酶基因密码子优化设计与合成及在毕赤酵母中的高效表达[D].南京农业大学,2007.
(责任编辑:张潇峮)
Expression of Ictalurus punctatus NK-lysin Mature Peptide in Pichia pastoris
WU Hui,TAO Yan
(ShanghaiEngineeringResearchCenterofAquatic-ProductProcessing&Preservation,CollegeofFoodScienceandTechnology,ShanghaiOceanUniversity,Shanghai201306,China)
NK-lysins are antimicrobial peptides that are produced in cytotoxic T lymphocytes (CTLs) and natural killer (NK) cells and play an important role in immune response against microbial invasion.Thus,they are considered to be good substitutes for traditional antibiotics.In the present study,the prokaryotic recombinant expression vector “pET-32a(+)-mNK-lysin” forIctaluruspunctatusNK-lysin mature peptide,which was constructed in previous study,was used as the template of PCR.EcoRⅠandXbaⅠrestriction sites were added to 5’ and 3’ ends of themNK-lysinfragment respectively,and 6 x His tag was also added to 3’end to purify the target protein easily.ThemNK-lysinfragment was ligated to pPICZαA vector to construct a recombinant expression vector pPICZαA-mNK-lysin,which then was transformed into competentPichiapastorisX-33.The yeast transformants containing multicopy gene insertions were selected by using Zeocin and PCR identification for genomic DNA from yeast transformants.Recombinant mNK-lysin was induced with 0.5% methanol at 29 ℃and 250rpm.The expression product was purified by immobilized metal affinity chromatography (IMAC).Tricine-SDS-PAGE analysis indicated that molecular mass of the purified recombinant mNK-lysin was 11.5kD.Furthermore,Western blot analysis demonstrated that the recombinant mNK-lysin was expressed successfully inP.pastoris.
Channel catfish;NK-lysin mature peptide;Pichiapastoris;Recombinant DNA expression
2016-03-24;
2016-00-00
上海市教育委员会产学研项目(No.15CXY30)和农业部都市农业(南方)重点实验室开放基金(No.UA201307)
吴 慧(1989- ),女,硕士,专业方向为水产生物蛋白质生物化学与分子生物学,E-mail:470621868@qq.com
陶 妍。ytao@shou.edu.cn
Q786
A
1000-6907-(2017)01-0078-06
