基于微卫星的胭脂鱼养殖群体遗传多样性及人工放流监测的分析
2017-02-09胡新艳刘雄军周幼杨吴小平欧阳珊
胡新艳,刘雄军,周幼杨,吴小平,2,欧阳珊
(1.南昌大学生命科学学院,南昌 330031;2.南昌大学生命科学研究院流域生态研究所,南昌 330031)
基于微卫星的胭脂鱼养殖群体遗传多样性及人工放流监测的分析
胡新艳1,刘雄军1,周幼杨1,吴小平1,2,欧阳珊1
(1.南昌大学生命科学学院,南昌 330031;2.南昌大学生命科学研究院流域生态研究所,南昌 330031)
利用13个微卫星分子标记研究了我国重庆、江西永丰、江西新干三个胭脂鱼(Myxocyprinusasiaticus)繁殖基地子一代群体的遗传多样性和遗传结构。结果显示,13个微卫星位点均呈现多态性,等位基因数目为8~17个,多态信息含量为0.35~0.84,Shannon多样性指数为1.61~1.64,观测杂合度为0.108 1~0.825 5,期望杂合度为0.384 6~0.856 8,Hard-Weinberg遗传偏离指数(D)为-0.718 9~0.072 5,表明三个养殖群体遗传多样性均较高。从群体间的遗传结构看,三个养殖群体间存在遗传分化,其中江西新干胭脂鱼养殖群体内具有显著的遗传分化。野外采自赣江的5尾胭脂鱼的遗传结构分析推断其可能来自永丰和新干胭脂鱼繁殖基地的子一代个体,其结果对胭脂鱼的人工放流监测有指导意义。
微卫星;胭脂鱼(Myxocyprinusasiaticus);遗传多样性;放流监测
胭脂鱼(Myxocyprinusasiaticus),隶属于鲤形目(Cypriniformes)亚口鱼科(Catostomidae)胭脂鱼属(Myxocyprinus),是亚洲大陆唯一分布的单型属、种。主要分布于我国的长江和闽江流域[1]。近年来,由于过度捕捞、水域污染,水利工程建设等影响,胭脂鱼资源量急剧下降[2]。目前闽江胭脂鱼已绝迹,长江胭脂鱼种群的资源也日趋枯竭,同时,长江的胭脂鱼可能是现存胭脂鱼的唯一野生种群[3-4]。因此,胭脂鱼被列入我国二级重点保护动物[5]。
随着胭脂鱼的保护和野生种群资源恢复关注度的提高,了解养殖和野生的种群资源状况是必要的。人工增殖放流是维持胭脂鱼种群资源的有效途径,但目前胭脂鱼增殖放流效果评估还没有准确的方法。此外, 增殖放流效果无法得到完整的评估结果, 同时缺乏增殖放流对野生群体遗传多样性和生态系统平衡的负面影响等的评价内容[6]。微卫星分子标记符合孟德尔遗传规律, 多态性高且为共显性遗传, 是一种极具应用价值的遗传分子标记。在濒危动物种群特别是保护遗传学上得到越来越多的应用[7], 如微卫星遗传多样性检测[8]、个体/家系溯源[9]、遗传图谱构建[10]等。近年来,国内对胭脂鱼研究工作较多,但大多数是关于在形态解剖[11]、繁殖育种[12]、细胞遗传学分析[13]等方面的研究。而利用微卫星分子标记分析胭脂鱼种群遗传特性以及评估人工放流检测效果的研究较少[14-15]。本实验基于微卫星分子标记对长江中下游主要胭脂鱼繁殖基地及野生胭脂鱼个体的遗传多样性及遗传结构,以期为监测其群体遗传资源的变动水平及利用其优良遗传资源提供指导,为人工放流监测提供有效方法。
1 材料与方法
1.1 实验材料
胭脂鱼幼鱼于2015年12月采自重庆万州胭脂鱼原种场和江西新干胭脂鱼养殖场子一代各50尾;仔鱼于2014年4月采自江西永丰胭脂鱼良种场子一代,47尾。2015年7月至10月,采自江西赣江胭脂鱼样本5尾。所有标本取鳍条保存于-80 ℃冰箱中备用。
1.2 方法
1.2.1 基因组DNA提取
取鳍条组织50 mg剪碎,用试剂盒(北京天根生化科技有限公司)提取基因组DNA,分光光度计检测DNA浓度。
1.2.2 PCR反应及产物的检测
PCR反应体系参照成为为等[15,16],并做了优化 。利用13对多态性微卫星标记[16-17],合成荧光引物(HEX和FAM以及TAMRA),在合适的退火温度下进行PCR扩增。PCR引物和荧光引物均由上海生物工程有限公司合成。
PCR扩增产物用2%琼脂糖凝胶电泳检测,并在紫外凝胶成像系统观察和拍照。具有目的条带的PCR产物送上海生物工程公司进行STR检测,STR分型结果用GeneMapper v4.0软件分析。
1.2.3 数据分析
微卫星位点的等位基因数目(Na)、有效等位基因数目(Ne)、Shannon 多样性指数(I)、观测杂合度(Ho)、期望杂合度(He)和Nei’s遗传距离用POPGENE 1.32软件计算[18]; PIC-CALC 0.6软件计算多态信息含量(PIC),Cervus3.0软件计算无效等位基因频率(F)及检验哈迪-温伯格平衡(HWE)。Hardy-Weinberg 平衡偏离指数(D)按公式: D=(Ho -He)/He计算[19]。Structure2.3.4软件计算种群间的遗传结构并聚类分析[20]。
2 结果
2.1 微卫星位点多态性分析
对三个养殖群体和江西赣江野生胭脂鱼的13个微卫星标记分析检测得到154个等位基因,其中等位基因数目范围为8~17个,平均等位基因数目为12个。等位基因数目最少的位点为Mas16、 Mas18和Mas34,均为8个;最多的位点为Mas11,检测到17个;其中Mas6和Mas16的微卫星测序图如图1。期望杂合度范围为0.384 6~0.856 8,平均期望杂合度为0.764 1。观测杂合度范围为0.108 1~0.825 5,平均观测杂合度为0.637 8。多态信息含量(PIC)范围为0.35~0.84,平均多态信息含量为0.74。通过Hardy-Weinberg平衡检测,位点Mas5、Mas13偏离Hardy-Weinberg平衡,位点Mas34、Mas18、Mas43显著偏离Hardy-Weinberg平衡,其余位点均处于平衡状态(表1)。
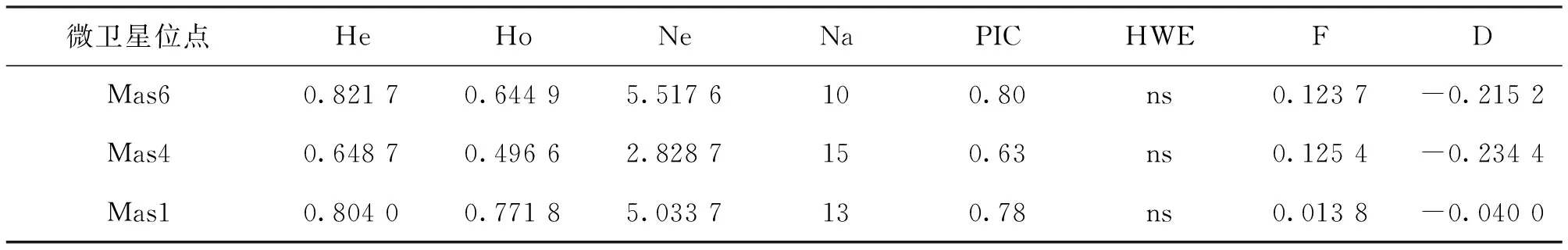
表1 胭脂鱼微卫星位点特征Tab.1 Characteristics of microsatellite loci in M.asiaticus

续表1
注: NS 表示未显著偏离Hardy-Weinberg 平衡(P>0.05);*表示显著偏离Hardy-Weinberg 平衡(P<0.05);**表示极显著偏离Hardy-Weinberg 平衡(P<0.01)
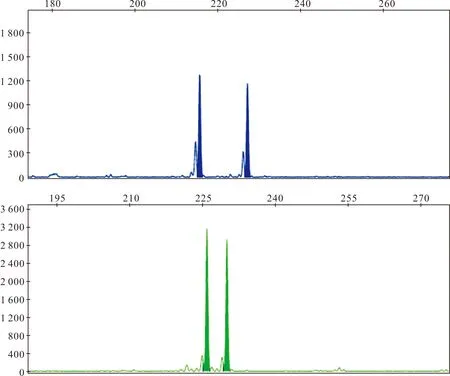
图1 多态微卫星位点Mas6(上)和Mas16(下)Fig.1 Analysis pattern of STR typing for polymorphic SSR locus Mas6 and Mas16 PCR product
2.2 三个胭脂鱼养殖群体的遗传多样性分析
三个胭脂鱼养殖群体遗传多样性分析结果显示,新干养殖群体多态信息含量、平均期望杂合度、Shannon 多样性指数以及平均有效等位基因数最高(PIC=0.73, He=0.77, I=1.64, Ne=4.5),重庆养殖群体居于中间水平(PIC=0.69, He=0.73, I=1.62, Ne=4.49),永丰养殖群体最低(PIC=0.62, He=0.66, I=1.41, Ne=3.58)。由此可见,三个养殖群体的平均PIC值具有高度多态性(PIC>0.5),遗传多样性较丰富,群体的遗传多样性水平没有明显差异(表2)。
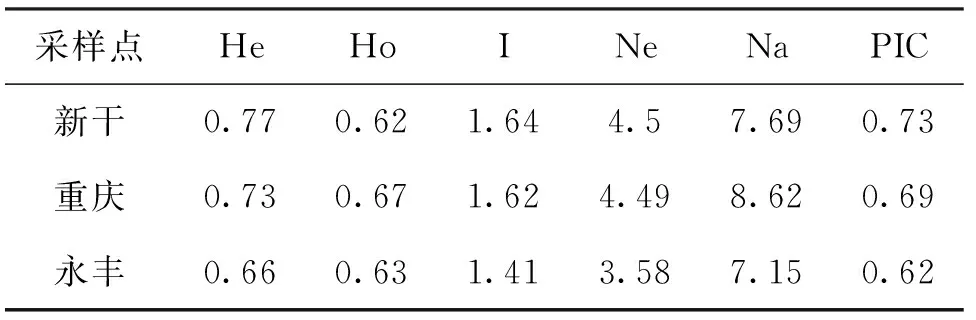
表2 三个胭脂鱼养殖群体的遗传多样性信息Tab.2 Genetic diversity of three M.asiaticus populations
2.3 三个胭脂鱼养殖群体遗传分化
从三个胭脂鱼养殖群体遗传分化系数(Fst)和基因流(Nm)来看:Mas6、Mas4、Mas13、Mas34、Mas43和Mas11共6个位点的遗传分化系数大于0.05,其余位点的遗传分化系数均小于0.05,各位点的遗传分化均值为0.075(表3)。

表3 三个胭脂鱼养殖群体在13个微卫星位点的遗传分化系数与基因流Tab.3 Genetic differentiation coefficient and gene flow of 13 microsatellite loci in the three populations of M.asiaticus
通过Popgene1.32软件计算3个养殖群体的Nei氏遗传距离和遗传相似指数,结果显示,永丰和重庆的胭脂鱼养殖群体相似度最高(0.803 4),遗传距离最近(0.218 9),重庆和新干的胭脂鱼养殖群体相似度最低(0.690 5),遗传距离最远(0.370 3)(表4)。上述结果表明,永丰和重庆群体遗传分化小,新干和重庆群体遗传分化大。

表4 三个胭脂鱼养殖群体的遗传距离和遗传相似度指数Tab.4 Genetic distance and genetic similar index in the three populations of M. asiaticus
注:表中右上角区为群体间的相似度,左下角区为群体间的遗传距离
2.4 微卫星标记在胭脂鱼人工放流中的应用
利用Structure软件对三个养殖群体和采自赣江的胭脂鱼的13个微卫星位点遗传信息进行分析,结果显示所有个体分为4 个簇。新干胭脂鱼养殖群体Cluster1和Cluster4占了大部分;重庆胭脂鱼养殖群体Cluster2占了大部分,永丰胭脂鱼养殖群体Cluster3占大部分。表明三个养殖群体的遗传结构相对独立,存在较小程度的混杂现象,同时,新干养殖群体内遗传结构分化明显。野外采集胭脂鱼YSC1、YSC2和YH1个体Cluster1和Cluster4占大部分,显示出与新干养殖群体具有很大相似性,表明遗传关系较其它两个种群关系近;YXJ1和YH2个体大部分为Cluster3,遗传信息与重庆胭脂鱼养殖群体表现出相似性(图2)。
3 讨论
3.1 三个胭脂鱼繁殖基地群体间的遗传多样性
杂合度(H)和多态信息含量(PIC)分别是衡量种群变异程度和位点多态性的重要指标[21-22]。本研究的三个胭脂鱼养殖群体中,平均等位基因数目和杂合度分别为4.80和0.70,同时,每个基因位点多态信息含量(PIC)范围为0.35-0.84,其中12个位点是高度多态的(PIC>0.5),位点Mas34则是中度多态水平(0.25 图2 基于微卫星数据的胭脂鱼养殖种群遗传结构图Fig.2 Population genetic structure of M.asiaticus sampled based on microsatellite analysis.1.新干胭脂鱼养殖群体,2.重庆胭脂鱼养殖群体,3.永丰胭脂鱼养殖群体,4.野外采集胭脂鱼YSC1,5.野外采集胭脂鱼YSC2,6.野外采集胭脂鱼YXJ1,7.野外采集胭脂鱼YH1,8.野外采集胭脂鱼YH2。 依据Hardy-Weinberg平衡检测显示,5个位点(Mas5、Mas13、Mas34、Mas18、Mas43)偏离HWE平衡,其他位点均符合HWE平衡。由于本次试验中选择的样本主要为人工繁殖子一代群体,并非自然种群,亲代的人工选择可能干扰实验结果,导致杂合子过剩或缺失,从而偏离HWE平衡。Hard-Weinberg 遗传偏离指数(D)反映了He和Ho二者之间的平衡关系,D值越接近0,表明基因型分布越接近于平衡状态,当D为正时,表明杂合子过剩;反之,杂合子缺失,数值大小反映过剩或缺失的程度[24]。本研究D值分析显示,只有Mas11位点为杂合子过剩,其他位点均为杂合子缺失。杂合子过剩现象一般出现在研究对象为相对较小群体,如有限的亲本繁殖子代会导致连锁不平衡现象,从而导致杂合子过剩[25]。杂合子缺失现象主要是由无效等位基因引起的,也可能是由非随机交配、自然选择或小种群中的一个或多个因素造成[26]。研究结果显示,在胭脂鱼养殖群体中,为了防止近交衰退现象,应尽量控制家系的遗传背景。 3.2 三个胭脂鱼繁殖群体间遗传结构 种群间的遗传变异与基因流是研究物种种群历史和动态的重要手段[27]。遗传分化指数是衡量群体间遗传分化程度的重要参数。Wright[28]认为Fst在0~0.05时,群体间无分化;在0.05~0.15时,群体间中度遗传分化;在0.15~0.25时,高度遗传分化;当大于0.25时,表示遗传分化极大。本研究中,三个胭脂鱼养殖群体间的遗传分化系数(Fst)均值为0.075,具有中度遗传分化,其中7.5%的遗传分化来自种群间,92.5%的遗传分化来自种群内。说明群体间遗传分化微弱。这可能由于群体分化程度对所在的生态条件相适应的结果,环境作用强度及方向大体相同,则会造成各分布区的种群遗传分化不显著;其次是由于重庆和永丰的亲本存在部分相互引种现象,导致遗传分化程度低;同时,胭脂鱼养殖群体间地理隔离的时间较短,并未发生显著遗传分化。本研究中,三个胭脂鱼养殖群体的基因流(Nm)范围0.634 5~11.102 7,均值为4.982 5。从Nm值来看,通常Nm大于1,表明群体间的基因流水平高;当Nm小于1时,说明群体可能由于遗传漂变而发生分化[29]。由此可见,三个胭脂鱼养殖群体间基因交流充分,而Structure分析结果显示三个地理种群存在分化,因此历史上的基因交流没有制约地理种群间的遗传分化。 遗传距离是研究物种遗传多样性的基础,Crawford等[30]指出由微卫星得出的遗传距离更能反映分化时间的长短,能客观反映品种间的遗传变异和分化。本研究中,永丰和重庆胭脂鱼养殖群体遗传距离最小为0.218 9。表明重庆与永丰胭脂鱼养殖群体具有较近的亲缘关系,这可能与永丰一部分胭脂鱼亲本是引进重庆胭脂鱼亲本有关,由此可见,对于今后的育种,可以考虑将新干胭脂鱼繁殖基地的亲本与重庆和永丰的亲本进行进一步杂交育种,增加群体基因交流,防止近交衰退现象。 Structure聚类分析结果显示,三个胭脂鱼养殖群体间存在遗传分化以及少量基因交叉和渗透,推测可能为早期生活的胭脂鱼在群体间的自然游动、繁殖所致的基因交流。新干胭脂鱼养殖群体遗传分化最大,可能与新干养殖群体亲本的遗传结构有关,由于地理的隔离及人工繁殖的影响,从而在新干养殖群体内形成两种相对独立的遗传结构。 3.3 人工放流监测 五尾野生胭脂鱼个体Structure聚类分析显示,YSC1、YSC2和YH1可能来自于新干胭脂鱼繁殖基地群体;YXJ1和YH2虽然与重庆胭脂鱼繁殖基地群体具有很大相似性,但因部分永丰胭脂鱼亲本是由重庆亲本引种而来,存在基因交流,同时胭脂鱼采集地点和人工放流地点均在赣江,距离较近,而距离重庆放流地点较远,并且在赣江人工放流工作开展前,历年文献中并未在赣江发现胭脂鱼记录种。因此,推断YXJ1和YH2个体出自于重庆胭脂鱼繁殖基地群体的可能性不大,更可能出自于永丰胭脂鱼繁殖基地群体。然而胭脂鱼人工放流增殖效果的更有效评估,需要对野外采集个体更加准确追溯其是野生种群还是人工放流群体,对于Structure遗传结构分析,具有一定局限性,因此,在接下来的人工放流评估工作中,利用微卫星分子标记位点的多态性,构建胭脂鱼人工养殖群体家系指纹图谱,依据亲本基因型进行亲子鉴定和谱系鉴定识别出该家系的后代,可为今后野外采集到的胭脂鱼判断其母系信息,同时为人工放流的胭脂鱼个体追溯到亲本提供依据,对人工放流群体与自然群体进行评价。 由于胭脂鱼野生资源日益下降,人工放流工作是恢复和保护野生濒危物种的有效途径,因此对其种质遗传资源监测,选择对多变环境具有更强的适应性和生存能力的遗传多样性高的群体进行人工放流尤为重要。本次实验研究结果表明,三个养殖群体的遗传多样性丰富,对选育优质苗种进行人工放流的工作具有理论的指导意义。人工放流效果的评估一般采用传统的标志重捕法,但此方法只限制于数量少的群体。自2013至2015年渔政局向赣江干流共人工放流15.13万尾胭脂鱼冬片鱼种,每年胭脂鱼放流量较大,标志重捕法是无法满足的。分子标记逐渐成为人工增值放流评估的有效手段,微卫星能提供精确的遗传信息,为动物保护管理以及为动物行为生态学提供依据。本次研究通过野外采集的胭脂鱼个体与三个养殖群体遗传结构的聚类分析,对人工放流进行了初步监测。因此,在未来的胭脂鱼保护工作中应进一步加强其分子水平监测,同时结合人工传统方法监测,这对胭脂鱼人工增殖放流效果评估起到关键作用。 [1]张春光,赵亚辉,康景贵.我国胭脂鱼资源现状及其资源恢复途径的探讨[J].自然资源学报,2000,15(2):155 -159. [2]吴国犀,刘乐和,王志玲,等.葛洲坝水利枢纽坝下宜昌江段胭脂鱼的年龄与生长[J].淡水渔业,1990(2):3-8. [3]张春光,赵亚辉.长江胭脂鱼的洄游问题及水利工程对其资源的影响[J].动物学报,2001,47(5):518-521. [4]汪 松,乐佩琦,陈宜瑜.中国濒危动物红皮书鱼:类[M]. 北京:科学出版社,1998. [5]伍献文,杨干荣,乐佩琦,等.中国经济动物志-淡水鱼类(第二版)[M].北京:科学出版社,1979:32 -33. [6]梁维波,于深礼.辽宁近海渔场海蜇增殖放流情况回顾与发展的探讨[J].中国水产,2007,26(7):72-74. [7] Raquel G, Teresa A, Susana L, et al. Conservation genetics of the endangered Dorcas gazelle (Gazelladorcasspp.) in Northwestern Africa [J]. Conserv Genet, 2012, 13(4):1003-1015. [8] Hulak M, Kaspar V, Kohlmann K, et al. Microsatellite-based genetic diversity and differentiation of foreign common carp (Cyprinuscarpio) strains farmed in The Czech Republic [J]. Aquaculture, 2010, 298(3): 194-201. [9] Borrell Y J, Alvarez J, Blanco G, et al. A parentage study using microsatellite loci in a pilot project for aquaculture of the European anchovy Engraulis encrasicolus L [J]. Aquaculture, 2011, 310(3): 305-311. [10] Ruan X H, Wang W J, Kong J, et al. Genetic linkage mapping of turbot (ScophthalmusmaximusL.) using microsatellite markers and its application in QTL analysis [J]. Aquaculture, 2010, 308(3): 89-100. [11]何舜平,乐佩琦,陈宜瑜.鲤形目鱼类咽齿形态及发育的比较研究[J].动物学报,1997,43(3):255-262. [12]周剑光,杨德国,吴国犀,等.胭脂鱼仔幼鱼发育及苗种培育技术[J].华中农业大学学报,1999,18(3):263-267. [13]祝东梅,杨 坤,王卫民,等.中国胭脂鱼的细胞遗传学分析[J].中国水产科学,2013,20(3):682-688. [14]杨 钟,史 方,阙延福,等.长江胭脂鱼人工放流子一代遗传多样性初步研究[J].水生态学杂志,2010,3(5):17-20. [15]成为为,汪登强,危起伟,等.基于微卫星标记对长江中上游胭脂鱼增殖放流效果的评估[J].中国水产科学,2014,21(3):574-580. [16] Cheng W,Wang D,Du H,et al.Isolation and characterization of 23 microsatellite loci in the Chinese sucker(Myxocyprinusasiaticus)[J].Conserv Geneti Resour,2012,5(2):375-377. [17] Li P, Zhang Y, Peng Z. Development of 34 new microsatellite markers for the endangered Chinese sucker (Myxocyprinusasiaticus) using 454 sequencing [J]. Conserv Genet Resour, 2013, 5(2): 441-444. [18] Raymond M, Rousset F. GENEPOP (version 1.2): population genetics software for exact tests and ecumenicism[J]. J Hered, 1995, 86(3): 248-249. [19]王长忠,梁宏伟,邹桂伟,等.长江中上游两个鲢群体遗传变异的微卫星分析[J].遗传,2008,30(10):1341-1348. [20] Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software structure : a simulation study[J].Mol Ecol, 2005, 14(8): 2611-2620. [21]李 莉,孙振兴,杨树德,等.用微卫星标记分析皱纹盘鲍群体的遗传变异[J].遗传,2006,28(12):1549-1554. [22] Botstein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. Am J Hum Genet, 1980, 32(3): 314-331. [23]季维智,宿 兵.遗传多样性研究的原理与方法[M].杭州:浙江科学技术出版社,1999. [24] Sophie Hubert D H. Linkage maps of microsatellite DNA markers for the pacific oyster crassostrea gigas [J]. Genetics, 2004, 168(1): 351-362. [25] Cordeiro G M, Maguire T L, Edwards K J, et al. Optimisation of a microsatellite enrichment technique inSaccharumspp [J]. Plant Mol Biol Rep, 1999, 17(3): 225-229. [26] Thorpe J P. The molecular clock hypothesis: biochemical evolution, genetic differentiation and systematics [J]. Annual Rev Ecol Systematics, 2003, 13(4): 139-168. [27] Sunnucks P. Efficient genetic markers for population biology [J]. Trends in Ecology & Evolution, 2000, 15(15): 199-203. [28] Wright S. Evolution and the genetics of populations [M]. Variability within and among natural populations. Chicago:University of Chicago Press, 1978. [29] Boivin T, Bouvier J C, Beslay D, et al.Variability in diapause propensity within populations of a temperate insect species: interactions between insecticide resistance genes and photoperiodism [J]. Biol J Linn Soc, 2004, 83(3): 341-351.[30] Crawford A M, Littlepohn R P. The use of DNA marker in deciding conservation priorities in sheep and other livestock [J]. Anim Genet Resour Inf, 1998, 23(1): 21-26. (责任编辑:张潇峮) Genetic diversity of Myxocyprinus asiaticus cultured population based on microsatellite molecular marker and analysis of the artificial release monitoring HU Xin-yan1, LIU Xiong-jun1, ZHOU You-yang1, WU Xiao-ping1,2, OUYANG Shan1 ( 1.SchoolofLifeSciences,NanchangUniversity,Nanchang330031,China; 2.CenterforWatershedEcologyInstituteofLifeScience,NanchangUniversity,Nanchang330031,China) Study was conducted on genetic diversity and genetic structure of first filial generation based on microsatellite molecular marker for Chongqing, Yongfeng and Xingan breeding bases, China. The results showed that 13 microsatellite loci was polymorphism and the number of allele was 8~16. The range of PIC, Shannon diversity index, observed heterozygosity, expected heterozygosity, Hard-Weinberg genetic deviation index were 0.35~0.84, 1.61~1.64, 0.108 1~0.825 5, 0.384 6~0.856 8, 0.718 9~0.072 5, respectively. The results indicated three cultured population had higher genetic diversity. Genetic structure of population analysis showed that the three populations had genetic divergence, and cultured population in the Xingan city was conspicuous. Analysis of genetic structure of 5 samples collected from the Ganjiang River inferred that they come from the first filial generation in Yongfeng and Xingan breeding base, and the result provided basis for artificial releasing monitoring. microsatellite;Myxocyprinusasiaticus; genetic diversity; releasing monitoring 2016-06-04; 2016-09-08 江西省科技重点项目(12003890);赣鄱英才“555”工程领军人才培养计划(18000041);科技基础性工作专项“罗霄山脉地区生物多样性综合科学考察”(2013FY111500) 胡新艳, (1991- ),女,硕士,专业方向为水生生物学。E-mail: huxinyan1234@163.com 欧阳珊。E-mail: ouys1963@qq.com S917.4 A 1000-6907-(2017)01-0035-07
