团头鲂Toll样受体II基因的克隆与表达分析
2017-02-09马洁乐刘小玲
李 洁,王 虹,周 洋,马洁乐,刘小玲,林 蠡
(华中农业大学水产学院水生动物医学系,农业部淡水生物繁育重点实验室,武汉 430070)
团头鲂Toll样受体II基因的克隆与表达分析
李 洁,王 虹,周 洋,马洁乐,刘小玲,林 蠡
(华中农业大学水产学院水生动物医学系,农业部淡水生物繁育重点实验室,武汉 430070)
为了研究团头鲂(Megalobramaamblycephala)TLR2(maTLR2)在抗嗜水气单胞菌(Aeromonashydrophila)感染中的作用,本实验克隆了maTLR2基因的cDNA全长。结果显示:maTLR2基因cDNA的全长包括2923 bp,编码792个氨基酸。预测得到的maTLR2的结构域包括一个信号肽、氨基端的亮氨酸重复基序(LRRs)、跨膜结构域(TM)和一个胞内的Toll/白介素(IL)-1受体区(TIR)。在嗜水气单胞菌感染后,团头鲂头肾中,TLR2的表达量在6 h时显著升高。TLR2下游相关的炎症细胞因子TNF-α的表达量也显著上调。结果表明maTLR2在嗜水气单胞菌感染团头鲂后的免疫应答中起到了重要作用。
团头鲂(Megalobramaamblycephala);Toll样受体II ;表达
先天性免疫系统是宿主防御的古老形式,是无脊椎动物和脊椎动物机体抵抗入侵病原微生物的有效防线[1]。在水生环境中,鱼类保护自己免受各种病原微生物侵入的主要方式是通过先天或特异性免疫进行的[2]。模式识别受体(pattern recognition receptors ,PRRs)是先天性免疫的重要组成部分。PRRs识别病原体中病原体相关分子模式,触发信号通路,激活免疫细胞以应对病原体感染[3]。
Toll样受体(Toll like receptors,TLRs)家族是PRRs中的一类[4]。TLRs是Ⅰ型跨膜蛋白,包括三个部分,即一个胞外氨基端亮氨酸重复基序,一个跨膜区,以及一个胞内羧基端Toll/IL-1受体区(TIR)。胞外的LRRs是多变的,但是TIR结构域却高度保守[5]。TLRs在识别病原体相关模式分子之后,下游信号的转导主要是通过TLRs的TIR与下游接头分子的特异性结合,从而将信号转导至下游途经。TLR信号途径大致可分为两种:与炎症因子产生相关的髓样分化因子88(myeloid differentiation factor 88,MyD88)-依赖和与干扰素产生相关的MyD88-非依赖的途径。大部分的TLRs成员是依赖于MyD88信号途径转导信号的[6], TLR4是同时拥有两个信号途径的TLR。
嗜水气单胞菌(Aeromonashydrophila,Ah)隶属于气单胞菌科(Aermonadaceae)气单胞菌属(Aeromonas),为革兰氏阴性短杆菌,其广泛分布于自然界的各类水体、土壤和水生动物[7]。嗜水气单胞菌分为致病性和非致病性菌株。致病性菌株可引起多种淡水养殖品种急性出血性败血症,并导致鱼类大量死亡[8]。嗜水气单胞菌可感染草鱼(Ctenopharyngodonidellus)[9]、团头鲂(Megalobramaamblycephala)[10]、鲫(Carassiusauratus)[11]、鲢(Hypophthalmichthysmolitrix)、罗非鱼(Oreochromisniloticus)[12]、黄颡鱼(Pelteobogrusfulvidraco)[13]等养殖品种。团头鲂作为我国淡水养殖系统中重要的一种鲤科鱼类,因其肉质鲜美,深受广大消费者的青睐,具有很高的经济价值。然而,细菌性疾病会导致大量的团头鲂死亡,从而给团头鲂养殖造成极大损失。而嗜水气单胞菌感染就是引起团头鲂细菌性疾病的一种。本研究通过研究团头鲂在嗜水气单胞菌感染后,先天性免疫相关的基因TLR2以及其下游相关的炎症细胞因子TNF-α的表达变化,从而探究其免疫防御机制。这为更深一步了解细菌感染后,团头鲂抵御病原侵害时先天性免疫发挥的作用具有重要意义。
1 实验材料与方法
1.1 实验材料
实验团头鲂(体重100 g)购自湖北百荣水产良种有限公司,在华中农业大学水产基地淡水循环养殖系统中(水温25~26 ℃)暂养。实验前,暂养两周。嗜水气单胞菌由本实验室保存。
1.2 实验方法
1.2.1 总RNA的提取
取30~50 mg的团头鲂头肾,加入Trizol试剂,充分研磨至匀浆液呈无颗粒透明状。采用RNAiso Plus试剂盒(TAKARA),用微量核酸测定仪NanoDrop 2000测定RNA样品的浓度及在260 nm与280 nm处吸光值。cDNA 合成按照Takara公司PrimeScript®RT reagent Kit with gDNA Eraser 试剂盒(TAKARA)说明书进行操作。
1.2.2 团头鲂TLR2基因cDNA片段的克隆
由于团头鲂与草鱼的亲缘关系近,所以本实验先参照草鱼TLR2(ACT68333.1)克隆出团头鲂TLR2的一段核心片段。根据核心片段的序列设计引物进行5′-RACE和3′-RACE,根据3′-Full RACE Core Set with PrimeScriptTMRTase和5′-Full RACE Kit with TAP试剂盒(TAKARA)操作步骤,以团头鲂头肾cDNA为模板进行套式PCR,得到团头鲂TLR2的cDNA全长。
1.2.3 生物信息学分析
cDNA序列使用NCBI BLAST程序(http://www.ncbi.nlm.nih.gov/blast)进行同源性分析,使用ORF finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)进行开放阅读框的寻找,使用ProtParam tool (http://web.expasy.org/protparam/)进行蛋白分子量及等电点的预测,使用Prosite (http://prosite.expasy.org/prosite.html)预测其蛋白结构域预测分析,使用Signal P (http://www.cbs.dtu.dk/services/SignalP/)预测序列信号肽,使用TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域。使用Mega6程序进行序列比对。系统进化树用MEGA6构建,重复1 000次。
1.2.4 细菌感染团头鲂后头肾中TLR2和TNF-α的表达变化
感染实验参照Wang等[10]的方法。将健康团头鲂48尾随机平均分为2组,实验组腹腔注射100 μL嗜水气单胞菌悬液(3×107CFU/mL),对照组注射等量的0.65%生理盐水。在注射后0、6、9、12、24和48 h取样,每个时间点每组分别取3尾鱼解剖,取头肾组织,立即投入液氮中保存,后转入-80 ℃冰箱保存用于组织RNA提取。Trizol裂解组织后,提取样品总RNA,反转录得到cDNA以备荧光定量实验所用。基因表达的定量分析通过罗氏公司的480荧光定量PCR仪完成,95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火20 s,72 ℃延伸20 s,共40个循环。每个样品设定3组重复,PCR反应结束后,分析其溶解曲线确保反应的特异性,β-actin作为内参。数据以Cp值输出,相对定量分析釆用2-ΔΔCP法。SPSS 16.0软件进行统计分析,P<0.05差异显著。
2 结果
2.1 maTLR2基因cDNA全长及序列特征
PCR扩增得到的产物经过纯化、连接转化、测序之后,得到的序列片段经过DNAstar软件拼接后,除去重叠序列和接头序列,最后得到团头鲂TLR2的cDNA全长序列(所用引物见表1)。如图1和图2所示,maTLR2的cDNA全长为2 923 bp,其中开放阅读框为2 379 bp,5′非编码区为174 bp,3′非编码区为370 bp,编码792个氨基酸。使用EXPASY ProtParam网站预测分析蛋白质的理化性质,推测maTLR2蛋白的分子质量是90.21 KDa,等电点7.07。使用TMHMM预测出maTLR2的跨膜结构域在585~607 AA。使用Signal P预测出maTLR2的信号肽在1~22。使用EXPASY网站预测出maTLR2拥有9个LRR,一个TIR区。
表1 本实验所用引物
Tab.1 Primers used in these experiments

引物名称序列(5'→3')引物用途TF1(forward)GTCTCCCACCCTGAAACTCTGCT核心片段1扩增TF1(reverse)GTATCCATGCTTTAGTCATCTGC核心片段1扩增TF2(forward)CTTGGCCTTGACCTGTCTTT核心片段2扩增TF2(reverse)AGCAGAGTTTCAGGGTGGGAGAC核心片段2扩增5'TR1(reverse)TTACCGAATCTACCCGAGTG5'RACE5'TR2(reverse)TATGTGTTCCTCCGTAAGTTTAGAGTTGC5'RACE5'RACEOuterPrimerCATGGCTACATGCTGACAGCCTA5'RACE5'RACEInnerPrimerCGCGGATCCACAGCCTACTGATGATCAGTCGATG5'RACE3'TF1(forward)TTTATGGAACTGCCACAGGGGGAA3'RACE3'TF2(forward)TGTGCTCCTGCGAGTTTGTATCTTTCTTC3'RACE3'RACEOuterPrimerTACCGTCGTTCCACTAGTGATTT3'RACE3'RACEInnerPrimerCGCGGATCCTCCACTAGTGATTTCACTATAGG3'RACETLR2-qF(forward)GTCCCATCGGTTTAGTCTqRT-PCRTLR2-qR(reverse)TAGTCCCACCTTCTTTCGqRT-PCRβ-actinF(forward)ACCCACACCGTGCCCATCTAqRT-PCRβ-actinR(reverse)CGGACAATTTCTCTTTCGGCTGqRT-PCRIL-1βF(forward)GTGCCAGGTGCCAAGTAGCqRT-PCRIL-1β-R(reverse)AAGCCCAAGATATGCAGGAGTqRT-PCRTNF-αF(forward)CCGCTGCTGTCTGCTTCAqRT-PCRTNF-αR(reverse)GCCTGGTCCTGGTTCACTCTqRT-PCR



图1 团头鲂TLR2核苷酸对应氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of maTLR2
起止密码子用加粗字体表示,*代表的是终止密码子。波浪线:信号肽(Signal P);灰色:LRR(亮氨酸重复基序);方框:TM(跨膜结构域);双下划线:TIR(Toll/IL-1 受体区)。mRNA不稳定基序(ATTTA)用下划线表示。
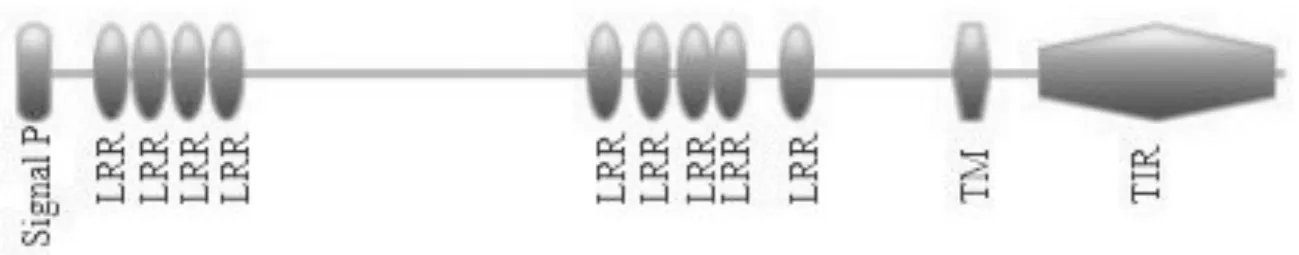
图2 团头鲂TLR2结构预测图Fig.2 The diagram of TLR2 of M.amblycephala
2.2 maTLR2基因同源性及系统进化分析
为了得到maTLR2的进化信息,分别从NCBI数据库中选取20种TLR2的蛋白序列,其中包括11种鱼类TLR2的蛋白序列,1种鸟类的蛋白序列,8种哺乳动物的蛋白序列,并将其进行BLAST分析,表2显示同源性分析及进化树分析所用物种的蛋白名称、序列登录号及比对结果。由进化树可看出,团头鲂与鲤、鲫、印度鲮、草鱼和斑马鱼聚为鲤形目的一簇,其中团头鲂TLR2与草鱼TLR2的亲缘关系最近。12种鱼类TLR2组成了硬骨鱼类的分支,同时与鸟类和哺乳动物聚为脊椎动物分支(图3),这与传统分类学相匹配。
2.3 maTLR2及TNF-α在嗜水气单胞菌的感染后的表达变化
采用Real time PCR检测在嗜水气单胞菌攻毒后,团头鲂免疫相关组织头肾中maTLR2基因在mRNA水平上的表达变化。在处理后的6、9、12、24和48 h取样分析。β-actin作为内参基因。每个实验样本至少有三个重复。实验数据均为平均值±标准差显示。星号显示的与对照组的显著性差异(P<0.05)。误差线显示的标准差。团头鲂头肾中,TLR2的表达变化趋势如图4所示。在头肾中,TLR2在6 h时出现峰值,急剧上升至对照组的2.68倍(P<0.05),之后迅速恢复到注射前的水平。大体上来说就是在嗜水气单胞菌注射团头鲂后,头肾中maTLR2的瞬时表达量显著升高。
细菌感染通常会引起机体的炎症反应,为获得关于团头鲂机体中细胞因子的信息,本实验也检测了团头鲂头肾中TNF-α的表达变化。如图4所示,TNF-α的表达模式与maTLR2的相似,大体符合单峰型的表达模式。即在感染后的6 h表达量迅速上升,达到对照组的2.14倍(P<0.05),然后显著降低。
表2 TLR2蛋白序列同源性和进化树所用物种蛋白及序列登录号
Tab.2 Species,protein and accession number of TLR2 used in the homologous and phylogenetic analysis,andthe amino acid sequence identities between maTLR2 and other organisms.
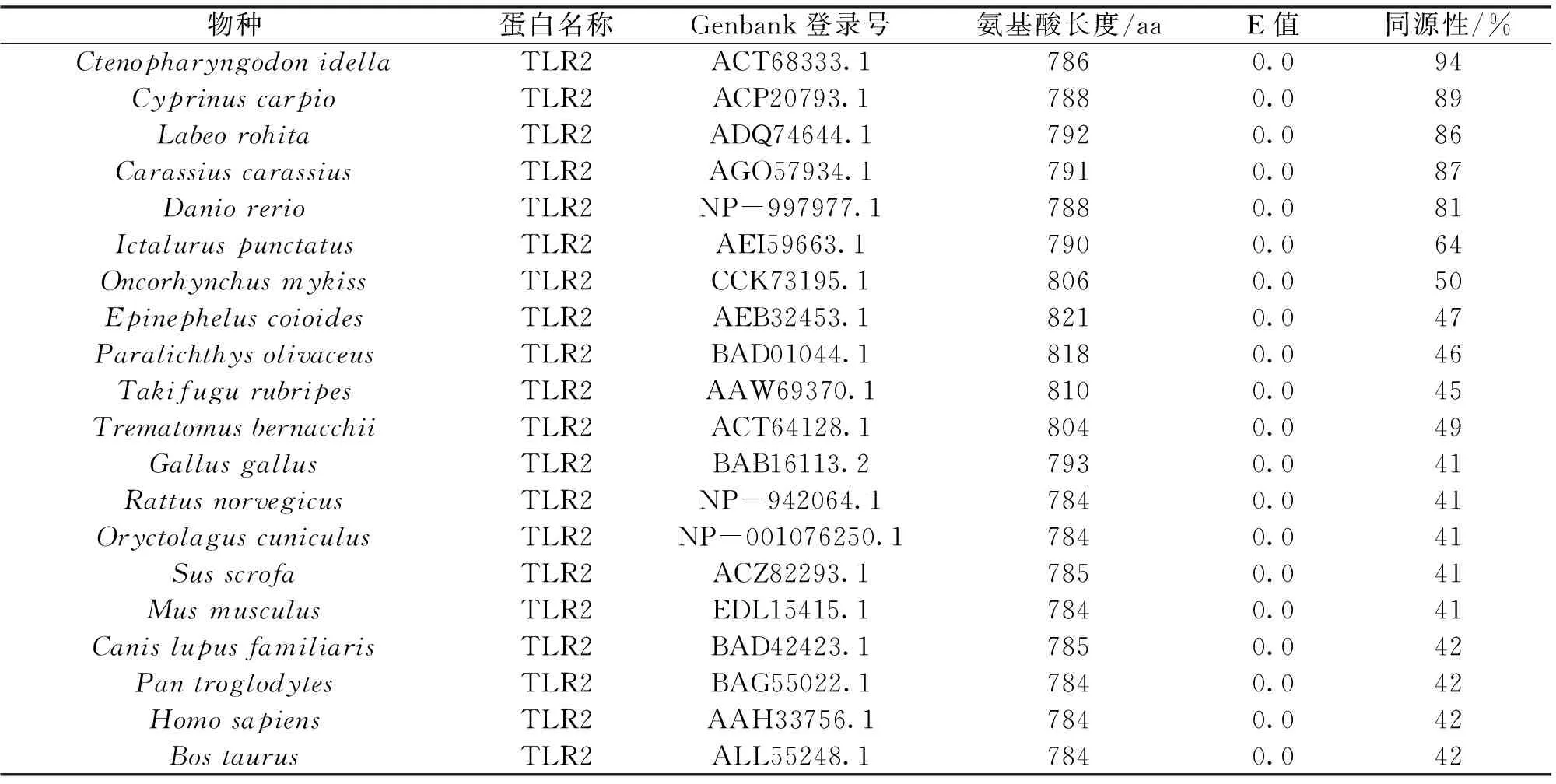
物种蛋白名称Genbank登录号氨基酸长度/aaE值同源性/%CtenopharyngodonidellaTLR2ACT68333.17860.094CyprinuscarpioTLR2ACP20793.17880.089LabeorohitaTLR2ADQ74644.17920.086CarassiuscarassiusTLR2AGO57934.17910.087DaniorerioTLR2NP-997977.17880.081IctaluruspunctatusTLR2AEI59663.17900.064OncorhynchusmykissTLR2CCK73195.18060.050EpinepheluscoioidesTLR2AEB32453.18210.047ParalichthysolivaceusTLR2BAD01044.18180.046TakifugurubripesTLR2AAW69370.18100.045TrematomusbernacchiiTLR2ACT64128.18040.049GallusgallusTLR2BAB16113.27930.041RattusnorvegicusTLR2NP-942064.17840.041OryctolaguscuniculusTLR2NP-001076250.17840.041SusscrofaTLR2ACZ82293.17850.041MusmusculusTLR2EDL15415.17840.041CanislupusfamiliarisTLR2BAD42423.17850.042PantroglodytesTLR2BAG55022.17840.042HomosapiensTLR2AAH33756.17840.042BostaurusTLR2ALL55248.17840.042
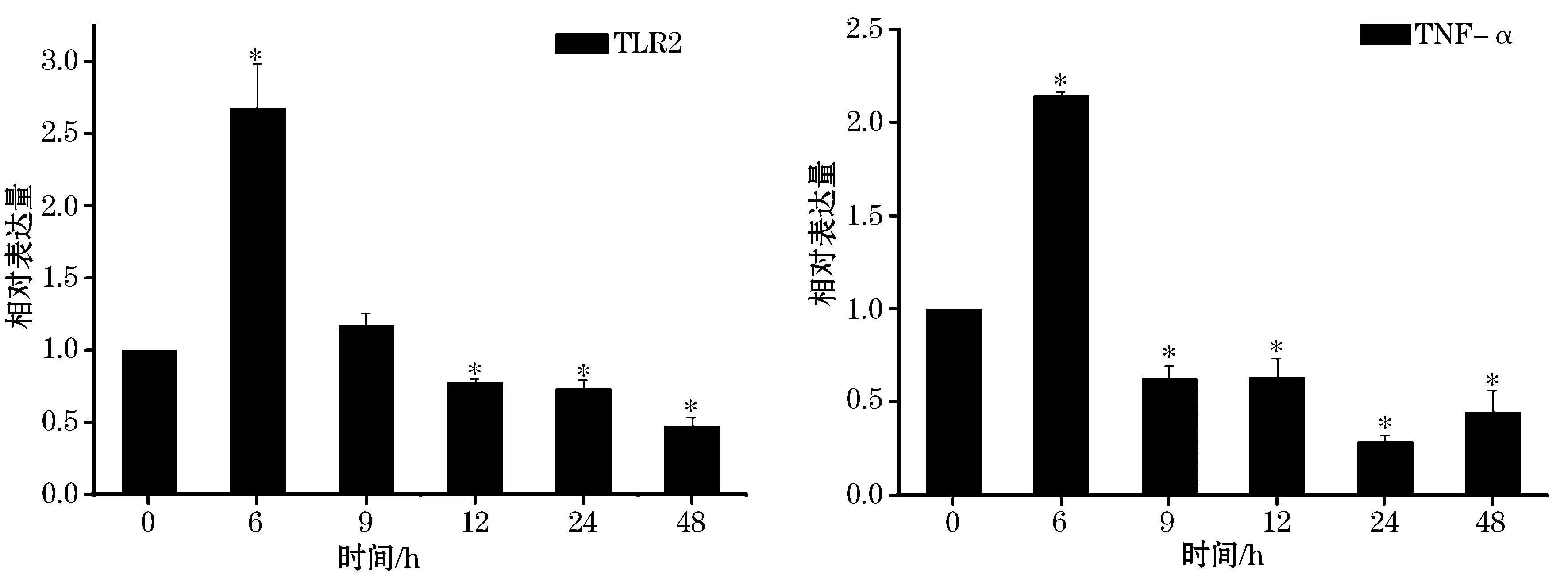
图4 嗜水气单胞菌感染后,团头鲂头肾中TLR2 (A)和TNF-α (B)在mRNA水平的表达变化Fig.4 Relative expression of maTLR2 (A) and TNF-α (B) at the mRNA level in head kidney after A.hydrophila infection
3 讨论
Toll样受体识别细菌、真菌、原生动物的组成部分,并引起炎症反应,在模式识别受体中扮演重要角色。本实验克隆了团头鲂的TLR2的cDNA全长序列,由预测结构域可看出,团头鲂TLR2符合TLRs的结构特征,即含有一个信号肽、多个LRR、一个跨膜结构域、一个TIR区。由于头肾是鱼类重要的免疫器官,所以本实验在细菌刺激后,检测了团头鲂头肾中TLR2的表达变化。在嗜水气单胞菌刺激团头鲂后,团头鲂TLR2 在头肾中的瞬时表达量显著升高,同时检测了典型的炎症细胞因子TNF-α的表达变化。由结果可看出,TNF-α的瞬时表达量也同时显著升高。本实验说明TLR2在嗜水气单胞菌感染团头鲂时起到了免疫调节作用。
TLR胞外的LRR段呈马蹄形,可以形成同型或异型二聚体,如TLR1/TLR2、TLR2/TLR6、TLR3/TLR3或TLR4/TLR4[14]。TLR2识别细菌、真菌和病毒的多种成分。TLR2是通过与TLR1或者TLR6形成二聚体来识别配体的[5,15]。也有研究证明了TLR2可以和受体相互影响以发挥作用。Good等[16]证明了,脂多糖诱导TLR4信号途径时需要TLR2的参与。Xaplanteri等[17]研究发现在绿脓杆菌刺激下,MR与TLR2协同作用激活促炎性反应。Tachado等[18]的研究说明在巨噬细胞中,肺孢子虫介导的IL-8的释放是要通过MR和TLR2的共表达。这些都说明了TLR2在识别病原微生物时,是与多种受体相互影响着起作用的。TLR2识别嗜水气单胞菌的机理需要进行更进一步的研究。MR在识别病原菌和介导机体先天免疫应答过程中具有重要作用[19],本实验室已经证明了在嗜水气单胞菌感染后,团头鲂和草鱼的MR都参与了机体抗细菌感染的免疫反应[10],且团头鲂MR对细菌的识别依赖于钙离子[20]。本实验对于TNF-α的释放同maTLR2-MR-NF-κB之间是否存在联系还不清楚,其具体的分子机理还需深入研究。
[1]Rauta P R,Samanta M,Dash H R,et al.Toll-like receptors (TLRs) in aquatic animals:signaling pathways,expressions and immune responses[J].Immunol Lett,2014,158(1-2):14-24.
[2]Pietretti D,Wiegertjes G F.Ligand specificities of Toll-like receptors in fish:indications from infection studies[J].Dev Comp Immunol,2014,43(2):205-222.
[3]Basu M,Paichha M,Lenka S S,et al.Hypoxic stress:impact on the modulation of TLR2,TLR4,NOD1 and NOD2 receptor and their down-stream signalling genes expression in catla (Catlacatla)[J].Mole Biology Rep,2016,43(1):1-9.
[4]Tang D,Kang R,Coyne C B,et al.PAMPs and DAMPs:signal 0s that spur autophagy and immunity[J].Immunol Rev,2012,249(1):158-175.
[5]Akira S,Takeda K.Toll-like receptor signalling[J].Nat Rev Immunol,2004,4(7):499-511.
[6]叶 华,朱成科,郑宗林,等.齐口裂腹鱼MyD88基因的cDNA序列及特征分析[J].淡水渔业,2014,44(1):14-19.
[7]孙金辉,王庆奎,陈成勋,等.嗜水气单胞菌灭活疫苗对虹鳟免疫力和抗病力的影响[J].淡水渔业,2013,43(1):44-49.
[8]郑宗林,郑曙明,Gatlin D M,等.嗜水气单胞菌外膜蛋白ompA基因的原核表达及免疫保护性研究[J].淡水渔业,2015,45(5):3-10.
[9]Wang L,Liu L,Zhou Y,et al.Molecular cloning and expression analysis of mannose receptor C type 1 in grass carp (Ctenopharyngodonidella)[J].Dev Comp Immunol,2014,43(1):54-58.
[10]Liu X,Tang X,Wang L,et al.Molecular cloning and expression analysis of mannose receptor in blunt snout bream (Megalobramaamblycephala)[J].Mole Biol Rep,2014,41(7):4601-4611.
[11]Zhang J,Li L,Kong X,et al.Expression patterns of Toll-like receptors in natural triploidCarassiusauratusafter infection withAeromonashydrophila[J].Vet Immunol Immunopathol,2015,168(1-2):77-82.
[12]Musthafa M S,Ali A R J,Mohamed M J,et al.Protective efficacy of Azomite enriched diet inOreochromismossambicusagainstAeromonashydrophila[J].Aquaculture,2016,451:310-315.
[13]Wang Y,Ke F,Ma J,et al.A tandem-repeat galectin-9 involved in immune response of yellow catfish,Pelteobagrusfulvidraco,againstAeromonashydrophila[J].Fish Shellf Immunol,2016,51:153-160.
[14]余益本,王建平.TLR信号通路研究进展[J].细胞与分子免疫学杂志,2012,28(12):1304-1311.
[15]Trinchieri G,Sher A.Cooperation of Toll-like receptor signals in innate immune defence[J].Nat Rev Immunol,2007,7(3):179-190.
[16]Good D W,George T,Watts B A.Toll-like receptor 2 is required for LPS-induced Toll-like receptor 4 signaling and inhibition of ion transport in renal thick ascending limb[J].J Biol Chem 2012,287 (24):20208-20220.
[17]Xaplanteri P,Lagoumintzis G,Dimitracopoulos G,et al.Synergistic regulation ofPseudomonasaeruginosa-induced cytokine production in human monocytes by mannose receptor and TLR2[J].Eur J Immunol,2009,39(3):730-740.
[18]Tachado S D,Zhang J,Zhu J,et al.Pneumocystis-mediated IL-8 release by macrophages requires coexpression of mannose receptors and TLR2[J].J Leukoc Biol,2007,81(1):205-211.
[19]刘小玲,曾令兵.甘露糖受体结构、功能、表达和应用研究的新进展[J].水产学杂志,2013,26(1):54-59.
[20]Zhao X,Liu L,Hegazy A M,et al.Mannose receptor mediated phagocytosis of bacteria in macrophages of blunt snout bream (Megalobramaamblycephala) in a Ca(2+)-dependent manner[J].Fish Shellf Immunol,2015,43(2):357-363.
(责任编辑:张潇峮)
Cloning and expression of Toll-like receptor 2 in Megalobrama amblycephala
LI Jie,WANG Hong,ZHOU Yang,MA Jie-le,LIU Xiao-ling,LIN Li
(DepartmentofAquaticAnimalMedicines,CollegeofFisheries,HuazhongAgriculturalUniversity/KeyLabofFreshwaterAnimalBreeding,MinistryofAgriculture,Wuhan430070,China)
In this study,in order to clarify the function of TLR2 inMegalobramaamblycephala(maTLR2) during the infection ofAeromonashydrophila,we clonedmaTLR2,and analyzed the expression change ofmaTLR2 during the bacterial infection.The full-length cDNA ofmaTLR2 contained 2923 bp encoding a putative protein of 792 amino acid.The predicted amino acid sequences showed thatmaTLR2 contained a signal peptide,N-terminal leucine-rich repeats (LRRs),a trans-membrane region (TM) and a cytoplasmic toll/interleukin (IL)-1R homology (TIR) domain.Temporal expression ofmaTLR2 mRNA transcripts in head kidney ofM.amblycephalawas significantly increased at 6h after the infection ofA.hydrophila.TLR2 downstream related molecular TNF-α also up-regulated.These finding suggested thatmaTLR2 is a critical part in the immune responses ofA.hydrophilainfection.
Megalobramaamblycephala;Toll-like receptor 2;expression
2016-04-11;
2016-08-08
湖北省科技支撑计划(2015BBA228;YSF2015000255)
李 洁(1989- ),女,硕士,专业方向为鱼类病害与免疫研究。E-mail:li1005@hotmail.com
刘小玲。E-mail:liuxl@mail.hzau.edu.cn
S917.4
A
1000-6907-(2017)01-0022-08
