化工流程题的解题指导
2017-02-06王晓波
王晓波
(内蒙古赤峰市林东第一中学化学教研组 025450)
从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力.将实际问题分解,通过运用相关知识, 采用分析、综合的方法,解决简单化学问题的能力.将分析和解决问题的过程及成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力.纵观近几年来对这些“能力”的要求基本没有变化,且这些能力要求主要体现在工艺流程题中,考试说明中已将此试题列入样题中,说明这类试题能更好地体现考试说明要求,重能力轻记忆.
一、解题指导
类型一物质制备类化工流程题
1.熟悉常用的操作方法及其作用
(1)对原料进行预处理的常用方法及其作用:
①研磨——减小固体的颗粒度,增大固体与液体或气体间的接触面积,加快反应速率.
②水浸——与水接触反应或溶解.
③酸浸——与酸接触反应或溶解,使可溶性金属进入溶液,不溶物通过过滤除去.
④灼烧——除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质.
⑤煅烧——改变结构,使一些物质能溶解.并使一些杂质在高温下氧化、分解,如煅烧高岭土.
(2)常用的控制反应条件的方法:
①调节溶液的pH.常用于使某些金属离子形成氢氧化物沉淀.调节pH所需的物质一般应满足两点:
a.能与H+反应,使溶液pH增大;
b.不引入新杂质.
例如:若要除去Cu2+中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等.
②控制温度.根据需要升温或降温,改变反应速率或使平衡向需要的方向移动.
③趁热过滤.防止某物质降温时会析出.
④冰水洗涤.洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗.
2.识别流程图
化工流程中箭头指出的是投料(反应物),箭头指向的是生成物(包括主产物和副产物),返回的箭头一般是被“循环利用”的物质.
类型二提纯类化工流程题
1.明确常用的提纯方法
(1)水溶法:除去可溶性杂质.
(2)酸溶法:除去碱性杂质.
(3)碱溶法:除去酸性杂质.
(4)氧化剂或还原剂法:除去还原性或氧化性杂质.
(5)加热灼烧法:除去受热易分解或易挥发的杂质.
(6)调节溶液的pH法:如除去酸性溶液中的Fe3+等.
2.明确常用的分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法.
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴.
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl.
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等.
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇或甘油.
(6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气.
二、答题模板
(1)除杂:除去……中的……
(2)干燥:除去……气体中的水蒸气,防止……
(3)增大原料浸出率(离子在溶液中的含量多少)的措施:搅拌、升高温度、延长浸出时间、增大气体的流速(浓度、压强),增大气液或固液接触面积.
(4)加热的目的:加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动.
(5)温度不高于××℃的原因,适当加快反应速率,但温度过高会造成挥发(如浓硝酸)、分解(如H2O2、NH4HCO3)、氧化(如Na2SO3)或促进水解(如AlCl3)等,影响产品的生成.
(6)从滤液中提取一般晶体(溶解度随温度升高而增大)的方法:蒸发浓缩(至少有晶膜出现)、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥.
(7)从滤液中提取溶解度受温度影响较小或随温度升高而减小的晶体的方法:蒸发浓缩、趁热过滤,如果温度下降,杂质也会以晶体的形式析出来、洗涤、干燥.
(8)控制某反应的pH使某些金属离子以氢氧化物的形式沉淀,调节pH所用试剂为主要元素对应的氧化物、碳酸盐、碱,以避免引入新的杂质;pH分离时的范围确定:范围过小导致某离子沉淀不完全,范围过大导致主要离子开始沉淀.
(9)减压蒸馏(减压蒸发)的原因:减小压强,使液体沸点降低,防止(如H2O2、浓硝酸、NH4HCO3)受热分解、挥发.
(10)检验溶液中离子中是否沉淀完全的方法:将溶液静置一段时间后,向上层清液中滴入沉淀剂,若无沉淀生成,则离子沉淀完全.
(11)洗涤沉淀:沿玻璃棒往漏斗中加蒸馏水至液面浸没沉淀,待水自然流下后,重复操作2~3次.
(12)检验沉淀是否洗涤干净的方法:取少量最后一次的洗涤液于试管中,向其中滴入某试剂,若未出现特征反应现象,则沉淀洗涤干净.
(13)洗涤沉淀的目的:除掉附着在沉淀表面的可溶性杂质.
(14)冰水洗涤的目的:洗去晶体表面的杂质离子并降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗.
(15)乙醇洗涤的目的:降低被洗涤物质的溶解度,减少其在洗涤过程中的溶解损耗,得到较干燥的产物.
(16)蒸发、反应时的气体氛围:抑制某离子的水解,如加热蒸发AlCl3溶液时为获得AlCl3需在HCl气流中进行.
(17)事先煮沸溶液的原因:除去溶解在溶液中的(如氧气)防止某物质被氧化.
三、实例解析
例辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
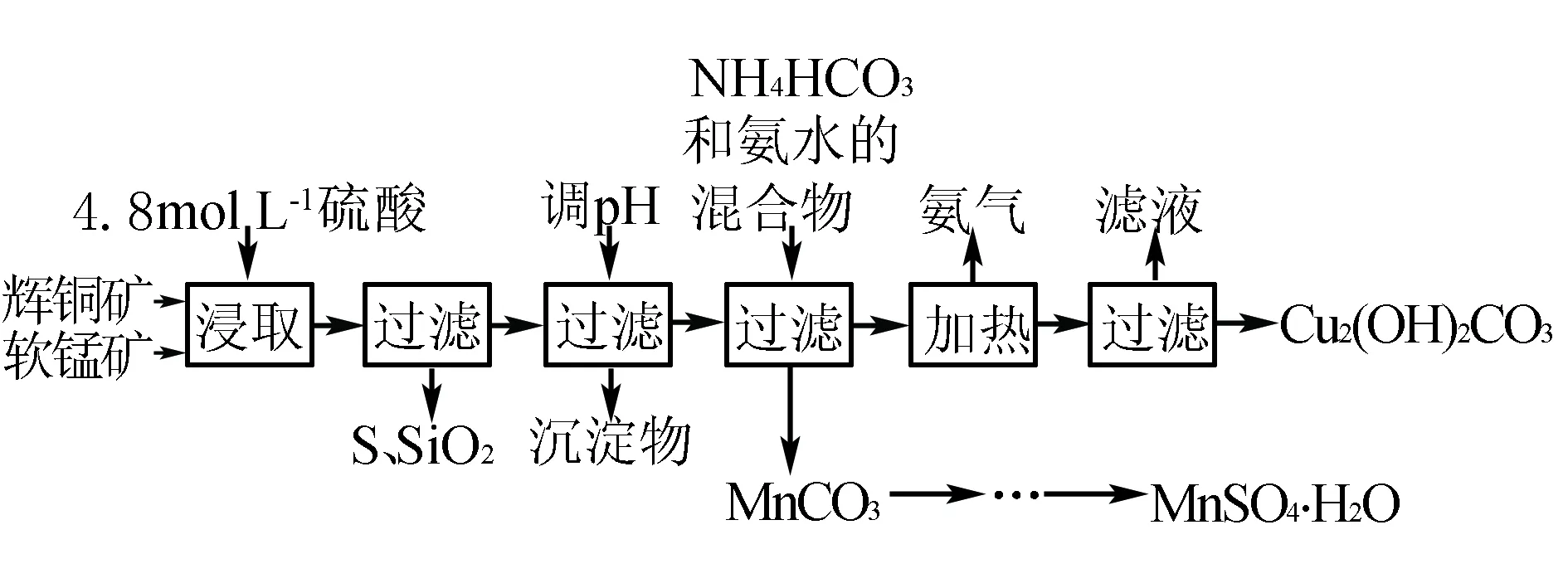
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):

开始沉淀的pH沉淀完全的pHFe3+1.13.2Mn2+8.39.8Cu2+4.46.4
(1)酸浸时,为了提高浸取率可采取的措施有____(任写一点).
(2)调节浸出液pH的范围为____,其目的是____.
(3)本工艺中可循环使用的物质是____(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成的结果是____.
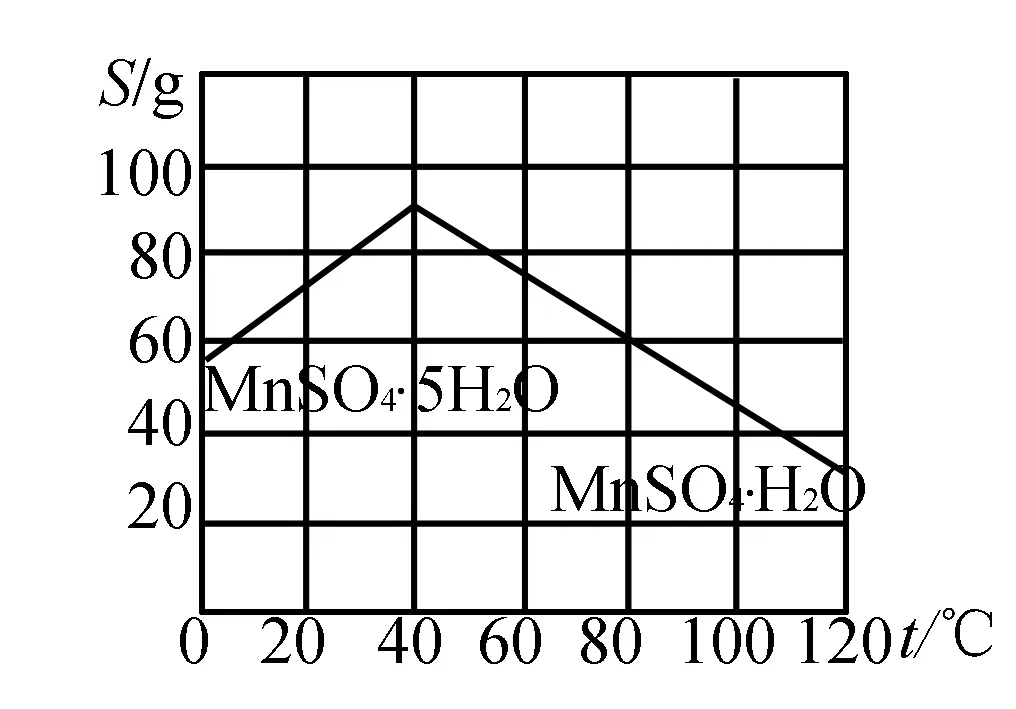
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____.
(6)用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因是____(任写一种).
答案:(1)粉碎矿石(或适当升高温度或搅拌)
(2)3.2≤pH<4.4 使Fe3+转化为Fe(OH)3沉淀而除去
(3)NH3
(4)碱式碳酸铜产量减少
(5)蒸发、结晶温度大于40 ℃,趁热过滤,用酒精洗涤,最后低温干燥
(6)混有硫酸盐杂质或部分晶体失去结晶水
解析(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率.(2)要除去滤液中的Fe3+,pH=3.2,Fe3+完全沉淀,pH=4.4,铜离子开始沉淀,故pH的范围是3.2≤pH<4.4.(3)工艺流程中,加入了氨水,最后又得到了氨气,NH3可循环使用.(4)若加热的温度较低或过高,都会造成碱式碳酸铜减少.(5)由硫酸锰溶液制备MnSO4·H2O需要经过蒸发、结晶温度大于40℃,趁热过滤,用酒精洗涤,最后低温干燥等操作才能实现.(6)质量分数大于100%,说明了硫酸锰晶体中可能混有不分解的硫酸盐杂质或部分硫酸锰晶体失去结晶水.
化工流程题是以流程图为信息给予的一种题型,其考查的核心还是高中化学中所学的元素化合物性质、化学基本理论和基本概念、基本实验操作、基本计算等基础知识,考查的能力点是根据流程图提取信息的阅读能力、根据曲线和表格数据发现规律的分析抽象归纳推理能力及数据处理能力.答好该类试题的根本还是在于牢固掌握教材中的化学基本理论和基本概念、熟练掌握元素化合物的性质制备和用途、通过典型试题的练习训练对典型图表的分析及数据处理能力.遇到具体题目应当具体问题具体对待.
[1]韦民.与名师对话[M].北京:光明日报出版社出版,2017.
