NK4基因联合奥沙利铂对人结肠癌细胞株HCT116凋亡和侵袭的影响
2017-02-06杨柳婷姜蓬垒祖丹丹李美宁张栋常冰梅
杨柳婷 姜蓬垒 祖丹丹 李美宁 张栋 常冰梅
结直肠癌是全球排名第四的恶性肿瘤。以手术治疗为基础联合放疗、化疗、内分泌治疗、靶向治疗等给结直肠癌患者带来较大生存获益,但术后复发转移仍是困扰临床医师的难题[1]。有研究显示结直肠癌的发生、发展及转移与肝细胞生长因子(hepatocyte growth factor,HGF)及其受体 c-MET 高表达相关[2]。HGF 是一种多功能细胞因子,能诱导肿瘤细胞侵袭与迁移;同时也是一种强力促血管生成因子[3]。HGF与受体c-MET结合后,可促使c-MET酪氨酸激酶磷酸化,招募下游效应分子(如Gab1、Grb2、PI3K等),并激活相关信号通路(如PI3K/Akt、Ras/Raf/MEK/ERK等),发挥其生物学效应[4]。基于HGF和c-MET在肿瘤发生、发展中的关键作用,其成为目前重要的潜在治疗靶点[5]。
基因治疗是近年肿瘤治疗领域迅速发展的治疗手段[6]。NK4基因是Date等[7]利用胰弹性蛋白酶消化HGF得到的一个片段。有文献报道,NK4可抑制转染HGF基因的Raji裸鼠淋巴移植瘤生长,可能与NK4竞争性阻断HGF/c-MET及下游信号通路,抑制肿瘤血管生成,进而促进肿瘤细胞凋亡有关[8]。体外研究同样证实NK4对HGF/c-MET信号通路有阻断作用,可抑制肿瘤细胞增殖、转移等[9-10],但NK4单独使用对肿瘤细胞生长的抑制效果并不理想。有研究证实NK4联合传统化疗药物或信号通路抑制剂可获得理想的抗肿瘤效果[11-12]。奥沙利铂是继顺铂和卡铂之后的第三代铂类抗癌药物,具有较好的抗肿瘤效果[13],是目前临床上治疗胃癌及结直肠癌的一线化疗药物[14]。有研究证实,奥沙利铂可通过调控凋亡相关蛋白(如Bcl-2、Bax和Cleaved-caspase 3等)的表达促进肿瘤细胞凋亡[15]。但转移性结直肠癌患者在应用奥沙利铂后不可避免地出现耐药而导致疾病进展[16]。本研究初步探索NK4基因联合奥沙利铂对人结肠癌HCT116细胞凋亡和侵袭的影响及其相关分子机制。
1 材料与方法
1.1 材料
人结肠癌细胞株 HCT116、大肠杆菌 DH5α、pcD-NA3.1及pGEX-4T-1-NK4质粒由山西医科大学生物化学与分子生物学教研室提供;IMDM培养液购自美国Hyclone公司;胎牛血清(FBS)购自杭州四季青生物材料有限公司;引物合成、NK4基因与pcDNA3.1质粒的连接由TaKaRa公司完成;PCR产物回收试剂盒、DNA聚合酶、DNA连接试剂盒、RNAisoPlus均购自日本TaKaRa公司;质粒提取试剂盒购自美国OMEGA公司;非脂质体转染试剂Effectene试剂盒购自德国QIAGEN公司;Annexin V-FITC凋亡试剂盒购自南京凯基生物科技有限公司;Matrigel胶购自美国BD公司;Transwell小室购自美国 Corning公司;Akt和p-Akt一抗购自Cell Signaling公司;β-Actin和辣根酶标记山羊抗兔IgG(H+L)购自北京中杉金桥生物技术有限公司;eECL高灵敏度化学发光试剂盒购自北京康为世纪生物科技有限公司;GELDOC XR凝胶成像仪购自美国BIO-RAD公司。
1.2 NK4基因表达载体构建
以pGEX-4T-1-NK4质粒为模板,以CTS712-F/CTS712-R(CTS712-F:5'-AAGGTACCCCAGCACTGAAGATAAAAAC-3',CTS712-R:5'ACGGATCCGACTATTGTAGGTGTGGTAT-3')为引物进行PCR扩增。PCR条件:92 ℃ 预变性 5 min,92 ℃ 20 s,55 ℃ 20 s,72 ℃2 min,共 30个循环,72 ℃ 8 min,4 ℃ 40 min。将 PCR产物及pcDNA3.1质粒用Kpn I/BamH I双酶切后,琼脂糖凝胶电泳并进行切胶回收。将双酶切目的基因及pcDNA3.1质粒连接并进行双酶切鉴定。CaCl2法将重组质粒转化入大肠杆菌DH5α中,筛选氨苄抗性克隆,摇菌扩增后抽提质粒。
1.3 细胞培养和转染
人结肠癌细胞HCT116用含10%FBS、1%青霉素/链霉素的IMDM培养液,在5%CO2、37℃饱和湿度的细胞培养箱中培养。每3 d换液1次,待细胞铺满瓶底后以0.25%胰蛋白酶消化液消化传代。取对数生长期的HCT116细胞接种于6孔板中,每孔4×105个细胞,按照Effectene试剂盒说明书分别将pcDNA3.1、pcDNA3.1-NK4转染至HCT116细胞中,于37℃、5%CO2饱和湿度条件下培养24 h。本研究设置pcDNA3.1阴性对照组(NC组)、pcDNA3.1-NK4处理组(NK4组)、pcDNA3.1联合奥沙利铂处理组(L-OHP组)和pcDNA3.1-NK4联合奥沙利铂处理组(NK4/LOHP组)4个组别。
1.4 实时荧光定量PCR(qRT-PCR)
用RNAiso Plus提取细胞总 RNA,逆转录条件:总 RNA 500 ng,37 ℃ 15 min,85 ℃ 5 s,4 ℃ 40 min,10 μL体系。Real Time PCR 条件:50 ℃ 2 min,95 ℃10 min预变性,95 ℃ 10 s,55 ℃ 20 s,72 ℃ 10 s,20 μL体系,共计40个循环,检测NK4在空白组、NC组和NK4组细胞中的表达情况。NK4上游引物:5'-GCTATCGGGGTAAAGACCTACA-3',下游引物 5'-CGTAGCGTACCTCTG-GATTGC-3',GAPDH 作为内 参 。qRT-PCR的结果分析采用2-ΔΔCt方法进行相对定量分析。实验重复3次。
1.5 流式细胞术检测细胞凋亡
按照上述步骤进行转染。转染24 h后,按照分组加入奥沙利铂,药物浓度为12.5 μg/mL,作用6 h。细胞继续培养48 h后,取上述4组细胞胰蛋白酶消化后离心,弃上清液,加入200 μL Binding Buffer并重悬细胞,然后加入 10 μL Annexin V-FITC 和 5 μL PI,混匀,避光室温反应15 min。流式细胞仪检测细胞凋亡情况。实验重复3次。
1.6 Transwell小室法检测细胞的侵袭能力
Matrigel基质胶4℃过夜,用无血清培养基稀释8倍后,50 μL每孔铺到Transwell上室,置于37℃孵箱中凝固6 h。按照上述步骤进行转染,调整细胞密度为 1×106/mL,取 100 μL 细胞悬液和 100 μL 无血清培养基加入Transwell上室,下室加入含有20%FBS的培养基500 μL,37℃、5%CO2饱和湿度条件下培养。24 h后擦去上室基质胶,用0.1%结晶紫溶液染色,于倒置显微镜下观察微孔膜下层的细胞,计数并拍照。每组细胞设置3个复孔,实验重复3次。侵袭抑制率(%)=[(对照组侵袭穿膜细胞数-实验组侵袭穿膜细胞数)/对照组侵袭穿膜细胞数]×100%。
1.7 Western blot检测p-Akt蛋白表达水平
不同药物刺激细胞后分别提取蛋白,BCA定量分别得出样品蛋白浓度。配制分离胶和浓缩胶,调整蛋白上样浓度一致,100 V,2 h电泳,随后按照1.5 A/cm2选择恒流转膜1.5~2 h。将PVDF膜浸泡在含5%脱脂奶粉的TBST中,室温封闭1 h,一抗4℃孵育过夜,隔天按照说明书比例室温孵育二抗1~2 h,随后用凝胶成像仪进行发光并记录灰度值。
1.8 统计学分析
采用SPSS 19.0软件进行数据分析,数据用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析(one-way ANOVA),若整体差异有统计学意义,进一步两两比较采用LSD检验,以P<0.05为差异有统计学意义。以金正均Q值法判断NK4和奥沙利铂是否有协同作用。公式:Q=Ea+b/(Ea+Eb-Ea*Eb),其中Ea+b为联合处理组的抑制率,Ea和Eb分别为NK4和奥沙利铂单独处理组的抑制率。Q<0.85时为拮抗作用,0.85≤Q<1.15时为协同相加作用,Q≥1.15时为协同增效作用[17]。
2 结果
2.1 qRT-PCR鉴定转染细胞中目的基因的表达情况
内参基因GAPDH与目的基因NK4的PCR扩增曲线和熔解曲线如图1所示。以常规培养生长的人结肠癌HCT116细胞基因表达水平为100%,qRT-PCR检测结果(表1)显示:NK4组的mRNA表达水平高于NC组和空白组,差异均有统计学意义(P<0.01),NC组与空白对照相比,差异无统计学意义(P=0.338)。
2.2 NK4基因联合奥沙利铂对HCT116细胞凋亡的影响
Annexin V-FITC和PI对4组细胞双染后,流式细胞仪检测各组细胞的凋亡情况。结果如图2所示,NK4/L-OHP组的细胞凋亡率为46.86%,高于NK4组的 21.22%(P<0.05)、L-OHP 组的 36.85%(P<0.05)及NC组的 16.55%(P<0.05)。NK4组和 L-OHP组的细胞凋亡率高于NC组,但差异无统计学意义(P>0.05)。提示NK4基因联合奥沙利铂具有协同促进HCT116细胞凋亡的作用。
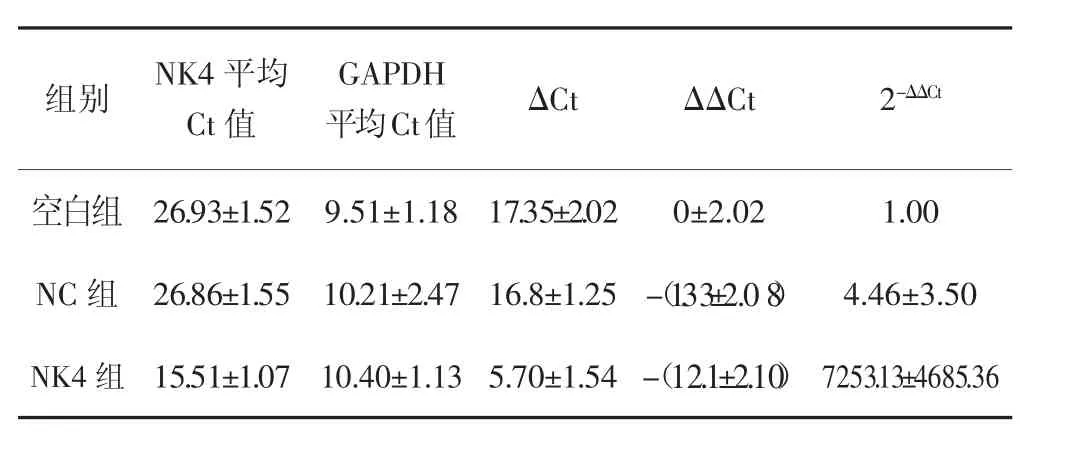
表1 qRT-PCR扩增后内参基因与目的基因的ΔCt值

图1qRT-PCR鉴定转染细胞中NK4的表达情况

图2 流式细胞术检测不同处理组HCT116细胞的凋亡率
2.3 NK4基因联合奥沙利铂对HCT116细胞侵袭能力的影响
Transwell小室法检测结果(表2、图3)显示:与NC组相比,L-OHP组及NK4/L-OHP组穿膜细胞数均明显减少,差异有统计学意义(P<0.05);NK4组、L-OHP组和NK4/L-OHP组的细胞侵袭抑制率组间比较差异有统计学意义(23.6%vs 58.7%vs 77.4%,P<0.05),金正均Q值为0.982(0.85≤Q<1.15),提示NK4基因联合奥沙利铂具有协同相加抑制HCT116细胞侵袭的作用。
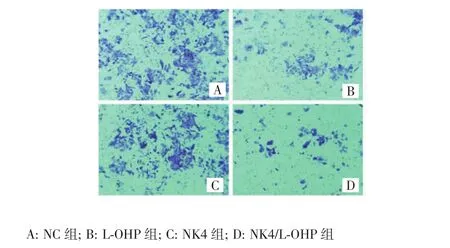
图3 Transwell小室法检测不同处理组HCT116细胞的侵袭能力(×100)

表2 Transwell小室法检测不同处理组穿膜细胞数和侵袭抑制率
2.4 NK4基因联合奥沙利铂对HCT116细胞Akt磷酸化水平的影响
采用Western blot法检测HCT116细胞在不同药物处理下,凋亡和侵袭相关蛋白p-Akt的变化。结果(图4)显示,与NC组相比,NK4组和L-OHP组对应的p-Akt蛋白条带灰度值均有所下调,表达量均下降(P<0.01)。NK4/L-OHP组可见灰度值较NC组显著降低(P<0.001),且表达量显著低于L-OHP组和NK4组,差异有统计学意义(P<0.01)。提示NK4基因联合奥沙利铂较单药对p-Akt作用更强,且具有协同下调作用。

图4 Western blot法检测不同处理组HCT116细胞Akt磷酸化水平
3 讨论
c-MET磷酸化可激活胞内下游信号通路包括RAS/RAF、PI3K/Akt和STAT3,从而激活下游与增殖、凋亡相关的 CREB[18]、NF-κB[19]、多药耐药 蛋白ABCG2[20]以及 DNA 修复关键分子 DNK-PKcs[21]等。因此c-MET的激活与细胞的存活、迁移、侵袭和转移密切相关[1]。且c-MET的高度激活往往伴随着肿瘤耐药性的产生[22],有研究显示在黑色素瘤中,HGF与c-MET结合后可激活MAPK和PI3K/Akt信号通路,介导BRAF抑制剂耐药[6]。NK4基因可通过拮抗HGF,抑制HGF诱导肿瘤生长、转移和侵袭,抑制肿瘤血管生成[23]。已有研究证实,NK4可增强多种癌细胞对顺铂、5-FU等化疗药物的敏感性[12,24]。同时有体内研究显示,NK4可增强癌细胞对自然杀伤细胞的敏感性,并促进自然杀伤细胞在癌巢中聚集[25]。奥沙利铂为结直肠癌临床上最常用的化疗药物之一,可显著抑制肿瘤细胞存活、迁移、侵袭和转移。
前期研究[26]证实奥沙利铂与NK4联合可以协同增效抑制HCT116细胞增殖(金正均Q值为1.767)。本研究流式细胞实验结果显示NK基因联合奥沙利铂可显著抑制HCT116细胞凋亡。Transwell小室实验结果显示奥沙利铂可在一定程度上抑制HCT116细胞侵袭,联合NK4后穿膜细胞数目显著降低,与单药处理组相比,侵袭抑制率显著增高,提示两者联用对HCT116细胞侵袭有协同抑制效果。Western blot检测p-Akt的变化,结果显示,NK4或奥沙利铂组可在一定程度上下调p-Akt的表达,联合之后下调程度明显增强,提示两者具有协同抑制作用。文献报道在奥沙利铂作用于脑胶质瘤后,主要通过PI3K/Akt信号通路及下游BAD、NF-KB和mTOR调控脑胶质瘤细胞凋亡、存活以及周期进程[15]。在卵巢癌相关研究中,有实验结果表明NK4可通过c-Met-PI3K-AKT信号通路抑制吲哚胺2,3-双加氧酶表达,进而抑制癌细胞发生发展[25]。而人胶质瘤[27]、人黑色素瘤[28]等研究结果表明,Akt信号通路在不同药物对肿瘤的协同抑制中扮演着至关重要的作用。与本实验研究结果基本一致。提示NK4作为HGF的竞争性抑制剂,可阻断HGF/c-MET及下游信号通路,联合化疗药物奥沙利铂后,通过协同作用抑制Akt信号通路,促进肿瘤细胞凋亡并抑制其侵袭性,进而获得更加理想的抗肿瘤效果。
本研究证实NK4基因与奥沙利铂联合使用有效下调凋亡和侵袭相关蛋白p-Akt磷酸化的表达,显著促进结肠癌细胞HCT116凋亡,明显抑制该细胞侵袭,为HGF高表达结直肠癌患者提供了潜在新型治疗方法。下一步将对NK4基因与奥沙利铂协同作用的机制进行更加深入探索,为临床应用提供更充分的依据。
[1] Siegel R,Desantis C,Jemal A.Colorectal cancer statistics,2014[J].CA Cancer J Clin,2014,64(2):104-117.
[2] Samamé Pérez-Vargas JC,Biondani P,Maggi C,et al.Role of cMET in the development and progression of colorectal cancer[J].Int J Mol Sci,2013,14(9):18056-18077.
[3] Jiang WG,Martin TA,Parr C,et al.Hepatocyte growth factor,its receptor,and their potential value in cancer therapies[J].Crit Rev Oncol Hematol,2005,53(1):35-69.
[4] Osada S,Yoshida K.Application of biological study for met expression to cancer therapy[J].Anticancer Agents Med Chem,2010,10(1):58-63.
[5] Owusu BY,Galemmo R,Janetka J,et al.Hepatocyte growth factor,a key tumor-promoting factor in the tumor microenvironment[J].Cancers(Basel),2017,9(4):35.
[6] 赵京,余清.肺癌Adp53基因治疗临床研究进展[J].武警医学,2017,28(3):217-222.
[7] Date K,Matsumoto K,Shimura H,et al.HGF/NK4 is a specific antagonist for pleiotrophic actions of hepatocyte growth factor[J].FEBS Lett,1997,420(1):1-6.
[8] Gao Z,Zheng X,Shen R,et al.NK4 growth inhibition of human Raji lymphoma xenografts by competitive interrupting HGF/Met signal pathway[J].Zhonghua Bing Li Xue Za Zhi,2014,43(8):551-555.
[9] Heideman DA,Overmeer RM,Van Beusechem VW,et al.Inhibition of angiogenesis and HGF-cMET-elicited malignant processes in human hepatocellular carcinoma cells using adenoviral vector-mediated NK4 gene therapy[J].Cancer Gene Ther,2005,12(12):954-962.
[10]Yue D,Wang Y,Ma P,et al.Effects of transferred NK4 gene on proliferation,migration,invasion and apoptosis of human prostate cancer DU145 cells[J].Asian J Androl,2010,12(3):381-389.
[11] Namiki Y,Namiki T,Yoshida H,et al.Preclinical study of a"tailormade"combination of NK4-expressing gene therapy and gefitinib(ZD1839,Iressa)for disseminated peritoneal scirrhous gastric cancer[J].Int J Cancer,2006,118(6):1545-1555.
[12]Taiyoh H,Kubota T,Fujiwara H,et al.NK4 gene expression enhances 5-fluorouracil-induced apoptosis of murine colon cancer cells[J].Anticancer Res,2011,31(6):2217-2224.
[13]Liang R,Lin Y,Li Y,et al.Seven-day capecitabine plus docetaxel and oxaliplatin regimen for the treatment of advanced gastric cancer:A phase-I clinical trial[J].Mol Clin Oncol,2017,6(4):622-626.
[14]朱秋燕,王颖怡,刘小林,等.结直肠癌患者发生奥沙利铂过敏反应的临床特点分析[J].肿瘤药学,2017,7(4):509-512.
[15]段友强,刘义锋,李巍.奥沙利铂调控PI3K/Akt信号通路抑制脑胶质瘤细胞株U87生长的作用研究[J].中国免疫学杂志,2017,33(3):328-332.
[16]Wang SS,Zimmermann M,Zhang H,et al.A diagnostic microdosing approach to investigate platinum sensitivity in non-small cell lung cancer[J].Int J Cancer,2017,141(3):604-613.
[17] 戴体俊.合并用药的定量分析[J].中国药理学通报,1998,14(5):479-480.
[18] Chou CH,Lai SL,Chen CN,et al.IL-6 regulates Mcl-1L expression through the JAK/PI3K/Akt/CREB signaling pathway in hepatocytes:implication of an anti-apoptotic role during liver regeneration[J].PLoS One,2013,8(6):e66268.
[19] Caporali S,Levati L,Graziani G,et al.NF-κB is activated in response to temozolomide in an AKT-dependent manner and confers protection against the growth suppressive effect of the drug[J].J Transl Med,2012,10:252.
[20]De Boussac H,Orbán TI,Várady G,et al.Stimulus-induced expression of the ABCG2 multidrug transporter in HepG2 hepatocarcinoma model cells involves the ERK1/2 cascade and alternative promoters[J].Biochem Biophys Res Commun,2012,426(2):172-176.
[21]Toulany M,Kasten-Pisula U,Brammer I,et al.Blockage of epidermal growth factor receptor-phosphatidylinositol 3-kinase-AKT signaling increases radiosensitivity of K-RAS mutated human tumor cells in vitro by affecting DNA repair[J].Clin Cancer Res,2006,12(13):4119-4126.
[22]Yu G,Jing Y,Kou X,et al.Hepatic stellate cells secreted hepatocyte growth factor contributes to the chemoresistance of hepatocellular carcinoma[J].PLoS One,2013,8(9):e73312.
[23]Cai C,Hou L,Zhang J,et al.The inhibitory effect of mesenchymal stem cells with rAd-NK4 on liver cancer[J].Appl Biochem Biotechnol,2017.
[24]Matsumoto G,Omi Y,Lee U,et al.NK4 gene therapy combined with cisplatin inhibits tumour growth and metastasis of squamous cell carcinoma[J].Anticancer Res,2011,31(1):105-111.
[25]Wang D,Saga Y,Sato N,et al.The hepatocyte growth factor antagonist NK4 inhibits indoleamine-2,3-dioxygenase expression via the c-Met-phosphatidylinositol 3-kinase-AKT signaling pathway[J].Int J Oncol,2016,48(6):2303-2309.
[26]祖丹丹,李美宁,张悦红,等.奥沙利铂联合NK4基因对大肠癌HCT116 细胞凋亡的影响[J].中国医药指南,2013,11(28):317-318,321.
[27]Jia F,Ruan S,Liu N,et al.Synergistic antitumor effects of berbamine and paclitaxel through ROS/Akt pathway in glioma cells[J].Evid Based Complement Alternat Med,2017,2017:8152526.
[28] Calero R,Morchon E,Martinez-Argudo I,et al.Synergistic antitumor effect of 17AAG with the PI3K/mTOR inhibitor NVP-BEZ235 on human melanoma[J].Cancer Lett,2017,406:1-11.
