直肠癌DCE-MRI参数与病理分期的相关性研究
2017-02-06谢雨恩廖锦元王铮李坤芳
谢雨恩 廖锦元 王铮 李坤芳
在西方国家结直肠癌发病率和病死率均居恶性肿瘤第3位,其中直肠癌占30%[1]。近年来,我国结直肠癌的发病率也逐年增高,居我国恶性肿瘤发病率的第5位[2],其中直肠癌约占70%[3]。直肠癌治疗难度大,预后相对较差,且术后并发症对患者生活质量影响较大[4]。DCE-MRI检查方法已广泛应用于临床,具有无创、快捷和可重复性好,可反映肿瘤血供状况及病灶微血管分布情况等优势[5]。有学者[6]进行结直肠癌大样本病例分析得出,直肠癌预后与肿瘤TNM分期、淋巴结转移情况、病理分级、淋巴和血管有无浸润密切相关,其中TNM分期为最重要的影响因素[7],与直肠癌发生、治疗及预后密切相关。本研究分析68例直肠癌DCE-MRI参数与病理分期的相关性,探讨DCE-MRI成像在直肠癌术前的临床应用价值。
1 资料与方法
1.1 一般资料
收集本院2015年3月至2016年4月住院的直肠癌患者,纳入标准:⑴MRI检查前行直肠镜检查并经活检病理证实为直肠癌;⑵未经放疗、化疗及盆腔手术治疗者;⑶无对比剂过敏,术前于我院行常规MRI+高分辨率MRI及DCE-MRI检查;⑷检查后2周内手术切除并经术后病理证实为直肠癌。共68例符合条件入组,其中男性48例,女性20例,年龄27~79岁,平均年龄(56.2±11.6)岁。
1.2 设备及检查方法
1.2.1 设备及检查前准备 采用Siemens Magnetom Verio 3.0 T超导型磁共振扫描仪,检查前所有患者签署知情同意书,禁食12 h,排空肠内容物。采用8通道体表相控阵列线圈及西门子工作站4D Tissue软件;对比剂用顺磁性对比剂钆Gd-DTPA,以1.5 mL/s流率经肘或手背静脉注入。
1.2.2 扫描参数 患者取仰卧位,扫描序列:矢状位快速自旋回波(fast spin echo,FSE)序列、轴位T2WI序列及脂肪抑制扫描;斜横断位及矢状位高分辨T1WI、T2WI(FOV160 mm);轴位DWI;动态增强扫描采用轴位3D VIBE 序列,TR=4.0 ms,TE=1.4 ms,层厚=2.0 mm,间隔=0.2 mm,翻转角=9°,FOV=317 cm×350 cm,矩阵=203×320。
1.2.3 图像及数据处理 应用Tissue 4D软件参照高分辨T2WI图像上肿瘤的位置及形态,选肿瘤最大径线的连续层面,避开肿瘤坏死区、囊变区及病灶边缘,在肿瘤实质强化明显区手动勾勒,ROI面积25~50 mm2,经过图像校准后由Intermedia动脉输入函数(AIF)及Tofts双室药代动力学模型获得伪彩图,多点测量Ktrans值、Kep值、Ve值等,并取其平均值,生成时间-信号强度曲线(TIC),据其形态不同分为以下3个类型:Ⅰ型为平台型,Ⅱ型为流出型,Ⅲ型为流入型[8]。常用的定量参数有以下方面:容量转移常数(Ktrans),代表对比剂从血管分布到细胞外血管外间隙(EES)的速率(单位:min-1);EES容积比(Ve),指单位容积组织内EES的容积;速率常数(Kep),即对比剂从EES回流到血管的速率(单位:min-1);三者之间的关系为 Kep=Ktrans/Ve[9]。
1.3 分组
以AJCC/UICC结直肠癌TNM分期系统(2010年第七版)作为病理标准:按T分期分为T1、T2、T3、T4期,因T1期只有1例,故分组为T1~2期27例,T3期29例,T4期12例;N分期分为N0期38例,N1期16例,N2期14例。
1.4 统计学方法
应用SPSS 17.0软件对数据进行分析,计量资料用均数±标准差(±s)表示,不同病理分期组间Ktrans、Kep、Ve值的均数比较先采用Levene法进行方差齐性检验,若方差齐(P>0.05),则采用单因素方差分析进行组间比较,多重比较采用LSD检验;直肠癌病理分期与Ktrans、Kep、Ve值的相关性采用Spearman秩相关进行分析;确定部分指标诊断病理分期的临界值采用ROC曲线进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MRI表现
肿瘤位于直肠高位9例、中位9例、中高位23例、中低位18例、低位9例;Ⅰ型平台型TIC为26.5%(18/68),Ⅱ型流出型TIC为63.2%(43/68),Ⅲ型流入型TIC为10.3%(7/68)。
2.2 DCE-MRI参数在直肠癌不同病理分期中的比较
直肠癌不同病理T分期中,肿瘤Ktrans值差异有统计学意义(P>0.05),见表1;而不同病理N分期,肿瘤Ktrans、Kep 值、Ve值差异均无统计学意义(P>0.05),见表2。
表1 不同病理T分期各参数的比较(±s)

表1 不同病理T分期各参数的比较(±s)
指标 T1~2期(n=27)T3期(n=29)T4期(n=12) F P Ktrans(min-1)0.719±0.1310.874±0.232 0.978±0.2388.174 0.001 Kep(min-1) 1.337±0.390 1.369±0.468 1.505±0.433 0.635 0.533 Ve 0.631±0.092 0.678±0.115 0.675±0.101 1.567 0.216
表2 不同病理N分期各参数的比较(±s)
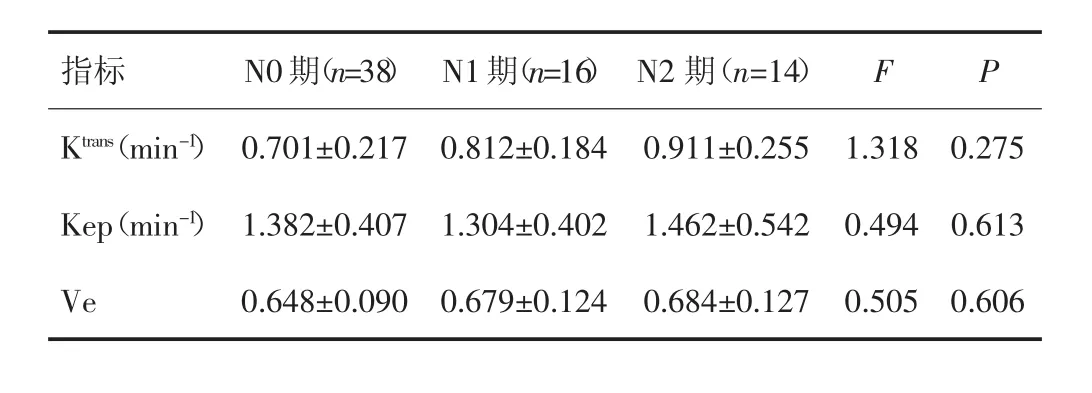
表2 不同病理N分期各参数的比较(±s)
指标 N0期(n=38) N1期(n=16) N2 期(n=14) F P Ktrans(min-1)0.701±0.2170.812±0.1840.911±0.2551.3180.275 Kep(min-1) 1.382±0.407 1.304±0.402 1.462±0.542 0.494 0.613 Ve 0.648±0.090 0.679±0.124 0.684±0.127 0.505 0.606
2.3 Ktrans值判断直肠癌早晚病理T分期的诊断效能
将病理T分期分为T1~2期(早期组)和T3~4期(晚期组),评估Ktrans的诊断效能。结果显示,当Ktrans值等于0.869 min-1为诊断阈值时,AUC为0.722,此时鉴别诊断效能较低,灵敏度为59.0%,特异度为99.0%。ROC曲线见图1。

图1 Ktrans值判断直肠癌病理早晚T分期的ROC曲线
2.4 直肠癌各指标相关性分析
Spearman相关分析结果显示,直肠癌病理T分期与 Ktrans值呈正相关(r=0.403,P<0.01);直肠癌病理 T分期与 Ve值亦呈正相关(r=0.249,P<0.05),见表 3。
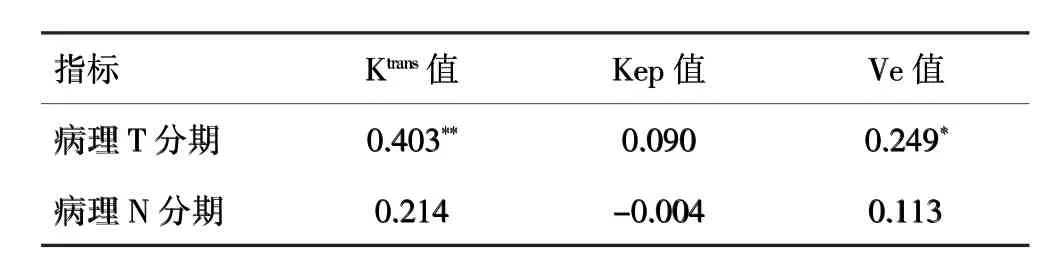
表3 各指标Spearman相关检验结果
3 讨论
3.1 DCE-MRI成像在直肠癌诊断中的应用价值
DCE-MRI原理为对比剂随时间推移从血管内漏出至肿瘤血管外细胞外间隙,导致周围组织T1值缩短,从而反映病变组织内的血管密度;血管通透性和对比剂进入组织细胞外间隙的多少快慢,反映对比剂在血管内外及细胞外液的动态交换过程。应用Tofts等[10]的两室模型(细胞外血管内血浆容积与细胞外血管外间质容积),可定量分析直肠癌病变的局部微循环情况。Ktrans值、Kep值、Ve值等参数不仅可反映病灶血供状况及微血管分布情况[11],还可在分子水平上对肿瘤血管进行评估,反映病变组织的生理性变化情况[12]。Yao等[13]通过研究定量参数与TNM分期、组织学分级、淋巴结转移、血管受侵及MVD的相关性,发现Ktrans值与淋巴结转移及TNM分期明显相关,Kep值与TNM分期呈中度正相关。国内学者研究亦表明,Ktrans值随肿瘤病理Dukes分期增高而升高[14]。本研究结果与上述研究结果一致。
通过图像采集和处理,可测绘出组织表示动态增强过程其信号随时间增加而改变的曲线,即TIC。TIC体现了病灶区域血流状况的特点和肿瘤病灶增强的完整过程。本研究显示,直肠癌中三种类型TIC曲线中Ⅱ型流出型TIC占63.2%,占总数最大比例,与谢宗源等[14]研究结果一致。
3.2 直肠癌不同病理T分期、N分期与DCE-MRI参数比较及相关性
直肠癌TNM分期是判断其预后的主要依据,是体现肿瘤进展程度最主要指标,亦是选择正确治疗决策的前提。关于DCE-MRI应用相关研究结论各异。英国学者Chikui等[15]研究口腔鳞癌的DCE-MRI应用,结果显示原发肿瘤灌注参数(Ktrans值、Ve值及Kep值)均被证实与肿瘤临床T分期呈负相关。而韩国学者Kim等[16]研究显示直肠癌不同T分期和N分期Ktrans值、Ve值差异无统计学意义。造成这些结果差异的原因可能与扫描条件及数据采集方法有关,比如,在Chikui等得出负相关关系的研究中,病灶DCE-MRI参数采集时ROI均为勾画肿瘤范围区域,而Kim等研究及本研究均选取小类圆形的肿瘤强化最明显的区域作为ROI。本研究得出,Ktrans值与病理T分期呈中等正相关,提示直肠癌Ktrans值越高,其病理T分期可能越晚。
淋巴转移是直肠癌早期最主要的转移方式,如何确定阳性淋巴结,诊断标准不一,研究的方式方法亦不同。Dworak等[17]研究发现正常淋巴结、反应性淋巴结和转移淋巴结在大小上有很多重叠交叉。Brown等[18]认为淋巴结轮廓不规则和信号不均匀较淋巴结大小对判断转移更有价值。近几年有文献报道,恶性肿瘤N分期与肿瘤Ktrans及Kep值呈负相关[19]。而本研究得出,N0分期直肠癌原发灶的Ktrans值低于N1、N2期,但差异无统计学意义,尚未能从肿瘤组织的灌注参数得到有意义的线索,有待今后进一步探索。
3.3 Ktrans值评估直肠癌病理分期的价值
目前研究认为,DCE-MRI定量参数中反映血管通透性最常用的参数是Ktrans[20]。本研究将直肠癌病理分期分为早期和晚期两组,对Ktrans值进行ROC曲线分析。结果提示,Ktrans值≤0.869 min-1为早期,>0.869 min-1为晚期,其诊断灵敏度(59.0%)较低,导致漏诊率升高,但特异度(99.0%)较高,则可大大降低误诊率。总之,DCE-MRI定量参数与直肠癌分期存在一定相关性,直肠癌T分期越晚Ktrans值越高,或可为直肠癌术前诊断提供参考价值。但本研究不足之处在于直肠癌肿瘤形态常不规则,且大多为溃疡性直肠癌,勾画ROI不可避免出现测量误差,同时病例数相对较少,有关结论有待扩大样本量进一步研究。
[1] Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Li M,Gu J.Changing patterns of colorectal cancer in China over a period of20 years[J].World J Gastroenterol,2005,11(30):4685-4688.
[4] Zhan T,Gu J,Li M,et al.Intermediate-fraction neoadjuvant radiotherapy for rectal cancer[J].Dis Colon Rectum,2013,56(4):422-432.
[5] Franiel T,Hamm B,Hricak H.Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer[J].Eur Radiol,2011,21(3):616-626.
[6] 陈创奇,方乐堃,马晋平,等.结直肠癌2042例临床病理特点及预后回归分析[J].中华医学杂志,2010,90(26):1804-1807.
[7] O'connell JB,Maggard MA,Ko CY.Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging[J].J Natl Cancer Inst,2004,96(19):1420-1425.
[8] Beets-Tan RG,Beets GL.Rectal cancer:how accurate can imaging predict the T stage and the circumferential resection margin[J].Int J Colorectal Dis,2003,18(5):385-391.
[9] Yankeelov TE,Gore JC.Dynamic contrast enhanced magnetic resonance imaging in oncology:theory,data acquisition,analysis,and examples[J].Curr Med Imaging Rev,2009,3(2):91-107.
[10]Tofts PS,Brix G,Buckley DL,et al.Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer:standardized quantities and symbols[J].J Magn Reson Imaging,1999,10(3):223-232.
[11] Rosen MA,Schnall MD.Dynamic contrast-enhanced magnetic resonance imaging for assessing tumor vascularity and vascular effects of targeted therapies in renal cell carcinoma[J].Clin Cancer Res,2007,13(2 Pt 2):770s-776s.
[12] Türkbey B,Thomasson D,Pang Y,et al.The role of dynamic contrastenhanced MRI in cancer diagnosis and treatment[J].Diagn Interv Radiol,2010,16(3):186-192.
[13] Yao WW,Zhang H,Ding B,et al.Rectal cancer:3D dynamic contrastenhanced MRI;correlation with microvascular density and clinicopathological features[J].Radiol Med,2011,116(3):366-374.
[14]谢宗源,徐香玖,黄刚,等.直肠癌DCE-MRI参数与病理特征的相关性研究[J].磁共振成像,2015,6(4):289-293.
[15] Chikui T,Kitamoto E,Kami Y,et al.Dynamic contrast-enhanced MRI of oral squamous cell carcinoma:a preliminary study of the correlations between quantitative parameters and the clinical stage[J].Br J Radiol,2015,88(1050):20140814.
[16] Kim YE,Lim JS,Choi J,et al.Perfusion parameters of dynamic con trast-enhanced magnetic resonance imaging in patients with rectal cancer:correlation with microvascular density and vascular endothelial growth factor expression[J].Korean J Radiol,2013,14(6):878-885.
[17] Dworak O.Morphology of lymph nodes in the resected rectum of patients with rectal carcinoma[J].Pathol Res Pract,1991,187(8):1020-1024.
[18] Brown G,Richards CJ,Bourne MW,et al.Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison[J].Radiology,2003,227(2):371-377.
[19] Zheng D,Chen Y,Chen Y,et al.Dynamic contrast-enhanced MRI of nasopharyngeal carcinoma:a preliminary study of the correlations between quantitative parameters and clinical stage[J].J Magn Reson Imaging,2014,39(4):940-948.
[20] Teifke A,Behr O,Schmidt M,et al.Dynamic MR imaging of breast lesions:correlation with microvessel distribution pattern and histologic characteristics of prognosis[J].Radiology,2006,239(2):351-360.
