术前外周血嗜酸性粒细胞升高对肝细胞癌根治术预后的影响
2017-02-06张杰齐亚鹏陈斌卢菲袁卫平马良黎乐群向邦德
张杰 齐亚鹏 陈斌 卢菲 袁卫平 马良 黎乐群 向邦德
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,位于癌症致死率第三位[1-2]。根治性肝切除术是HCC目前最主要的治疗方法之一[3]。已有文献报道外周血嗜酸性粒细胞(eosinophils,EOS)升高可调节肿瘤微环境,有可能作为评估肿瘤患者预后的因素之一[4]。研究发现,伴EOS升高的子宫颈癌、结肠癌、食管癌等患者中,常提示预后较好,而在霍奇金淋巴瘤中,则提示预后不良[5]。同时有研究阐述EOS的抗肿瘤或促进肿瘤增殖机制[6]。但目前尚缺乏EOS对HCC患者预后影响的相关研究。因此本研究回顾性分析我院2011年1月至2013年12月首诊的接受肝切除术治疗的HCC患者的临床资料,探讨术前外周血EOS升高对HCC患者总生存率的影响。
1 资料与方法
1.1 一般资料
收集2011年1月至2013年12月于我院首诊并接受肝切除术治疗HCC患者的临床资料。纳入标准:⑴术前未经化疗、TACE或无水酒精灌注等除手术切除外的其他治疗;⑵术后切除肿物经病理学检查确诊为HCC;⑶所有患者均具备完整的随访资料,无失访病例;⑷术前均无肿瘤破裂出血,术后均无出血、胆漏等严重并发症。共431例患者符合标准纳入研究。本研究已征得广西医科大学附属肿瘤医院伦理委员会批准,患者均签署知情同意书。根据每例患者术前外周血嗜酸性粒细胞计数进行分组,其中正常(术前外周血嗜酸性粒细胞计数<0.5×109/L)组375例,升高(术前外周血嗜酸性粒细胞计数≥0.5×109/L[7])组56例。
1.2 随访
术后半年内,每1~2个月复查1次;半年后,3个月复查1次;2年后,每半年复查1次。所有患者均接受开腹手术,完整切除肿瘤,术后病理确诊为HCC,术后1个月影像学检查肿瘤无残留。患者复查监测项目包括肝功能、AFP、腹部彩超、增强CT或MRI检查。研究终点为患者死亡或者至随访截止日期,随访开始日期为肝切除术手术日期,截止日期为2016年7月31日。随访内容包括患者是否健在、复查时间、地点以及患者死亡时间等。
1.3 统计学方法
采用SPSS 22.0统计软件对数据进行分析。采用倾向性评分匹配法(propensity score matching,PSM)均衡组间混杂因素的影响,使抽样近似随机化。正态或近似正态分布的资料用均数±标准差(±s)描述,非正态分布的资料用M(P25,P75)描述。计量资料比较用t检验或Mann-Whitney U检验;计数资料比较用χ2检验或Fisher's确切概率法。累积生存率用Kaplan-Meier法估计,组间差异用log-rank检验。对匹配前431例临床数据采用Cox比例风险模型确定影响患者总生存期的独立危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 组间临床资料比较
EOS正常组及升高组性别比例、肿瘤数目、CA199水平、肝功能Child-Pugh分级、白蛋白、中性粒细胞、AST及ALT水平差异有统计学意义(P<0.05),其余临床资料组间比较差异无统计学意义(P>0.05),见表1。
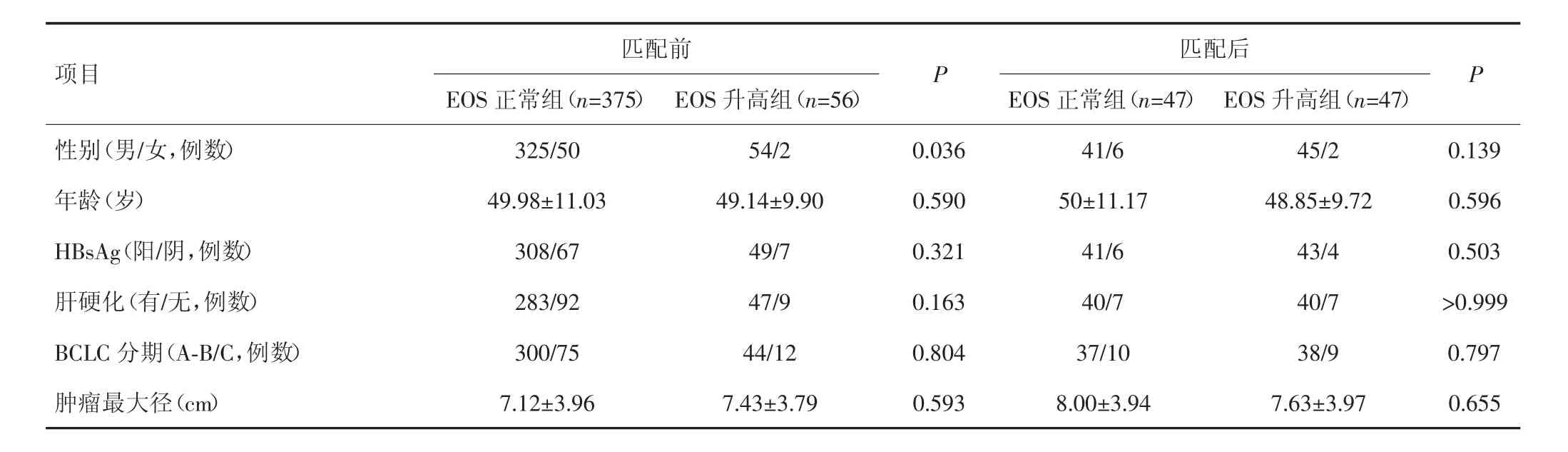
表1 PSM匹配前后两组患者的临床资料比较
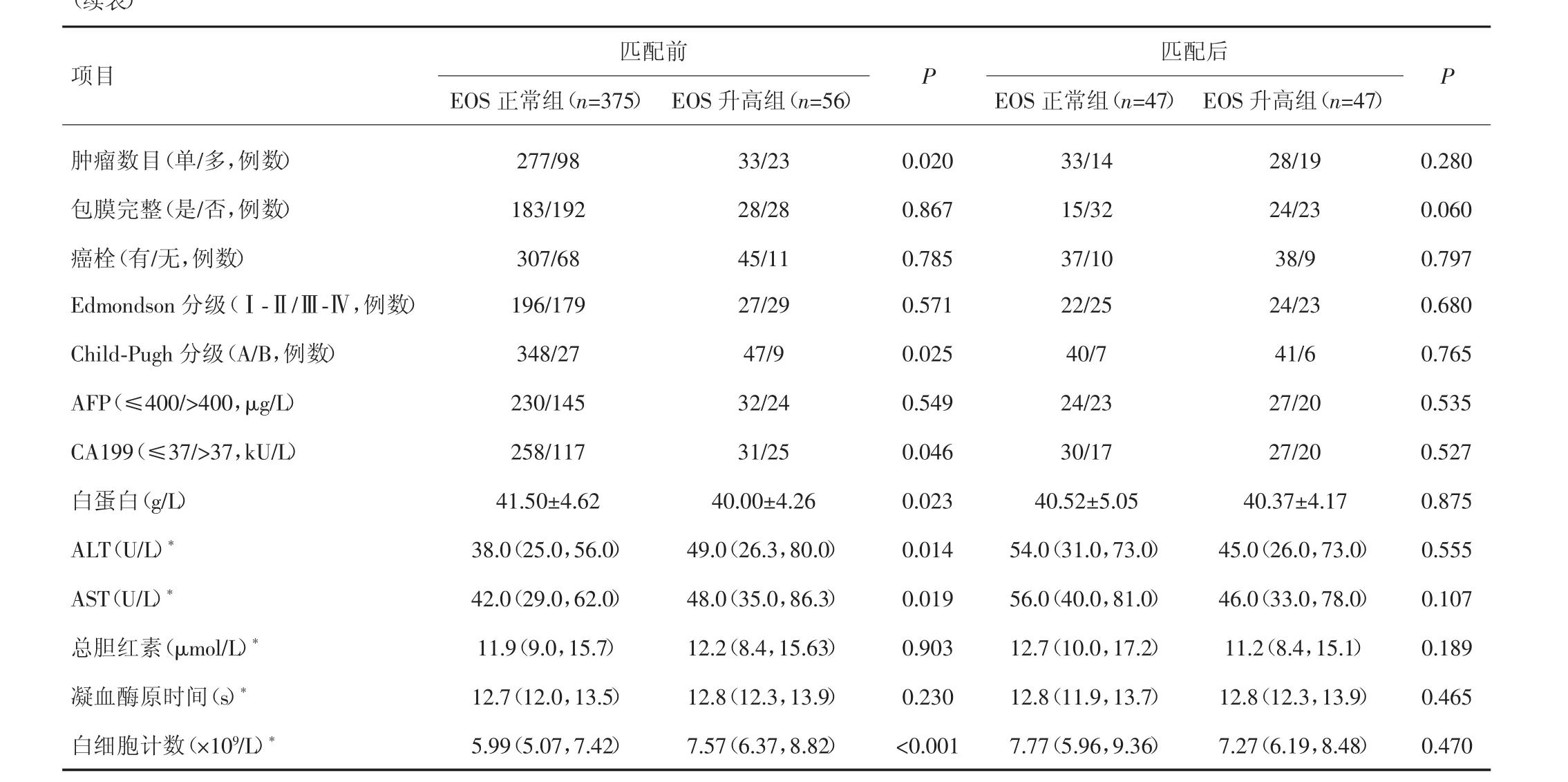
(续表)
2.2 总生存率比较
术前外周血EOS正常组中位生存时间为40.3个月,升高组为37.9个月;正常组1年、3年、5年生存率分别为78.9%、54.3%、38.0%,升高组分别为82.1%、49.9%、30.1%,两组生存曲线比较差异无统计学意义(χ2=0.614,P=0.341)。见图 1。

图1 匹配前EOS正常组与升高组的生存曲线
2.3 经PSM匹配后两组患者总生存率的比较
术前外周血EOS正常组及升高组按1∶1进行匹配,卡尺0.1,匹配后两组各47例,临床资料均衡,差异均无统计学意义(P>0.05),见表1。EOS正常组中位生存时间为40.5个月,EOS升高组为38.2个月;EOS正常组1年、3年、5年生存率分别为85.1%、61.6%、31.2%,升高组分别为87.2%、50.0%、25.1%,两组生存曲线比较差异亦无统计学意义(χ2=0.601,P=0.438)。见图2。

图2 匹配后EOS正常组与升高组的生存曲线
2.4 影响HCC患者生存的危险因素分析
单因素分析显示,BCLC C期、EdmondsonⅢ~Ⅳ级、结节型肝硬化、多个肿瘤、肿瘤大小>5 cm、有癌栓、包膜不完整、AFP>400 μg/L、CA199>37 kU/L、ALT>40 U/L、AST>40 U/L 等为影响患者生存率的危险因素(P<0.05)。多因素COX回归分析显示,EdmondsonⅢ~Ⅳ级、结节型肝硬化、多个肿瘤、肿瘤大小>5 cm、包膜不完整、AST>40 U/L等6项为影响患者生存率的独立危险因素(P<0.05)。见表2。
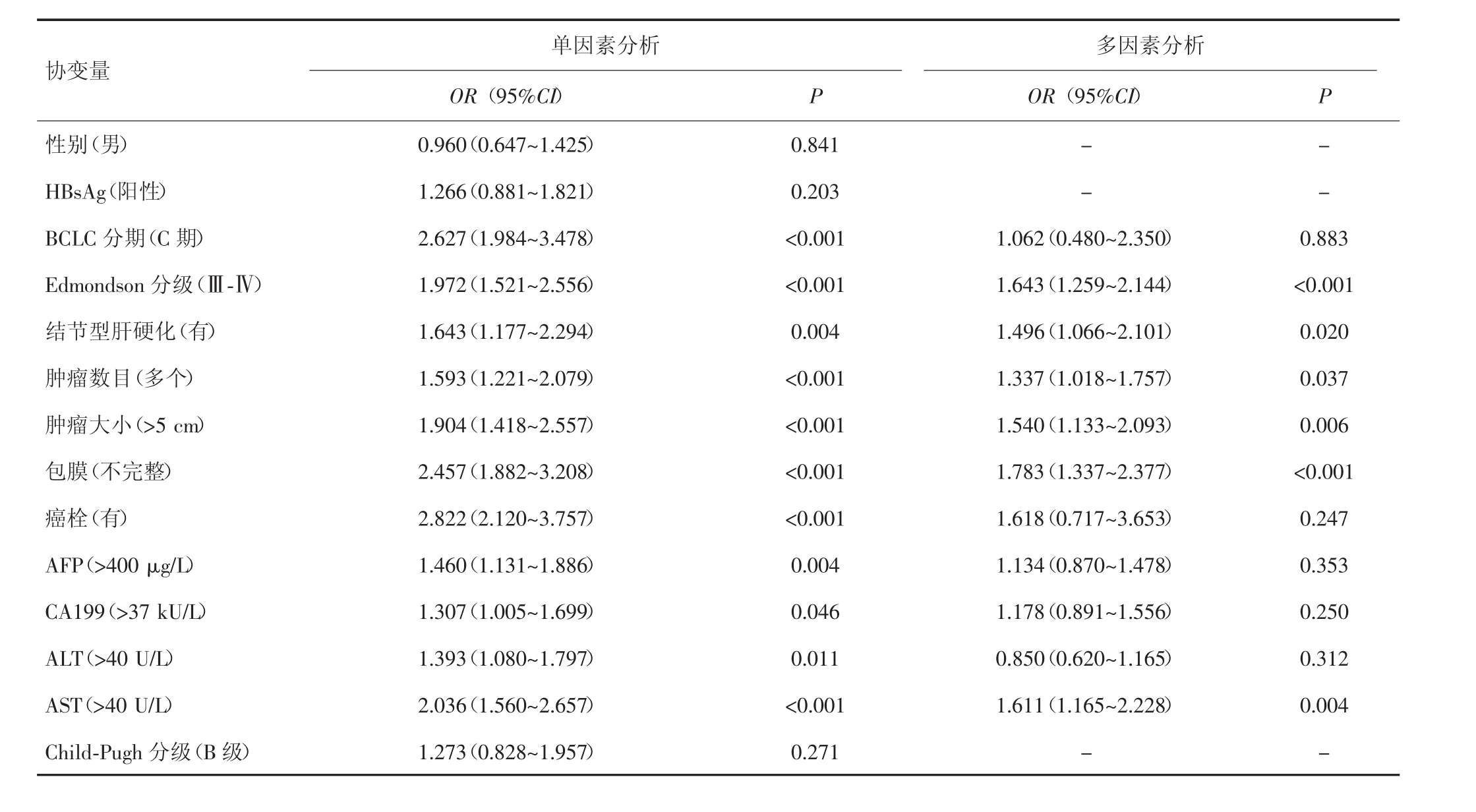
表2 431例HCC患者根治性切除术后生存率的影响因素分析
3 讨论
EOS为白细胞的一种亚型,细胞质中含有嗜酸性颗粒,EOS升高与许多炎症过程包括寄生虫、细菌、病毒感染以及组织损伤、过敏反应等有关。此外,肿瘤免疫以及恶性肿瘤细胞本身特性如异位内分泌激素等也可使嗜酸性粒细胞升高[8]。因此,在肿瘤周围组织及肿瘤炎性浸润中,亦可见外周血EOS相应升高。已有研究表明EOS可通过多种机制起抗肿瘤作用。首先,EOS作为一种多功能白细胞,可根据不同刺激因素释放不同的细胞毒性分子,其中主要包括碱性蛋白(MBP)、阳离子蛋白(ECP)、过氧化物酶(EPO)以及嗜酸粒细胞衍生神经毒素(EDN)。MBP可破坏细胞脂质双分子层而直接起抗肿瘤作用[9]。同时,体外实验证明,ECP可明显抑制口腔鳞状细胞癌和霍奇金淋巴瘤T细胞来源的肿瘤细胞[10-11]。其次,EOS还可通过分泌多种趋化因子,加强肿瘤中CD8+T细胞浸润而起抗肿瘤作用[4]。此外,EOS还可能通过改变肿瘤微环境或免疫调节功能改造细胞的免疫抑制作用,促进肿瘤增殖。Alrawi等[12]研究认为肿瘤相关的EOS浸润可通过释放92-kd白明胶酶破坏细胞外基质,从而促进肿瘤增殖。已有研究证实肿瘤坏死可进一步激活EOS对肿瘤增殖的促进作用[6]。亦有研究指出,EOS参与免疫调节功能,某些细胞因子尤其是IL-4及IL-5增多,可使Th1/Th2失衡而影响抗肿瘤相关细胞免疫[13-14]。此外,EOS通过综合多种因素包括VEGF、IL-8及纤维母细胞生长因子-2等促进肿瘤血管生成,从而促进肿瘤生长[13]。
虽然有大量研究阐述了EOS与肿瘤生物学特性的关系及其机制,但本研究并没有充分证据表明嗜酸性粒细胞增高对HCC患者远期预后有影响,张侃等[15]亦得出类似阴性结果。分析原因可能是EOS对HCC患者的肿瘤抑制作用及促生长作用达到相对平衡。在两组患者的临床资料比较中发现,EOS升高组患者在肝功能指标上表现差异,如Child-Pugh分级、白蛋白、AST及ALT水平等,提示EOS升高可能对肝功能产生负面影响,而两组患者的总生存率无统计学差异,亦可能由于上述EOS的抗肿瘤机制发挥了一定作用。
本研究进一步对影响患者生存的危险因素进行分析,结果显示EdmondsonⅢ~Ⅳ级、多个肿瘤、肿瘤大小>5 cm、包膜不完整、AST>40 U/L等是影响HCC患者生存率的独立危险因素。EdmondsonⅢ~Ⅳ级、多个肿瘤、肿瘤大小>5cm、包膜不完整提示预后较差常与肿瘤分化程度低、恶性程度高、多中心发病易复发的肿瘤生物学特点密切相关,而结节型肝硬化及AST>40 U/L为影响HCC患者生存率的独立危险因素,可能由于炎症所致的肝细胞受损严重,而肝脏过度炎症反应则是HCC复发的重要因素[16]。
综上所述,EOS升高并不能作为独立影响因素为HCC的远期预后提供参考。但在深入临床及基础研究中,可进一步探究其抗肿瘤机制的优势,为肿瘤免疫治疗提供新策略,同时作为一种简便易行的常规检查项目,在联合其他血清学检查亦可能有一定临床指导意义,有关方面值得进一步研究。
[1] Alejandro F,Llovet JM,Bruix J.Hepatocellular carcinoma[J].Lancet,2012,379(9822):1245-1255.
[2] Torre LA,Bray F,Siegel RL,et al.Global Cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3] Guo Z,Zhong JH,Jiang JH,et al.Comparison of survival of patients with BCLC stage A hepatocellular carcinoma after hepatic resection or transarterial chemoembolization:a propensity score-based analysis[J].Ann Surg Oncol,2014,21(9):3069-3076.
[4] Carretero R,Sektioglu IM,Garbi N,et al.Eosinophils orchestrate cancer rejection by normalizing tumor vessels and enhancing infiltration of CD8(+)T cells[J].Nat Immunol,2015,16(6):609-617.
[5]Davis BP,Rothenberg ME.Eosinophils and cancer[J].Cancer Immunol Res,2014,2(1):1-8.
[6] Lotfi R,Kaltenmeier C,Lotze MT,et al.Until death do us part:necrosis and oxidation promote the tumor microenvironment[J].Transfus Med Hemother,2016,43(2):120-132.
[7] 万学红,卢雪峰,刘成玉.诊断学[M].第8版.北京:人民卫生出版社,2013:250-251.
[8] Hogan SP,Rosenberg HF,Moqbel R,et al.Eosinophils:biological properties and role in health and disease[J].Clin Exp Allergy,2008,38(5):709-750.
[9] Gatault S,Legrand F,Delbeke M,et al.Involvement of eosinophils in the anti-tumor response [J].Cancer Immunol Immunother,2012,61(9):1527-1534.
[10] Po DEL,Dos Santos FV,Oliveira DT,et al.Effect of eosinophil cationic protein on human oral squamous carcinoma cell viability[J].Mol Clin Oncol,2015,3(2):353-356.
[11] Glimelius I,Rubin J,Fischer M,et al.Effect of eosinophil cationic protein (ECP) on Hodgkin lymphoma cell lines[J].Exp Hematol,2011,39(8):850-858.
[12]Alrawi SJ,Tan D,Stoler DL,et al.Tissue eosinophilic infiltration:a useful marker for assessing stromal invasion,survival and locoregional recurrence in head and neck squamous neoplasia[J].Cancer J,2005,11(3):217-225.
[13]Ellyard JI,Simson L,Parish CR.Th2-mediated anti-tumour immunity:friend or foe?[J].Tissue Antigens,2007,70(1):1-11.
[14] Fulkerson PC,Rothenberg ME.Targeting eosinophils in allergy,inflammation and beyond[J].Nat Rev Drug Discov,2013,12(2):117-129.
[15]张侃,陈利红,阮土耿.外周血嗜酸性粒细胞检测对口腔鳞状细胞癌术后的预后意义[J].口腔医学,2016,36(6):546-549.
[16]齐亚鹏,杨浩洁,杨富权,等.术后预防性肝动脉化疗栓塞对合并微血管侵犯肝细胞癌患者早期复发的影响[J].中华肝胆外科杂志,2016,22(9):607-610.
