邻菲啰啉铋配合物的合成和与DNA的相互作用
2017-02-01叶新辉庞绪良董志伟董建方赵培然李连之
叶新辉 庞绪良 董志伟 董建方 赵培然 李连之
(聊城大学 化学化工学院,山东 聊城 252059)
0 引言
金属铋在元素周期表中位于金属和非金属交界处,它具有特殊的物理化学性质.随着研究者们对其理化性质的不断深入研究,发现金属铋没有毒性且不具致癌性,是公认的绿色金属[1].研究表明,铋配合物的用途也越来越广泛,如在医学上利用其能够有效杀灭肠胃中的幽门螺旋杆菌且无毒副作用的特性用于治疗胃溃疡和胃肠道紊乱[2-4].因此,近年来,人们对铋配位化学的研究产生了浓厚的兴趣,合成了一些不同性质和结构新颖的配合物[5].
邻菲啰啉是很好的π-电子受体,对金属有很强的配位能力,它与金属离子配位时能够形成反馈π键.邻菲啰啉不仅具有良好的配位特性,而且还是重要的有机合成中间体,因而在众多领域都有应用[6].核酸是由许多核苷酸聚合成的生物大分子化合物,是生命的最基本物质之一.DNA是生物体遗传信息的传递者和储存者,是很多药物分子作用的靶点之一[7,8].自从顺铂类抗癌药物的问世以来,有关金属配合物作为抗肿瘤药物的研究已成为生物无机化学的热点之一[9].近些年来,人们一直致力于新型抗肿瘤药物的开发和抗癌机理的研究[10].因此,研究金属配合物与DNA 的相互作用对于设计合成高效低毒药物和探讨其作用的分子机理都具有重要指导意义.目前研究表明,金属配合物与DNA的非共价作用方式主要有插入作用、沟面结合和静电作用,同时也存在着疏水键、氢键、离子键和范德华力这些弱相互作用[11,12].我们实验室曾合成了系列邻菲啰啉配体的金属配合物,这里报道了邻菲啰啉铋(Ⅲ)配合物[Bi(phen)2(NO3)3]的合成及利用光谱法研究该配合物与小牛胸腺DNA(CT-DNA)的相互作用.
1 实验部分
1.1 试剂与仪器
五水合硝酸铋,无水甲醇、甘露醇、氢氧化钾等均为市售分析纯试剂、未经进一步提纯.1,10-邻菲啰啉为天津市科密欧化学试剂有限公司产品,三羟甲基氨基甲烷(Tris)、小牛胸腺DNA(CT-DNA)和溴化乙锭(EB)均为华美生物工程有限公司试剂.CT-DNA母液用10 mmol·L-1Tris-HCl(含10 mmol·L-1NaCl, pH 7.1)缓冲液配制,光谱法测得其在260 nm 吸光度与280 nm吸光度之比(A260/A280)大于1.8,这表明DNA的纯度较高可用于实验.DNA浓度以ε260=6 600 L·mol-1·cm-1确定[13].
Bruker Smart-1000 CCD 型衍射仪,日立F-7000荧光光谱仪,Perkin Elmer Lambda 750型紫外分光光度计,日本分光JASCO J-810 型圆二色光谱仪.
1.2 配合物[Bi(phen)2(NO3)3]的合成与表征
称取1mmol(0.485 1 g )五水合硝酸铋和10 mmol(0.1822 g)甘露醇混合研磨后,加2 mL二次水将其溶解.称取2 mmol(0.396 g)邻菲啰啉溶于20 mL甲醇中,50 ℃水浴加热至完全溶解,将硝酸铋和甘露醇混合液逐滴加入,搅拌反应2 h后冷却至室温.过滤、室温下放置使其缓慢挥发,三周后得到浅黄色单晶体.配合物[Bi(phen)2(NO3)3]的结构在Bruker Smart-1000 CCD 型单晶衍射仪上进行了测定.
1.3 配合物[Bi(phen)2(NO3)3]与DNA作用的谱学研究
1.3.1 紫外吸收光谱.利用10 mmol·L-1Tris-HCl(pH=7.1)的缓冲液配制系列样品,使配合物的浓度保持15 μmol·L-1,改变CT-DNA的浓度.将配好的试样充分混合,室温下放置2 h后测其吸收光谱,参比溶液为与样品含有相同浓度的DNA缓冲液,扫描波长范围为200-500 nm.
1.3.2 荧光光谱.用10 mmol·L-1Tris-HCl (pH=7.1)缓冲液配制不同浓度梯度的试样,固定CT-DNA浓度为15 μmol·L-1,使EB浓度保持3 μmol·L-1,依次增加配合物的浓度.将配好的试样混匀后,室温放置2 h,测定EB-DNA体系的荧光光谱.激发光和发射光狭缝大小均为10 nm;扫描速度为300 nm·min-1;激发波长为510 nm;发射波长范围为530-700 nm.
1.3.3 圆二色光谱.用10 mmol·L-1Tris-HCl(pH=7.1)缓冲液配制试样,分别测定在不加配合物和配合物浓度为1.4×10-4mol·L-1时的CT-DNA溶液(浓度为1.0×10-4mol·L-1)的圆二色光谱(扣除缓冲液和配合物的吸收).扫描范围为220-320 nm,扫描速度为200 nm·min-1,响应时间为1 s,路径长度1 cm,累积次数为3次.
2 结果与讨论
2.1 配合物[Bi(phen)2(NO3)3]的晶体结构
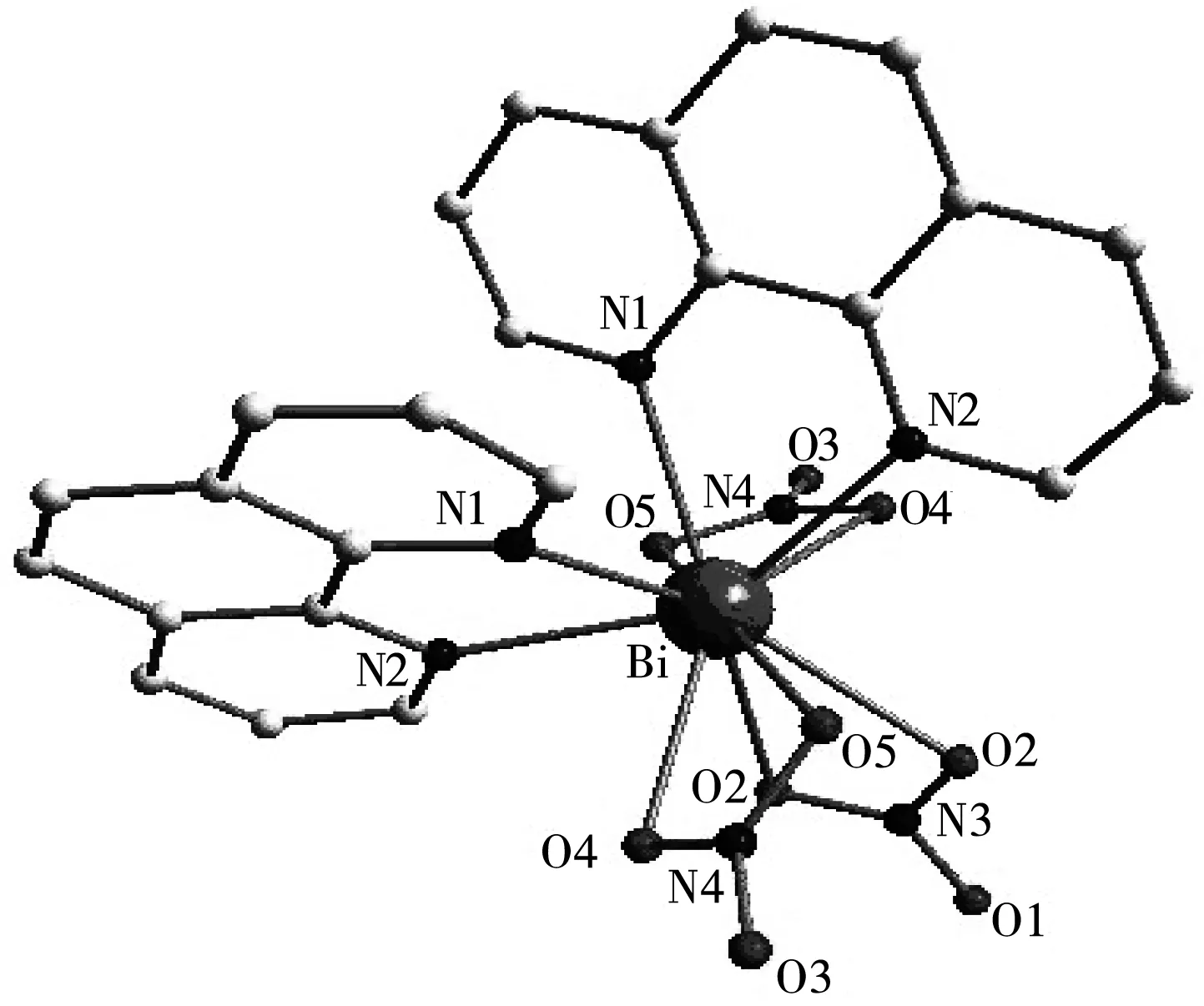
图1 邻菲啰啉铋配合物的晶体结构图
图1为配合物[Bi(phen)2(NO3)3]的分子结构图.该配合物的晶体结构测定结果与文献[14]报道的一致.
2.2 配合物与DNA作用光谱
2.2.1 紫外吸收光谱.具有双螺旋结构的DNA分子中含有生色团嘌呤和嘧啶碱基,其紫外吸收光谱在260 nm附近有一强的吸收峰.因此,可以利用DNA与金属配合物相互作用前后的紫外吸收光谱变化来研究二者间的相互作用.一般认为,当小分子与DNA作用后,若其紫外可见吸收光谱产生减色效应且伴有红移现象,则被认为是小分子与DNA发生了插入作用,减色效应越明显它们间的结合作用就越强[15];若其紫外可见吸收光谱产生增色效应,则被认为小分子的结合破坏了DNA双螺旋结构.增色效应则说明小分子可能嵌入到DNA双螺旋碱基对间,引起碱基堆积力中的疏水作用和范德华力发生改变,将会影响到DNA构象与结构的稳定[16].
不同浓度的CT-DNA存在下,邻菲啰啉铋配合物[Bi(phen)2(NO3)3]的紫外吸收光谱见图2.从图2中可知,配合物[Bi(phen)2(NO3)3]在264 nm左右有一最大吸收峰,它是由于邻菲啰啉配体芳香环的π-π*跃迁产生的.随着DNA浓度的逐渐增大,264 nm左右吸收峰出现了明显的减色效应并伴有小幅度的红移,可认为是该配合物与CT-DNA 发生插入作用的证据之一[17].
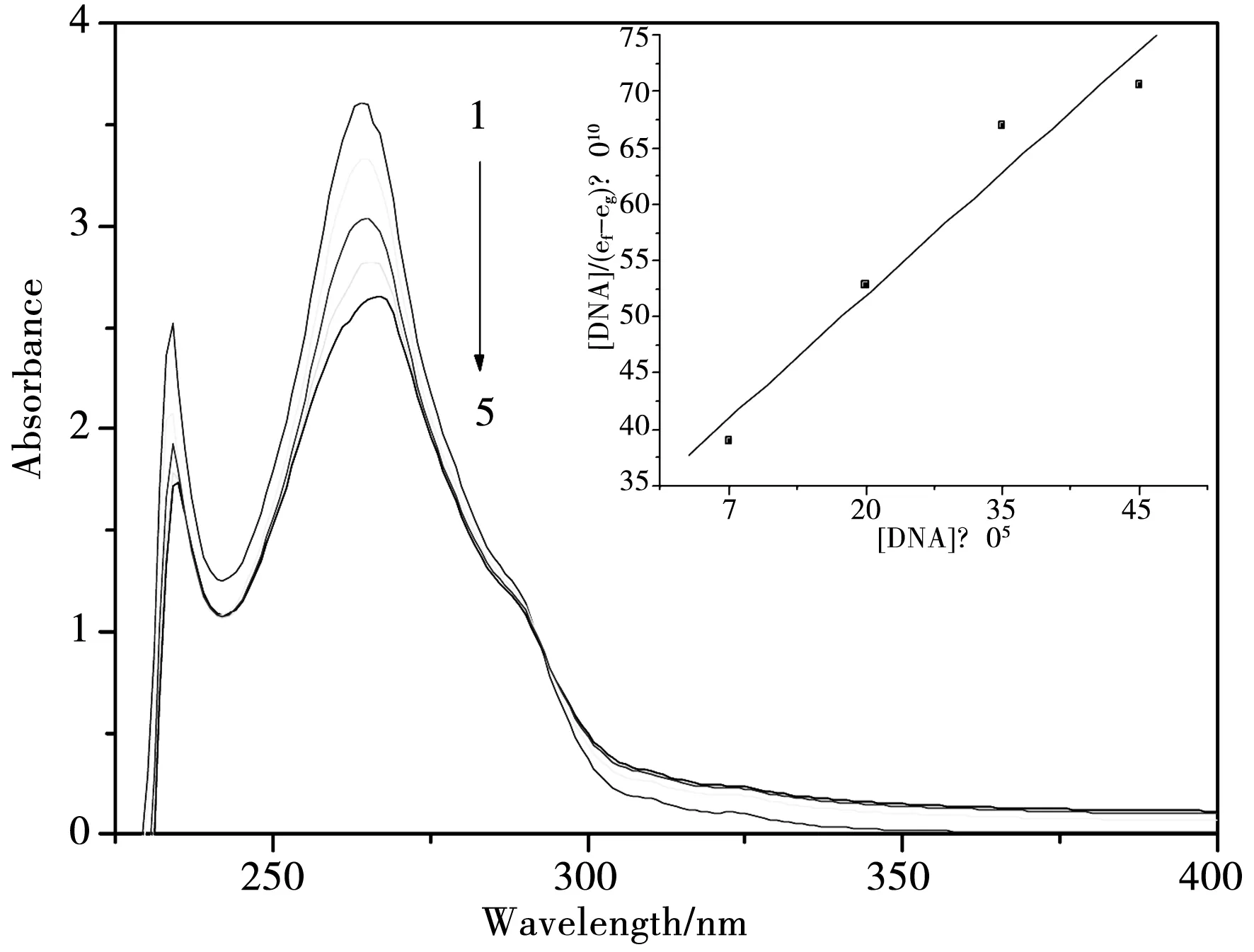
图2 邻菲啰啉铋配合物与CT-DNA作用的紫外可见光谱,配合物浓度为1.5×10-5 mol·L-1;CT-DNA的浓度从上到下分别为0, 1.0×10-5,2.0×10-5, 2.5×10-5, 4.5×10-5 mol·L-1, 内嵌图是[DNA]/(εf-εa)对[DNA]作图.
为了对该配合物与DNA之间结合作用的强弱进行定量描述,我们可以利用以下方程来计算配合物[Bi(phen)2(NO3)3]与DNA的结合常数Kb的大小[18]
[DNA]/(εa-εf)=[DNA]/(εb-εf) + 1/Kb(εb-εf),
式中的εa为配合物本身的表观摩尔吸光系数,εf,εb分别为自由配合物和键合配合物的摩尔吸光系数,Kb为它们间的结合常数.结合常数越大,说明配合物与DNA作用就越强.图2中的内嵌图为[DNA]/(εf-εa)对[DNA]作图得到的直线,由该直线的斜率和截距求得结合常数Kb=1.11×105L·mol-1.
2.2.2 荧光光谱.当某些化合物分子与荧光分子相互作用后,使荧光分子的荧光强度减弱甚至消退的现象被称为荧光猝灭.一般来说,荧光猝灭主要包括静态猝灭和动态猝灭两种形式.
当荧光分子与猝灭剂分子形成不发荧光的复合物时,原荧光分子的化学结构发生变化,这种猝灭方式称为静态猝灭.当荧光分子处于激发态时,猝灭剂与荧光分子相互接触使其不能发射荧光而直接返回到基态的过程称为动态猝灭[19,20].
溴化乙锭(EB)是一个含有可以嵌入DNA堆积碱基之间的三环平面基团的分子,EB分子和DNA本身的荧光很弱.当EB分子插入到DNA分子碱基对之间后,所形成的EB-DNA复合物却具有很强的荧光特性[18].
当配合物分子与DNA 发生类似于EB的嵌入作用时,配合物会与EB分子竞争其与DNA结合位点.因此,EB-DNA 复合体系发生荧光猝灭现象.检测该体系的荧光强度变化,可初步判断配合物分子与DNA间是否也发生了与EB类似的嵌入作用.通常认为,当c(配合物)/c(DNA)<100、EB-DNA体系的荧光强度减弱50%时,就可以认为化合物分子与DNA发生了类似于EB的嵌入作用[21].图3为邻菲啰啉铋配合物对DNA-EB体系的荧光猝灭光谱,内嵌图中横坐标为浓度比c(配合物)/c(DNA),纵坐标为相对荧光强度.结果表明,随着化合物浓度的逐渐增加,体系的荧光强度不断减弱.从图3可以看出,该配合物使EB-DNA体系的荧光强度减弱了50%以上,这也证明了该配合物以类似于EB与DNA的嵌入作用方式相结合.猝灭常数Ksq可由Stern-Volmer方程求得[22]
I0/I=1+Ksqr,
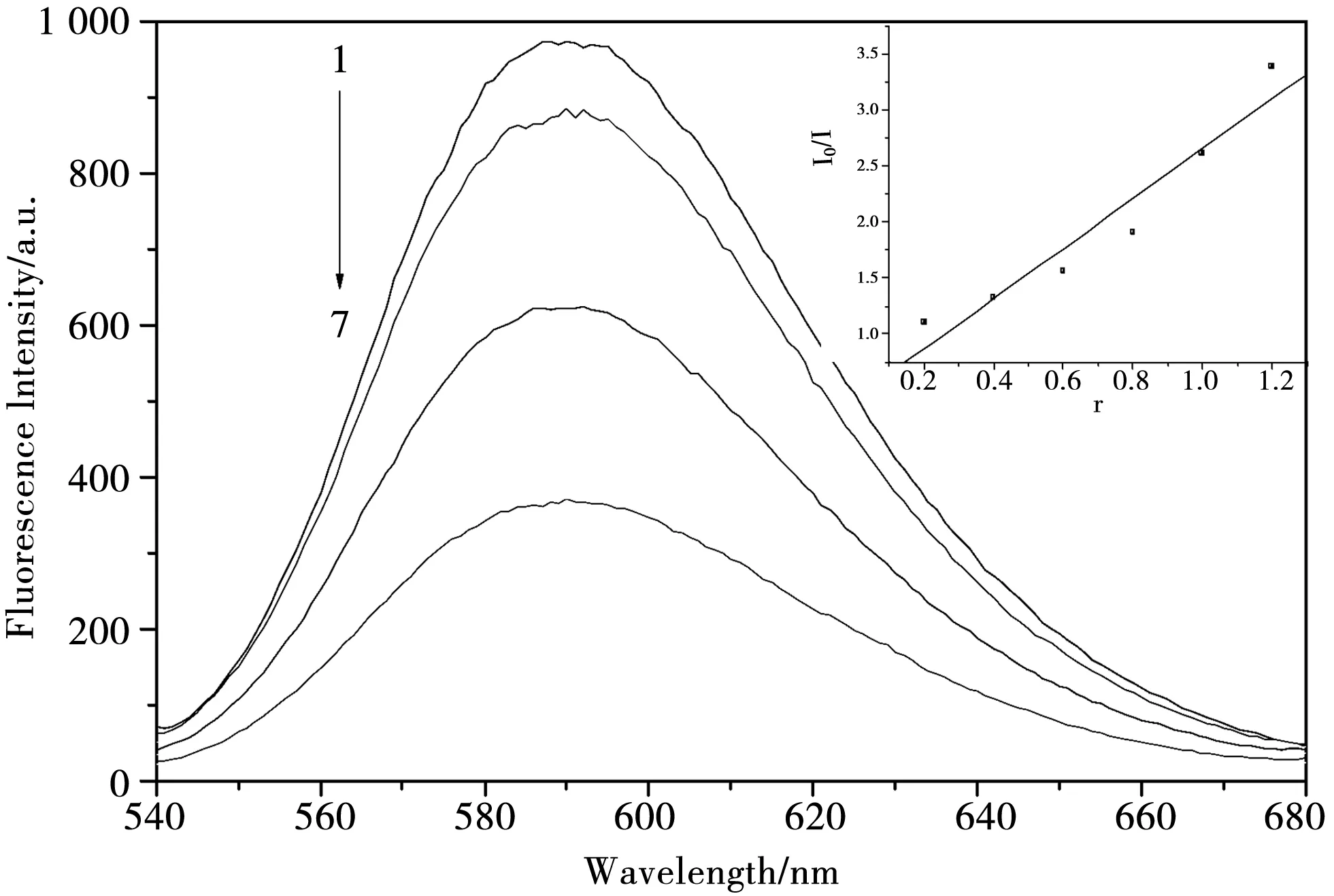
图3 邻菲啰啉铋配合物对EB-DNA体系的荧光猝灭光谱, [DNA]=1.5×10-5 mol·L-1;[EB]=3.0×10-6 mol·L-1;[配合物](1-7) = 0, 1×10-6, 2×10-6, 3×10-6, 4×10-6, 6×10-6 and 8×10-6 mol·L-1
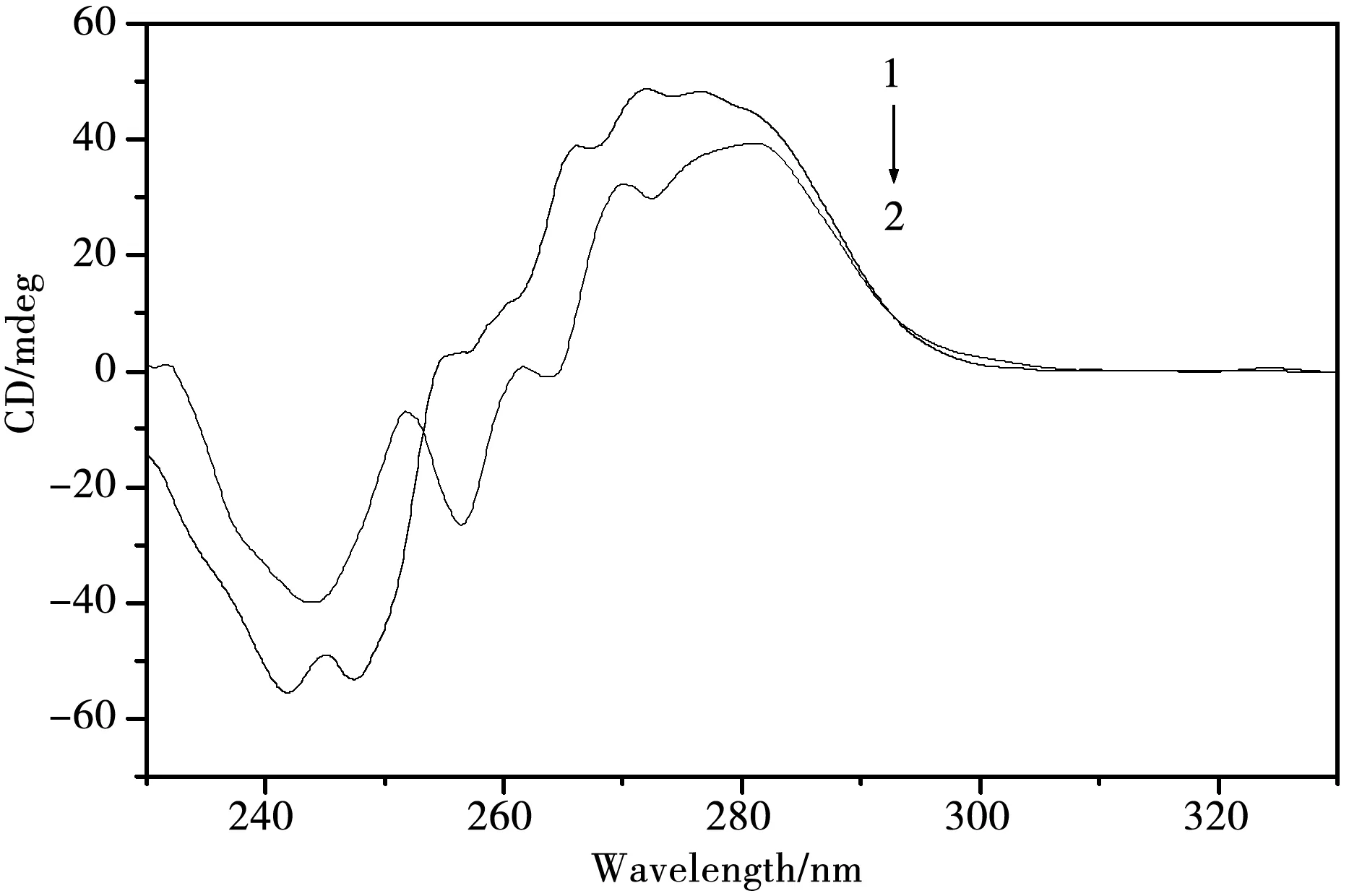
图4 邻菲啰啉铋配合物与DNA作用的圆二色光谱,[DNA]=1.0×10-4 mol·L-1, [配合物]=0(1), 1.4.×10-4 mol·L-1 (2).
其中I0为不加配合物分子时EB-DNA复合体系本身的荧光强度,I为EB-DNA复合体系在加入不同浓度的配合物时的荧光强度,r为配合物浓度与DNA浓度的比值,即c(配合物)/c(DNA).由I0/I对r作图,求得配合物对EB-DNA复合体系的荧光猝灭常数Ksq=2.23.
2.2.3 圆二色光谱.圆二色光谱(CD)测定技术是一种利用平面偏振光研究溶液中蛋白质、DNA等生物大分子二级和三级结构的快速、简单和较准确的方法.CD是测定手性化合物旋光性的重要手段,DNA是一种具有光学活性的手性生物大分子,CD光谱可以很灵敏的反映出DNA分子的构象变化.因此,我们可以利用圆二色光谱法研究配合物与DNA之间的相互作用,以探究配合物对DNA分子构象的影响.研究表明,当化合物分子与DNA通过插入作用结合后,将会很大程度上影响DNA的二级结构.邻菲啰啉铋配合物与CT-DNA作用的圆二色谱如图4,由图4可以看出,DNA分子在274 nm左右有一正吸收峰,它归属为DNA分子中碱基对的π-π*堆积作用;在243 nm左右则有一负吸收峰,它主要对应于双螺旋结构的B型构象[23,24].邻菲啰啉铋配合物的加入,导致DNA在274 nm正吸收峰减弱且发生红移;使243 nm 处的负吸收峰也有所减小.这表明该配合物分子与CT-DNA作用后改变了DNA的二级结构,使DNA分子中碱基对之间的π-π*堆积作用发生变化,并且对DNA的右手螺旋结构也产生了一定的影响.
3 结论
合成了的邻菲啰啉铋配合物,利用X-射线单晶衍射测定了它的分子结构.结构表明,该配合物以三价铋为中心,铋原子与双齿邻菲啰啉配体中的两个氮原子和三个硝酸根中的六个氧原子形成十配位的配位化合物.通过多种光谱技术研究了邻菲啰啉铋配合物与小牛胸腺DNA的相互作用,结果表明该配合物与DNA的相互作用主要为插入方式,计算得到了该配合物与DNA的结合常数和对EB-DNA体系的荧光猝灭常数.
[1] 贾如宝. 绿色金属-铋[J]. 金属世界, 1993(5):22-22.
[2] Briand G G, Burford N. Bismuth compounds and preparations with biological or medicinal relevance[J]. Chem Rev,1999, 99(9):2 601-2 658.
[3] Sun H, Szeto K Y.Binding of bismuth to serum proteins: Implication for targets of Bi(Ⅲ) in blood plasma[J].J Inorg Biochem,2003,94(1-2):114-120.
[4] Sun H, Szeto K Y, Zhang L. Bismuth in medicine[J]. Met Ions Biol Syst, 2004, 41(7):333-378.
[5] 张志朋, 钟国清, 蒋琪英. 砷、锑、铋配合物的生物活性[J].化学进展, 2008, 20(9):1 315-1 323.
[6] 刘延福. 邻菲咯啉衍生物的配合物的合成、结构与性质[D].无锡:江南大学, 2008.
[7] Komor A C,Barton J K.ChemInform Abstract: The Path for Metal Complexes to a DNA target[J].Cheminform, 2013, 44(24):11-15.
[8] Guo H, Karberg M, Long M, et al. Group II introns designed to insert into therapeutically relevant DNA target sites in human cells[J]. Science, 2000, 289(5 478):452-457.
[9] Pizarro A M, Sadler P J.Unusual DNA binding modes for metal anticancer complexes[J].Biochimie,2009, 91(10):1 198-1 211.
[10] Uma V, Vaidyanathan V G, Nair B U.Synthesis, structure, and DNA binding studies of copper(II) complexes of terpyridine derivatives[J]. Bull Chem Soc Jpn, 2005, 78(5):845-850.
[11] 陈勇, 李元宗, 常文宝, 等. 核酸分子嵌入剂[J]. 分析科学学报, 1994,10 (1):67-74.
[12] 翟珊珊. 氨基酸芳香醛希夫碱镍配合物的合成、结构及与DNA和BSA的相互作用[D]. 聊城:聊城大学, 2014.
[13] Reichmann M E, Rice S A, Thomas C A, et al. A further examination of the molecular weight and size of desoxypentose nucleic acid[J]. J Am Chem Soc, 1954, 76(11):3 047-3 053.
[14] Mahjoub A R, Morsali A. Refinement of the crystal structure of tris(nitrato-O,O′)-bis(l,l-phenanthroline) bismuth(Ⅲ), Bi(C12H8N2)2(NO3)3, at 110[J]. Κ Ζ Kristallogr NCS, 2002, 217:443-444.
[15] Kumar C V, Asuncion E H. DNA binding studies and site selective fluorescence sensitization of an anthryl probe[J]. J Am Chem Soc, 1993,115(19):8 547-8 553.
[16] Tysoe S A, Morgan R J, Baker A D, et al. Spectroscopic investigation of differential binding modes of DELTA- and LAMBDA-Ru(bpy)2(ppz)2+with calf thymus DNA[J]. J Phys Chem, 1993, 97(8):1 707-1 711.
[17] 刘延成,王海璐,梁炜乾,等. 2-羟基苯乙酮铜(Ⅱ)配合物与CT-DNA的键合作用研究[J]. 分析测试学报, 2011,30(12):1 400-1 405.
[18] Mansuri-Torshizi H, Mital R, Srivastava T S et al. Synthesis, characterization, and cytotoxic studies of α-diimine/1,2-diamine platinum(II) and palladium(II) complexes of selenite and tellurite and binding of some of these complexes to DNA[J]. J Inorg. Biochem, 1991, 44(4):239-247.
[19] 杨曼曼, 席小莉, 杨频.变温下荧光猝灭和加强理论公式合理性的比较[J]. 化学学报, 2006, 64(14):1 437-1 445.
[20] 庞绪良, 赵培然,董建方,等.水杨醛缩乙二胺希夫碱与牛血清白蛋白的相互作用及抑菌活性研究[J].聊城大学学报:自然科学版, 2017, 30(2):45-49.
[21] 丁菲菲, 丁名成, 魏强,等. L-丝氨酸水杨醛希夫碱镍(Ⅱ)配合物的合成、结构及与DNA的相互作用[J]. 聊城大学学报:自然科学版,2016,29(1):37-42.
[22] Lakowicz J R, Weber G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules[J]. Biochemistry, 1973, 12(21):4 161-4 170.
[23] Maheswari P U, Palaniandavar M. DNA binding and cleavage properties of certain tetrammine ruthenium(II) complexes of modified 1,10-phenanthrolines-effect of hydrogen-bonding on DNA-binding affinity[J]. J Inorg Biochem, 2004, 98(2):219-230.
[24] Uma V,Kanthimathi M,Weyhermuller T,et al.Oxidative DNA cleavage mediated by a new copper(Ⅱ) terpyridine complex: crystal structure and DNA binding studies[J].J Inorg Biochem,2005,99(12):2 299-2 307.
