沉默TRIM27基因对鼻咽癌5-8F细胞增殖、侵袭与迁移的影响
2017-01-19孟易禹黄栋栋金巧智陈武兵蔡志毅
孟易禹, 王 雪, 黄栋栋, 金巧智, 陈武兵, 蔡志毅,△
(1温州医科大学第一临床学院,浙江 温州 325000; 2台州市立医院耳鼻咽喉科,浙江 台州 318000)
沉默TRIM27基因对鼻咽癌5-8F细胞增殖、侵袭与迁移的影响
孟易禹1, 王 雪1, 黄栋栋1, 金巧智2, 陈武兵2, 蔡志毅1,2△
(1温州医科大学第一临床学院,浙江 温州 325000;2台州市立医院耳鼻咽喉科,浙江 台州 318000)
目的: 检测TRIM27蛋白在鼻咽癌组织和鼻咽部正常组织中的表达水平,观察沉默TRIM27对鼻咽癌5-8F细胞增殖、侵袭和迁移能力的影响。方法: 通过免疫组化技术检测鼻咽癌组织和鼻咽部正常组织中TRIM27的表达水平,采用实时荧光定量PCR(real-time PCR)和Western blot法分别检测5-8F细胞和NP69细胞中TRIM27的mRNA和蛋白表达水平;利用脂质体2000将TRIM27干扰序列转入5-8F细胞中;采用real-time PCR检测转染后细胞中TRIM27 mRNA表达水平的变化,Western blot法检测转染后细胞中TRIM27蛋白水平的变化;CCK-8法检测细胞活力的变化;细胞平板集落形成实验观察转染后细胞增殖能力的变化;Transwell实验检测细胞侵袭能力的变化;划痕实验观察细胞迁移能力的变化。结果: 免疫组化结果显示TRIM27在鼻咽癌组织中的表达率高于鼻咽部正常组织;TRIM27基因沉默后5-8F细胞增殖、侵袭和迁移能力均明显受到抑制(P<0.05)。结论:TRIM27在鼻咽癌5-8F细胞中可能充当癌基因的角色。沉默TRIM27基因可以明显抑制鼻咽癌细胞的增殖、侵袭和迁移能力。
TRIM27蛋白; 鼻咽癌; 细胞增殖; 细胞侵袭; 细胞迁移
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种起源于鼻咽部黏膜上皮的肿瘤,常发生在鼻咽部咽隐窝和顶前壁,是我国南方各省及东南亚地区最常见的头部恶性肿瘤之一,其分布具有明显的地域性和种族性,个别城市的发病率高达20.32/100 000[1]。研究表明,鼻咽癌的发病与多种因素有关,包括EB病毒感染、遗传易感性、环境因素等。目前的研究尚未鉴定出与NPC发生发展密切相关的癌基因和抑癌基因,NPC的发病机制仍不十分清楚。放疗仍是目前临床上治疗鼻咽癌的主要手段,但由于鼻咽癌浸润生长快,恶性程度高,解剖位置深且隐蔽、周围淋巴结丰富,早期病灶小,症状不典型,临床上易忽略及误诊,而且发病早期就可能发生颈部淋巴结转移,甚至远处转移,鼻咽癌放疗后容易出现局部复发和远处转移,影响其预后。因此寻找特异性早期诊断的分子标志以及靶向基因治疗的新策略成为当前肿瘤基础与临床研究的热点。
三结构域蛋白(tripartite motif protein,TRIM)家族是一个结构保守、进化快速的蛋白家族,目前人类基因组已发现和鉴定了多种TRIM蛋白。近年来其家族成员的功能研究也越来越受到重视。研究报道,TRIM蛋白在许多细胞生物过程,如细胞凋亡、细胞周期的调控及病毒学应答,均发挥着重要作用[2-5],与肿瘤的发生发展、侵袭和转移也密切相关[6-7]。三结构域蛋白27(tripartite motif protein 27,TRIM27)属于TRIM蛋白家族,基因定位于染色体6p22上。研究发现TRIM27在肿瘤发生或分化过程中可能扮演转录调控因子的角色,并参与细胞增殖、分化、凋亡、迁移和侵袭等过程,因此可能与肿瘤的发生发展以及侵袭转移密切相关[8-11]。本实验通过对比研究TRIM27 mRNA及蛋白在5-8F细胞和NP69细胞中的表达情况,探讨TRIM27在鼻咽癌发生发展的关系,旨在为进一步探讨鼻咽癌的早期诊断的分子标志以及靶向基因治疗提供新的依据。
材 料 和 方 法
1 组织标本
标本来自2008~2015年间台州市立医院耳鼻咽喉科鼻咽癌手术切除的标本,其中实验组鼻咽癌组织45例经病理证实均为鼻咽部低分化鳞癌,收集同期15例正常鼻咽部组织作为对照组。所有鼻咽癌患者均为首次确诊,且尚未接受任何治疗。标本使用获医院伦理委员会批准。
2 材料
人低分化 5-8F 鼻咽癌细胞株及永生化NP69鼻咽上皮细胞株购自中国科学院上海生命科学研究院细胞资源中心;二步法超敏免疫组化检测试剂盒及DAB显色试剂盒购自北京中杉金桥生物科技有限公司;RPMI-1640 培养基、Opti-MEMI无血清培养基、胎牛血清和胰蛋白酶-EDTA 消化液均购自Gibco;PBS缓冲液购自 Thermo;CCK-8试剂盒购自Bryotime;TRIzol reagent、cDNA第一链合成试剂盒和 Real MasterMix (SYBR Green)荧光定量PCR试剂盒购自Tiangen;兔来源多克隆TRIM27抗体购自Proteintech;兔抗人GAPDH抗体购自杭州贤至生物科技有限公司;辣根过氧化物酶标记的羊抗兔IgG Ⅱ抗购自北京索来宝生物科技有限公司。
3 主要方法
3.1 石蜡切片免疫组织化学 免疫组化检测石蜡标本鼻咽癌及正常鼻咽部组织TRIM27蛋白的分布情况。10%甲醛浸泡, 脱水后常规石蜡包埋, 3 μm连续切片, 二甲苯脱蜡, 梯度乙醇去二甲苯,PBS洗涤, 滴加3% H2O2室温静置10 min以灭活内源性过氧化物酶,PBS洗涤,枸橼酸钠缓冲溶液(pH 6.0)中高压加热法修复抗原,5%山羊血清封闭20 min, 滴加TRIM27抗体(1∶100)4 ℃过夜,以PBS代替 Ⅰ 抗作为阴性对照,用已知阳性片作为阳性对照,37 ℃复温45 min,PBS洗涤,滴加Ⅱ抗(辣根过氧化物酶标记的山羊抗兔IgG抗体)37 ℃、1.5 h,PBS清洗后DAB显色,显微镜下判断染色情况,自来水冲洗,苏木精复染2 min,盐酸乙醇分化,自来水冲洗,梯度乙醇脱水,二甲苯透明,封片,镜检,显微图像分析系统拍照。实验结果判断标准参照Carcangiu等[12]半定量评分方法, 根据阳性细胞着色强度和阳性细胞数量计分, 阳性着色强度按无色、淡棕色、棕黄色和棕褐色分别记为0、1、2和3分;再在高倍镜(×400)下对每张切片随机选取5个高倍镜视野, 计数500个细胞/视野, 共计2 500个,阳性细胞数按<5%、5%~35%、36%~70%和>70%分别记为0、1、2和3分。取两项评分的乘积进行综合评分, ≤1分为阴性,2~3分为弱阳性,4~5分为中度阳性,≥6分为强阳性。合并阴性和弱阳性作为阴性表达标准, 中度阳性和强阳性作为阳性表达标准。
3.2 细胞培养 将5-8F细胞接种于含有10%胎牛血清的RPMI-1640培养基中,于37 ℃、5% CO2恒温恒湿密闭培养箱中培养。细胞贴壁生长,1~2 d换液,传代培养。
3.3 5-8F细胞转染及转染效率的检测 实验分为 siRNA-TRIM27+Lipo2000组 (si-TRIM27组)、阴性对照(negative control, NC)+Lipo2000组(NC组)和正常空白对照(control)组。将5-8F细胞以每孔3×105个接种于6孔板,培养 24 h后换新鲜培养液,按操作说明以等量Opti-MEMI无血清培养基分别稀释适当量的si-TRIM27和Lipo2000,混匀后各自室温静置5 min,后将两者混匀室温下共孵育15~20 min,加入培养板中,轻轻混匀,放入培养板中继续培养,隔6~8 h后换完全培养基继续培养。转染带荧光的FAM-NC时,所有操作均需避光,并以锡箔纸包被培养板放置培养箱中培养,转染24 h后用PBS冲洗1次,荧光显微镜下观察转染效率并拍照。
3.4 Real-time PCR检测TRIM27的干扰效率 各组 5-8F 细胞经转染 48 h后,按照TRIzol 说明书中步骤提取细胞总RNA,取RNA于紫外分光光度计下测A260/A280,比值处于1.8~2.1之间则符合纯度要求。按miRNA 逆转录试剂盒说明配制逆转录试剂,逆转录合成cDNA,按real-time PCR说明书配制反应体系,每个样本设3个复孔。反应条件为:95 ℃10 min; 95 ℃ 30 s, 60℃ 30 s, 72 ℃ 30 s,共40个循环。反应以GAPDH为内参照。TRIM27的上游引物序列为5’-GGCAGUGUCUUUGUGGUAUTT-3’,下游引物序列为5’-AUACCACAAAGAACUGCCTT-3’;GAPDH的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。记录各孔Ct值,取各孔平均值作为结果,并采用2-ΔΔCt法对结果进行分析。
3.5 Western blot检测TRIM27的干扰效率 分别收集对数期的5-8F及NP69细胞于1.5 mL离心管中,1 200 r/min离心3 min,弃上清液,加1 mL PBS吹打均匀,1 200 r/min离心3 min,弃上清液后PBS重复洗涤 1 次。各孔加入200 μL预冷的RIPA裂解液,置于冰上20 min使其充分裂解细胞。将细胞裂解液转移至1.5 mL EP管中,4 ℃、12 000 r/min离心5 min,取上清,收集的上清液即为样本蛋白,BCA法检测蛋白浓度。于样品中加入5×SDS凝胶电泳上样缓冲液,100 ℃变性10 min。顺序加样,待电泳分离完全后,采用湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h,TBST充分洗膜后加特异性Ⅰ抗[GAPDH(1∶10 000)和TRIM27(1∶1 000)],4 ℃ 过夜孵育,Ⅱ 抗(1∶10 000)室温孵育1 h,充分洗膜后加ECL发光液显影,ImageQuant LAS 4000 Mini 凝胶成像仪自动曝光,并分析灰度值,计算各组与内参照 GAPDH 灰度的相对比值。每个样本重复 3 次实验。
3.6 CCK-8 法检测细胞活力 取96孔板按上述方法转染各组5-8F细胞, 另于标准空白孔中加不含细胞的完全培养液(每组取 4 孔),培养48 h后于每孔中加入10 μL CCK-8试剂,轻晃混匀,放置于培养箱中培养12 h,再测450 nm波长下每孔的A值,观察各组的细胞活力变化情况。
3.7 平板集落形成实验 于6孔板中转染各组5-8F细胞24 h后,胰酶消化,1 000 r/min 离心 5 min 收集细胞,重悬细胞并计数,以每孔100个接种于新的 6 孔板中,并尽量使细胞均匀分布于板底,放入培养箱中连续培养10 d,或至肉眼可见克隆斑时,弃原培养液,PBS洗涤 1 次后加10%甲醛固定15 min,PBS 洗2次后用结晶紫染色30 min,PBS 洗净后晾干,拍照。
3.8 Transwell实验检测细胞侵袭能力 将Matrigel从-20 ℃取出,4 ℃解冻后置于冰上,用无血清1640培养基将Matrigel稀释至50 mg/L,按每孔50 μL加入Transwell小室的上室,超净台内风干过夜。使用前每孔加入100 μL含1%牛血清白蛋白的无血清1640培养液,37 ℃静置1 h后吸去小室内液体备用。Transwell小室杯孔直径为6.5 mm,杯底由聚碳酸脂微孔滤膜封闭(微孔孔径为8 μm)。用无血清1640培养基制备转染后的5-8F单细胞悬液,并调整细胞浓度1×108/L。每孔加入 200 μL的细胞悬液至Transwell上腔小室,加入 500 μL含有10%胎牛血清的1640培养基至 Transwell 下腔小室。放入37 ℃、5% CO2细胞培育箱中培养24 h。取出Transwell小室,PBS轻轻洗涤2次,并用棉球擦去上室内的细胞。4%多聚甲醛室温下固定15 min,1%结晶紫染色5 min,倒置显微镜下观察并随机选择3个视野进行细胞计数,拍照,重复 3 次。下室面的细胞代表迁移率(平均迁移细胞数/平均注入细胞数),每组预设3次实验。
3.9 划痕实验检测细胞迁移能力 用标记笔在孔板背面均匀地画根平行线,相邻平行线间的平均间距为5 mm。取对数期细胞,用含10%小牛血清的培养液调整细胞浓度为3×105个,于6孔板每孔中加入细胞悬液2 mL,37 ℃、5% CO2培养箱中培养24 h,待细胞汇合90%左右时,吸弃培养基,用200 μL的Tip头沿垂直背面所画平行线划痕,PBS液洗3遍,加入无血清培养液,0 h、24 h和48 h后分别在倒置显微镜下观察并拍照,用ImageJ 1.46软件对缩窄距离进行分析,按照以下公式来计算细胞迁移率:迁移率(%)=(初始划痕的宽度值-相应点的划痕宽度值)/初始划痕的宽度值×100%。实验重复3次。
4 统计学处理
采用SPSS 19.0 软件分析。数据以均数±标准差(mean±SD)表示,多样本均数之间比较采用单因素方差分析(one-way ANOVA),组间比较采用 Bonferroni校正的t检验,率的比较采用2检验或Fisher精确概率法,以P<0.05 为差异有统计学意义。
结 果
1 免疫组化实验结果
免疫组化检测鼻咽癌和正常鼻咽部组织的蛋白表达情况及定位。实验结果显示,TRIM27蛋白在鼻咽癌的胞浆胞核均有表达,以胞核为主,见图1。TRIM27在鼻咽癌中的表达率显著高于正常鼻咽部组织(P<0.01),见表1。
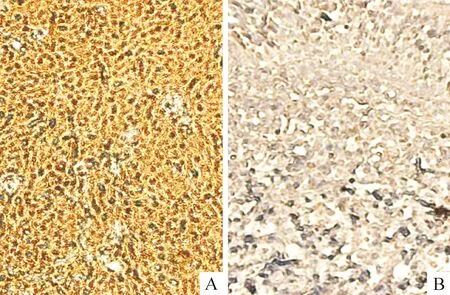
Figure 1.The immunohistochemical analysis of nasopharyngeal carcinoma (A) and normal nasopharyngeal tissues (B) stained for TRIM27 expression (×200).
图1 TRIM27在鼻咽癌及正常鼻咽部组织中免疫组化结果
表1 免疫组化检测TRIM27在鼻咽癌和正常鼻咽部组织中的表达情况
Table 1.The expression of TRIM27 in nasopharyngeal carcinoma and normal nasopharyngeal tissues detected by immunohistochemical staining

GroupnPositiveNegativeNPC4540∗∗ 5∗∗Normal15312
**P<0.01vsnormal.
2 细胞转染情况
用带有FAM荧光蛋白的无关序列(FAM-NC)转染人鼻咽癌5-8F细胞24 h 后,吸去6孔板内培养基并用PBS冲洗3~4次,于荧光显微镜下观察并拍照, 以荧光下细胞数/白光下细胞数表示转染效率。转染效率在90%左右,见图2。
3 Real-time PCR和Western blot检测si-TRIM27的干扰效率
人鼻咽癌5-8F细胞经转染si-TRIM27或NC siRNA处理48 h,提取各组细胞总RNA并逆转录合成cDNA, 经 real-time PCR 检测结果。根据2-ΔΔCt法
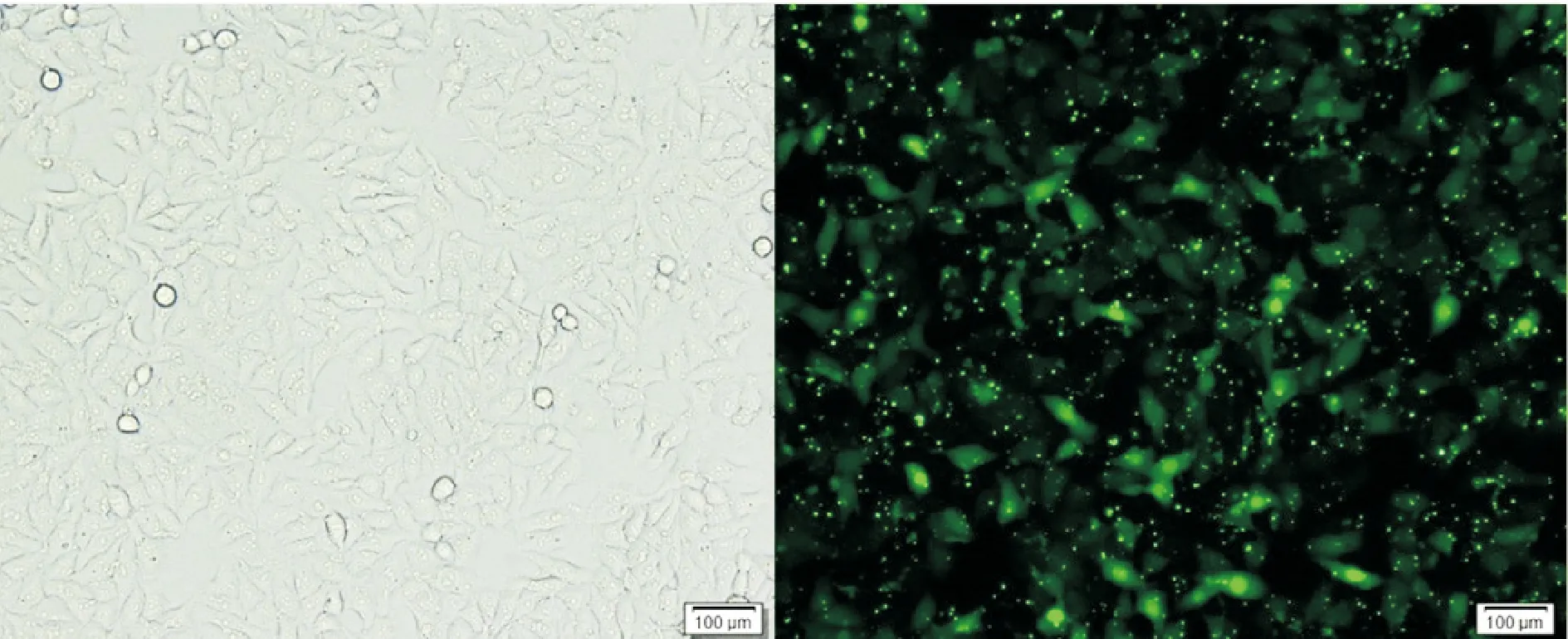
Figure 2.The expression of FAM fluorescin in the human nasopharyngeal carcinoma 5-8F cells 24 h after transfection (×100).
图2 转染24 h后荧光显微镜下FAM荧光蛋白的表达
计算出TRIM27在si-TRIM27组、NC组及空白对照组的相对表达量分别为0.12±0.02、0.96±0.02和0.97±0.01,应用单因素方差分析对计算结果进行统计显示转染后si-TRIM27组的TRIM27的相对表达量相对NC组及空白对照组明显下调(P<0.01),NC组和空白对照组之间的差异无统计学显著性。Western blot实验结果表明,人鼻咽癌5-8F细胞经转染si-TRIM27或NC处理48 h后,si-TRIM27组、NC组及空白对照组的TRIM27的蛋白相对表达量分别为0.18±0.02、0.42±0.03和0.44±0.02,si-TRIM27组相对NC组及空白对照组明显下调(P<0.01),NC组和空白对照组之间的差异无统计学显著性,见图3。
4 干扰TRIM27对5-8F细胞增殖能力的影响
CCK-8实验结果表明,si-TRIM27组、NC组及空白对照组的A值分别为0.64±0.02、0.93±0.03和0.95±0.02,统计分析结果显示,si-TRIM27组的A值与NC组和空白对照组的相比差异有统计学显著性(P<0.01),然而NC组和空白对照组相比差异无统计学显著性。结果表明,下调TRIM27的表达后5-8F细胞的活力明显降低。集落形成实验结果显示,si-TRIM27组、NC组及空白对照组的菌落数分别为78±7、204±6和196±8,统计分析结果显示,si-TRIM27组的菌落数与NC组和空白对照组相比差异有统计学显著性(P<0.01),然而NC组和空白对照组相比差异无统计学显著性,进一步证实了下调TRIM27的表达后5-8F细胞的集落形成能力受到抑制,见图4。
5 干扰TRIM27表达对5-8F细胞侵袭能力的影响
细胞体外侵袭实验结果显示,si-TRIM27组的小室其穿膜细胞数为每视野162±6,NC组的穿膜细胞数为每视野226±8,control组的穿膜细胞数为每视野236±7,与NC组和control组相比,si-TRIM27组的5-8F细胞侵袭能力明显受到抑制,差异有统计学意义(P<0.01),NC组和control组之间的差异无统计学显著性,见图5。

Figure 3.The relative expression of TRIM27 at mRNA (A) and protein (B) levels in human nasopharyngeal carcinoma 5-8F cells 24 h after tansfection. Mean±SD.n=3.**P<0.01vssi-TRIM27.
图3 5-8F细胞转染24 h后TRIM27的mRNA和蛋白相对表达量
6 干扰TRIM27表达对5-8F细胞迁移能力的影响
划痕实验结果显示,si-TRIM27组、NC组及control组的细胞迁移率分别为0.33±0.03、0.71±0.01和0.73±0.02,与NC组和control组相比,si-TRIM27组的5-8F细胞侵袭能力明显降低,差异有统计学意义(P<0.01),NC组和control组之间的差异无统计学显著性,见图6。
讨 论
TRIM27作为TRIM蛋白家族中的成员之一,曾被报道在转录调控、炎症反应、细胞凋亡、细胞周期、细胞分化、肿瘤细胞迁移等多种生命过程中都有功能,并与肿瘤的分期及预后等密切相关,在肿瘤的发生及演化过程中发挥重要作用。以往的研究报道表明,TRIM27在多种人类癌细胞系中高表达,比如子宫内膜癌、肺癌、乳腺癌、卵巢癌、结肠癌、精原细胞癌等,这表明它可能参与癌症的发生和发展[13-15]。但TRIM27在鼻咽癌中的研究国内外报道甚少,本实验通过real-time PCR、Western blot及免疫组化方法对比研究TRIM27 mRNA和蛋白在鼻咽癌5-8F细胞和NP69细胞中的表达情况及TRIM27在鼻咽癌组织和正常鼻咽部组织中的表达情况,免疫组化实验结果表明,TRIM27在45例鼻咽癌中阳性率高达88.9%,明显高于正常鼻咽部组织。Real-time PCR和Western blot结果显示,TRIM27在5-8F细胞中无论是基因水平还是蛋白水平明显高于NP69细胞。这些都提示TRIM27可能在鼻咽癌中扮演癌基因的角色,在鼻咽癌的发生发展过程中发挥作用。

Figure 4.The proliferation of human nasopharyngeal carcinoma 5-8F cells 24 h after tansfection detected by CCK-8 assay (A) and cell colony formation assay (B). Mean±SD.n=3.**P<0.01vssi-TRIM27.
图4 CCK-8法和平板集落形成实验检测转染24 h后各组细胞的增殖情况
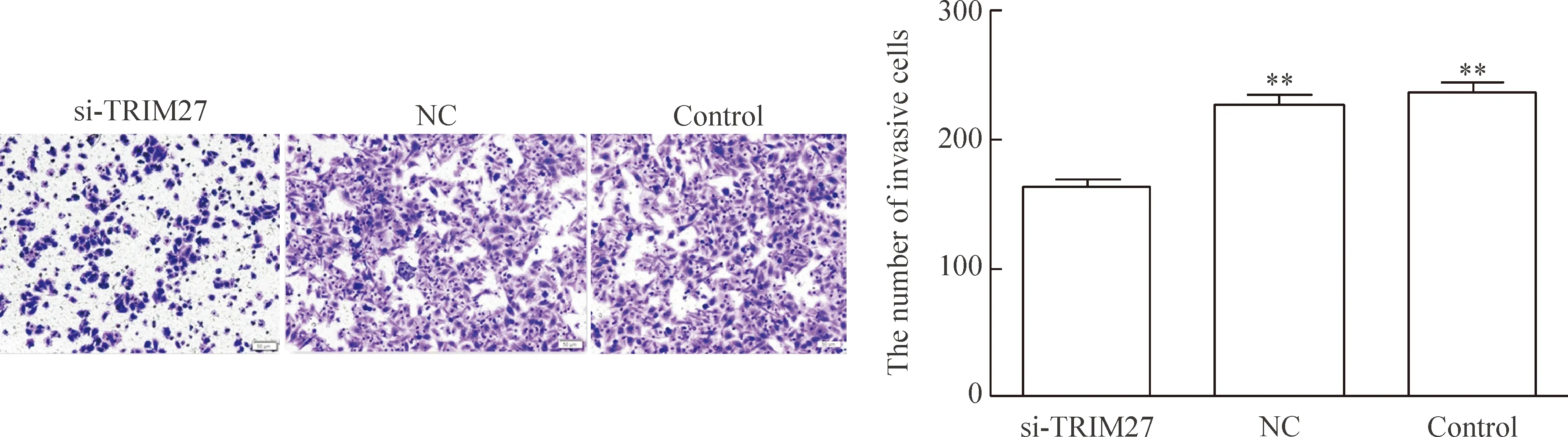
Figure 5.The effect of knockdown ofTRIM27 expressive on the invasive ability of human nasopharyngeal carcinoma 5-8F cells (co-lored by 0.1% crystal violet, ×100). Mean±SD.n=3.**P<0.01vssi-TRIM27.
图5 干扰TRIM27后对细胞侵袭能力的影响
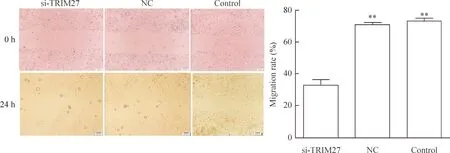
Figure 6.The effect of knockdown ofTRIM27 expression on the migratory ability of human nasopharyngeal carcinoma 5-8F cells. Scale bars at 0 h were 50 μm, while those at 24 h were 200 μm. Mean±SD.n=3.**P<0.01vssi-TRIM27.
图6 干扰TRIM27后对细胞迁移能力的影响
研究发现TRIM27是原癌基因RET的融合伴侣,而RET基因是一种编码受体酪氨酸激酶的基因,具有与其它跨膜受体相似的特点,可以和其它基因结合重排而活化,从而调节细胞的生长分化。当神经营养因子等配体与RET蛋白结合并形成二聚体后,RET蛋白胞内酪氨酸激酶功能区域发生自体磷酸化,接着可以使底物分子磷酸化从而激活下游信号通路。RET蛋白可以通过激活Ras 激活MAPK通路,也可以通过生长因子受体连接蛋白和生长因子受体因子连接蛋白黏合因子激活PI3K(磷脂酰肌醇3激酶)途径,进一步活化AKT通路等[16-17]。这些下游信号的激活可以启动一系列级联放大反应,促进细胞过度增殖和分化,和肿瘤的发生密切相关。而TRIM27作为RET的伴侣基因,可能也通过MAPK通路或AKT通路来调控肿瘤细胞的增殖和分化。有研究表明,牛蒡子苷元及miRNA-7也可通过PIK3/AKT通路来调控鼻咽癌细胞的增殖和凋亡,因此TRIM27和牛蒡子苷元等可能有部分相似的调控机制[19-20]。TRIM27的过表达还能通过MDM2和AKT的蛋白酶体降解诱导细胞凋亡[18]。这提示 TRIM27 对于诱导细胞凋亡具有重要作用,可能作为一个靶点来控制肿瘤细胞的凋亡。在其它肿瘤中如卵巢癌,研究发现TRIM27充当癌基因的角色,其高表达与卵巢癌FIGO分期呈正相关,下调TRIM27的表达后,可通过P38/MAPK及AKT通路影响细胞周期,抑制细胞凋亡[21]。
本研究通过特异性siRNA干扰TRIM27在5-8F细胞中的表达,荧光显微镜观察结果显示Lipo2000瞬时转染法的转染效率在90%左右,real-time PCR和Western blot结果提示TRIM27表达量的确下降。转染后经CCK-8实验检测发现,si-TRIM27组的鼻咽癌5-8F细胞活力较NC组及control组明显受抑制;而平板集落形成实验则显示转染后肿瘤细胞克隆斑形成数量较NC组及control组显著减少;Transwell及细胞划痕实验分结果显示干扰TRIM27的表达可显著抑制鼻咽癌5-8F细胞侵袭和迁移能力。
综上所述,TRIM27在鼻咽癌中高表达可能扮演癌基因的角色,通过特异性siRNA干扰下调TRIM27的表达可以显著抑制鼻咽癌5-8F细胞的增殖及侵袭迁移能力。然而,TRIM27在鼻咽癌发生发展中的调控是否通过MAPK或AKT信号通路促进鼻咽癌5-8F细胞的增殖和侵袭转移有待进一步研究。这也是本课题组下一步的研究方向,阐明这些机制将更有助于为鼻咽癌的诊断和治疗提供新的候选分子,也为进一步研究TRIM27对鼻咽癌5-8F细胞生物学功能的影响奠定了基础。
[1] 李伟栋, 魏矿荣, 梁志恒, 等. 中山市鼻咽癌流行病学危险因素探究[J]. 中华疾病控制杂志, 2012, 16(6):486-489.
[2] Bonnefont J, Laforge T, Plastre O, et al. Primate-specificRFPL1 gene controls cell cycle progression through cyclin B1/Cdc2 degradation[J]. Cell Death Differ, 2011, 18(2):293-303.
[3] Mandell MA, Jain A, Arko-Mensah J, et al. TRIM proteins regulate autophagy and can target autophagic substrates by direct recognition[J]. Dev Cell, 2014, 30(4):394-409.
[4] Kawai T, Akira S. Regulation of innate immune signalling pathways by the tripartite motif (TRIM) family proteins[J]. EMBO Mol Med, 2011, 3(9):513-527.
[5] Tanji K, Kamitani T, Mori F, et al. TRIM9, a novel brain-specific E3 ubiquitin ligase, is repressed in the brain of Parkinson’s disease and dementia with Lewy bodies[J]. Neurobiol Dis, 2010, 38(2):210-218.
[6] Ozato K, Shin D, Chang TH, et al. TRIM family proteins and their emerging roles in innate immunity[J]. Nature Rev Immunol, 2008, 8(11):849-860.
[7] Kaldate R, Huston A, McCoy H, et al. Cost effectiveness analysis of genetic testing for breast and ovarian cancer susceptibility genes: BRCAI and BRCA2[J]. Breast J, 2014, 20(3):325-326.
[8] Urano T, Saito T, Tsukui T, et al. Efp targets 14-3-3 sigma for proteolysis and promotes breast tumour growth[J]. Nature, 2002, 417(6891):871-875.
[9] Horn EJ, Albor A, Liu Y, et al. RING protein Trim32 associated with skin carcinogenesis has anti-apoptotic and E3-ubiquitin ligase properties[J]. Carcinogenesis, 2004,25(2):157-167.
[10]Pearson M, Pelicci PG. PML interaction with p53 and its role in apoptosis and replicative senescence[J]. Oncogene, 2001, 20(49):7250-7256.
[11]Meroni G, Diez-Roux G. TRIM/RBCC, a novel class of ‘single protein RING finger’ E3 ubiquitin ligases[J]. Bioessays, 2005, 27(11):1147-1157.
[12]Carcangiu ML, Chambers JT, Voynick IM, et al. Immunohistochemical evaluation of estrogen and progesterone receptor content in 183 patients with endometrial carcinoma. Part I: Clinical and histologic correlations[J]. Am J Clin Pathol, 1990, 94(3):247-254.
[13]Tsukamoto H, Kato T, Enomoto A, et al. Expression of Ret finger protein correlates with outcomes in endometrial cancer[J]. Cancer Sci, 2009,100(10):1895-1901.
[14]Iwakoshi A, Murakumo Y, Kato T, et al. RET finger protein expression is associated with prognosis in lung cancer with epidermal growth factor receptor mutations[J]. Pathol Int, 2012, 62(5):324-330.
[15]Tezel GG, Uner A, Yildiz I, et al. RET finger protein expression in invasive breast carcinoma: relationship between RFP and ErBb2 expression[J]. Pathol Res Pract, 2009, 205(6):403-408.
[16]Hayashi H, Ichihara M, Iwashita T, et al. Characterization of intracellular signals via tyrosine 1062 in RET activated by glial cell line-derived neurotrophic factor[J]. Oncogene, 2000, 19(39): 4469-4475.
[17]Encinas M, Robert J, Milbrandt J, et al. Tyrosine 981, a novel ret autophosphorylation site, binds c-Src to mediate neuronal survival [J]. Biol Chem, 2004, 279(18):18262-18269.
[18]Joo HM, Kim JY, Jeong JB, et al. Ret finger protein 2 enhances ionizing radiation-induced apoptosis via degradation of AKT and MDM2[J]. Eur J Cell Biol, 2011, 90(5):420-431.
[19]黄栋栋, 金巧智, 陈武兵, 等. 牛蒡子苷元诱导人鼻咽癌CNE-1细胞凋亡及其作用机制[J].中国病理生理杂志,2016, 32(1):101-105.
[20]孙栋勋, 黄栋栋, 金巧智, 等. miRNA-7通过EGFR/PI3K/Akt通路抑制鼻咽癌5-8F细胞增殖[J].中国病理生理杂志, 2014, 30(10):1807-1812.
[21]Ma Y, Wei Z, Bast RC Jr, et al. Downregulation of TRIM27 expression inhibits the proliferation of ovarian cancer cellsinvitroandinvivo[J]. Lab Invest, 2016, 96(1):37-48.
(责任编辑: 林白霜, 罗 森)
Knockdown of TRIM27 expression regulates cell proliferation, invasion and migration in human nasopharyngeal 5-8F carcinoma cells
MENG Yi-yu1, WANG Xue1, HUANG Dong-dong1, JIN Qiao-zhi2, CHEN Wu-bing2, CAI Zhi-yi1,2
(1TheFirstClinicalMedicalInstitute,WenzhouMedicalCollege,Wenzhou325000,China;2DepartmentofOtolaryngology,TaizhouMunicipalHospital,Taizhou318000,China.E-mail:caizy008@tom.com)
AIM: To investigate the expression characteristics of TRIM27 in human nasopharyngeal carcinoma tissues, nasopharyngeal carcinoma 5-8F cells and NP69 cells, and to observe the effect of TRIM27 on the proliferation, invasion and migration of 5-8F cells.METHODS: The levels of TRIM27 in the nasopharyngeal carcinoma tissues and normal nasopharyngeal epithelial tissues were observed by the method of immunohistochemistry. The mRNA and protein levels of TRIM27 in the 5-8F cells and NP69 cells were determined by real-time PCR and Western blot.TRIM27 siRNA was transfected into the 5-8F cells with Lipofectamine 2000. The relative mRNA expression of TRIM27 was detected by real-time PCR. The relative protein expression of TRIM27 was detected by Western blot. The cell proliferation was analyzed by CCK-8 assay and cell colony formation assay. The change of cell invasion was examined by Matrigel invasion assay. The change of cell migration were examined by wound healing assay. RESULTS: The results of immunohistochemistry showed that the protein expression of TRIM27 in the nasopharyngeal carcinoma tissues was obviously higher than that in the normal nasopharyngeal epithelial tissues. The results of real-time PCR and Western blot showed that the mRNA and protein levels of TRIM27 in the 5-8F cells were obviously higher than those in the NP69 cells. The abilities of proliferation, invasion and migration in the 5-8F cells were significantly suppressed afterTRIM27 gene silencing (P<0.05). CONCLUSION:TRIM27 acts as a oncogene in the 5-8F nasopharygeal carcinoma cells. The abilities of proliferation, invasion and migration are significantly suppressed afterTRIM27 gene silencing in the 5-8F cells.
TRIM27 protein; Nasopharyngeal carcinoma; Cell proliferation; Cell invasion; Cell migration
1000- 4718(2017)01- 0053- 07
2016- 05- 10
2016- 11- 14
R730.23
A
10.3969/j.issn.1000- 4718.2017.01.009
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0576-88858023; E-mail: caizy008@tom.com
