伴血管神经性水肿的过敏性紫癜患儿预后及治疗
2017-01-18王佳佩王天波郑吉卡狄亚珍戴霞华
王佳佩,吴 菱,王天波,郑吉卡,狄亚珍,戴霞华
(1.宁波大学医学院, 浙江 宁波 315211; 2.宁波市妇女儿童医院 小儿风湿免疫科,浙江 宁波 315211)
·论著·
伴血管神经性水肿的过敏性紫癜患儿预后及治疗
王佳佩1,吴 菱2,王天波2,郑吉卡2,狄亚珍2,戴霞华2
(1.宁波大学医学院, 浙江 宁波 315211; 2.宁波市妇女儿童医院 小儿风湿免疫科,浙江 宁波 315211)
目的 观察伴血管神经性水肿的过敏性紫癜(HSP)患儿应用不同治疗方法对改善其预后的影响。方法 回顾分析HSP住院患儿1 012例,详细记录住院初始及随访的临床资料。将HSP患儿根据血管神经性水肿发生与否分A、B组,再将A组根据不同治疗方案分A1(常规治疗+低分子肝素钙)、A2组(常规治疗+双嘧达莫),比较不同组临床指标、实验室指标、紫癜性肾炎(HSPN)发生率等情况。结果 本研究HSP患儿发生血管神经性水肿402例(39.7%)。A组血D-二聚体水平、皮疹反复率、HSPN发生率均高于B组(P均<0.05)。治疗后A1组血管神经性水肿消失时间早于A2组,血D-二聚体水平、皮疹反复率、HSPN发生率均低于A2组(P均<0.05)。结论 伴血管神经性水肿的HSP患儿血液高凝状态明显,是疾病反复和HSPN的高发人群,早期积极予低分子肝素钙抗凝等治疗能迅速缓解病情、减少复发、改善预后。
紫癜,过敏性;血管性水肿;治疗;预后
过敏性紫癜(HSP)是以坏死性小血管炎为主要病理改变的全身性疾病,可累及多个器官。临床表现为出血性皮疹、关节肿痛、腹痛和消化道出血、肾脏损害等。35%~70%的年幼儿还可出现头皮、面部、眼周、会阴部、腓肠肌、手背或足背等不同部位的非凹陷性血管神经性水肿和压痛[1-2]。单纯研究伴血管神经性水肿的HSP患儿报道罕见,本研究观察这类患儿的预后及不同治疗的转归,旨在提高对伴血管神经性水肿HSP患儿的关注,早期采取适宜的治疗改善预后。
1 资料与方法
1.1 病例选择 2013年4月至2015年12月宁波市妇女儿童医院住院HSP患儿1 012例,详细记录住院初始及随访的临床资料。HSP参照2006年欧洲抗风湿病联盟和欧洲儿科风湿病学会(EULAR/PReS)制定的儿童血管炎新的分类[3]。其中男552例(54.5%),女460例(45.5%),年龄2~16岁,平均(7.2±2.8)岁,≥6岁699例(69.1%);初发739例(73.0%),复发273例(27.0%)。
1.2 分组方法 A组:伴血管神经性水肿的HSP患儿402例, B组:无血管神经性水肿的HSP 610例。将A组患儿根据不同治疗方案分A1组(常规治疗+低分子肝素钙)、A2组(常规治疗+双嘧达莫)。常规治疗:避免接触过敏源,开瑞坦或西替利嗪抗过敏治疗,维生素C稳定细胞膜,合并有感染的予抗生素治疗,合并有腹痛、消化道出血、关节肿痛的予糖皮质激素治疗。低分子肝素钙(葛兰素史克(中国)投资有限公司,国药准字J20130168,规格0.4 ml:4100AXaIU)10~30 IU/(kg·d),静脉滴注,10天为1个疗程。
1.3 检测方法 D-二聚体检测仪器CA1500血凝仪由日本Sysmex公司提供,D-二聚体定量采用免疫透射比浊方法,试剂由美国德灵公司提供,操作步骤按说明书进行。患儿入院时、治疗后7~10天分别清晨空腹抽静脉血查D-二聚体。
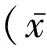
2 结 果
2.1 临床表现 皮肤紫癜1 012例(100%),关节症状534例(52.8%),消化道症状458例(45.3%),肾脏受累456例(45.1%),血管神经性水肿402例(39.7%),心脏受累102例(10.1%),肝功能异常45例(4.4%),睾丸受累32例(3.2%),神经系统受累21例(其中颅内出血1例)(2.1%),急腹症(阑尾炎、肠套叠、肠梗阻)14例(1.4%),肢端感觉异常(表现为阵发性足底胀和双手、双足阵发性疼痛伴双手伸直障碍)1例,膀胱血肿1例(因排尿障碍查膀胱镜发现膀胱与尿道口交界处有活动性血肿)。
2.2 首发表现 皮肤紫癜765例(75.6%),关节症状125例(12.4%),消化道症状101例(10.0%),血管神经性水肿12例(1.2%),肾脏受累5例(0.5%),睾丸受累4例(0.4%)。
2.3 诊断 A组血D-二聚体水平、皮疹反复率、紫癜性肾炎(HSPN)发生率均高于B组(P均<0.05),见表1。本组病例出现HSPN 389例(38.4%)。HSPN参照2009年中华医学会儿科学分会肾脏病学组制定的《儿童紫癜性肾炎的诊治循证指南(试行)》[4]。2.4 疗效 治疗后,A1组症状(血管神经性水肿)消失时间早于A2组,血D-二聚体水平、皮疹反复率、HSPN发生率均低于A2组(P均<0.05),见表2。

表1 两组血D-二聚体水平、皮疹反复率、HSPN发生率比较

表2 两组血D-二聚体水平、症状消失时间、皮疹反复率、HSPN发生率比较
3 讨 论
HSP是一种以变态反应引起的血管炎性病变和血管壁通透性增高为基础的全身多脏器病变为表现的出血性疾病。反复出现皮肤紫癜为本病特征,部分病例可伴有荨麻疹和血管神经性水肿。血管神经性水肿为血管通透性增高血管内液体过度渗出的急性局限性非凹陷性水肿,多发生于组织疏松处,如眼睑、口唇、包皮、肢端、头皮、耳廓等,皮损皮肤紧张发亮,境界不明显。当累及喉头黏膜时,有胸闷、喉部不适,声音嘶哑、呼吸困难,甚至有窒息的可能。故伴血管神经性水肿HSP患儿有一定的急诊风险。本研究中近40%的HSP患儿有伴发血管神经性水肿,应引起临床重视。除特征性皮肤紫癜外,还可累及全身多个脏器如胃肠道、关节、肾脏、心脏、肝脏、神经系统、阴囊、急腹症等。尤其当以血管神经性水肿、关节肿痛、腹痛、睾丸肿痛为首发症状时,极易引起误诊及延误治疗。故接诊此类患者应详细进行皮肤、软组织、关节、阴囊等查体,以及尿常规、尿四联蛋白等检查,必要时做胃镜鉴别。
本研究HSP患儿血D-二聚体水平明显高于正常范围,且伴血管神经性水肿的HSP患儿血D-二聚体水平更高。D-二聚体是活化因子XⅢ交联后纤维蛋白被纤溶酶降解的特异标志物之一,是确定体内有无血栓形成及继发性纤溶的重要指标,其含量变化可作为体内高凝状态和纤溶亢进的标志[5-6]。HSP被认为致敏因素作用机体后产生变态反应,合成抗原-抗体复合物损伤毛细血管内皮,内皮胶原纤维暴露从而激活内源性凝血系统,同时,凝血酶原活化和纤维蛋白沉积又可刺激外源性凝血系统,使患者血液呈现高凝状态[7]。血管神经性水肿的发生与伴有过多的纤维蛋白沉积或纤维蛋白溶解所导致的不平衡有关,增多的纤维蛋白降解产物有血管活性作用,从而导致毛细血管通透性改变[8]。HSP及血管神经性水肿的发生与高凝状态密不可分,D-二聚体可作为监测疾病活动的指标。
本研究中伴血管神经性水肿的HSP患儿皮疹反复率及HSPN发生率明显升高,提示此类患儿易复发且预后不良。有研究表明HSP患儿D-二聚体持续阳性者,易发生肾损害,在HSPN患儿中,血浆D-二聚体表达水平与病情严重程度呈正相关[9]。血浆D-二聚体测定对HSP患儿肾损程度、评判预后和指导治疗较有价值。
本研究发现予低分子肝素钙治疗后血D-二聚体水平恢复明显,血管神经性水肿消失快,皮疹反复率低,HSPN发生率减少。国内外研究发现低分子肝素钙治疗HSP,可有效缓解临床症状,有效预防早期肾损害的发生,且使用方便、不良反应少[10]。
HSP发生肾损害时,主要构成电荷屏障的硫酸类肝素等物质丢失,使肾小球基底膜的通透性增加,致使蛋白等物质漏出,而肝素与硫酸类肝素的分子结构十分相似,通过补充肾小球基底膜丢失的电荷,使已破坏的毛细血管基底膜阴离子屏障重建,减少HSP患儿肾损害的发生;肝素还具有阻碍纤维蛋白形成,抑制体内凝血系统,抑制血小板的黏附、聚集和释放的作用,改善微循环,从而减轻血液的高凝状态,促进纤维溶解,对内皮细胞进行保护,从而减少炎症反应;肝素还能够抑制补体的激活、补体介导的炎性递质释放及中性粒细胞聚集,减轻炎症反应,从而减少了一系列免疫复合物激活后的免疫损伤[11-13]。低分子肝素钙是一种低分子质量的肝素,由具有抗血栓形成和抗凝作用的普通肝素解聚而成,具有肝素的上述作用。同时具有很高的抗凝血因子Ⅹα活性和较低的抗凝血因子Ⅱα或抗凝血酶活性,不延长出血时间,不显著改变活化部分凝血活酶时间(APTT),极少有出血等合并症[14]。
综上所述,伴血管神经性水肿的HSP患儿血液高凝状态明显,是疾病反复和HSPN的高发人群,早期积极予低分子肝素钙抗凝等治疗能迅速缓解病情、减少复发、改善预后。
[1] Ozen S, Pistorio A, Iusan SM, et al. EULAR/PRINTO/PRES criteria for Henoch-Schonlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis: Ankara 2008. Part II: Final classification criteria[J]. Ann Rheum Dis,2010,69(5):798-806.
[2] 高晓琳,黄永坤,李琪,等. 住院过敏性紫癜患儿100例临床资料分析[J]. 临床荟萃, 2009,24(8): 702-703.
[3] Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis, 2006,65(7):936-941.
[4] 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J]. 中华儿科杂志, 2009,47(12):911-913.
[5] Takach Lapner S, Julian JA, Linkins LA, et al. Questioning the use of an age-adjusted D-dimer threshold to exclude venous thromboembolism: analysis of individual patient data from two diagnostic studies[J]. J Thromb Haemost,2016,14(10):1953-1959.
[6] Adam SS, Key NS, Greenberg CS. D-dimer antigen: current concepts and future prospects[J]. Blood, 2009,113(13):2878-2887.
[7] Reakatanan W, Kadegasem P, Chunharas A, et al. High D-dimer level in Henoch-Schonlein purpura with pancreatitis[J]. Pancreas,2016,45(1):e4-5.
[8] Reshef A, Zanichelli A, Longhurst H, et al. Elevated D-dimers in attacks of hereditary angioedema are not associated with increased thrombotic risk[J]. Allergy,2015,70(5):506-513.
[9] 黄可,刘日阳. 儿童过敏性紫癜继发肾损伤中血FIB、D-D和FDP的表达意义研究[J]. 国际医药卫生导报,2016, 6(22): 747-749,755.
[10] Tong CX, Xing XF, Qiao SH, et al. Effect of low molecular weight heparin calcium combined compound Danshen injection on perinatal outcomes of nephrotic syndrome patients with early onset severe pre-eclampsia[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2015,35(8):957-961.
[11] Tian M, Liu C. Heparin calcium treated Henoch-Schonlein purpura nephritis in children through inhibiting hyperfibrinolysis[J]. Ren Fail, 2015,37(7):1100-1104.
[12] Hahn D, Hodson EM, Willis NS, et al. Interventions for preventing and treating kidney disease in Henoch-Schonlein Purpura (HSP)[J]. Cochrane Database Syst Rev,2015(8):CD005128.
[13] Salaru DL, Arsenescu-Georgescu C, Chatzikyrkou C, et al. Midkine, a heparin-binding growth factor, and its roles in atherogenesis and inflammatory kidney diseases[J]. Nephrol Dial Transplant, 2016,31(11):1781-1787.
[14] Suzuki T, Ishii-Watabe A, Hashii N, et al. The establishment and validation of efficient assays for anti-IIa and anti-Xa activities of heparin sodium and heparin calcium[J]. Biologicals, 2013,41(6):415-423.
Prognosis and treatment of children in Henoch-Schönlein purpura with angioneurotic edema
Wang Jiapei1,Wu Ling2,Wang Tianbo2,Zheng Jika2,Di Yazhen2,Dai Xiahua2
1. Medical School, Ningbo University, Ningbo 315211,China; 2.Department of Pediatric Rheumatoid Immunity,Ningbo Women and Children's Hospital,Ningbo 315211,China
Di Yazhen,Email: dyz028sa@163.com
Objective To explore the influence of different therapies in children of Henoch-Schönlein purpura(HSP) with angioneurotic edema. Methods Retrospectively study was performed on 1 012 cases with HSP, including onset patterns, clinical manifestations and outcomes. According to HSP children with angioneurotic edema or not,the patients were divided into two groups: group A and B. With different therapies, group A subdivided into A1(treated with conventional therapy plus low molecular mass heparin calcium) and A2(treated with conventional therapy plus dipyridamole). Comparison was made in the different sets of clinical indicators, laboratory indicators, and incidence rate of HSP nephritis (HSPN). Results Of 1 012 cases,402(39.7%) patients had angioneurotic edema. The blood D-dimer level, the rash recurrence and HSPN incidence of group A were significantly lower than those of group B (P<0.05). After treatment, the angioneurotic edema in group A1 disappeared earlier than A2. The blood D-dimer level, the rash recurrence and HSPN incidence of group A1 were significantly lower than those of group A2 (P<0.05). Conclusion HSP patients with angioneurotic edema had a high incidence of HSPN because of the blood hypercoagulable state. And low molecular mass heparins calcium in early use can help relieve pain, reduce recurrence and have good prognosis.
purpura,Henoch-Schoelein; angioedema; treatment; prognosis
宁波市医学科技项目(2015[50014]);浙江省重点平台科研项目(2015ZDA027);宁波市自然基金项目(2014A610280;2016A610172)
狄亚珍,Email: dyz028sa@163.com
R593.2
A
1004-583X(2017)01-0068-03
10.3969/j.issn.1004-583X.2017.01.016
2016-11-03 编辑:武峪峰
